CINÉTICA
QUÍMICA
Parte da Química que estuda a velocidade das
reações e os fatores que a influenciam.
Rápidas
Reações Químicas
Moderadas
Lentas
Reação Rápida
http://pt.wikipedia.org/wiki/Explos%C3%A3o64
http://www.publicdomainpictures.net/view
-image.php?image=403&picture=fogos-deartificio
Reação Moderada
http://www.publicdomainpictures.net/viewimage.php?image=1656&picture=macas-podres
http://www.diaadia.pr.gov.br/tvpendrive/arqui
vos/File/imagens/4quimica/2vela2.jpg
Reação Lenta
http://pt.wikipedia.org/wiki/Ferrugem
http://pt.wikipedia.org/wiki/Petr%C3%B
3leo#O_petr.C3.B3leo_no_Brasil
O que se faz
no dia a dia para
diminuir a velocidade
das reações químicas?
O que fazer para conservar os
alimentos durante mais tempo?
http://www.diaadia.pr.gov.br/tvpendrive/arquivo
s/File/imagens/4quimica/8frutasesteres.jpg
http://pt.wikipedia.org/wiki/Geladeira
Colocam- se em geladeira, uma
vez que a temperatura elevada
é um dos fatores que aumenta
a velocidade das reações.
Como é que antigamente se
conservavam os alimentos, se
não existiam geladeiras?
http://pt.wikipedia.org/wiki/Carne_de_sol
A salga foi um dos primeiros
processos de conservar os
alimentos (peixe e carne).
O sal funciona como inibidor
- diminui a velocidade da
reação.
Por que é que os chouriços
são defumados?
http://pt.wikipedia.org/wiki/Chouri%C3%A7o
A substância química
formaldeído, liberada no
fumo, mata muitas
bactérias que iriam
degradar mais rapidamente
o alimento.
Por que as garrafas de vinho
são fechadas com rolha e
lacre?
O lacre nas rolhas das
garrafas de vinho, isola
mais o vinho do contato
com o ar, que o iria oxidar
mais rapidamente.
http://pt.wikipedia.org/wiki/Vinho
Por que alguns alimentos são
embalados à vácuo?
Rosana N. R. Campos
A falta de oxigênio
fará com que sua
degradação se torne
mais lenta.
Já reparou que ao abrirmos
um lata de picles, a lata dá
um estalido?
Rosana N. R. Campos
Antes da lata ser fechada,
o alimento é por vezes
aquecido para retirar o ar
que iria favorecer a sua
oxidação. O vinagre inibe o
crescimento de bactérias
que iriam degradar o
alimento.
Quando temos que acender
uma fogueira porque é que
não usamos os troncos
maiores e mais grossos?
Os troncos mais grossos
demoram mais tempo para
acender. Quanto mais
pequenos forem os troncos
mais depressa acendem!
http://www.publicdomainpictures.net/viewimage.php?image=330&picture=fogo
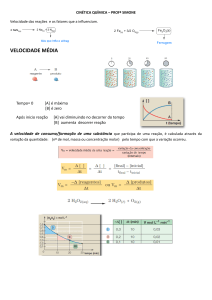
VELOCIDADE DAS REAÇÕES
I - Velocidade média (Vm)
Representa a variação na quantidade de um
reagente ou produto num intervalo de
tempo.
m
n
V
C
vm
ou
ou
ou
t
t
t
t
m = massa, n = no mol, V = volume, C = concentração molar
VELOCIDADE DAS REAÇÕES
reagentes
Vm
tempo
produtos
Vm
tempo
A Vm dos reagentes também é chamada de
velocidade de desaparecimento. A Vm dos
produtos também é chamada de velocidade de
formação.
Obs.: para os reagentes podemos calcular a
velocidade em módulo.
Vm
reagentes
tempo
A (REAGENTE)
B (PRODUTO)
DESAPARECIMENTO
FORMAÇÃO
[ ]
B
A
t
EXERCÍCIO-1
O gráfico abaixo se refere às concentrações de reagentes e produtos da reação
equacionada como: 2N2O5 → 4NO2 + O2
Associe as curvas A, B e C com as
substâncias N2O5 , NO2 e O2.
[ ]
A
B
C
tempo
Fonte: CANTO, E. l.; PERUZZO, T. M. Química na abordagem do cotidiano – Físico-Química: volume 2. 2ed. São Paulo:
Moderna, p. 255, 1998.
RESOLUÇÃO
A= NO2 curva crescente (produto).
B= O2 curva crescente (produto).
C= N2O5 curva decrescente (reagente).
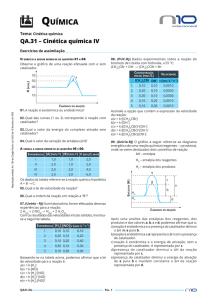
EXERCÍCIO-2
Coloca-se dentro de um recipiente
fechado amônia gasosa (NH3) com uma
concentração inicial de 8,0 mol/L.
Com o passar do tempo ocorre a
reação 2NH3(g) → N2(g) + 3H2(g), e um
pesquisador, utilizando métodos
adequados, verifica, à medida que o
tempo passa, o quanto resta de NH3 e
anota os valores numa tabela.
Tempo (h)
[NH3] (mol/L)
0
8,0
1,0
4,0
2,0
2,0
3,0
1,0
Calcule:
a) A Velocidade média de consumo da amônia (NH3)
no intervalo de 0 e 2h.
RESOLUÇÃO
28 6
3
20
2
28
6
Vm
3 mol L.h
20
2
Esse resultado pode ser interpretado:
A cada hora, consome-se 3mol/L de amônia.
*Obs: Na prática, utiliza-se a velocidade dos reagentes
em módulo | | , para evitar valores negativos.
Ficando assim:
Vm
28
20
6
2
3 mol L.h
b) A velocidade média de consumo de
NH3 entre 1 e 3h.
RESOLUÇÃO
Vm
1 4
3 1
3
2
1,5 mol L.h
c) A velocidade média de formação do N2
entre 0 e 2h.
RESOLUÇÃO
Equação química 2NH3(g) → N2(g) + 3H2(g)
Coeficientes
2
: 1
Vm(0-2h)
3mol/L.h __ VmN2
VmN2=1,5mol/L.h
d) A velocidade média de formação do N2
entre 1 e 3h.
RESOLUÇÃO
Equação química 2NH3(g) → N2(g) + 3H2(g)
Coeficientes
2
: 1
Vm(1-3h)
1,5mol/L.h __ VmN2
VmN2=0,75mol/L.h
Fonte: CANTO, E. l.; PERUZZO, T.M. Química na abordagem do cotidiano – Físico-Química: volume 2. 2ed. São Paulo:
Moderna, p. 254, 1998.
EXERCÍCIO-3
Ao realizar a reação de formação da
água: 2H2(g) + O2(g) → 2H2O(g),
verificou-se que a velocidade de
consumo de oxigênio foi de 4 mol/min.
Determine a velocidade de consumo do
hidrogênio.
Fonte: CANTO, E. l.; PERUZZO, T.M. Química na abordagem do cotidiano – Físico-Química: volume 2. 2ed. São Paulo:
Moderna, p. 254, 1998.
RESOLUÇÃO
Equação química 2H2(g) + O2(g) → 2H2O(g)
Coeficientes
2
: 1
V. de consumo
VmH2 __ 4 mol/min
VmH2= 8mol/min
Condições para que ocorra uma Reação
Os reagentes devem estar em contato.
Afinidade química entre os reagentes.
Teoria da Colisão
As moléculas dos reagentes
colidir entre si.
devem
A colisão deve ocorrer com geometria
favorável e energia suficiente.
Teoria da Colisão
Colisão
Desfavorável
(não-efetiva)
Colisão
Desfavorável
(não-efetiva)
Colisão Favorável (efetiva)
O2 N2
Reagentes
O-------N
2 NO
O
N
Complexo
Ativado
Produtos
Para
que a colisão seja efetiva é necessário ainda que os
reagentes adquiram uma energia mínima denominada energia de
ativação.
Energia de Ativação é o valor mínimo de energia que
as moléculas de reagentes devem possuir para que uma
colisão entre elas seja efetiva.
Quanto maior for a energia de ativação, mais lenta
será a reação.
Complexo Ativado: estado intermediário formado
entre reagentes e produtos, ocorre um progressivo
enfraquecimento das ligações entre as moléculas
iniciais e um fortalecimento das ligações entre as
moléculas finais.
O2 N2
Reagentes
O-------N
2 NO
O
N
Complexo
Ativado
Produtos
REVISÃO
HI+HI
I2 + H2
I2
H2
REAÇÃO EXOTÉRMICA
Energia (Kcal/mol)
E2
Complexo Ativado
. . . . . . . . . . . . . . .
b
E1
. . . . . . . . . .
c
E3
. . . . . . . . . . . . . . . . . . . . . . . .
E1= energia dos reagentes
E2= energia do complexo
ativado
E3= energia dos produtos
b=energia de ativação
c=variação de entalpia
ΔH= Hp – Hr
Caminho da reação
Quanto menor for a energia de ativação,
maior a velocidade da reação.
REAÇÃO ENDOTÉRMICA
Energia (Kcal/mol)
E2
E3
. . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . .
b
E1
Complexo Ativado
c
. . . . . . . . . . . . . . . .
E1= energia dos reagentes
E2= energia do complexo
ativado
E3= energia dos produtos
b=energia de ativação
c=variação de entalpia
ΔH= Hp – Hr
Caminho da reação
Quanto maior for a energia de ativação, menor a
velocidade da reação.
EXERCÍCIO-4
O gráfico descreve a variação de energia de
uma certa reação:
Energia (Kcal/mol)
30
10
2
. . . . . . . . . . . . . . .
A+B
. . . . . . . . . .
C
. . . . . . . . . . . . . . . . . . . . . . . .
Caminho da reação
Descubra:
a) O valor da entalpia dos reagentes.
b) O valor da entalpia dos produtos.
c) Se a reação é endo ou exotérmica.
d) O valor da energia de ativação.
e) O valor da energia do complexo
ativado.
f) O valor da energia da reação
(variação de entalpia).
Fonte: Adaptação:
HARTWIG, D.R., SOUZA, E. e MOTA, R.N. Físico- Química: volume 2. São Paulo, Scipione, p. 153, 1999.
RESOLUÇÃO
a)
b)
c)
d)
e)
f)
H reagentes= 10 Kcal/mol
H produtos= 2 Kcal/mol
A Reação é exotérmica (Hp‹Hr)
Eat= 30 – 10= 20 Kcal/mol
CA= 30 Kcal/mol
ΔH= Hp – Hr
ΔH= 2 – 10
ΔH= - 8 Kcal/mol ( o processo libera
energia:reação exotérmica).
Fatores que influenciam a
velocidade de uma reação
a ) Superfície de contato entre os
reagentes;
b ) Concentração dos reagentes;
c) Temperatura;
d) Presença de catalisadores;
e) Pressão.
a) Superfície de contato entre os reagentes.
Quanto maior a superfície de contato,
maior é o número de choques efetivos
entre as partículas dos reagentes e,
portanto, maior será a velocidade da
reação.
http://www.brasilescola.com/q
uimica/cinetica-quimica.htm
EXERCÍCIO-5
Na digestão dos alimentos
ocorre uma série de reações
químicas.
Explique, levando em conta a
velocidade
das
reações
químicas, por que é benéfico
mastigar bem os alimentos.
Fonte: CANTO, E. l.; PERUZZO, T.M. Química na abordagem do cotidiano – Físico-Química: volume 2. 2ed.
São Paulo: Moderna, p. 273, 1998.
RESOLUÇÃO
Quanto mais triturado estiver o
alimento, mais rápidas serão as
reações envolvidas na digestão,
graças ao aumento da superfície de
contato entre os reagentes.
b) Concentração dos reagentes.
Quanto maior a concentração de partículas
dos reagentes, maior será o número de
colisões efetivas e consequentemente maior
a velocidade da reação.
Abanando carvão em
brasa, aumentamos a
concentração de gás
oxigênio (O2) (reagente),
aumentando a velocidade
da reação.
http://www.diaadia.pr.gov.br/tvpendrive/arquivos/
File/imagens/4quimica/2fogo2.jpg
Lei da Ação das Massas,
Lei da Velocidade ou Lei de
Guldberg-Waage
“A uma dada temperatura, a velocidade
de uma reação química elementar
(reação que ocorre em uma única etapa)
é diretamente proporcional ao produto
das concentrações dos reagentes, em
mol/L, elevadas a seus respectivos
coeficientes”.
EXEMPLO:
aA + bB → cC + dD
V = k [A] [B]β
V = velocidade da reação;
K = constante de velocidade (característica da reação e da
temperatura);
[ ] = concentração dos reagentes (mol/L), exceto reagente
sólido, pois a concentração de uma substância sólida é
sempre constante, ficando assim incorporada à constante de
velocidade.
e β = expoentes determinados experimentalmente.
Obs.: Se a reação for elementar
= a e
β= b
Se a reação não for elementar, deve-se calcular o valor de
e β.
Reação Elementar
Quando a reação química se desenvolve em
uma única etapa, dizemos que a reação é
elementar.
Numa reação elementar,
devem ser elevadas as
reagentes na expressão
os próprios coeficientes
equação balanceada.
os expoentes a que
concentrações dos
da velocidade são
dos reagentes na
aA + bB → cC + dD
V = k [A]a.[B]b
EXERCÍCIO-6
Determine a expressão da velocidade
(segundo a Lei de Guldberg-Waage),
supondo elementares:
a) C2H4(g) + H2(g) → C2H6(g)
b) 3Cu(s)+ 8HNO3(aq) → 3Cu(NO3)2(aq)+ 4H2O(l)+ 2NO(g)
Fonte: HARTWIG, D.R., SOUZA, E. e MOTA, R.N. Físico- Química: volume 2. São Paulo, Scipione, p. 167, 1999.
RESOLUÇÃO
a) C2H4(g) + H2(g) → C2H6(g)
V K C2 H 4 . H 2
V K C2 H 4
. H2
V K C
H
.H
b) 3Cu(s)+ 8HNO3(aq) →
3Cu(NO
3)2(aq)+ 4H2O(l)+ 2NO(g)
2
4
V K HNO3
8
2
Reação Não-Elementar
Quando a reação se desenvolve em duas ou
mais etapas distintas, a velocidade da
reação depende apenas da velocidade da
etapa lenta.
A etapa lenta é a etapa determinante
da velocidade da reação.
1º EXEMPLO: (REAÇÃO NÃO-ELEMENTAR)
O óxido nítrico reage com hidrogênio,
produzindo nitrogênio e vapor de água de
acordo com a equação:
2 H2 + 2 NO → 1 N2 + 2 H2O
Etapa I
1H2 + 2NO → 1N2O + 1H2O (lenta)
Etapa II 1H2 + 1N2O → 1N2 + 1H2O (rápida)
Reação Global
2H2 + 2NO → 1N2 + 2H2O
Descubra a Lei da velocidade para
essa reação:
Fonte: FELTRE, R. FÍSICO-QUÍMICA: volume 2. 6ed. São Paulo: Moderna, p. 166, 2004.
RESOLUÇÃO
Equação da velocidade (etapa lenta)
V = k [H2].[NO]2
EXERCÍCIO-7
A poluição é uma das causas da destruição
da camada de ozônio. Uma das reações que
podem ocorrer no ar poluído é a reação do
dióxido de nitrogênio com o ozônio:
2NO2(g) + O3(g) → N2O5(g) + O2(g)
Essa reação ocorre em duas etapas:
I. NO2(g) + O3(g) → NO3(g) + O2(g) (lenta)
II. NO3(g) + NO2(g) → N2O5(g)
(rápida)
Descubra a lei da velocidade para essa reação.
Fonte: USBERCO,J.;SALVADOR,E. Química: volume único. 2ed. São Paulo: Saraiva, p. 356, 1998.
RESOLUÇÃO
Equação da velocidade (etapa lenta)
V = k [NO2].[O3]
2º EXEMPLO: (REAÇÃO NÃO-ELEMENTAR)
Considere a seguinte reação:
2H2(g)+ 2NO(g) → N2(g)+ 2H2O(g)
Em diversos experimentos com essa
reação, feitos à temperatura de 700oC,
foram obtidos os seguintes dados:
Experimento
[H2]
(mol/L)
[NO]
(mol/L)
Velocidade
(mol/L.h)
1
2
3
1.10-3
2.10-3
2.10-3
1.10-3
1.10-3
2.10-3
3.10-5
6.10-5
24.10-5
A expressão da Lei da velocidade é:
v=k.[H2]x.[NO]y
Como essa é uma reação não-elementar,
devemos calcular o valor de x e y.
Fonte: HARTWIG, D.R., SOUZA, E. e MOTA, R.N. Físico- Química: volume 2. São Paulo, Scipione, p. 163-164, 1999.
1ª etapa: Determinar o valor de x.
- Escolher dois experimentos nos quais varie a [H2] ,
mas não varie a [NO].
(Escolhemos o experimento 1 e 2)
- Substituímos na expressão v=k.[H2]x.[NO]y
x
1
x
3 1x
1 1x
1 1
1 1
x x 1
6 2x
2 2
2 2
2 2
3.10-5=k.(1.10-3)x.(1.10-3)y
1º Experimento
6.10-5=k.(2.10-3)x.(1.10-3)y
2º Experimento
x
1
x
3 1
1 1
1 1
1 1
x x x 1
6 2
2 2
2 2
2 2
x
x
2ª etapa: Determinar o valor de y.
- Escolher dois experimentos nos quais varie a [NO]
, mas não varie a [H2].
(Escolhemos o experimento 2 e 3)
- Substituímos na expressão v=k.[H2]x.[NO]y
x
1
x
3 1x
1 1x
1 1
1 1
x x 1
6 2x
2 2
2 2
2 2
2º Experimento
6.10-5=k.(2.10-3)x.(1.10-3)y
3º Experimento
24.10-5=k.(2.10-3)x.(2.10-3)y
y
y
2
y
6 1 1 1
1 1 1 1
y 2 y 2
24 2 4 2 2 2 2 2
y
6 1
1 1
1 1
1 1
2 y 2
24 2y
4 2
2 2
2 2
y
y
y
2
y
3ª etapa: Utilizando então os valores de x e
y na expressão v=k.[H2]x.[NO]y , obtemos
a Lei da velocidade dessa reação:
v=k.[H2]1.[NO]2 ou
x
1
x
3 1x
1 1x
1 1
1 1
x x 1
6 2x
2 2
2 2
2 2
v=k.[H2].[NO]2
3º EXEMPLO: (REAÇÃO NÃO-ELEMENTAR)
Considere a reação de síntese da amônia:
N2(g)+ 3H2(g) → 2NH3(g)
O que ocorrerá com a velocidade se a
concentração molar do hidrogênio for
reduzida à terça parte e a do nitrogênio for
triplicada?
Fonte: SARDELA, A.; MATEUS, E. Curso de Química: volume 2. 10ed. São Paulo: Ática, p. 153, 1992.
RESOLUÇÃO
N2(g)+ 3H2(g) → 2NH3(g)
1ª etapa: [N2] = x [H2] = y
v = k . [N2] . [H2]3
v = k . x . y3
2ª etapa: [N2] = 3x
[H2] = y/3
v= k . [N2] . [H2]3
v, = k . 3x . (y/3)3 v, = k . 3x . y3/27
v, = v/9
A velocidade reduzirá à nona
parte ou 9 vezes.
A equação dessa reação é:
2CO(g) + O2(g) → 2CO2(g)
O que ocorrerá com a velocidade dessa
reação se duplicarmos as concentrações
de CO(g) e O2(g).
Fonte: FONSECA, Martha Reis Marques da. Completamente Química: FÍSICO-QUÍMICA. São Paulo: FTD, p. 291, 2001.
RESOLUÇÃO
2CO(g) + O2(g) → 2CO2(g)
1ª etapa: [CO] = x [O2] = y
v = k . [CO]2 . [O2]
v = k . x2 . y
2ª etapa: [CO] = 2x
[O2] = 2y
v= k . [CO]2 . [O2]
v, = k . (2x)2 . (2y) v, = k . 4x2 . 2y
v, = 8v
A velocidade aumentará
8 vezes.
c) Temperatura.
As variações de temperatura modificam o valor da
constante de velocidade (k).
Um aumento na T, aumenta a freqüência das
colisões intermoleculares e aumenta a energia
cinética das moléculas fazendo com que um maior
número alcance a energia mínima para reagir (Eat).
Um aumento na energia cinética (agitação
molecular) favorece a ruptura das ligações.
Regra de Vant’Hoff
Um aumento de 10ºC faz com que a
velocidade da reação dobre.
Temperatura
Velocidade
10ºC
V
20ºC
2V
40ºC
8V
EXERCÍCIO-9
A regra de Vant’Hoff diz que “um
aumento de 10oC na temperatura
duplica a velocidade de uma reação
química”.
Admita que essa regra seja válida
para as reações que fazem os
alimentos estragarem. Dentro de uma
geladeira (5oC) os alimentos estragam
com uma certa velocidade.
Quantas vezes mais rápido o
alimento estragaria se estivesse
fora da geladeira:
a) Em um dia a 15oC?
b) Em um dia a 25oC?
c) Em um dia a 35oC?
Fonte: CANTO, E. l.; PERUZZO, T.M. Química na abordagem do cotidiano – Físico-Química: volume 2.
2ed. São Paulo: Moderna, p. 272, 1998.
RESOLUÇÃO
Se a cada 10oC de aumento na temperatura a
velocidade da reação duplica, então, sendo v a
Velocidade com que o alimento estraga a 5oC,
podemos concluir que:
a) A 15oC, a velocidade com que o alimento
estraga é 2v.
b) A 25oC, a velocidade com que o alimento
estraga é 4v.
c) A 35oC, a velocidade com que o alimento
estraga é 8v.
d) Presença de catalisadores.
Catalisadores são substâncias que, quando
presentes, aumentam a velocidade das
reações químicas, sem serem consumidos.
Ao final encontram-se qualitativa e
quantitativamente inalterados.
Os catalisadores encontram “caminhos
alternativos” para a reação, envolvendo
menor energia (diminuem a Energia de
Ativação), tornando-a mais rápida.
Gráfico Cinética Química e a influência do Catalisador
Complexo ativado sem
catalisador
E (KJ/mol)
Complexo ativado com
catalisador
Ea2
Ea1
reagente
H < 0
produto
Caminho da reação
Fonte: Rosana N. R. Campos
Características dos catalisadores
a) Aumentam a velocidade das reações;
b) Não são consumidos durante as reações;
c) Não iniciam reações, mas interferem nas
que já ocorrem sem a sua presença;
d) Podem ser utilizados em pequenas quantias,
visto que não são consumidos;
e) Seus efeitos podem ser diminuídos pela
presença de “venenos de catálise”.
f) A introdução do catalisador diminui a
Energia de Ativação.
Como funciona o catalisador
automotivo?
O catalisador têm aspecto semelhante a uma colméia
proporcionando uma maior superfície de contato entre o
catalisador e os gases que saem do motor. Sua função é
acelerar a oxidação dos gases emitidos após a combustão.
O catalisador acelera as reações químicas,
que transformam os poluentes (CO, NOx, HC)
em compostos menos prejudiciais à saúde
(CO2, H20, N2).
http://pt.wikipedia.org/wiki/Ficheiro:Aufgeschnittener_Metall_Katalysator_f%C3%BCr_ein_Auto.jpg
EXERCÍCIO-10
Considere gráfico:
Energia (Kcal/mol)
36
30
15
8
. . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . .
A+B
AB
. . . . . . . . . . . . . . . . . . . . . . . . .
Caminho da reação
Agora, responda:
a) Qual a energia de ativação com
catalisador?
b) Qual a energia de ativação sem
catalisador?
c) Qual a diminuição da energia de
ativação provocada pelo catalisador?
d) Qual a energia liberada pela
reação?
Fonte: SARDELA, A.; MATEUS, E. Curso de Química: volume 2. 10ed. São Paulo: Ática, p. 162, 1992.
RESOLUÇÃO
a)
b)
c)
d)
30-15= 15 Kcal/mol.
36-15= 21 Kcal/mol.
36-30= 6 Kcal/mol.
ΔH=produto - reagente
ΔH=8-15= -7 Kcal/mol.
e) Pressão.
Em reações envolvendo
reagentes gasosos,
quando se aumenta a
pressão ocorre
diminuição do volume e
consequentemente há
aumento na
concentração dos
reagentes, aumentando
o número de colisões.
http://www.brasilescola.com/quimica/cinetica
-quimica.htm
A pressão parcial de um gás é diretamente proporcional à
sua concentração.
Maior pressão parcial
Maior velocidade
Maior concentração
Ordem de uma reação
Chama-se ordem de uma reação (ordem global) à
soma dos valores das potências a que as
concentrações de reagentes se encontram
elevadas a equação cinética da reação.
H2 + 2 NO
→
1 N2O + H2O
V = k [H2].[NO]2
Ordem da reação: 1 +2 = 3 (3ª ordem)
Em relação ao H2: 1ªordem, v = k [H2]
Em relação ao NO: 2ªordem, v = k [NO]2
Molecularidade
É o número de moléculas que se chocam em cada
reação elementar ou em uma etapa de uma
reação não-elementar.
H2 + 2 NO
→
1 N2O + H2O
Molecularidade igual a 3 (trimolecular).
EXERCÍCIO-12
Considerando a reação
NO2(g) + CO(g) → NO(g) + CO2(g)
Que ocorre em uma única etapa e
que, numa dada temperatura,
apresenta a lei experimental de
velocidade dada por v=K[NO2] [CO].
Qual a ordem e a molecularidade
dessa reação?
Fonte: FELTRE, R. FÍSICO-QUÍMICA: volume 2. 6ed. São Paulo: Moderna, p. 167, 2004.
RESOLUÇÃO
A reação é de 2ª ordem, visto que a soma
dos expoentes na fórmula da velocidade é
igual a 2.
A molecularidade é também igual a 2,
pois, ocorrendo a reação em uma única
etapa, ela envolverá o choque
de 2 moléculas (NO2 e CO).
BIBLIOGRAFIA
BENABOU, J.; RAMANOSKI, M. Química: volume único. São Paulo: Atual, 2003.
CANTO, E. l.; PERUZZO, T. M. Química na abordagem do cotidiano – Físico-Química:
volume 2. 2ed. São Paulo: Moderna, 1998.
CANTO, E. l.; PERUZZO, T. M. Química: volume único. 2 ed. São Paulo: Moderna, 2003.
CANTO, E. l.; PERUZZO, T. M. Química na abordagem do cotidiano: volume único. 2ed.
São Paulo: Moderna, 2002.
CARVALHO, G. C.; Química Moderna 2. São Paulo:Scipione, 1995.
CARVALHO, G. C.; SOUZA, C. L. Química de olho no mundo do trabalho: volume
único. São Paulo:Scipione, 2003.
FELTRE, R. FÍSICO-QUÍMICA: volume 2. 6ed. São Paulo: Moderna, 2004.
FONSECA, Martha Reis Marques da. Completamente Química: FÍSICO-QUÍMICA. São
Paulo: FTD, 2001.
HARTWIG, D. R., SOUZA, E. e MOTA, R. N. Físico- Química: volume 2. São Paulo,
Scipione, 1999.
LEMBO, A.; SARDELA, A. Química: volume 2. 10ed. São Paulo: Ática, 1988.
MATSUI, Ana N.; LINGUANOTO, Maria; UTIMURA, Teruko Y. Química, 2: 2o Grau. São
Paulo: Editora FTD, 1987.
NOBREGA, O. S.; SILVA, E. R.; SILVA, R. H. Química: volume único. 1ed. São Paulo:
Ática, 2005.
SANTOS, W. L. P.; MÓL, G. S. Química e Sociedade: volume único. São Paulo: Nova
Geração, 2005.
SARDELA, A.; MATEUS, E. Curso de Química: volume 2. 10ed. São Paulo: Ática, 1992.
USBERCO,J.;SALVADOR,E. Química: volume único. 2ed. São Paulo: Saraiva, 1998.