Há muitos anos atrás surgiu a expressão
COMPOSTOS ORGÂNICOS
para indicar as substâncias produzidas por
ORGANISMOS VIVOS
Era a TEORIA DA FORÇA VITAL
A URÉIA
era obtida a partir da urina,
A partir desta
observação,
onde ela
existe devidodefine-se
QUÍMICA
ORGÂNICA
à degradação
de proteínas
no organismo
como sendo a parte da química que estuda os
Em 1828, o cientista
alemão Wöhler
compostos
do elemento
químico
conseguiu produzir a uréia
a partir do cianato de amônio,
CARBONO
COMPOSTO INORGÂNICO
NH2
NH4CNO
O
C
NH2
GNV
Álcool etílico
gás natural veicular
C2H5OH
CH4
Existem substâncias como o
CO, CO2,
H2CO3 e demais carbonatos,
HCN e demais cianetos,
que são considerados compostos de transição
Alguns elementos formam, praticamente, todos
os compostos orgânicos,
tais elementos são chamados de
ORGANÓGENOS e,
são constituídos pelos elementos
C, H, O e N
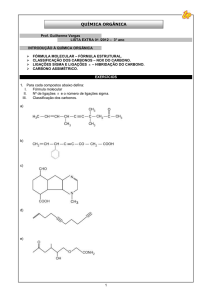
01)(UFSE) Wöhler conseguiu realizar a primeira síntese de
substância dita “orgânica” a partir de uma substância
dita “inorgânica”. A substância obtida por Wöhler foi:
a) uréia.
b) ácido úrico.
c) ácido cítrico.
d) vitamina C.
e) acetona.
NH2
NH4CNO
O
C
NH2
02) (Covest – 2004)Tendo em vista as estruturas do tolueno,
clorofórmio e acetonitrila, abaixo, podemos classificá-los,
respectivamente, como compostos:
CH3
H
Cl
H
H
H
H
H
C
Cl
Cl
H
C
C
H
H
tolueno
clorofórmio
a) orgânico, inorgânico e orgânico.
b) orgânico, orgânico e orgânico.
c) inorgânico, orgânico e orgânico.
d) orgânico, inorgânico e inorgânico.
e) inorgânico, inorgânico e inorgânico.
acetonitrila
N
Em 1858 AUGUST KEKULÉ
estudou o carbono e enunciou uma teoria que se resume a:
O carbono é TETRAVALENTE
12
6
K=2
C
L
L == 44
As quatro valências do carbono EQUIVALENTES e COPLANARES
Cl
H
H
C
H
Cl
H
C
H
H
H
H
C
Cl
H
H
Cl
C
H
H
Os átomos de carbono podem ligar-se entre si, formando CADEIAS
CARBÔNICAS
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
C
O átomo de carbono forma múltiplas ligações
(simples, dupla e tripla)
C
C
C
C
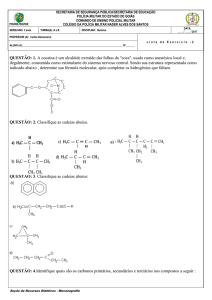
01) Na estrutura
H2C
(1)
C (2)
C
NH2
H
(3)
CH2
As ligações representadas pelos algarismos são,
respectivamente:
a) dupla, simples, dupla.
b) simples, tripla, dupla.
c) dupla, tripla, simples.
d) simples, dupla, simples.
e) dupla, dupla, tripla.
02) Na fórmula H2C .x..CH – CH2 – C .y..N, x e y
representam, respectivamente, ligações:
a) simples e dupla.
b) dupla e dupla.
c) tripla e simples.
d) tripla e tripla.
e) dupla e tripla.
x CH – CH – C ....
y N
H2C ....
2
C
O carbono tem geometria TETRAÉDRICA.
O carbono tem ângulo entre suas valências de 109°28’.
O carbono tem 4 ligações sigma ( s ).
O carbono se encontra hibridizado “sp 3 “.
C
Com um ligação dupla e duas ligações simples:
O carbono tem geometria TRIGONAL PLANA.
O carbono tem ângulo entre suas valências de 120°.
O carbono tem 3 ligações sigma (
s ) e 1 ligação pi ( p
O carbono se encontra hibridizado “sp 2 “.
).
C
Com duas ligações dupla:
O carbono tem geometria LINEAR.
O carbono tem ângulo entre suas valências de 180°.
O carbono tem 2 ligações sigma ( s ) e 2 ligação pi (
O carbono se encontra hibridizado “sp“.
p
).
C
Com uma ligação tripla e uma ligação simples:
O carbono tem geometria LINEAR.
O carbono tem ângulo entre suas valências de 180°.
O carbono tem 2 ligações sigma ( s ) e 2 ligação pi (
O carbono se encontra hibridizado “sp“.
p
).
01) (UFV-MG) Considere a fórmula estrutural abaixo:
H
H
H
H
C
C
C
C
C
4
3
2
1
5
H
H
São feitas das seguintes afirmativas:
s (sigma).
II. O átomo de carbono 3 forma 3 ligações s (sigma) e 1 ligação p (pi).
III. O átomo de carbono 2 forma 3 ligações p (pi) e 1 ligação s (sigma).
I.
O átomo de carbono 5 forma 4 ligações
IV. O total de ligações
p
(pi) na estrutura é igual a 3.
Assinale a alternativa correta.
a) Apenas as afirmativas I e IV são corretas.
b) Apenas as afirmativas II e III são corretas.
c) Apenas as afirmativas I, II e IV são corretas.
d) Todas são corretas.
e) Apenas as afirmativas I e II são corretas.
02) (UFRN) O ácido metanóico (fórmico), encontrado em algumas formigas
e causador da irritação provocada pela picada desses insetos, tem a
seguinte fórmula:
sp
H
s
2
s
O
p
C
s
O
H
O átomo de carbono dessa molécula apresenta hibridização:
a) sp com duas ligações sigma (
s ) e duas ligações pi ( p ).
b) sp2 com três ligações sigma (
s ) e uma ligação pi (p ).
c) sp2 com uma ligações sigma (
s ) e três ligações pi ( p ).
d) sp3 com três ligações sigma (
s ) e uma ligação pi ( p ).
e) sp2 com duas ligações sigma ( s ) e duas ligações pi ( p ).
03) (PUC – PR) A acetona (fórmula abaixo), um importante
solvente orgânico, apresenta nos seus carbonos,
respectivamente, os seguintes tipos de hibridizações:
sp3
H
H
O
H
C
C
C
H
a) sp, sp2 e sp3
b) sp3 , sp3 e sp3
c) sp2, sp e sp3
d) sp3, sp2 e sp3
e) sp3, sp2 e sp2
H
sp2
sp3
H
04) Indique os ângulos reais entre as valências dos carbonos 2, 3 e 5,
respectivamente, na figura abaixo:
H
H 3C
H
(2)
120°
120°
(3)
C
C
C
C
H
H
H
H
a) 90o, 180o e 180o.
b) 90o, 120o e 180o.
c) 109o28’, 120o e 218o.
d) 109o28’, 120o e 109o28’.
e) 120o, 120o e 109o28’.
109°28’
(5)
H
05) (UFRGS) A morfina, alcalóide do ópio extraído da papoula, pode ser
sintetizada em laboratório, tendo como um dos seus precursores o
composto com a seguinte estrutura:
O
O
1
CH3O
3
CH3O
2
CH2
C
N
A geometria dos carbonos com números 1, 2 e 3 é, respectivamente:
a) tetraédrica, trigonal, linear.
1
linear
c) tetraédrica, linear, trigonal.
2
tetraédrica
d) trigonal, tetraédrica, linear.
3
trigonal
b) linear, tetraédrica, trigonal.
e) linear, trigonal, tetraédrica.
06)(Covest – 2007) A partir da estrutura do composto abaixo, podemos
afirmar que:
CH3
C
C
C
C
CH3
C
2
C
C
H
C
5
1 C
C
H
C
H
H
C
C
0
Os carbonos 1 e 2 apresentam hibridização sp 2
1
1
Os carbonos 3 e 4 apresentam hibridização sp 3
2
2
O carbono 5 apresenta hibridização sp
3
4
4
C
3
4
H
0
3
C
CH3
C
H
C
H
H
H
H
H
H
C H3
H
H 3C
H
Os carbonos 1 e 2 apresentam duas ligações pi ( p ) entre si.
Os carbonos 3 e 4 apresentam duas ligações pi ( p ) e uma
sigma ( s ), entre si
H
07) ( Covest – 2004 ) O b – caroteno , precursor da vitamina A, é um
hidrocarboneto encontrado em vegetais, como a cenoura e o espinafre.
Seguindo a estrutura abaixo, indique quais os tipos de hibridização
presentes no b – caroteno.
H 3C
H 3C
CH3
CH3
CH3
CH3
CH3
a) sp2 e sp3.
b) sp e sp2.
c) sp e sp3.
d) somente sp2.
e) sp, sp2 e sp3.
C H3
H 3C
CH3
Py
Pz
s
s
Px
A primeira ligação covalente entre dois átomos ocorre com
orbitais de mesmo eixo
(ligação sigma),
as demais ligações ocorrem com
orbitais paralelos e são chamadas de
LIGAÇÕES pi (
p
s
p
)
Neste tipo de ligação teremos
duas ligações do tipo pi ( p )
e uma ligação do tipo sigma ( s )
p
p
s
p
Apesar disso,o em
todos os
Observando
carbono
noseus
estado
normal
concluiríamos
ele só
compostos
o carbono que
realiza
teria condições
de efetuar apenas
quatro ligações.
duas
ligaçõeseste
covalentes,
Para justificar
fato surgiupois
a
3
possui
somente
dois
elétrons
2
TEORIA
DA
HIBRIDIZAÇÃO
sp
sp
e sp
desemparelhados
L
K
ESTADO ATIVADO
ESTADO
ou
FUNDAMENTAL
EXCITADO
Um elétron emparelhado,
do último nível, pula para o primeiro orbital vazio,
de um subnível mais energético
sp 3 sp 3 sp 3 sp 3
L
K
ESTADO ATIVADO
ou
EXCITADO
ESTADO HÍBRIDO
Ocorre
a fusão dos
contêm elétrons
A forma
geométrica
doorbitais
carbonoque
hibridizado
“ sp 3 “ é
desemparelhados, formando
igual número de orbitais híbridos
TETRAÉDRICA
idênticos entre
com forma
geométrica
diferente
e o si,
ângulo
entre as
suas valências
é dedas originais
109°28’
L
K
ESTADO ATIVADO
ESTADO
ou
FUNDAMENTAL
EXCITADO
Um elétron emparelhado,
do último nível, pula para o primeiro orbital vazio,
de um subnível mais energético
sp 2 sp 2 sp 2
L
K
“p” puro
ESTADO ATIVADO
ou
ESTADO HÍBRIDO
EXCITADO
Ocorre
a fusãohibridizado
de
A forma geométrica
do carbono
“ sp 2 “ é
dois orbitais “p”TRIGONAL
com o orbital
“s”, formando igual
PLANA
número
orbitais
híbridos
idênticos
entre
si, com
e ode
ângulo
entre
as suas
valências
é de
forma geométrica 120°
diferente das originais
L
K
ESTADO ATIVADO
ESTADO
ou
FUNDAMENTAL
EXCITADO
Um elétron emparelhado,
do último nível, pula para o primeiro orbital vazio,
de um subnível mais energético
sp
L
K
sp
“p”ATIVADO
puro
ESTADO
ou
EXCITADO
ESTADO
HÍBRIDO
A forma geométrica
do carbono
“ sp “ é
Ocorre
a fusãohibridizado
de
um orbitais “p” comLINEAR
o orbital “s”, formando igual
e o de
ângulo
entre
as suasidênticos
valências
é desi, com
número
orbitais
híbridos
entre
forma geométrica180°
diferente das originais