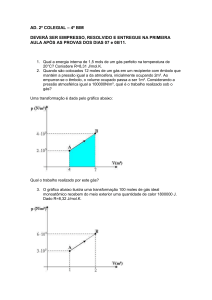
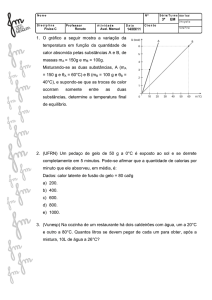
Site: www.isrrael.com.br
Calorimetria
Calor Sensível:
É a quantidade de calor necessária para varia a temperatura de um
corpo sem que haja variação do estado físico da matéria. A equação que mede a quantidade de
calor cedida ou recebida por um corpo é:
Calor Específico:
É a quantidade de calor necessária para varia em 1 grau
Celsius a temperatura de um corpo. Essa grandeza é característica específica de cada
material. A unidade de medida de calor específico no SI é J/Kg.K
Calor Latente:
É a quantidade de calor necessária para varia o estado físico da
matéria sem varia a temperatura. O calor latente pode ser calculado usando a
equação:
Unidades:
L – cal/g
L – J/kg (S.I.)
Para a pressão atmosférica de 1 atm (normal),
para a água, temos:
Para a água, à 1 atm, se o calor latente de fusão é de 80 cal/g, significa que, para cada 80
cal que um bloco de gelo a 0ºC receber, (1g) um grama de gelo se transformará em (1g) um
grama de água também a 0ºC.
Trocas de calor
Para que o estudo de trocas de calor seja realizado com maior precisão, este é
realizado dentro de um aparelho chamado calorímetro, que consiste em um
recipiente fechado incapaz de trocar calor com o ambiente e com seu interior.
Dentro de um calorímetro, os corpos colocados trocam calor até atingir o equilíbrio
térmico. Como os corpos não trocam calor com o calorímetro e nem com o meio em
que se encontram, toda a energia térmica passa de um corpo ao outro.
Como, ao absorver calor Q > 0 e ao transmitir calor Q < 0, a soma de todas as
energias térmicas é nula, ou seja:
ΣQ = 0
(lê-se que somatório de todas as quantidades de calor é igual a zero)
Sendo que as quantidades de calor podem ser tanto sensível como latente.
Princípio geral das trocas de calor: Se dois ou mais corpos trocam calor
entre sí, a soma algébrica das quantidades de calor trocadas pelos corpos, até o
estabelecimento do equilíbrio térmico, é nula.
QA + QB + QC +... = 0
Exemplo 01:
Um estudante misturou num calorímetro 20
g de um líquido A, de calor específico 0,056
cal/g.ºC, a 160 ºC, com 28 g de um líquido
B, de calor específico 1,0 cal/g.ºC, a 30 ºC.
Supondo que não houve troca de calor
entre os líquidos e o calorímetro, qual foi a
temperatura
de
equilíbrio
térmico
θf registrada pelo estudante?
Resolução:
Do Princípio geral das trocas de calor:
QA + QB = 0
mA.cA.ΔθA + mB.cB.ΔθB = 0
20.0,056.(θf - 160) + 28.1,0.(θf - 30) = 0
1,12.(θf - 160) + 28.(θf - 30) = 0
1,12.θf - 179,2 + 28.θf - 840 = 0
29,12.θf - 1019,2 = 0
θf = 35 ºC
Exemplo 02: Qual a temperatura de equilíbrio entre uma bloco de
alumínio de 200g à 20°C mergulhado em um litro de água à 80°C?
Dados calor específico: água=1cal/g°C e alumínio = 0,219cal/g°C.
Exemplos
Pg. 276 / A2 – Um corpo de massa 30 gramas deve receber 2100 calorias para que sua temperatura se eleve
de – 20 °C para 50 °C. Determine a capacidade térmica do corpo e o calor específico da substância que o
constitui.
C = Q/∆T
e
c = C/m
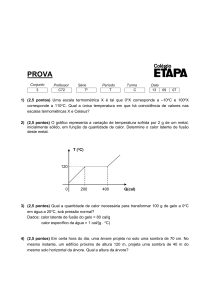
Pg. 278 / A4 – O gráfico registra como varia a temperatura da amostra de uma
substância X, cuja massa é 10 gramas, a medida que recebe calor (Q) de uma fonte.
Determine o calor específico da substância.
Q = m.c.∆T
Pg. 281 / A9 – Um corpo de massa 200g a 50 °C feito de um material desconhecido é mergulhado em 50g de
água liquida a 90 °C. O equilíbrio térmico se estabelece a 60 °C. Sendo 1 cal/g. °C¹ o calor especifico da água e
admitindo só haver troca de calor entre o corpo e a água, determine o calor específico do material
desconhecido?
Q1 + Q2 = 0
Pg. 281 / A12 – Mistura-se m1 = 50g de álcool na temperatura 1 = 18 °C com m2 = 50g de álcool na
temperatura 2 = 54 °C. Qual a temperatura de equilíbrio térmico?
= m1.1 + m2.2 / m1 + m2
Pg. 282 / A14 – Um pequeno cilindro de alumínio de massa 50g esta colocado numa estufa. Num certo
instante, tira-se o cilindro da estufa e, rapidamente joga-se dentro de uma garrafa térmica que contem 330g de
água. Observa-se que a temperatura dentro da garrafa eleva-se de 19 °C para 20 °C. Sendo 1 cal/°C a
capacidade térmica da garrafa, determine a temperatura da estufa no instante em que o cilindro foi tirado.
calor especifico Alumínio: 0,22 cal/g.°C e da água: 1 cal/g.°C
RESOLVER EXERCÍCIOS
Página: 276 – Ex: A1 , A2 , A3
Página: 278 – Ex: A4 , A5 , A6 , A7
Página: 281 – Ex: A8 , A9 , A11 , A12
Página: 282 – Ex: A13 , A14 , A15