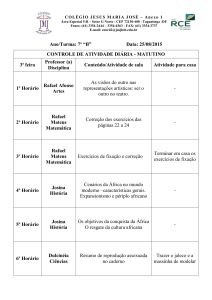
QUÍMICA
EXERCÍCIOS
Professor: Rafael Odorico
1. (PUC-MG) Fosgênio, COCl2, é um gás venenoso. Quando inalado, reage com a
água nos pulmões para produzir ácido clorídrico (HCl), que causa graves danos
pulmonares, levando, finalmente, à morte: por causa disso, já foi até usado como gás
de guerra. A equação química dessa reação é:
COCl2 + H2O → CO2 + 2 HCl
Se uma pessoa inalar 198 mg de fosgênio, a massa de ácido clorídrico, em gramas,
que se forma nos pulmões, é igual a:
a) 1,09 . 10-1.
b) 1,46 . 10-1.
c) 2,92 . 10-1.
d) 3,65 . 10-2.
e) 7,30 . 10-2.
Professor: Rafael Odorico
2. (CESGRANRIO) O álcool etílico, C2H5OH, usado como combustível, pode ser
obtido industrialmente pela fermentação da sacarose, representada
simplificadamente
pelas equações:
C12H22O11 + H2O → 2C6H12O6
2C6H12O6 →2C2H50H + CO2
Partindo-se de uma quantidade de caldo de cana, que contenha 500 kg de sacarose,
e admitindo-se um rendimento de 68,4%, a massa de álcool obtida em kg será:
Dados: C = 12 H = 1 O = 16
a) 44
b) 46
c) 92
d) 107
e) 342
Professor: Rafael Odorico
3. (UFRS) Noni (Morinda citrifolia) é uma das plantas medicinais tradicionais mais
importantes na Polinésia, sendo usada há mais de 2.000 anos. Dessa planta, é
isolado um composto, o damnacanthal, que vem sendo estudado devido à sua
atividade anticancerígena.
Observe abaixo a estrutura desse composto.
Assinale a alternativa que apresenta as funções orgânicas presentes na estrutura do
damnacanthal.
a) ácido carboxílico, aldeído, éter e álcool
b) aldeído, cetona, éster e fenol
c) ácido carboxílico, aldeído, éster e fenol
d) ácido carboxílico, cetona, éter e álcool
e) aldeído, cetona, éter e fenol
Professor: Rafael Odorico
4. (UFPR/2014) O salicilato de metila é um produto natural amplamente utilizado
como analgésico tópico para alívio de dores musculares, contusões etc. Esse
composto também pode ser obtido por via sintética a partir da reação entre o ácido
salicílico e metanol, conforme o esquema abaixo:
A reação esquematizada é classificada como uma reação de:
a) esterificação.
b) hidrólise. c) redução.
d) pirólise.
e) desidratação.
Professor: Rafael Odorico
5. (UFPR/2014) A pólvora negra, utilizada como propelente em armas de fogo,
consiste numa mistura de enxofre, carvão vegetal e salitre. A reação que causa a
propulsão e lançamento do projétil é descrita por:
2KNO3(s) + S(s) + 3 C(s)
→
K2S(s) + N2(g) + 3 CO2(g)
Para formular uma mistura baseada na estequiometria da reação, a proporção em
massa dos constituintes enxofre, carvão vegetal e salitre na mistura deve ser,
respectivamente:
a) 12%, 13%, 75%.
b) 32%, 12%, 56%.
c) 33%, 17%, 50%.
d) 35%, 11%, 54%.
e) 40%, 20%, 40%.
Professor: Rafael Odorico
6. (UFPB) Em 1996, o prêmio Nobel de Química foi concedido aos cientistas que
descobriram uma molécula com a forma de uma bola de futebol, denominada
fulereno (C60). Além dessa substância, o grafite e o diamante também são
constituídos de carbono. Os modelos moleculares dessas substâncias encontram-se
representados abaixo.
A respeito dessas substâncias, é correto afirmar:
a) O grafite e o diamante apresentam propriedades físicas idênticas.
b) O fulereno, o grafite e o diamante são substâncias compostas.
c) O fulereno, o grafite e o diamante são isótopos.
d) O fulereno, o grafite e o diamante são alótropos.
e) O fulereno é uma mistura homogênea de átomos de carbono.
Professor: Rafael Odorico
7. Em uma das etapas de tratamento de água, ocorre a retenção de partículas
sólidas em uma massa gelatinosa constituída de hidróxido de alumínio - Aℓ(OH)3.
Essa substância é preparada pela adição de Ca(OH)2 e Aℓ2(SO4)3 à água contida
em tanques de tratamento. Qual a massa, em gramas, de Aℓ2(SO4)3 que deve reagir
com Ca(OH)2 para formar 0,1 mol de Aℓ(OH)3?
Professor: Rafael Odorico
8. (UFPR) Um elemento químico possui massa atômica A = 39,098 u.m.a. e número
atômico Z = 19. Acerca desse elemento, considere as seguintes afirmativas:
1. A substância pura desse elemento apresenta-se na forma de um metal em
condições normais.
2. O íon mais estável desse elemento apresenta carga +2.
3. Esse elemento formará compostos iônicos com os elementos do grupo XVII.
4. A substância pura desse elemento deve ser inerte (não reage) com água.
Assinale a alternativa correta.
a)
b)
c)
d)
e)
Somente a afirmativa 3 é verdadeira.
Somente as afirmativas 1 e 2 são verdadeiras.
Somente as afirmativas 2 e 4 são verdadeiras.
Somente as afirmativas 1 e 3 são verdadeiras.
As afirmativas 1, 2, 3 e 4 são verdadeiras.
Professor: Rafael Odorico
9. (UNESP SP) Três substâncias puras, X, Y e Z, tiveram suas condutividades
elétricas testadas, tanto no estado sólido como no estado líquido, e os dados obtidos
encontram-se resumidos na tabela.
Com base nessas informações, é correto classificar como substância(s) iônica(s)
a)
b)
c)
d)
e)
Y e Z, apenas.
X, Y e Z.
X e Y, apenas.
Y, apenas.
X, apenas.
Professor: Rafael Odorico
10. (UFPR) A tabela periódica dos elementos está organizada em grupos e períodos.
Cada grupo possui uma característica, que tem pequena variação nos períodos.
Tendo posse da informação sobre o número de prótons e nêutrons de um átomo, é
possível associá-lo a um grupo e um período e assim prever seu comportamento.
Um átomo de um elemento X possui 16 prótons e 16 nêutrons.
A partir dessa informação, considere as seguintes afirmativas:
1. A substância pura de X é sólida à temperatura ambiente.
2. O íon mais estável de X possui carga 2-.
3. O hidreto desse composto possui massa molar igual a 34 g.mol-1
4. O produto da reação de combustão de X é um óxido covalente.
Assinale a alternativa correta.
a) Somente a afirmativa 1 é verdadeira.
b) Somente as afirmativas 1 e 2 são verdadeiras.
c) Somente as afirmativas 2, 3 e 4 são verdadeiras.
d) Somente as afirmativas 1, 3 e 4 são verdadeiras.
e) As afirmativas 1, 2, 3 e 4 são verdadeiras.
Professor: Rafael Odorico