Halogenação
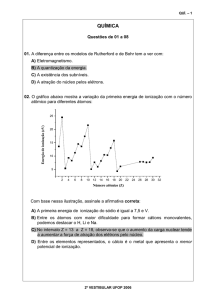
INTRODUÇÃO
DIFERENTES CONDIÇÕES DE PROCESSO
PARA DIFERENTES ESTRUTURAS
Se aromático, parafínico, derivado nitrogenado, já contendo halogênio
na estrutura, tipo de halogênio, .....
Diferentes condições, fase de condução da reação, pressão, uso ou
não de catalisador, tipo. Se catálise homogênea ou heterogênea.....
IMPORTÂNCIA DA HALOGENAÇÃO
Aplicabilidade dos produtos
Disponibilidade de matérias-primas
Baixo custo Cloro * e hidrocarbonetos
• GRAU IMPORTÂNCIA POR HALOGÊNIOS
Clorados,
fluorados
Derivados de bromo e iodo
PRIMCIPAIS RAMOS DE APLICAÇÃO
SOLVENTES
Tricloroetileno, cloreto de metileno, tetracloreto de carbono
INTERMEDIÁRIOS
Clorohidrinas, cloretos de alquilas, cloretos de arila
MONÔMEROS;
Clorados: cloreto de vinila, cloreto de vinilideno
Fluorados: PTFE, FEP * (trifluorcloroetileno)
REFRIGERANTES INDUSTRIAlS
Freon α = C-1
β = H +1
δ=F
PLASTIFICANTES
Fenilbenzenoclorado, Mirrex*
*(produto da dimerização do hexaclorociclopentadieno)
INSETICIDAS
Hexaclorociclohexano, Mirex
Cloroderivados de ácidos e de fenóis.
PESTICIDAS
Derivados de cloro ou bromo
Hexaclorociclopentadieno, M.P p/ Heptachlor
LUBRIFICANTES :
Características importantes………..
ASPECTOS MARCANTES
DOS HALOGÊNEOS/ HALOGENAÇÃO
CORROSÃO
Fluor e cloro altamente reativos
EXPLOSIVIDADE
Consequência da elevada entalpia de reação
REATIVIDADE
F > Cl > Br > I
SOLUBILIDADE
Solúveis normalmente em líquidos orgânicos, Particularmente clorados
Br2 > Cl2 > F2
HBr > HCl > HF
AGENTES HALOGENANTES
Cl2 :
Eletrólise do NaCl (aq)
Na+
Fusão
HCl:
H2
(H2, NaOH e Cl2)
+ Cl-
Na0
+ Cl2
+ Cl2
ClO F2
HF :
eletrólise
(fluorita)
KHF2 (fundido)
+
H2SO4
F2
HF .
Emprego em solução até 60% em temperatura baixa* ou liquefeito
*Materiais de contato, monel, hasteloy....ligas com Cu, Ni.
Temperatura elevada (seco) Cerâmica, vidro, chumbo.
Br:
eletrólise
BrO3, BrO-
HI, I2 (catalisadores, PCl3, POCl3)
COCl2 (fosgênio)
SOCl2 ou SO2Cl2 ,
Benzotricloreto,
Misturas halogênicas (IBr, ICl “cloreto de iodo”, ativo em condições
suaves
Ex. Iodação de compostos amínicos
EXEMPLO DE SELETIVIDADE X CONDIÇÕES DE REAÇÃO
P /ex. A presença ou não de catalisador ou forma de iniciação leva a
diferentes produtos (diferentes mecanismos envolvidos)
H
λυ
H
H
+
Cl
Radicais livres
H
H
H
Cl
+
Cl
HCl
H
H
H
H
H
H
110 – 120º C
H
H
H
H
FeCl3
25º C
H
H
H
H
Cl
Cl
H
Iônico catalítico
Curiosidade?
1 - Composto clorados naturais
2 - DDT (dicloro-difenil-tricloroetano)
3 - Dioxinas
PROCESSOS DE HALOGENAÇÃO
SUBSTITUIÇÃO - tanto em fase líquida quanto gasosa
ELIMINAÇÃO DE HIDROGÊNIO - A reação ocorre tanto para
carbono saturado, insaturado ou aromático.
Reatividade: Em temperatura baixa (ambiente) - saturados
Cprimário < Csecundário < Cterciário
Obs. Para favorecer a reação em carbono terciário
reação em fase líquida
Comparada aos compostos saturados a substituição em
insaturados e aromáticos apresenta maior dificuldade requerendo
temperaturas elevadas.
Nas olefinas, particularmente, as reações efetuadas em fase gás
(mecanismo por radicais livres) concorre paralelamente adição e
substituição. Em temperatura elevada predomina substituição e em
temperatura baixa a adição. Os aromáticos tendem ao mesmo
comportamento.
Em um alquilaromático, o radical longo favorece reação no radical.
Porém, sempre o carbono α será o mais reativo. Contudo, em fase
líquida e temperatura baixa prevalece adição no anel. Só em
temperatura mais elevada ocorrerá substituição no núcleo.
Em uma olefina é o carbono saturado aquele
substituído
preferencialmente
REATIVIDADE X TAMANHO DA CADEIA EM SATURADOS
Quanto maior a cadeia mais fácil se torna a substituição e mais
energética e a reação.
REATIVIDADE X SUBSEQUENTE HALOGENAÇÕES
Havendo halogênio na molécula a reatividade reduz, o carbono
que contem o cloro terá maior atividade que os outros.
Normalmente menor é a energia liberada nas posteriores
substituições tanto para alifáticos quanto para arom/aticos.
SUBSTITUIÇÃO DE OH
Reações em :
álcoois
ácidos
ROH + HCL
ZnCl2
(COCl2 ou SOCl2)
RCl + H2O e
cloreto de ácido
SUBSTITUIÇÃO DE HALOGÊNIO POR HALOGÊNIO
(cloro por fluor),
Ainda: bromo, iodo
RBr + NaCL
RCl + NaBr
ADIÇÃO
Insaturados e aromáticos
Reações
normalmente conduzidas na presença de solventes
policlorado) , o-clorobenzeno, hexaclorobutadieno.
Halogenantes — Halogêneos e halogenetos de hidrogênio
Obs. Segue a regra de Markovinikoff, halogênio entra no carbono
mais pobre em hidrogênio
HIPOCLORAÇÃO ou CLOROHIDRINAÇÃO
Halogenante Cl2 e H2O
DECOMPOSIÇÃO
DEHIDROCLORAÇÃO
∆
RHyClx
*
RHy-1 Clx-1 + HCl
* A cinética de dehidrocloração é mais favorável
DECLORAÇÃO
RClx (policlorado sat.)
Cl2
∆ *
RCl x-2 (insaturado) + Cl2
Zn (KOH)
*Favorável à decloração
CLORINÓLISE
∆
RCIx (policlorado sat.) + Cl2
CCl4 + (policlorado saturado)
KCl
PIRÓLISE
(C primário < C secundário < C terciário)
RClx (policlorado)
∆
CCl4 + (policlorado insaturado)
Obs. A síntese do fosgênio é na realidade uma reação de halogenação
de um composto de carbono de reduzido estado de oxidação
CO + Cl2
COCl2
AVALIACÃO DA ENTALPIA NAS REAÇÕES DE HALQGENAÇÃO
≠ ENERGIAS ENVOLVIDAS
≠
CONTROLES DE PROCESSO
A energia de ativação de uma dupla ligação é bem diferente de
uma tripla, em consequência a entalpia de adição é muito diferente
da entalpia de substituição
Simples = 88,0,
dupla = 95,5
e
tripla = 124,5 Kcal
ASPECTOS TERMODINÂMICOS
∆G = ∆ H + T∆ S
reação possível
∆G < 0
∆G0 = RT ln K
∆S em todas as reações de halogenação é muito pequeno
*
REAÇÕES DE SUBSTITUIÇÃO
∆S ≥ 0
CH3 -H + X2
R- CH2 – X + HX
C – C = 88 Kcal
C - H = 87,7 Kcal
Halogênio X2
∆ H0 (Kcal/mol (25º C)
F2
-110
Cl2
-25
Br2
-8
I2
+12
REAÇÕES DE ADIÇÃO
∆S < 0
≈ -20 cal/mol
CH2=CH2 + X2
XH2C – CH2X
AG favorável a todas as reações
Cloro até 1000° C
Bromo 700 o C
Iôdo
50 o C
Halogênio X2
∆ H0 (Kcal/mol (25º C)
F2
-130
Cl2
-44
Br2
-22
I2
-4
REAÇÃO DE HIDROHALOGENAÇÃO
∆S < 0
≈ -30 cal/mol
CH2=CH2 + HX
∆
Equilíbrio favorável até
H3C – CH2X
250 oC para cloro
200 oC para bromo
200 oC para iôdo
Halogênio HX
∆ H0 (Kcal/mol (25º C)
F2
-10
Cl2
-17
Br2
-19
I2
-19
MECANISMO DE HALOGENAÇÃO
RADICAIS LIVRES (ou átomos livres) (reação em cadeia)
Frequentemente em fase gasosa e ausentes de catalisadores.
Aplicado mais frequentemente na halogenação de olefinas e
aromáticos em reações de substituição para inibir a adição.
Formas de ativação:
Por iniciação térmica, catalisadas ou não por Na, K,
Pb-Alquil, ou ainda H
Ação de luz (fotoquímica) ou
Química
Obs. Parafinas normalmente por ativação térmica
H
SUBSTITUIÇÃO X ADIÇÃO
H
H
Cl
I
H
H
Cl
Cl
H
H
H
H
H
H
+
Cl
Cl
CH3
H
H
II
+
HCl
H
H
Cl
H
H
III
H
H
H
Cl
H
Obs. Quando se submete o propileno a reação de substituição ocorre quase
que exclusivamente a formação do composto I. Enquanto a decomposição
do 1-2 dicloropropano favorece a produção do 2-cloropropeno.(II)
Temperatura crítica a partir da qual só ocorre substituição
O Isobutileno só sofre substituição.
Etileno 270oC
Propileno 250oC
2- buteno 170oC
AVALIAÇÃO DA SELETIVIDADE
Em relação à cadeia
Carbono alílico é mais reativo que insaturado
Em relação à reações sucessivas
Quanto maior a substituição mais difícil as consecutivas
substituições
No caso de Compostos aromáticos
É mais reativa a cadeia lateral (mais etrofílica)
Após saturado o radical alquila, começa a ocorrer
halogenação no núcleo benzênico, preferencialmente o
carbono α
Nota: A adição do benzeno se dá em temperatura ambiente.
CINÉTICA DAS REAÇÕES POR RADICAIS /ou átomos LIVRES
ETAPAS DO PROCESSO
Iniciação ( formação dos radicais reativos)
Propagação
Término
INICIAÇÃO (principais ativadores (formas de ativação)
Cl2 ∆
Átomo livre
Radicais R •
CI• + Cl ads. (colisão)
Fotohalogenação
Radiação eletromagnéca (UV) EAT = 21 a 42 KJ / mol
Cl2 + λ
2 CI•
λ (Hg- Quartzo)=4875A°
Ativação Térmica
EAT = 126 a 168 KJ / mol
Colisão nas paredes do reator
Cl2 colisão
CI• + (Cl ads
quimiosorção)
Aquecimento
Cl2
∆ (100 - 150°C)
2CI•
Seletividade C 1ario< C2ario < C3ario (liquido ou vapor)
C 1ario ativação em temperatura elevada, 2ario e 3ario em
temperatura mais baixas
Em temperaturas extremamente altas
Saturados
polihalogenação
Olefinas
reações de substituição
Em relação as olefinas, quanto menor a cadeia, mais
favorável é a adição.
Temperatura intensa
Pirólise (quando + intenso o aquecimento) C1°< C2°< C3o
Antes porém ocorre dehidrohalogenação com formação de:
HX e Halo-olefina
Obs. C3° tem maior tendência a formação de halo-olefinas que
os secundários.
Forma de Controle:
Se temperatura é crítica
Reação em solvente
Tempo de residência
ATIVADORES QUÍMICOS
EAT = 84 KJ / mol
São substâncias que com reduzida energia de ativação e em baixa
temperatura decompõem gerando radicais livres.
A velocidade de reação depende da temperatura e da concentração
do iniciador
Hidroperóxidos ROOH, peróxidos ROOR, (azobisisobutironitrila)
H
H
H
O
H
H
O
O
H
H
H
H
C
+
O O
H
H
O
H
H
H
Peróxido de benzoíla
H
H
H
H
H
H
CO 2
N
CH3
H
CH3
H
H
N
N
N
2
H3C
H3C
POROFOR
+
C
N
H
H
N
H
(azobisisobutironitrila)
PROPAGAÇÃO (REAÇÃO EM CADEIA)
RH
CI•
+
R• +
H
Cl2
RCl
H
H
CI•
H
+
H
H
Cl
H
C
H
C
H H
H
H H
H
H
H
H
+
+
H
H
H
H
+
HCI
H
H
H H
+
H
H
H
H
R•
Cl
H
Cl Cl
H
HCl
H
H
H
H H
H
+
Cl
N
Mecanismos
Colisão bimolecular
(função da energia (T e P) )
H2 + X2
2 HX
(não há propagação)
Reação em cadeia
(presença de radical livre ou átomo livre)
Função do calor absorvido e da E AT do iniciador)
Obs. Pureza dos reagentes interfere na propagação
TÉRMINO
ex. O2 inibidor nas reações de adição
( bloqueio de radicais livres)
TÉRMINO DAS REAÇÕES EM CADEIA
Pelo bloqueio do radical ativo
Adsorção do átomo na parede do reator
CI•
Cl ads
Pela associação de átomo livre e radical livre
Interações na molécula do radical livre
H
H
H
H
H
H
H
H
R
H 1
H
R1
H
H
H
H
C
H
H
H
H
R1 H
H
H
C
CH
H
+
H
H
H
H
H
+
H
R2
H
H
C
HH
H2
H
R2
H
H
H
R2
H
H
H
H
H
H
H
C
HH
H
C
CH
H
H
R2
H
H
H
C
HH
+
R2 H
H
H
R2
H
H
H
H
H
H
H
H
H
H
H
H
H C
R2
C
H
H HH
H
R
H 2
H
H
H
+
H
Bloqueio via inibidor do radical ( VENENOS )
Ex: O2, Compostos de enxofre, Fenóis
INFLUÊNCIA DA TEMPERATURA NAS REAÇÕES DE HALOGENAÇÃO
SEGUNDO A FORMA DE INICIAÇÃO
TÉRMICA OU QUÍMICA
Para ativação térmica ou química, o controle de temperatura é
fundamental para a dinâmica do processo. Catalisadores heterogêneos
reduzem a energia de ativação das reações iniciadas termicamente. Na
iniciação química, além da temperatura, também a concentração de
iniciador afeta positivamente a cinética
FOTOQUÍMICA
Na iniciação fotoquímica pouca influência terá a temperatura sobre o
processo. Depende apenas da intensidade da radiação
SELETIVIDADE NAS REAÇÕES DE HALOGENAÇÃO
(REAÇÕES PAPALELAS)
ADIÇÃO X SUBSTITUIÇÃO
(OLEFINAS OU AROMÁTICOS X PARAFINAS)
FUNÇÃO (k
EAT
T)
Para reações de mesma ordem e mesma molecularidade
Cl• + CH2 = CH2
k1
CH2Cl - C• H2
Cl• + CH3 - CH3
k2
CH3 - C• H2
S1
k
k k
1
(adição) S1
1
2
k
1
(substituição)
2
k k
+ HCl
2
S1
1
1 k 2
k
Pela lei de Arrhenius
k k exp( E At. )
RT
0
daí,
1
Substituindo a expressão das constantes cinéticas em S1 teremos:
S
1
1
0
k
E
E
At
2
At
1
2
1 0 exp
RT
k 1
Valores para energia de ativação
E1 (adição)
= 25,2 kcal/mol
E2 (subtituição) = 43,4
“
Logo, se a energia de ativação aumenta, a reatividade diminui e
consequentemente, a adição será mais favorável que a substituição.
Somente se a temperatura aumenta tem-se a formação de compostos por
substituição
TENDÊNCIA A SUBSTITUIÇÃO, SEGUNDO A ENERGIA DE ATIVAÇÃO:
CH2=CH-H < AR-H << C1-H < C2 –H < C3 – H < CH2 CH-CH2 < AR-CH2 -H
Mais difícil reação
mais fácil
FATORES RELEVANTES PARA REAÇÕES DE HALOGENAÇÃO
A presença de cloro na molécula diminui a reatividade em relação à
substituição.
Quanto mais afastado do cloro mais reduzido o efeito da
desativação
A reação na presença de solventes clorados (o-diclorobenzeno,
hexaclorobutadieno) favorece reações em outras posições, devido a
formação de complexos que alteram a atividade do átomo de cloro
O átomo de hidrogênio do carbono adjacente ao cloro é desativado.
PROCESSOS DE HALOGENAÇÃO EM FASE LÍQUIDA
JUSTIFICATIVA
Obtenção de compostos termicamente instáveis
(perdem facilmente HCl)
Ex.: monocloroparafinas de elevado PM
Policlorados de alto PM
Derivados clorados do etano
Quando se deseja seletividade. Quando processo térmico é pouco seletivo
Elevado calor de reação — dificuldade de troca térmica por fluido gasoso
CARACTERÍSTICAS DOS PROCESSOS
Normalmente iniciados por radicais livres ou por radiação
Baixa temperatura de operação até no máximo 1500 C
PRODUTOS OBTIDOS VIA REAÇÃO EM ESTADO LÍQUIDO
Policloroderivados do etano : 1,1,2-tricloroetano
Materia prima para cloreto de vinilideno
Hexacloroetileno
Materia prima para solventes fluorado, monômero do FEP,..
Cloroparafinas ,
Matéria prima para
detergentes (querozene)
plastificantes - aditivos para plásticos (cloro aumenta
flexibilidade e adesão)
CARACTERÍSTICAS GERAIS DOS PROCESSOS DE REAÇÕES EM FASE LÍQUIDA
REATORES DE PROCESSO
Borbulhamento
SOLVENTE: Reagente
solvência
reação em solução
em excesso, ou o-diclorobenzeno, hexaclorobutadieno,
tetracloreto de carbono ou ainda reação em suspensão aquosa.
CONTROLE DO PROCESSO
Concentração do iniciador, reagente (halogenante) temperatura ou
intensidade de radiação
FORMAS DE RESFRIAMENTO EMPREGADAS
Recirculação ( circulação forçada). Alimentação contracorrente
Circulação natural. Uso de calor latente
batelada
Contínuo
Observação quanto a eficiência dos reatores em relação à sua
configuração
Batelada
Nescessidade de eficiente agitação
(Cotato entre fases, troca térmica)
Agitação no reator (ideal)
dificuldade construtiva
Por circulação externa (trocador externo ao reator)
Deficiência no contato entre fases
Comprometimento da seletividade
Reator contínuo
Resfriamento externo ineficiente
Resfriamento interno - fluxo preferencial - pode prejudicar o
contato entre fases
seletividade comprometida
Pratos ou reatores em série, mais eficiente
ETAPAS DE UM PROCESSO DE HALOGENAÇÃO
1- PREPARACÃO DOS REAGENTES
Vaporização:
Do halogenante
Da matéria prima, se reação no estado de vapor
Secagem
H2S04, Destilação azeotrópica ou emprego de adsorventes
Aquecimento*
Obs. Remoção de impurezas sólidas, quando presentes,
Sais e óxidos metálicos catalisam reação iônica
Remoção de compostos de enxofre
2- SEPARACÃO E REFINO DO HALOGENOCOMPOSTO
Remoção do HCl dissolvido
Se RCI tem ponto de ebulição elevado
Arraste com N2 ou ar
Se RCl tem ponto de ebulição baixo
Lavagem em contracorrente, ou
Destilação fracionada
condensação do HCl e RCl
3- PURIFICAÇÃO DO COMPOSTO FINAL
Remoção do solvente ou matéria prima em excesso
Cristalização,
Filtração,
Destilação com vapor ou
Destilação fracionada
3. TRATAMENTO DOS EFLUENTES GASOSOS
Recuperação da matéria prima (reciclado ao processo)
Se condensável
resfriamento
Se não condensável
absorção em solvente ( scrubber)
solventes - subprodutos halogenados de PE elevado
Recuperação do HCl
Provenientes das reações de adição
Reduzida quantidade de HCl
Lavagem com
água
Neutralização com soda
Descarte
Proveniente de reações de substituição
Adsorção em água
solução 20 a 30 %
Reuso (anidro) plantas de halogenação
ex.
HCl + CH3OH
CH3Cl + H2O
REATORES PARA HALOGENAÇÃO EM FASE GASOSA
PRINCIPAIS PRODUTOS OBTIDOS
Derivados do metano (mono, di, tri e tetra substituídos)
Halogenante cloro
Produtos:
Cloreto de metila* MP. para dimetil diclorosilano
* mais econômico porém através da cloração do metanol
(HCl residual) reação em fase líquida
Compostos alílicos e metilalílico (isobutileno) e também do
butadieno (produção de adiponitrila, hexametilenodiamina)
Obs.: O2 afeta pouco as reações em fase gasosa
CA RACTERÍSTICAS GERAIS DOS PROCESSOS GASOSOS
Reduzido tempo de residência (processo contínuo)
Operação a pressão atmosférica
Reagentes pré-misturados anterior ao reator
TIPOS DE REATORES EMPREGADOS
Com acumulador térmico
(Corpo cerâmico ou recheio )
Reações exotérmicas, o calor de reação otimizado para
aquecimento dos reagentes
Termocatalítico
(leito catalítico fluidizado pré-aquecido)
Tubular ( de passagem),
Pré aquecimento dos reagentes préviamente misturados
Tempo de residência: de 0,1 a 2,0 s.
ETAPAS DE UM PROCESSO EM FASE GASOSA
PRÉ-TRATAMENTO DOS REAGENTES
Secagem
Pré- aquecimento e mistura dos reagentes (MP e reciclo)
Remoçao do HCl formado
Reciclagem da matéia prima
REMOÇÃO DO HCl
Se produtos de elevada pressão de vapor
Ex. metano, monoclorometano, etc..
Lavagem com água
HCl 30%
Os Gases são resfriados e comprimidos
A fase líquida é separada, secada e posteriormente segue para
destilaçâo fracionada. A fase gás é reciclada
Se fácil condensação
Isolam-se as fases
lava-se
seca-se
fracionada. A matéria prima é então reciclada.
destilação
HALOGENACÃO POR MECANISMO IÔNICO CATALÍTICO
Reações de adição
Ligação dupla, tripla
Reações com: ClO , HCl
Reações de substituição
No anel aromático
Halogenação de compostos contendo nitrogênio ou
oxigênio
CARACTERÍSTICAS DAS REAÇÕES
Reações em fase líquida
Operação em temperaturas baixas
Sem uso de iniciadores/ luz
Uso de catalisador — ácido aprótico
Reação à pressão atmosférica *
CATALISADORES (ácidos apróticos)
FeCl3, Al Cl3, SbCl3, SbCl5, BiCl3, SnCl4, HgCl2, ZnCl2, BF4, etc..
MECANISMO DE REAÇÃO
RCH = CH 2 + HCl + AlCl 3 → RC+H-CH3 + AlCl 4δ+
Cl 2
+
FeCl3
Cl
δ_
Cl
: FeCl3
H
H
H
H
Cl
H
Cl
H
Cl
+
Cl
δ_
Cl
: FeCl3
FeCl 3
H
H
δ+
H
H
H
Cl
H
+
H
+
δ_
C
H H
H
Cl
Cl
FeCl 3
δ+
: FeCl 3
FeCl3
Cl
Obs.:
Reações de 1ª ordem em relação ao cloro e ao catalisador
Reatividade: Função da olefina, dependendo em consequência, da maior
ou menor estabilidade do complexo formado.
RCH = CH2 > CH2 - CH2 ≥ CH2 = CH-Cl
Obs.: Além das reações de adição, ocorrem também reações paralelas
de substituição (radicais livres) via cloro e olefinas
CH2 = CH2 + Cl2
C• H1- CH2 – Cl + Cl •
Para inibir esta reação paralela, trabalha-se em temperatura baixa
ou emprega-se o efeito de inibição incorporando O2
TECNOLOGIA DE HALOGENACÃO VIA MECANISMO IÔNICO
CARACTERÍSTICAS
Elevada seletividade
Elevada velocidade
Obs,: Apenas a secagem dos reagentes se faz necessário para
evitar hipohalogenação.
CONDUÇÃO DO PROCESSO
Adição das substâncias gasosas através do líquido
Opção de dissolução do agente halogenante no solvente e
posterior borbulhamento do hidrocarboneto
TROCA TÉRMICA
Via refluxo , interno, ou circuito externo
Sistema conjugado de reação com destilação fracionada.
Otimização do calor de reação para efetuar o fracionamento.
HIDROCLORACÃO
REATIVIDADE
Atenção, ainda que exotérmica , estas reações são reversíveis
Quanto ao halogenante: HI > HBr > HCI > HF ( ordem inversa
em relação ao halogênio livre)
Quanto ao Alceno: Idêntica para a adição de cloro
MECANISMO DE REAÇÃO
H
H
HCl
H
H
H
H
H
H
H
FeCl 3
H
H
H
+
C
H H
δ+
FeCl 3
Cl δ FeCl 3
-
Cl
FeCl 3
H
H
H
+
C
H H
Cl
H
H H
Cl
H H
+
FeCl 3
REAÇÕES PARALELAS DE HIDROHALOGENAÇÃO
Polimerizaçao (compostos de baixo peso molecular)
H
H
H
+
C
HH
H
δ-
δ+
H2C
CH2
H
H
C
H
H
H
+
H
H
H
δ-
δ+
H2C
CH2
H
H
H
H
H
H
H
H
H
H
H2C
+
C
CH2
H
H
H
Obs. : O catalisador atua da mesma forma favorecendo a reação
CONTROLE : Operar a temperatura reduzida e elevando a concentração do HCl
CATALISADORES: SAIS DE: Fe, Cu, Zn, etc...
HIDROHALOGENAÇÃO DO ACETILENO
Produz cloreto de vinila e consecutivamente dicloroetano.
Catalisador seletivo para cloreto de vinila
Hg+2 em fase gás ou (Cu+1 , em NH4Cl, em fase líquida)
Reações paralelas
Hidratação do acetileno
Hg+2 acetaldeldo (se presente água)
Controle ,
Reação em fase gás temperaturade 150 a 200º C
acetileno
Cu+1
dimerização
Controle
Com elevada concentração de HCl
vinilacetileno
HALOGENACÃO EM COMPOSTO AROMÁTICO POR
MECANISMO IÔNICO
Na presença de catalisador,
Mecanismo iônico
substituiçao no anel
Diferença em relação ao mecanismo por radicais livres
Substituição na cadeia lateral e posterior adição no núcleo.
H
H
H
+ Cl
H
H
Cl
+
FeCl 3
H
δ+
H
H
H
Cl
H
H
H
H
H
Cl Cl
H
H
H
H
H
Cl
H
Cl
-
+
+
+
H
H
H
H
HCl
+
FeCl 3
+
_
Cl
FeCl 3
Orientação nas reações de substituição no núcleo aromático
Substituintes eletron-doadores presentes no anel tais como
Hidroxila, radicais alquila favorecem a reação, ativando o anel
aromático e conduzindo a substituição para as posições orto e para.
Substituintes eletron - receptores desfavorecem a substituição .
Quando esta acontece, o halogênio substitui na posição meta
Exemplo de receptores de eletron - grupo substituinte NO2, Cl
Substituição sucessiva por átomo de halogênio
O cloro, desativa o núcleo tornando as subseqüentes reações
mais lentas e orientando para as posições orto e para.
HALOGENAÇÃO EM PRESENCA DE ÁGUA
Com uso do cloro
clorohidrinação (hipocloração)
Principal produto – clorohidrinas
Reação na ausência de catalisador
Reatividade das olefinas
RCH=CH2 > CH2=CH2 > CH2=CH-CH2Cl
Quanto aposição na cadeia
O átomo de cloro menos eletronegativo que a hidroxila atua
como proton ligando-se ao carbono mais hidrogenado
Mecanismo de Hipohalogenação
Cl2
HOCl + H+
+
H
H
H2O
Cl
H
+
Cl2
H
H
H
H
H2O
H
Cl
-
H
H
O
+
C
H
H
H
Cl
H
OH
H
H
H
H
H
H
H
+
H
H
H
HClO + HCl
H2O ...Cl+
H
H2O…Cl
+ H2O
H
Cl
H
+
H Cl
C H
H
Cl δ+
H OH
δ- Cl
H
+
H
H Cl
+
C H
H
H
H
+
OH
Cl
H
H
H
H
OH
Cl
H
H
+
+
H
_
+
H
PRODUTOS DE REAÇÃO CONSECUTIVA NA HIPOHALOGENÇÃO
Cl R+ +
Cl R+ +
ClHO – R – Cl
Cl – R - Cl
-H+
Cl – R - O – R - Cl
CONTROLE DA SELETIVIDADE
Operar com solução diluída de forma a reduzir a concentração de
íon cloreto, da mesma forma mantendo a concentração reduzida
de clorohidrina formada
EMPREGO DAS CLOROHIDRINAS
Produção de α- óxidos (oxiranos- (óxidos de olefinas))
Matéria prima para a produção de resinas epóxi , polióis,
tensoaticos não iônicos, solventes, etc.
FORMAÇÃO DE UM OXIRANO
H
O
H
HR
H
H
H
H
H
O
-
H
H R
H
H
O
H
+
H2O
Cl
Cl
HALOGENACÃO DE COMPOSTOS CONTENDO OXIGÊNIO
Reações de substituição em álcool, aldeídos ou cetonas
Halogenante – HX
Reatividade
C terciário
>
Csecundário
> Cprimário (catálise com ZnCl2)
+
Cl
-
MECANISMO DE REAÇÃO
A reação ocorre ocorre a custa da protonação do átomo de oxigênio
RO+H2 + X-
ROH + HX
H
H R
H
H
H
+
H
Cl
ZnCl2
O
H
RX +H2O
H
H
R
H H
H
Cl +
+
ZnCl2
H2O
Equilíbrio favorável pela remoção da água formada
HALOGENANTE – X2 - Reação com álcool e cetonas
H H
O
H
H
H
+ Cl 2
2 HCl
H
H
H
+
O
H
H
Cl 2
Cl
H
HCl
Cl
O
H
+
Cl 2
Cl
Cl
O
HCl
Cl
H
HCl
H
H
Cl
O
H
+ Cl 2
HALOGENANTE – X2
Reação de ácido carboxílico com Cloro
H
H
H
H
PCl 3
+
O
O
Cl 2
O
H
+
H
H
O
H
H
H
H
H
H
O
H
H
O
H
Cl
H
H
O
HCl
O
O
+
H
H
H
Cl
H
Cl
+ HCl
O
O
H
H
H
O
O
Cl
O
Cl
H O
O
O
Cl
H
Cl
H
Cl
HCl
H
H
O
Cl
O
Cl
H
H
H
H
H
H O
Cl
H
PCl 3
H
Cl 2
H
Cl
H
H
H
Cloreto de ácido
Cl
O H
H H
H
O
Cl
H
H
HCl
HALOGENACÃO DE COMPOSTOS DE NITROGÊNIO
Obtenção de “cloraminas” (desinfetantes, mono e dicloraminas) , ou
agentes de bleaching (alvejantes)
O
O
O
O
O
O
Cl 2
S
Cl 2
S
+
Na
-
NH2
HO
NaOH
-
N
Cl
benzenesulfonamide
S
Cl
-
HO
NaOH
N
Cl
N,N-dichlorobenzenesulfonamide
O produto monoclorado apresenta solubilidade em água, enquanto que o
segundo, diclorado ‘solúvel em compostos orgânicos.O primeiro obtido em
de soluções diluídas, enquanto que o último através da hipocloração de
suspensão.
Produção de diisocianatos (Reação com fosgênio)
O
H
N
H
O
H
N
N
H
H
Cl
H
H
H
Cl
H
N
H
- 2HCl
H
H
H
+2
H
N
O
Cl
H
H
H
+
H
2 HCl
N
Cl
O
O
Outra reação de importância industrial é a obtenção conjugada de
ácido insaturado e halogeneto de alquila
Produção de ácido acrílico
Cl
H
H
Al 2(PO 4)3
OH
H
H
O
300oC
H
O
H
H
OH
+
HCl
Produção de acrilato de metila
Cl
H
H
2
H
O
H
H
O
H
H
H
+
O
H
H H
H
H
Al 2(PO 4)3
300º C
Cl
H
O
H
2
H
H
O
H
H
Obs.: reações sob pressão (40 atm)
+
H
2
H
H
+
H2O
REAÇÕES DE DECOMPOSIÇÃO
Decomposição Ténnica (eliminação de ácido clorídrico , cloro)
Objetivos:
Obtenção de produtos pelo aproveitamento de
clorados ( policlorados)
subprodutos
Processo alternativo a processos de maior custo
Processo que substitua o emprego de materiais prima mais
caras e consequentemente produza menor número de resíduos.
PROCESSOS IMPORTANTES
Obtenção de cloroolefinas (eliminação de HCI e/ou Cl2)
Obtenção de solventes (CCl4, hexalorobutadieno)
CARACTERÍSTICAS DA REAÇÕES
Endotérrnicas, exceto a clorinólise
Reversíveis
Facilidade de decomposição
C 3 ario
>
C 2ário
e policlorados de alto PM
Mecanismo – (Mais frequentemente radical livre )
Obs.
Na dehidrocloração, perde hidrogênio o carbono que tem menor
número deste.
As reações de dehidrocloração também podem de forma mais
seletiva ser conduzidas na presença de bases (mecanismo iônico)
Reações paralelas
Oxidação
Hidrólise
Processo conjugado (cloração oxidativa)
Reação de DEACON
2 HCl +
0,5 O2
CuCl2 +
KCl
H2O + Cl2
200 - 400º C
RH
+
HCl
+
O2
catalisador
200 - 400º C
Obs: Empregado com matérias-primas estáveis
RCl
+ H 2O
FLUORAÇÃO
Principais emprego de compostos fluorados
Lubrificantes, fluidos hidráulicos especiais, solventes , fluidos de
refrigeração, polímeros, etc
Reatividade:
F2 (reação em fase gas ) - Altamente reativo –
Mecanismo via radical livre
Elevado risco de explosão
diluição com gás inerte
Desnecessário emprego de iniciador
Obs.: Se reação em solução
temperatura reduzida
solvente fluorado ou CCI4 , em
Seletividade reduzida, tanto para substituição quanto para
adição.
HF , usado frequentemente em fase líquida
PROCESSOS DE FLUORAÇÃO
CATALÍTICA
F2 (N2) + RH
AgF2
Cuo
RF + HF
Obs.: Prata suportada em cobre
FLUORETOS METÁLICOS (agente de fluoração)
PROCESSO POR BATELADA :Temperatura 150 a 200oC
Emprego de sais ( CoF3 ; MnF3 (agentes de fluoração) –
RH + 2CoF3
RF + 2CoF2
Regeneração: 2CoF2 + F2
+ HF
2CoF3
300 a 380oC
∆H = -52 Kcal/mol
∆H = -58 Kcal/mol
FLUORAÇÃO ELETROQUÍMICA
Reação anódica - Fácil controle
Aplicação: polifluorados derivados de ácido carboxílico, éteres, ésteres,
aminas, etc.
HF ou mesmo KF dissolvido no hidrocarboneto, ou então emulsificado
Obs. Fluoretos metálicos dissolvidos melhoram a condutividade
FLUORAÇÃO DE CLORODERVADOS
VANTAGENS : Facilidade de substituição
R – C - O - Cl > Ar – CH2 –Cl > CH2 = CH – CH2 –Cl > Ar -Cl
CARACTERÍSTICAS
Reações normalmente conduzidas na presença de catalisadores
Compostos como
cloreto de ácidos, sulfocloretos, clorohidrinas,
apresentam grande facilidade de substituição, podendo inclusive ser usado
KF como agente de fluoração.
Enquanto que compostos com cloro ligado ao carbono α de um aromático,
ou de um cloreto de ácido, ou ainda um clorosilano, um cloreto de alquila ou
um ligado a um carbono vinílico necessitam de catalisador
Catalisadores: AgF, HgF2, SbF3,.....
Obs. : A adição de Cl2, SbCI3 ou SbCl5 ,aumenta a ação do catalisador SbF3
SbCl3 + 3HF
SbCl5
Catalisadores:
Sb F3 + 3 HCl
SbCl3
+ Cl2
SbCl3F2 ,
SbCl2F,
SbCl2F3
SbClF2
Necessidade da presença de cloros vicinais, no emprego destes
catalisadores, daí, a necessidade da presença de dois ou mais cloros no
mesmo átomo no de carbono
H
H
H
H
Cl
F
F
H
Sb F
H
Cl
F
H
F
F
Cl
F
H
+
Sb F
Cl
F
F
Seqüência de substituição
Cl
H
Cl
Cl
Cl
1º ou 2º
Cl
+
H
HF
F
Cl
HCl
Cl
Cl
Cl
Cl
F
F
3º ou 4º
F
SELETIVIDADE NA PRODUÇÃO DE FLUORCOMPOSTOS PARTINDO
DE CLORADOS
Temperatura
CHCl3
CHF3
Ponto de
ebulição
volatilidade
CHCl3
CHCl2F
CHClF2
Halogenocomposto
CHF3
Controle:
Destilação na medida da formação do produto
Temperatura x tempo de residência
Pressão de operação
Reciclo
Escolha da temperatura
função da reatividade
Primeiro e segundo cloro mais fáceis de substituir que o terceiro
no caso do CHCI3
RCCI3 > RCHCl2 > R2CCI2
PRODUÇÃO DOS “FREONS”
α=F,
β = H+1,
δ = C-1 e a ≠ = Cl
Matérias primas
Clorofórmio, ou tetracloreto de carbono, metilclofórmio, tetra, penta e
hexacloroetano.
PRODUÇÃO DO FREON 12
M.P : HF ,Cl2 e CCl4 Reação mantida sob pressão 3 MPa ( R12 ( gás))
Recuperação do HF
HF
+
KF
KHF2
Produção do Monômero de teflon
2CHCIF2
pirólise
.
2 CF
HCl (650 — 700oC)
2
F2C=CF2
HALOGENAÇÃO
AVALIANDO A SELETIVIDADE SOB A ÓTICA DA ENERGIA DE
ATIVAÇÃO
Sabemos que a seletividade é função:
Da constante de equilíbrio,
Da energia de ativação e
Da temperatura.
Da equação de Arrhenius, temos que:
At
RT
k Ae
E
O fator de Arrhenius A, relaciona-se, a medida de freqüência de
colisões e ao fator de probabilidade e o termo
e
At
RT
E
está relacionado ao fator de energia ( fração de colisões com
energia maior que a energia de ativação)
Para efeito analítico, verifiquemos a probabilidade da ocorrência
de reação de halogenação com diferentes halogênios:
Fluor, cloro e bromo.
Ver na tabela abaixo os distintos valores de energia de ativação
para formação do íon metila,
“reagentes/intermediários”
“produtos/intermediários Energia de ativação
cal/mol
F•
HF
+ CH4
Cl• + CH4
Br • + CH4
R = 1,986 cal/ o K mol
1200
HCl
+ CH3•
+ CH3•
HBr
+ CH3•
18600
3800
Submetendo-se as três reações a mesma temperatura por exemplo,
573° K, teremos as seguintes frações de colisão, obtidas pela
resolução da equação de Arrhenius:
0,34 para o fluor,
0,035 para o cloro e
8 x 10-8 para o bromo,
TERMODINÂMICA E CINÉTICA DAS REAÇÕES DE HALOGENAÇÃO
Variação da entalpia durante as diferentes fases da halogenação
Fases
∆H (Kcal /mol)
EAt (Kcal /mol)
F
Cl
Br
I
F
Cl
Br
I
+38
+58
+46
+36
+38
+58
+46
+36
XH + CH3•
-32
+1
-16,5 +31
+1,2
+3,8
+18,6
+33,5
CH3 -X + X•
-70
-25,5
-24
-20
≈0
≈0
≈0
-102
-24,5
-7,5
+11
Halogênios
Iniciação
X2
2X•
Propagação
Fase 1
X • + CH4
Fase 2
CH3• + X2
∆ H final
≈0
Variação da entalpia durante a halogenação com cloro
Etapa
Reação
∆H (Kcal/mol
Iniciação
2 Cl•
Cl2
+58
Propagação
Cl• +
CH3 –H
CH3 • + HCl
CH3• + Cl – Cl
CH3 – Cl + Cl•
+1
-25,5
Finalização
CH3• + Cl•
2 CH3•
2 Cl•
CH3 - Cl
CH3 – CH3
Cl2
-83,5
-88
-58
Energia de dissociação
Ligação
E dissociação (Kcal/mol)
Cl - Cl
+58
I-Br
42,9
CH3- H
+104,0
I-Cl
51,0
CH3CH2- H
+98,0
Br-Cl
52,7
H – Cl
+103
Cl-F
86,4
CH3 – Cl
+83,5
Br-Br
46
CH3 - CH3
+88
I-I
36
F–F
+38
CH3-Br
67
CH3 – F
+108
CH3-I
55
C - dupla
+95,8
H-F
136
C - trípla
+124,5
C-C
+88,0
H-H
+103,8
Energia de dissociação
Halogênio
λ Aο
E dissociação (eV)
Cl2
2480
5000
Br2
1970
6288
I2
1540
8000
HCl
4300
2800
HBr
3350
HI
3850 - 4100
Energia de ligação a 25º C em Kcalorias
ligação
Fluor
cloro
Bromo
iodo
X-X
38
57,8
46,1
36,3
H-X
136
102,9
87,4
71,6
C-X
108
66,6
53,0
38,7
Calendário 1º semestre
2
2
2
2
2
Março
1
8
15
22
29
Abril
5
12
19
26
Maio
3
10
17
24
Junho
7
14
21
28
Julho
5
Semana de estudos
Exame final
31