Aspirina e analgésicos
relacionados
Aspirina (ASP)
ASP é analgésico, antipirético e anti-inflamatório
História
Salicine é extraído da planta Salix sp (1827)
Ácido salicilico foi extraído da mesma espécie em 1838;
Em meados do séc XIX a salicina e o ácido salicilico foi usado
na febre reumática pelas suas qualidades antipiréticas e antiinflamatórias;
A acetilação do ácido salicilico (feita por Dresser, 1890)
formando-se o ácido acetilsalicilico, veio reduzir os efeitos
laterais;
ASP foi comercializada pela Baeyer como fármaco em 1899.
Acetanilida, paracetamol e fenacetina são usados como
agentes mais suaves.
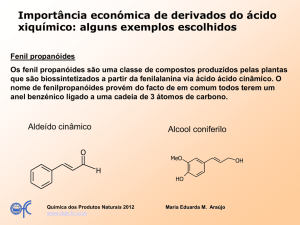
Formulas químicas ASP e analgésicos
derivados
O
CH2OH
OH
O C CH3
OGlucose
CO2H
CO2H
Salicine
Ácido salicilico
NHCOCH3
NHCOCH3
HO
Acetanilida
ASP
NHCOCH3
C2H5O
Paracetamol
Fenacetina
Modo de acção
Inibe a ciclooxigenase (COX) que estão envolvidas na
síntese das prostaglandinas
CO2H
Ciclooxigenase
Ácido araquidónico
CO2H
O
COX-1
Isoformas
COX-2
O
CO2H
HO
OH
PGE2 - prostaglandinas
COX-1:está sempre presente
COX-2: induzida pela inflamação
O
O
OH
Desenvolvimento de agentes antiinflamatórios não esteróides
Ibuprofeno: o composto que levou ao seu
desenvolvimento é um agroquímico
H3CH2C
O
O C OH
H3C
O
CH H2C
H3C
O C OH
H3C
CH3
CH
CH
3
CH H2C
H3C
Sómente o enantiomero (S) é activo
Morfina e seus derivados
Morfina
Analgésico
Induz euforia
Usado na doença terminal
Actua no SNC
Interage com os receptores das
encefalinas e endorfinas
Morfina: estrutura
HO
3
A
E
O D
B
C
6
N Me
H
HO
A molécula contém 5 anéis, nomeados de A-E e tem forma de
T.
É básica, porque contém o grupo amina terciária, mas
contém um grupo fenólico, um grupo álcool, um anel
aromático e uma ponte éter e uma dupla ligação.
Relação entre a estrutura e actividade
Mudança do grupo funcional 3–OH, formação da nalorfina que não actua nos
receptores opiáceo do tipo m (actua nos k e d).
6-OH; compostos que ou perderam o grupo álcool polar ou têm-no mascarado com o
grupo alquil ou acil atravessam a barreira hemato-encefálica e têm um efeito
analgésico;
A dupla ligação na posição 7-8 não é necessária para a actividade analgésica
N-Me substituída por NH reduz a actividade (atravessa mais dificilmente a barreira
hemato-encefálica). Contudo a presença do azoto é essencial.
O anel aromático é essencial;
Remoção do anel E conduz à perda de actividade
A ponte éter não é necessária para a actividade analgésica
Só o enantiómero é activo
Resumo da Relação Estrutura Actividade
Essencial
A
E
O D
B
C
HO
Essencial
N Me
Pode ser removido
Nalorfina
Modo de acção
Interage
com
os
receptores
encefalinas e endorfinas
Tyr-Gly-Gly-Phe-Met
Encefalinas
Tyr-Gly-Gly-Phe-Leu
O
HO
N Me
NH2
O
Tirosina
HO
Morfina
das
Desenvolvimento de análogos de morfina (I)
Remoção do anel D conduz à actividade analgésica
HO
HO
N Me
N Me
Dextrorfanol
(não é activo como analgésico)
Usado na supressão
de tosse
Levorfanol
Remoção dos anéis C e D: o composto tem actividade
analgésica
HO
Fenazoina (4 x mais potente que a morfina)
Me
N Me (-CH2CH2Ph)
H
Me
Metazocine
(Tem a mesma potência que a morfina)
Desenvolvimento de análogos de morfina (II)
Remoção dos anéis B, C, e D: cocaína e análogos
Meperidina: tem menos efeitos colaterais que a morfina
HO C
O
mas não é tão bom analgésico
N
CH3
Remoção dos anéis B, C, D e E
COCH2CH3
C CH2CH(Me)N(Me)2
*
Metadona
(R) 2x mais potente que a morfina
(S) Inactiva
Desenvolvimento de análogos de morfina (III)
Rigidificação
MeO
MeO
O
+
O
N Me
MeO
Tebaina
MeO
O
N Me
Me
O
N Me
H
MeO
Me
H
O
MeO
Me
OH
Me
Etorfina (mais potente
que a morfina)
FIM