LÍQUIDO CEFALORRAQUIDIANO - LCR
Narcizo Antonio Tonet– Citologia Clínica
LCR
É o terceiro principal fluído biológico.
Descoberto em 1764 por Cotugno.
Funções:
Distribuição de nutrientes para o tecido nervoso
Remoção de resíduos metabólicos.
Produção de uma barreira mecânica dos traumas
ao cérebro e medula espinhal.
Meninges: membranas conjuntivas que
envolvem o sistema nervoso. São três:
Dura-máter - mais superficial, espessa e resistente,
formada por tecido conjuntivo muito rico em fibras
colágenas, contendo nervos e vasos.
Aracnóide – é uma membrana muito delgada, justaposta à
dura-máter, da qual se separa por um espaço virtual, o
espaço subdural, contendo uma pequena quantidade de
líquido. A aracnóide separa-se da pia-máter pelo espaço
subaracnóideo que contem líquor.
Pia-máter - é a mais interna das meninges, aderindo
intimamente à superfície do encéfalo e da medula.
LCR
Fisiologia
• Plexo Coróides dos ventrículos
Produção contínua e lenta
• Granulações aracnóides
Reabsorção
• Movimento em uma só direção – de baixo
para cima
c
Produção
• 20 ml/hora
• Volume total:
Adulto: 100 a 150ml
Neonatos:10 a 60ml
Composição
- Não se parece com o ultrafiltrado do
plasma devido ao transporte ativo
bidirecional entre o líquor, fluído
intersticial do cérebro, células
cerebrais e sangue capilares
cerebrais.
- Toda essa dinâmica é coloquialmente
representada pela expressão Barreira
Hematoencefálica.
Características
- Pouca proteína
- Baixa densidade (1,006 a 1,009)
- Pouquíssimas células (< 5)
- Maioria Linfócitos
- Levemente alcalino
- Pressão 18 a 25 cm de água
(sentado) gotas lentas.
Objetivos do estudo
- Diagnóstico:
Infecções (bacterianas, viróticas, micóticas)
Processos imunoalérgicos
Abscessos
Neuroleucemias
- Prognóstico:
Infiltrações leucêmicas do SNC
Metástases tumorais
- Tratamento:
Neuroleucemias – controle no uso de medicamento
Meningite micótica – controle no uso de atb e
anfotericina
Coleta do LCR
•Ventricular, Cisternal, toráxica não muito utilizadas.
•Lombar – coleta mais fácil, mais
freqüente.
Coleta
Local: 3º e 4º ou 4º e 5º vértebra.
Padrão ouro de coleta - 3 tubos:
Nr 1 – ex. bioquímicos e imunológicos (frasco estéril)
Nr 2 – ex. microbiológicos (frasco estéril)
Nr 3 – ex. hematológicos (frasco estéril, com EDTA).
Coleta
Padrão ouro - aspecto hemorrágico.
Remessa
Frasco microbiológico – temp. ambiente
Frasco citológico – refrigerar
Contagio.
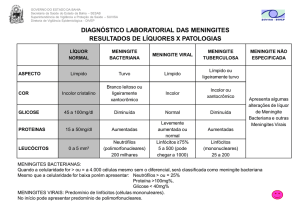
EXAME DO LCR
•Exame físico: cor, aspecto, presença de coágulo
e pressão.
•Exame citológico: leucometria, hematimetria e
contagem diferencial.
•Exame bioquímico: proteínas, glicose, cloretos,
LDH, etc.
•Imunológico
•Microbiológico
Aspecto
• Antes e após centrifugação (10 min. 1500 rpm).
• Normal :
límpido, cristalino, transparente e incolor
ou “água de rocha”. Não coagula nem forma
precipitado.
• Patológico :
ligeiramente turvo (pt ou pleocitose),
turvo ou opaco (meningite aguda), purulento (aguda
mais avançada), hemorrágico (subaracnoidiano ou
punção) e xantocrômico (após hemorragia).
APARÊNCIA
CAUSA
cristalino
PRINCIPAL
SIGNIFICADO
normal
turvo ou opaco
leucócitos
eritrócitos
microorganismos
proteínas
meningite
hemorragia
punção traumática
imunoglobulinas no SNC
hemorrágico
eritrócitos
hemorragia
acidente de punção
xantocrômico
hemoglobina
bilirrubina
mertiolate
proteínas
hemorragia antiga
hemácias velhas
bilirrubina sérica
proteínas séricas
coagulado
fatores de
coagulação
punção traumática
meningite tuberculosa
Aspecto
Retículo fibrinoso
•Retículo de fibrina no fundo do
frasco como teia de aranha, em
repouso meningite tuberculosa.
• 4°C, após 2 a 12 h.
Aspecto
Coágulo
•Pesquisa de coágulo a fresco e após 1
hora a 37°C.
•Presente quando aparece fibrinogênio
ou por aumento das proteínas
(Síndrome de Froin).
COR
Normal: incolor, xantocrômico até 30
dias de vida.
Xantocrômico
– produtos de
degradação da Hg
Rosa- pequena quantidade de oxi-hemoglobina.
Laranja- forte hemólise.
Amarelo- conversão de oxi-hemoglobina em bilirrubina
não conjugada.
Acidente Punção
•Prova dos três tubos
•Centrifugação
•Formação de coágulo
Pressão
•VR: 90 a 180 mmHg (lombar). Gotas
lentas.
Hipotensão: desidratação, bloqueio.
•Hipertensão: processos expansivos,
meningites e encefalites. Gotejamento
rápido ou mesmo jorro.
EXAME CITOLÓGICO
Leucometria
•VR: adulto até 5/mm³
RN: até 30 /mm³
• Imediatamente à coleta.
•Não usar contadores eletrônicos.
•Diluir com salina se necessário.
EXAME CITOLÓGICO
Hematimetria
•VR: até 1/mm³
•RN: até 150 / mm³
•Usar câmara de Neubauer/ FuchsRosenthal.
•Pode-se usar contador eletrônico.
EXAME CITOLÓGICO
•Pleocitose: aumento do número de
células no líquor.
Ligeira: 10 / mm³
Moderada: 50 / mm³
Intensa: > 100 / mm³
Métodos de contagem
A) CONTAGEM EM CÂMARA DE NEUBAUER:
N° de células contadas
= células /ul
N° de quadrantes contados x 0,1ul
Se for diluído multiplicar pela diluição
B) CONTAGEM EM CÂMARA DE FUCHSROSENTHAL:
O número de células contadas / fator (3,2).
Câmara de Fuchs - Rosenthal
Câmara de Neubauer
EXAME CITOLÓGICO
Contagem diferencial
•Concentrar por filtração, sedimentação em
câmara de Suta, citocentrifugação ou
centrifugação comum.
•Soro comum ou albumina bovina 20%
• Secar em estufa a 37°C.
•Corar
EXAME CITOLÓGICO
Método de May-Grumwald Giemsa
•Cobrir a lâmina com Mey-Grumwald por 3 min.
•Adicionar água por 3 min sem desprezar corante.
•Desprezar.
•Cobrir com Giemsa diluído (1 gota / ml água) por 5
min.
•Lavar a lâmina com água e secar.
EXAME CITOLÓGICO
Método de Giemsa
•Cobrir a lâmina com metanol por 5 min.
•Adicionar sobre o metanol 3 a 4 gotas de Giemsa e
deixar por 5 min.
•Lavar a lâmina com água e secar.
EXAME CITOLÓGICO
Contagem diferencial
•VR: absoluto predomínio de mononucleares.
Linfócitos: 95%
Monócitos: 3 a 5%
Segmentados: 0 a 2%
Eosinófilos: 0%
EXAME CITOLÓGICO
Contagem diferencial
Linfócitos: normal; meningite virótica, tuberculosa,
fúngica e bacteriana inicial; esclerose.
Monócitos: meningite bacteriana crônica, virótica,
tuberculosa, fúngica e esclerose.
Segmentados: meningite bacteriana, virótica inicial,
tuberculosa e fúngica; hemorragia subaracnóidea; e
neoplasia.
Eosinófilos: infecções parasitárias, reações alérgicas.
EXAME CITOLÓGICO
Contagem diferencial
•pleocitoses:
elevada: meningite bacteriana.
Moderada: meningite virótica, fúngica e parasitária.
Leve (inferior a 25 com grande número de linfócitos):
esclerose.
EXAME CITOLÓGICO
Contagem diferencial
• Células
anormais
Macrófagos
Células epindimárias
Células do plexo coróide
Células malignas.
Câmara de Suta
Técnica
•Colocar uma lâmina limpa na câmara, colocando sobre a
mesma papel de filtro com um orifício do tamanho da
abertura da câmara por onde vai ser colocado o líquor. A
quantidade de líquor colocado na câmara deve ser
proporcional à contagem de leucócitos na câmara:
OBS: pode acrescentar uma gota de albumina para melhor
visualização após coloração.
• Após aproximadamente duas horas, retirar a lâmina e corar
com coloração de MayGrumwal - Giemsa. Contar em objetiva
de imersão 100 células e liberar diferencial como é realizado
em uma lâmina de hemograma.
Número de células contadas
10 – 50
50 – 100
100 – 200
200 – 500
500 – 1000
Sup a 2000
Volume
1,5 - 2,0 ml
1,2 - 1,8 ml
1,0 - 1,5 ml
0,8 - 1,0 ml
0,5 - 0,8 ml
0,2 - 03 ml
Citocentrífuga
EXAMES BIOQUÍMICOS
• Mesmas substâncias - quantidades diferentes.
Alterações da barreira hematoencefálica.
Grande produção.
Metabolismo das células neurais.
EXAMES BIOQUÍMICOS
Proteínas
• VR: 10 a 30 mg/dl (1/5 globulinas).
• Método de dosagem: sulfossalicílico 3% ou
tricloroacético 10% (melhor).
• Aumentado em meningites, hemorragias e
esclerose.
EXAMES BIOQUÍMICOS
Proteínas
• Hiperproteinorraquia: em processos
inflamatórios, hemorragias e compressões
medulares (aumentos mais notáveis).
• Dissociação albuminocitológica.
EXAMES BIOQUÍMICOS
Proteínas
Comprometimento da barreira (causa mais
comum)- meningite e hemorragia.
Produção de Ig pelo SNC.
Redução da depuração
Degeneração do tecido neural.
EXAMES BIOQUÍMICOS
Proteínas - técnica
• Método turbidimétrico – sulfossalicílico 3%
3 ml do reagente com 250 ul do LCR centrifugado.
Esperar 5 min e ler em 620 nm.
EXAMES BIOQUÍMICOS
Glicose
• VR: 2/3 da glicemia (60 a 70%). Portanto depende
da glicemia sendo normalmente inferior em 20 a 30
mg/dl.
• Colher 2 h antes da punção lombar.
•Método: idem glicemia.
•Análise de imediato – glicólise in vitro é rápida –
erro grave.
EXAMES BIOQUÍMICOS
Glicose
• Significado clínico:
Hipoglicorraquia- meningites bacterianas, micótica,
tuberculosa (especialmente), amebiana e hipoglicemia.
Hiperglicorraquia- encefalite virótica, trauma, DM.
• Causa da redução: alteração do transporte ativo pela
barreira (principal) e utilização pelas células.
EXAMES BIOQUÍMICOS
Ácido lático
• Útil no diagnóstico e no tratamento.
• VR: 9 a 25 mg/dl.
• Método: idem plasma.
• Meningite bacteriana, tuberculosa ou fúngica e tumores
cerebrais – elevação.
• Tratamento (caem com o êxito).
EXAMES BIOQUÍMICOS
Cloretos
• VR: 115 a 130 mEq/l.
• Método: idem plasma.
• Hipoclororraquia: meningite bacteriana e
tuberculosa (particularmente).
Hiperclororraquia: acidose metabólica e diarréia
crônica.
EXAMES BIOQUÍMICOS
LDH (Desidrogenase lática)
• VR: 0 a 25 U/l.
• Método: idem plasma.
• Isoenzimas - tipo de meningite (células cerebrais LDH1 e
2; neutrófilos LD4 e 5; linfócitos LD2 e 3).
Aumentam no AVC, meningite bacteriana, hemorragia,
neoplasia.
Diagnóstico Diferencial de Meningites
BACTERIANA
VIRAL
TUBERCULOSA
FÚNGICA
contagem elevada de
leucócitos
contagem elevada de
leucócitos
contagem elevada de
leucócitos
contagem elevada de
leucócitos
presença predominante
de neutrófilos
presença predominante
de linfócitos
presença de linfócitos
e monócitos
presença de linfócitos
e monócitos
grande elevação dos
níveis de proteínas
elevação moderadanos níveis de
proteínas
elevação moderada ou
acentuada dos níveis
de proteínas
elevação moderada ou
acentuada dos níveis
de proteínas
acentuada diminuição dos níveis de
glicose
Níveis normais de glicose
Níveis baixos de glicose
Ác lático ↑
LDH ↑ 4 e 5
N
↑2e3
↑
níveis normais ou baixos de glicose
↑
Meningites
3 grandes grupos:
Purulentas – 1° meningococo, 2° pneumococo,
hemófilos, estreptococo e estafilococo. Muitos casos
não se consegue identificar o germe. No RN
predomina BGN.
Granulomatosa – tuberculosa e sifilítica (rara),
leptospira, histoplasma e outros fungos.
Asséptica – vírus, bactérias em fase precoce ou
mascarada, fungos, protozoários e alergia.
IMUNOLOGIA
Reação de Aglutinação do Látex – PCR (> 90%
meningite bacteriana).
Contra-imunoeletroforese - Haemophilus influenzae,
Streptococcus pneumoniae, Neisseria meningitidis,
Estreptococcus do grupo B.
Útil nos casos que bacterioscopia e cultura são negativas
(meningites parcialmente tratadas).
Reação de Fixação de Complemento –
Neurocisticercose.
Reação de Floculação : VDRL ( Neurosífiles)
IMUNOLOGIA
REAÇÃO DE PANDY:
Para avaliação qualitativa de imunoglobulinas.
Método turbidimétrico com solução de fenol
saturado.
Positiva - proteínas totais > 70 mg/dl.
Útil na inflamação incipiente ou crônica com taxa
normal de proteínas totais.
TÉCNICA:
1 ml do reativo de Pandy + 50ul do líquor
centrifugado. Observar turbidez. Resultado em
cruzes conforme grau de turvação.
EXAMES MICROBIOLÓGICOS
Cultura e Bacterioscopia
Bacterioscopia - diagnóstico.
Cultura - confirmatório.
Bacterioscopia: coloração de Gram, de ZielhNeelsen, tinta da China.
EXAMES MICROBIOLÓGICOS
Cultura:
Coleta.
Processamento.
Meios empregados: Agar chocolate, Agar sangue,
caldo tioglicolato, meio de Lowenstein-Jensen, Agar
Mac-Conkey.
Incubar em atmosfera de CO2
Pode-se semear o sedimento (10 min a 3000 rpm).
EXAMES MICROBIOLÓGICOS
Bacterioscopia:
Gram:
DCGP capsulado, intra e extra-celular, em forma de
“chama de vela” penumococo*
DCGN intra e extra-celular meningococo *
CBGN capsulado ou não, extra-celular
hemófilos *
BGP intra e extra-celular Listéria
Zielh-Neelsen: BAAR
Tinta da china: fungos (criptococcus)
TÉCNICA
Condições:
Processar o exame o mais rápido possível.
Coletar amostra de sangue simultaneamente.
Definir a prioridade dos exames a serem realizados de
acordo com o volume da amostra.
Técnica (no caso de frasco único, estéril):
Homogeneizar a amostra;
Observar a cor e o aspecto;
Separar (assepticamente) uma pequena amostra para
citologia passando o restante para tubo estéril;
Centrifugar o tubo por 10 min a 3000 rpm;
TÉCNICA
Observar o aspecto após centrifugação;
Separar assepticamente o sobrenadante:
No sedimento fazer bacterioscopia, cultura e
diferencial;
No sobrenadante fazer os exames bioquímicos
conforme técnica própria;
Para teste de coágulo colocar em BM a 37° C por 1 h.
Para teste de retículo fibrinoso colocar na geladeira
por 2 a 12 h.