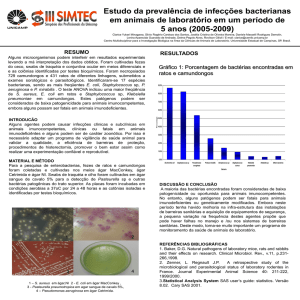
ÁGAR R2A – R2A AGAR (7390)
Uso Previsto
Ágar R2A é utilizado para a contagem e cultivo de bactérias em água potável.
Sumário e Explicação do Produto
O Ágar R2A foi desenvolvido por Reasoner e Geldreich1 para a contagem em placa em água potável tratada.
Ágar R2A é um meio de baixo valor nutricional e sua combinação com um tempo de incubação prolongado e
baixa temperatura, estimula o crescimento de bactérias injuriadas e tolerantes ao cloro.1 Meios ricos em
nutrientes promovem o crescimento de organismos de crescimento rápido, o que pode inibir o crescimento
de bactérias injuriadas e de crescimento lento encontradas em água tratada. O Ágar R2A quando
comparado ao Ágar Triptona Glicose Extrato de Levedura ou Ágar Método Padrão, registrou uma maior
recuperação de bactérias injuriadas e tolerantes ao cloro, provenientes de água potável. 2,3,4
Ágar R2A é recomendado em métodos padrões para métodos de semeadura em profundidade, semeadura
em superfície e filtração por membrana para contagem de organismos heterotróficos em placa.5
Princípios do Procedimento
A Digestão Enzimática de Caseína, Digestão Enzimática de Tecido Animal e Hidrolisado Ácido de Caseína
fornecem nitrogênio, carbono e minerais no Ágar R2A. O Extrato de Levedura é a fonte de vitaminas e
microelementos. A Dextrose serve como a fonte de carbono. O Amido Solúvel ajuda na recuperação de
organismos injuriados, absorvendo os metabólitos tóxicos. Fosfato Dipotássico é utilizado para balancear o
pH e o Sulfato de Magnésio Heptahidratado é a fonte de cátions bivalentes e sulfato. O Piruvato de Sódio
aumenta a recuperação de células injuriadas. O Ágar é o agente solidificante.
Fórmula / Litro
Digestão Enzimática de Caseína ......................................... 0,25 g
Digestão Enzimática de Tecido Animal (Proteose Peptona) .... 0,25 g
Hidrolisado Ácido de Caseína................................................ 0,5 g
Extrato de Levedura............................................................... 0,5 g
Dextrose (Glicose) .................................................................... 0,5 g
Amido Solúvel ........................................................................ 0,5 g
Fosfato Dipotássico ............................................................... 0,3 g
Sulfato de Magnésio Heptahidratado................................... 0,05 g
Piruvato de Sódio ................................................................... 0,3 g
Ágar ........................................................................................ 15 g
pH Final: 7,2 ± 0,2 a 25°C
A fórmula pode ser ajustada e/ou suplementada conforme necessário para atender as especificações de desempenho.
Precauções
1. Somente para o uso em laboratório.
2. IRRITANTE. Irritante para os olhos, sistema respiratório e pele.
Modo de Preparo
1. Suspenda 18,2 g do meio em 1 L de água purificada.
2. Aqueça, agitando frequentemente e ferva por 1 minuto para dissolver completamente o meio.
3. Autoclave a 121°C por 15 minutos.
Especificações de Controle de Qualidade
Aparência Desidratado: O pó é homogêneo, fluxo livre e bege claro a bege.
PI 7390, Rev 03, Agosto 2009
Aparência Preparado: O meio preparado é transparente a ligeiramente turvo e bege claro.
Resposta Esperada de Cultivo: Resposta de cultivo no Ágar R2A incubado aerobiamente a 35 ± 2°C e
examinado para crescimento em 40 a 72 horas de incubação.
Micro-organismo
Enterococcus faecalis ATCC 29212
Escherichia coli ATCC 25922
Staphylococcus aureus ATCC 25923
Inóculo
Aproximado
(UFC)
Resultados Esperados
10–300
10–300
10–300
Fraco a bom
Regular a excelente
Fraco a bom
Os organismos listados são os mínimos que devem ser avaliados para o teste de controle de qualidade.
Procedimento do Teste
1. Prepare as diluições para a contagem de heterotróficos.
2. Semeia as amostras e diluições por semeadura em superfície, semeadura em profundidade ou filtração
por membrana. Não semeie mais de 1 mL de amostra ou diluição em superfície ou profundidade. O
volume da amostra a ser filtrada através da membrana é variável.
3. Em incubações prolongadas, mantenha níveis de umidade apropriados:
Temperatura de Incubação
35°C
20 ou 28°C
Tempo Mínimo de
Incubação3
72 horas
5 dias
Tempo Ideal de Incubação3
5–7 dias
7 dias
Resultados
Conte as colônias semeadas em superfície ou em profundidade entre 30–300 colônias por placa ou 20–200
colônias ao utilizar o método de filtração por membrana. Calcule a contagem de colônias por mL de amostra
multiplicando a média do número de colônias por placa pela diluição utilizada.
Reporte a contagem como Unidades Formadoras de Colônia (UFC) por mL e reporte variações em
incubações como temperatura e duração.
Armazenamento
Armazene o frasco contendo o meio desidratado devidamente fechado entre 2–30°C. Uma vez aberto e
fechado novamente, coloque o frasco em um ambiente de baixa umidade e na mesma temperatura de
armazenamento. Proteja contra a umidade e luz mantendo o frasco firmemente fechado.
Validade
Refira-se à data de validade no frasco. O meio desidratado deve ser descartado se não fluir livremente ou se
houver mudança na coloração original. A validade se aplica ao meio em sua embalagem intacta quando
armazenado como indicado.
PI 7390, Rev 03, Agosto 2009
Limitações do Procedimento
1.
2.
3.
4.
Devido à variação dos requerimentos nutricionais, algumas cepas podem apresentar um crescimento fraco ou
ausência de crescimento neste meio.
Ágar R2A é destinado somente para o uso em água potável tratada.
O uso do método de semeadura em profundidade não é aconselhado pois a recuperação das bactérias injuriadas
pode ser comprometida devido à elevação da temperatura (44–46°C) e baixa tensão de oxigênio, o que faz parte
do procedimento.6,7
Um tempo de incubação prolongado pode ser necessário para a recuperação de bactérias com crescimento lento.
Embalagem
Ágar R2A
N° Código
7390A
7390B
7390C
500 g
2 kg
10 kg
Referências
1.
2.
3.
4.
5.
6.
7.
Reasoner, D. J., and E. E. Geldreich. 1979. A new medium for the enumeration and subculture of bacteria from potable water.
Abstracts of the Annual Meeting of the American Society for Microbiology 79th Meeting, Paper No. N7.
Fiksdal, L., E. A. Vik, A. Mills, and T. Staley. 1982. Non-standard methods for enumerating bacteria in drinking water. Journal
AWWA. 74:313-318.
Kelly, A. J., C. A. Justice, and L. A. Nagy. 1983. Predominance of chlorine tolerant bacteria in drinking water systems. Abstracts
of the Annual Meeting of the American Society for Microbiology 79th Meeting, Paper No. Q122.
Means, E. G., L. Hanami, H. F. Ridgway, and B. H. Olson. 1981. Evaluating mediums and plating techniques for enumerating
bacteria in water distribution systems. Journal AWWA. 53:585-590.
Eaton, A. D., L. S. Clesceri, and A. E. Greenberg (eds.). 1995. Standard methods for the examination of water and wastewater,
19th ed. American Public Health Association, Washington, D.C.
VanSoestberger, A. A., and C. H. Lee. 1969. Pour plates or streak plates? Appl. Microbiol. 18:1092.
Klein, D. A., and S. Wu. 1974. Stress: a factor to be considered in heterotrophic microorganisms enumeration from aquatic
environments. Appl. Microbiol. 27:429.
Informação Técnica
Contate a Neogen do Brasil para Serviços Técnicos ou questões envolvendo a preparação ou desempenho do meio de cultura
desidratado no telefone 19.3935-3727.
Contate a Acumedia Manufacturers, Inc. para Serviços Técnicos ou questões envolvendo a preparação ou desempenho do meio de
cultura desidratado no telefone +1 (517)372-9200 ou fax +1 (517)372-2006.
PI 7390, Rev 03, Agosto 2009