Bioquímica I: Macromoléculas
I. Fracionando a vida:
Os bioquímicos fracionam um organismo e analisam os componentes individuais.
1) Qual é a composição atômica das células vivas/organismos?
H:
60%
O:
25%
C:
12%
N:
~5%
P, S, Mg, Mn, Se, também estão presentes em quantidades menores
Em certos níveis de estudo, a maioria dos organismos parece igual – especialmente a
nível celular.
2) Qual é a composição molecular das células?
Principalmente água: ~80%
O restante:
Lipídios, gordura: 10%
Carboidratos: 15%
Proteínas: 50%
Ácidos Nucléicos: 15%
** As proteínas são as macromoléculas-chave, têm diversos papéis estruturais e
funcionais nas células) **
Ácidos Nucléicos (DNA, RNA; DNA armazena as informações hereditárias na
célula)
Até certo nível, forças químicas determinam a forma das moléculas e a forma determina a
função.
Que forças fornecem às moléculas suas propriedades?
II. Forças Covalentes
Ligações e interações químicas mantêm as moléculas juntas:
1) Ligações Covalentes
- tipo mais importante de ligações
- tipo de ligações mais fortes – força ~80 kcal/mol
Uma ligação covalente é o compartilhamento de um par de elétrons:
2
A energia térmica (vibracional) média em temperatura ambiente é em média ~5 kcal/mol.
Considerando-se que são necessários ~80 kcal/mol para quebrar uma ligação covalente,
pode-se dizer que elas são relativamente estáveis à temperatura ambiente.
Tipos de ligações covalentes:
Força
Simples C-C (um par de elétrons)
Dupla C=C (dois pares de elétrons)
Tripla C=C (três pares de elétrons)
80 kcal/mol
150 kcal/mol
200 kcal/mol
Existe uma rotação livre ao redor de uma ligação covalente simples, porém isso não ocorre
com as ligações duplas e triplas.
As ligações covalentes também possuem um ângulo fixo.
Algumas ligações covalentes envolvem o compartilhamento desigual de elétrons.
Alguns átomos estão ligados aos elétrons de forma mais forte do que outros átomos.
A tendência para atrair elétrons é a chamada medida de eletronegatividade de um átomo.
Observe algumas ligações com compartilhamento desigual de elétrons:
As ligações polares apresentam movimentos bipolares; possuem polaridade
O oxigênio é um átomo mais eletronegativo quando comparado com o hidrogênio e,
portanto, uma ligação O-H é considerada uma ligação polar.
Carbono e hidrogênio possuem eletronegatividades semelhantes. Dessa forma, uma ligação
C-H é considerada uma ligação apolar.
2) Ligações de Hidrogênio
−
−
−
−
−
atração entre uma carga levemente positiva em um átomo de hidrogênio e uma carga
levemente negativa em um átomo próximo
força da ligação ~ 5 kcal/mol (relativamente fraca)
mais forte quando o doador, o hidrogênio, e o receptor estão a uma distância de mais
ou menos 0,25nm
as ligações de hidrogênio fornecem ordem e estrutura às moléculas
uma única ligação de hidrogênio é fraca, mas a maior parte das moléculas são
compostas por diversas ligações de hidrogênio, fato esse que proporciona força geral à
molécula
As propriedades da água são determinadas por interações de ligações de hidrogênio. A
água é muito bem estruturada, mesmo sendo um líquido. A formação do gelo deve-se ao
conjunto de redes de ligações de hidrogênio.
3
Ligações de hidrogênio entre regiões diferentes de uma molécula de proteína:
NA água, essas regiões irão formar ligações de hidrogênio com as moléculas da água.
Essas moléculas adotam uma conformação mais favorável, quando elas interagem com
água.
3) Ligações Iônicas
− interação eletrostática entre dois grupos de cargas opostas em uma molécula
−
causa limitante do compartilhamento desigual de elétrons; um átomo fica
com o elétron
NaCl → Na+ + Cl- compartilhamento desigual de elétrons, Cl fica com ambos os elétrons.
Em solução, esse grupo torna-se ionizado, perde um próton e fica com carga negativa:
4
Átomos carregados podem ser atraídos por átomos de carga oposta:
−
a força da ligação iônica é de aproximadamente 3-7 kcal/mol, mais forte
quando os dois átomos estão a uma distância de aproximadamente 0,28mm
4) Interação de Van Der Walls
−
força de atração não específica que está presente quando qualquer um dos
dois átomos chega a uma distância menor
−
mais favorável quando os átomos estão a uma distância de
aproximadamente 0,2-0,3 nm
−
polaridade transitória induziu entre átomos uma ligação apolar que leva à
atração dos átomos próximos
−
interação muito fraca – força é ~ 1 kcal/mol. No entanto, a soma de diversas
interações de Van Der Walls leva a um aumento da força e estabilidade
Exemplo: Um ligante interagindo com seu receptor é completado por diversas interações
não-covalentes tais como as interações de Van Der Walls.
5) Interações Hidrofóbicas / Entropia
De maneira geral, a estrutura de uma molécula é mantida por diversas interações. Uma
molécula tem uma forma particular porque adota o estado de menor energia (minimiza
entropia)
Ao adotar essa forma, as conformações alternativas são selecionadas e os grupos que não
podem formar pontes de hidrogênio com a água (hidrofóbicos) tendem a aglomerar-se
dentro da molécula (longe da água).
Hidrofóbico: (“odeia água”) moléculas sem carga, apolares, não interagem com a água
Hidrofílico: (“ama água”): moléculas com carga ou polares, de ligações de hidrogênio
com água
A forma que as macromoléculas biológicas podem adotar depende de um grande número
de interações moleculares.
III. Principais Macromoléculas
A. Lipídios, Fosfolipídios
Estrutura de um carboidrato:
CH3 (CH2 )3 CH3
5
Se adicionarmos um grupo hidroxila (OH) a um carboidrato, teremos um álcool:
CH3 (CH2 )4 OH
Álcoois de cadeia curta são solúveis em água.
Podemos criar um ácido graxo adicionando um grupo carboxila (COOH) ao grupo dos
carboidratos:
CH3 (CH2 )3 COOH
Um ácido graxo é uma molécula anfipática – contém tanto porções hidrofóbicas quanto
porções hidrofílicas.
Um ácido graxo também pode ser representado por:
6
Três ácidos graxos e uma molécula de glicerol podem ser combinados em uma síntese de
desidratação para formar um lipídio (um triglicéride). Triglicérides são formas principais
de armazenamento de ácidos graxos dentro das células.
Fosfolipídeos:
Um subgrupo de lipídios que desempenha um papel-chave na estrutura celular.
Fosfolipídios são formados por dois ácidos graxos e um grupo fosfato:
7
Os fosfolipídeos também podem ser representados como:
em solução, os fosfolipídios irão se reunir para formar micelas
Uma micela
Os fosfolipídeos formam uma bicamada em solução aquosa. Uma célula típica é englobada
por uma membrana plasmática, que é composta de uma bicamada de fosfolipídeos (2
camadas de moléculas de fosfolipídeos dispostas em uma bicamada lipídica)
O interior hidrofóbico da membrana plasmática é impermeável às moléculas carregadas ou
polares.
8
B. Açúcares, Carboidratos
1) Fórmula geral de um açúcar:
(CH2 O)n
ex.: Glicose C6 H12 O6
Em todos os açúcares, n-1 dos carbonos possuem um grupo hidroxila (OH) e o Carbono C1 possui um grupo carbonil (C=O). A localização do grupo carbonil e a orientação dos
grupos hidroxila determinam o tipo de açúcar.
Se o grupo carbonil estiver no final (um grupo aldeído), então o açúcar é uma aldose (ex.:
glicose)
Se o grupo carbonil estiver no meio da cadeia (um grupo cetona), então o açúcar é uma
cetose (ex.: frutose)
Açúcares compostos por seis átomos de carbono são chamados de hexoses (ex.: glicose)
Açúcares compostos por cinco átomos de carbono são chamados de pentoses (ex.:
ribose)
9
Os açúcares compostos por três átomos de carbono são chamados de trioses (ex.:
gliceraldeído)
2) Conformação dos açúcares
a) Monossacarídeos
A glicose é encontrada com mais freqüência em forma de anel em solução:
A orientação do grupo OH no carbono C-1 pode ser tanto alfa (abaixo do plano do anel) ou
beta (acima do plano do anel)
b) Dissacarídeos
Os dissacarídeos são formados por dois monossacarídeos unidos por uma ligação
covalente:
Lactose (forma)
(Galactose (1 → 4) Glicose)
A enzima lactase quebra a lactose em glicose e galactose. Muitos indivíduos adultos param
de sintetizar a enzima lactase. Como resultado, uma grande porcentagem de certas
populações torna-se intolerante à lactose.
c) Polissacarídeos
Polissacarídeos são formados por diversas unidades de monossacarídeos (geralmente
monômeros de glicose) ligados para formar cadeias longas.
ex.: amido, glicogênio, celulose
Polissacarídeos são usados como uma forma de armazenar energia e também para funções
estruturais.
Amido é um polímero de Glicose (1 → 4) ligação
10
Celulose – desempenha um papel importante nas plantas, uma das moléculas mais
abundantes na terra. É um polímero não ramificado de glicose em ligação (1 → 4).
As unidades alternantes de glicose possibilitam que as moléculas adjacentes de
celulose formem ligações de hidrogênio umas com as outras. A capacidade das ligações de
hidrogênio da celulose leva à força das paredes celulares e de fibras tais como a madeira.
Bioquímica II: Proteínas
Proteínas
−
−
−
possuem diversas funções nas células
papéis estruturas e funcionais
105 tipos diferentes de proteínas são produzidas por células eucarióticas
As proteínas são polímeros de blocos de construção conhecidos como aminoácidos
20 aminoácidos diferentes → podem resultar em 20n combinações de proteínas de
extensão n
Ácidos Nucléicos
−
armazenam e transferem material genético
quatro diferentes blocos de construção chamados de nucleotídeos → podem resultar
em 4n combinações diferentes de ácidos nucléicos de extensão n
§ 1. Amino ácidos e Ligações Peptídicas
Fórmula Geral dos Aminoácidos:
O grupo R (cadeia lateral) varia ao longo de 20 aminoácidos diferentes. Os 20 aminoácidos
diferentes compõem todas as proteínas.
Peptídeos são oligômeros de aminoácidos formados: através de uma reação de desidratação
quando o grupo carboxila do peptídeo está ligado ao grupo amino de um segundo
aminoácido.
11
A ligação peptídica é plana, tem caráter parcial de dupla ligação. Não há rotação ao redor
da ligação amida. A estrutura real da ligação peptídica é um híbrido das duas formas
apresentadas abaixo:
No entanto, existe a rotação ao redor das ligações adjacentes à ligação peptídica.
Uma unidade peptídica é uma disposição plana de quatro átomos.
Um polipeptídeo longo composto por diversos aminoácidos é chamado de proteína. Cada
proteína possui uma ordem específica de aminoácidos e adota uma forma particular –
determinada pela seqüência de aminoácidos.
§ 2. Os Vinte Diferentes Aminoácidos
a. Cadeias laterais polares porém sem carga
As cadeias laterais desses grupos podem foram ligações de hidrogênio com outros
grupos polares
b. Cadeias laterais polares e carregadas
12
As cadeias laterais desses aminoácidos podem formar ligações de hidrogênio ou ligações
iônicas
1. Com cargas positivas
2. Cargas negativas
c. Cadeias laterais hidrofóbicas (apolares, sem carga)
As cadeias laterais da maior parte dos aminoácidos não pode formar ligações de hidrogênio
ou ligações iônicas e comportam-se melhor em ambientes apolares. Tais aminoácidos
preferem ficar no interior das proteínas em uma solução aquosa.
13
Apesar do fato da Tirosina ser fortemente apolar, sua cadeia lateral possui um grupo
hidroxila que é polar e pode formar ligações de hidrogênio.
Algumas proteínas são chamadas de proteína transmembrana. Uma região de proteínas
transmembrana atravessa a membrana da célula ou o compartimento celular no qual elas
são encontradas
14
d. Casos especiais
§ 3. Estrutura das Proteínas
Para entendermos a estrutura das proteínas – uma combinação de forças determina a
estrutura:
−
efeito hidrofóbico
−
ligações iônicas
−
ligações de hidrogênio
−
ligações de dissulfeto
15
−
Década de 30: Linus Pauling propôs que o grupo NH em um aminoácido, e
o grupo C=O em outro aminoácido(s) podem interagir para formar uma
ligação de hidrogênio.
Ele previu que esses grupos iriam interagir, resultando em uma estrutura
polipeptídica (polipetídica) chamada de hélice a (hélice alfa). EM uma
hélice a (§)o grupo CO do aminoácidos n liga-se ao hidrogênio (no do)
grupo NH do aminoácido(s) (n+4).
Estrutura da a -hélice:
Pauling previu também outro tipo de estrutura polipeptídica (polipetídica) chamada de –
folha beta pregueada (folha ß pregueada). Na estrutura pregueada, existem atrações
intermoleculares entre duas ou mais cadeias polipetídicas:
(NR)* Cadeias antiparalelas são cadeias opostas, são paralelas mas em direção contrária.
Não são não paralelas como se se apresentam na figura acima.
16
Níveis de Estrutura de Proteína:
a) Estrutura primária:
−
A seqüência linear de aminoácidos (ex.: NH3 +..met-cis-leu-lis-glu…COO-)
b) Estrutura secundária
−
A disposição local dos aminoácidos próximos na cadeia linear para formar
estruturas como hélices, - folhas pregueadas e alças e molas aleatórias.
c) Estrutura terciária
Disposição espacial de aminoácidos afastados na cadeia do polipeptídio
(polipetídeo) linear para formar a estrutura tridimensional completa (dobrada) da
proteína. Também inclui ligações de dissulfetos :
−
d) Estrutura quaternária
Interação de mais de uma cadeia polipeptídica (polipetídica); associação entre
proteínas diferentes para formar complexos como dímeros, trímeros, tetrâmeros:
−
§4. Estrutura e Função das Proteínas
−
A estrutura determina a função das proteínas.
−
Veja um exemplo de proteína que catalisa uma reação bioquímica.
Triose fosfato isomerase (TFI)
TFI é uma proteína dimérica composta (um dímero de proteína composto) de duas cadeias
polipeptídicas (polipetídicas) de 247 aminoácidos cada uma. O polipeptídio (polipetídeo)
dobra-se para formar uma enzima em forma de cesta com um poço no centro.
APENAS O DÍMERO É ENZIMATICAMENTE ATIVO!
A TFI catalisa a seguinte reação:
17
Apesar de essa proteína possuir 247 aminoácidos, apenas três deles (Glu165, His95 e
Lis12) são importantes na função catalítica da TFI. O sítio catalítico (ativo) é formado
quando a proteína dobra-se em sua forma 3-D final e os três aminoácidos ficam próximos.
Observe o sítio ativo da TFI:
Mecanismo:
1) G 3-P liga-se ao sítio ativo da TFI (N de His95)
2) Lys12 estabiliza G 3-P no sítio ativo
3) Glu165 age como um catalisador básico (B-) pega um H+ do grupo C2 (o carbono
próximo ao carbonil) do G 3-P
4) His95 doa um a H+ para o grupo C1 (carbonil) de G 3-P para formar o grupo OH em
C1. (e facilita a formação do enediol intermediário)
5) Glu165 pega o H+ do grupo C1 do intermediário.
6) His95 pega o próton do grupo OH no grupo C2 do intermediário
TFI estabiliza (diminui a energia do intermediário) o intermediário fortemente
desfavorável, que possui uma energia livre positiva bem maior do que o G 3-P ou o DHAP
(uma energia livre bem mais positiva do que G 3-P ou DHAP).
A TFI também acelera 10 vezes a reação. O aminoácido que estabiliza o estágio de
transição é o Glu165. Se substituirmos Glu165 em TFI pelo Ácido aspártico (que é apenas
um carbono mais curto do que a glu), reduzimos a atividade da enzima em 1000 vezes (TFI
torna-se 1000 vezes menos eficaz)
ARTIGOS DO WASHINGTON POST, 21/5/93 pág. A3 “Influenza’s Burglary Tools” de Boyce Rensberger e NY
TIMES, 21/5/93 “Breakthrough on Flu Viruses Reported de Warren E. Leary
18
Bioquímica III: Energia Livre e Reações cinéticas (Reação Cinética)
TFI catalisa a seguinte reação:
Diagrama de Energia Livre para a Reação Acima:
TFI diminui a energia de ativação (Ea) da reação.
TFI faz isso ao estabilizar o estágio de transição (cis-enediol)
TFI (como com todas as enzimas) não afeta os (dos) valores de G°' de uma reação química.
§1.Equlíbrio da Reação, Keq e Energia Livre
Em equilíbrio, as moléculas tendem a permanecer em seu estado energético mais baixo.
Dois estágios, S1 e S2 com diferenças de energia entre os dois expressas como G°' =
variação na energia livre sob as condições padronizadas (as condição normais).
A equação que relaciona G às concentrações de S1 e S2:
G = Diferença de Energia Livre na Reação
°G= Energia Livre em condições padronizadas específicas
RT = constante de gás x T (em Kelvins)
[S1]/[S2] = razão entre os produtos e os reagentes
19
Em equilíbrio para a reação,?G = 0 ( não há variação líquida de energia livre ) (não há
reação líquida)
RT = 0,59 kcal/mol a 25°C, RT = 0,61 kcal/mol a 37°C então RT ~0,6
Keq = razão das constantes
razão da reação dianteira = K1 [S1 ]
razão da reação reversa = K2 [S2 ]
K1 [S1 ] = K2 [S2 ]
Exemplo: G3P ← → DHAP (∆G0’ = -1,86 kcal/mol)
Em equilíbrio
Keq = 22
Em equilíbrio haverá 22x mais DHAP do que G3P
Dado G3P puro: A reação prossegue → DHAP (síntese líquida de DHAP)
Dado DHAP puro: A reação prossegue ← para formar G3P (síntese líquida de G3P)
Quando G3P = DHAP G Rxn = 0 (não há variação líquida)
Is 22:1
20
~ 7:1
A reação prossegue para a direita → DHAP
A direção de uma reação depende de:
1) diferença da energia intrínseca entre os produtos e os reagentes
2) as concentrações das reações e dos produtos
Isso é descrito pela equação:
21
Se G de rxn < 0, rxn prosseguirá adiante → (reação exergônica)
Se G de rxn > 0, rxn prosseguira reversamente ← (reação endergônica)
Se G = 0, rxn está em equilíbrio, não há variação líquida de energia livre
Exemplo: SE a razão de DHAP: G3P fosse 7,4:1, qual seria o G do rxn e em qual direção
prosseguiria?
∆G = ∆G 0 + RT In
[PRODUTO ]
[REAGENTES ]
∆G = -1,86kcal/mol + 0,60kcal/mol In 7,4
G = -0,66 (G<0)
Portanto, a reação prosseguirá adiante → para produzir DHAP
§2. Reações Acopladas
Observe a reação A ←→ B
A reação tenderá a prosseguir na direção da molécula que apresenta a menor energia livre.
Como impulsionamos uma reação para frente que possui um ∆G0’ > 0?
É possível acoplar uma reação desfavorável ( G>0) com uma reação favorável ( G<0)
Algumas vezes o acoplamento pode resultar em condições desfavoráveis, mas é geralmente
mais favorável que a reação original não acoplada.
Rxn 1: A←→B ∆G0’ > 0
Rxn 2: C←→D ∆G0’ < 0
A+C←→B+D ∆G0’ < 0 (poderia ser inferior a 0 ou próximo de 0)
Exemplo:
A + X ←→ B
C ←→ D +X
A + C ←→ B+ D (reação geral)
As células usam esses mecanismos de acoplamento de reações desfavoráveis com reações
favoráveis para que as reações possam prosseguir adiante.
Exemplo:
1) Glicose + Pi ←→ Glicose 6-Fosfatase + H2 O ∆G0’ = 3,3 kcal/mol
2) ATP + H2 O ←→ ADP + Pi H2 O = -7,3 kcal/mol
Glicose + ATP ←→Glicose 6-P + ADP ∆G0’ = -4,0 kcal/mol
As células usam a energia da hidrólise do ATP para dirigir a reação 1
energeticamente desfavorável.
Pi = PO4 3 - fosfato inorgânico
O ATP é uma fonte principal de energia. O ATP armazena energia aproximando cargas
negativas em ligações altamente energéticas e libera essa energia quando a ligação é
quebrada.
22
Todas as reações que ocorrem nas células (1000) possuem G < 0
* As enzimas aumentam a taxa de reações; no entanto, elas não alteram as concentrações
de equilíbrio ou G para a reação.
§ 3.1 Taxas de Reação e o Papel das Enzimas
Para a reação G3P ←→ DHAP
Observe o perfil energético da reação
−
Energia de ativação (Ea) = barreira energética ou energia livre de ativação
para a reação.
−
Enzima (TFI) reduz a Ea estabilizando (reduzindo a energia livre de) estado
de transição (intermediário).
Na presença de TFI, a Ea para a reação é de 3 kcal/mol
Em equilíbrio G = 0, a energia de ativação é de 26 kcal/mol
Em equilíbrio, existem ~1019 mais G3P do que cis-enediol (ou 10-19 menos cis-enediol do
que G3P).
Portanto, a reação prossegue lentamente na ausência da enzima.
Na presença da enzima, G°’ = 13 kcal/mol. TFI estabiliza a cis-enediol intermediária,
reduzindo assim sua energia livre de 26 kcal/mol para 13 kcal/mol.
Em equilíbrio G=0; a energia de ativação é de 13 kcal/mol:
23
Em equilíbrio, existe ~1010 mais G3P do que cis-enediol (ou 10-10 menos cis-enediol do
que G3P).
A razão de [cis-enediol] para [G3P] é 109 vezes melhor na presença da enzima TFI.
Mas como sabemos que as enzimas reduzem a Ea para a reação ligando-se ao estágio de
transição?
−
Porque os análogos do estágio de transição (moléculas estáveis) que se parecem
com o estágio de transição ligam melhor as enzimas do que qualquer reagente ou
produto.
Papel das Enzimas nas Reações Químicas:
−
Uma reação pode ser exergônica, mas ter muita Ea; portanto, precisamos de uma
enzima para reduzir a Ea
−
Uma reação pode ser endergônica e não prosseguir a não ser que esteja acoplada a
uma reação exergônica. Uma enzima pode catalisar a reação acoplada, permitindo,
portanto, que a reação prossiga
Reações exergônicas ( G<0), reações endergônicas ( G>0)
§4. Cinética das Enzimas (Cinética de Michaelis-Menten 1913)
Podemos obter um modelo do mecanismo da reação enzimática da seguinte forma:
S = substrato
E = enzima
ES = complexo enzima – substrato
P = produto
K1 = Constante de taxa de reação adiante
K2 = Constante de taxa de reação reversa
K3 = Taxa de reação adiante
K1= ((# moles/L de ES formado.)/seg)/((# moles/L de E)(# moles de S))
= 1/ (mol/L x seg) unidades
K2= ((# moles/L de S formado.)/seg)/((# moles/L de ES)
= 1/seg unidades
K3= ((# moles/L de P formado.)/seg)/((# moles/L de ES)
= 1/seg unidades
24
1) Taxa Catalítica
A taxa catalítica é igual ao produto das concentrações de ES e K3
V = K3[ES]
V = velocidade ou taxa de reação
2) A fração (f) da enzima ligada ao substrato é:
f =
[ES ]
[ET ]
f =
[ET] = Concentração total da enzima
[S ]
[S ] + K
[ET] = Concentração da enzima ligada
f = fração da enzima ligada ao substrato
m
[ES ] = [ET ] [S ]
[S ] + K m
km =
k2 − k 3
= Constante de Michaelis
K1
1
1
+
moles
k m = sec sec =
units
1
1
(moles) ( sec )
Km é uma medida da afinidade de uma enzima por seu substrato
Qual é a fração (f) da enzima ligada quando:
1) [S] = Km
fração da enzima ligada = ½
2) [S] << Km fração de enzima ligada depende da afinidade da enzima por seu substrato
3) [S] >> Km fração ligada é 1 (enzima é limitada – toda ligada com o substrato)
A Taxa de Reação é V = K3 [ES]; substituindo na equação:
25
A taxa máxima de reação (Vmax) é obtida quando a enzima é saturada com o substrato
[S] aproxima-se de 1 (f =1)
(quando [S]>> Km) and
[S] + K m
V = K3 [ET ] (1)
Vmax= K3 [ET ]
Então V =
Vmáx [S ]
→ Equação de Michaelis-Menten
[S ] + K m
Observe a representação gráfica da velocidade de reação como uma função da
concentração do substrato [S], para um enzima que obedece à cinética de MichaelisMenten
1) [S] é baixa
([S] no denominador não é mais importante)
2) [S] é alta
(Valor de Km no denominador não é importante) então V=
Vmax
3) [S] = Km
(já que Km = [S]) então V = ½ Vmax
Km é a [S] na qual metade da enzima está ligada ao substrato
Qual é a velocidade da formação do produto:
Per [E], per [S]
Quando [S] é pequena, a maior parte da enzima está livre[E] = [ET]
26
Kcat = # transferência; # do molécula transferida pela enzima por unidade de
tempo para formar um produto
V = K3 / Km = Kcat
Para a Triose Fosfato Isomerase:
K1 = 108 l/(moles x seg)
K2 = 430/seg
K3 = 430/seg
K3 / Km = Kcat = ~ (108 produtos)/(reagentes x enzima x seg)
−
−
−
A taxa da reação de TFI é limitada apenas pela difusão; sempre que a TFI
encontra a G3P, a TFI converte a G3P em DHAP
A taxa de difusão é de ~108 (portanto a enzima raramente encontra o
substrato)
TFI é, portanto, cineticamente perfeita – sempre que encontra o substrato,
converte o mesmo em seu produto
7.012 Material Suplementar sobre Cinética das Enzimas (de 10/9/97). suplemento para
o Capítulo 6 de Purves et al.
Bioquímica IV: Metabolismo Energético
Revisão de Cinética
Estrutura do ATP em pH 7.0:
27
existe uma grande repulsão eletrostática entre os grupos fosfato com cargas negativas.
A hidrólise do ATP para ADP + Pi libera energia livre e reduz a repulsão
Como se produz ATP (energia para as células)?
Através de um processo conhecido como Glicólise (“glico” – açúcar, “lise” – quebra)
Na glicólise, 1 molécula de glicose é convertida em 2 moléculas de piruvato
Eficiência energética desse processo:
Com Oxigênio: C6 H12 O6 + 6H2 O – 6CO2 + 6CO2 + 6H2 Oproduz –686 kcal/mol
28
Sem Oxigênio: C6 H12 O6 → 2 lactatos → 2 ATPs
C6 H12 O6 → 2 etanol + CO2 → 2 ATPs
A glicólise ocorre no citoplasma das células, não necessita de oxigênio e ocorre em todos
os organismos
~ há 3,5 bilhões de anos: não havia oxigênio suficiente – portanto os organismo possuíam
um metabolismo anaeróbico
~ há 2,5 bilhões de anos: havia oxigênio suficiente para realizar metabolismo aeróbico
A glicólise pode ser realizada nos extratos de leveduras (i.e. as leveduras vivas não são
necessárias, apenas as enzimas. O termo enzima significa “na levedura”)
A glicólise possui duas fases:
1) Fase de investimento de energia (usa ATP)
2) Fase de geração de energia (produz ATP)
Resumo das Reações da Glicólise:
Composta por 10 etapas: 1 açúcar de 6-carbonos é convertido em moléculas de 2 3carbonos.
Uma observação importante:
A reação G3P ←→ DHAP apresenta G°’ = -1,86 kcal/mol
No entanto, na glicólise DHAP é convertido em G3P. Dessa forma G°’ dessa reação é +
1,86 kcal/mol!
Como a reação prossegue nas células??
Uma vez que o G3P é usado em reações posteriores, a [G3P] diminui, o que direciona
a reação para a direita, produzindo mais G3P.
Mesmo que G°’> 0, o valor de G < 0 em virtude da razão de produtos/reagentes
29
∆G = ∆G 0 + RT In
[PRODUTO ]
[REAGENTES ]
Na célula, todas as reações prosseguirão adiante uma vez que G < 0 (obtido mantendo-se
uma razão ótima de produtos / reagentes)
TABELA DE valores de G°’ e G das reações na glicólise.
Observe que grande parte de G°’ > 0, mas todos os valores de G são < 0
Portanto, a reação prossegue formando o piruvato!
A Quinase é uma enzima que adiciona um grupo fosfato à molécula.
Regulação das Vias
O objetivo da glicólise é produzir ATP. O ATP produzido é usado em outras reações
na célula (reações biossintéticas, transporte, etc.)
−
A células sente a razão de ATP/ADP
por exemplo: quando os músculos estão trabalhando intensamente, o ATP é
convertido em ADP
−
−
se a [ATP] for alta, a glicólise é baixa
se a [ATP] for baixa, a glicólise é iniciada (aumento de ADP ativa a glicólise)
É possível variar as velocidades de reação (v) das enzimas na glicólise trocando-se as
variáveis na equação:
Para Aumentar a Taxa de Glicólise:
1) Aumentar [ET]; produzir mais enzimas
por exemplo: após a ingestão de altos níveis de carboidratos – os níveis de
piruvatoquinase aumentam
2) Aumento da [S]; se aumentarmos a quantidade de substrato, aumentaremos a
fração (f) da enzima que é ocupada pelo substrato:
3) Se Km for alterado – poderá afetar a taxa da reação
se Km for mais alto → taxa mais lenta
se Km mais baixo → taxa mais rápida
É possível alterar Km de uma enzima variando-se a forma do sítio ativo (sítio catalítico) da
enzima
30
Exemplo:
A ligação dos reguladores no sítio alostérico leva a uma variação da forma da enzima – o
que afeta o Km da enzima.
−
−
Se diminuirmos Km → a taxa (v) aumenta porque f será aumentado também
Se aumentarmos Km → a taxa (v) diminui porque diminuímos f
A ligação dos reguladores no sítio ativo – altera o sítio – a posição de alguns aminoácidos
muda em alguns angstroms – suficiente para inativar a enzima.
Regulação das Vias:
Regulação de Feedback e Feed-Forward
A maior parte das enzimas que catalisa reações nas vias bioquímicas é regulada.
Exemplo de Via
1) F pode agir como um inibidor de feedback da enzima que catalisa a etapa C → D
(primeira etapa comprometida na síntese de F
2) I pode agir como um inibidor de feedback da enzima que catalisa a etapa C → G
para reduzir a velocidade daquela etapa
3) Tanto I quanto G juntos ou sozinhos podem agir como inibidores de feedback da
etapa A → B
4) A pode agir como um inibidor feed forward da etapa B → C para aumentar a
velocidade daquela reação
Por exemplo: se tivermos muito A (A está construindo), é possível ir para a
etapa de limitação de velocidade, diminuir Km da enzima e acelerar a reação
31
Normalmente, o produto final de uma via geralmente regula a primeira etapa
comprometida da via (ou primeira etapa que necessita de enzimas)
Na glicólise, certas enzimas são reguladas de forma que a velocidade da glicólise possa ser
aumentada ou diminuída dependendo das exigências energéticas da célula.
Regulação da enzima hexoquinase:
G6-P inibe a hexoquinase se a glicólise for bloqueada ou freada.
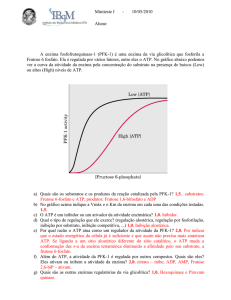
Regulação da enzima fosfofrutoquinase (enzima PFRK)
−
ATP age como um regulador negativo da enzima PFK.
−
Em alto [ATP] , ATP liga-se ao sítio alostérico e altera a atividade catalítica
da PFK (aumenta Km )
Em baixo , ATP liga-se ao sítio ativo da PFK e ativa PFK
Alto [ADP] ativa a PFK
−
−