UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC
CURSO DE FISIOTERAPIA
SARA DA SILVA DE MATOS
PROPOSTA DE TRATAMENTO FISIOTERAPÊUTICO EM
AMBIENTE AQUÁTICO PARA PACIENTES COM FIBROSE CÍSTICA:
UM ESTUDO DE CASO
CRICIÚMA, NOVEMBRO DE 2009
SARA DA SILVA DE MATOS
PROPOSTA DE TRATAMENTO FISIOTERAPÊUTICO EM
AMBIENTE AQUÁTICO PARA PACIENTES COM FIBROSE CÍSTICA:
UM ESTUDO DE CASO
Trabalho de Conclusão de Curso, apresentado
para obtenção de grau de Bacharel em
Fisioterapia pela Universidade do Extremo Sul
Catarinense, UNESC.
Orientador Técnico: MSc. Cláudio Sérgio da
Costa
Co-orientador: MSc. Rômulo Nolasco de Brito
CRICIÚMA, NOVEMBRO DE 2009
2
3
Dedico
com
muito
carinho
essa
conquista aos meus pais, Nilson e
Elbia, por todo amor e dedicação
prestados
a
mim
em
todos
os
momentos da minha vida, inclusive
nessa jornada. Por terem me ensinado
a importância dos estudos.
4
AGRADECIMENTOS
A Deus pela presença em minha vida, dando força para alcançar os meus
objetivos e por permitir essa conquista.
A minha família, por serem essenciais na minha vida. Aos meus pais, em
especial, que me doam amor incondicional, o que me dá segurança e força para
enfrentar qualquer dificuldade. As minhas irmãs, que são minhas melhores amigas e
estão sempre do meu lado em qualquer situação. Ao meu irmãozinho, que eu amo.
Aos meus avós, pela preocupação e carinho atribuídos a mim em todas
as fases da minha vida.
Ao meu namorado, Rossano, pelo incentivo quando escolhi a fisioterapia,
pela compreensão da distância, pelo amor e amizade que foram muito importantes
para que eu conseguisse enfrentar essa etapa. Te amo muito.
Às minhas colegas do curso, ou melhor, amigas, que compartilharam
comigo muitas histórias e fizeram com que a minha estada em Criciúma fosse mais
divertida. Vou sentir muitas saudades de cada uma.
Ao meu paciente, que participou e fez com que fosse possível a
realização desse estudo.
Ao meu orientador, Cláudio Sérgio da Costa, pela amizade e por me
auxiliar na realização desse trabalho.
Ao meu co-orientador, Rômulo Nolasco de Britto, que foi meu orientador
por dois semestres, me deu muitas idéias e ajudou na construção desse trabalho.
Aos demais mestres, que me conduziram ao conhecimento e contribuíram
para a minha formação.
Obrigada a todos!
5
“Se
você
é
capaz
de
tremer
de
indignação a cada vez que se comete
uma injustiça no mundo, então somos
companheiros”.
Che Guevara
6
RESUMO
A Fibrose Cística é uma doença genética de envolvimento multissistêmico que
ocorre por uma alteração nas glândulas exócrinas do organismo. Apesar de
multissistêmica, é a doença pulmonar a principal responsável pela morbi-mortalidade
desses pacientes. A progressão da doença conduz a lesões irreversíveis do trato
respiratório, alterando a mecânica e a função pulmonar, gerando incapacidades
funcionais, sendo preciso interferir nesse processo para proporcionar maior
sobrevida a esses pacientes. Esta pesquisa teve como objetivo verificar os efeitos do
tratamento fisioterapêutico em ambiente aquático em um paciente com Fibrose
Cística. Foi realizado um estudo de caso com um paciente adulto, 31 anos, estatura
1,69m, peso 64,5Kg, do sexo masculino, raça branca, com diagnóstico da doença. O
estudo compreendeu 14 sessões de fisioterapia em ambiente aquático, com duração
de 60 minutos, duas vezes por semana, onde foram incluídos exercícios para tronco,
membros superiores e inferiores e técnicas respiratórias. Antes e após o treinamento
foram realizadas avaliações para posterior comparação. Após a aplicação do
protocolo obteve-se aumento satisfatório da força muscular respiratória, da
capacidade de tosse, da expansibilidade tóraco-abdominal e da tolerância ao
exercício, mantendo a estabilização em relação à prova de função pulmonar. Com a
pesquisa percebeu-se que a fisioterapia aquática é benéfica e pode ser um
importante tratamento na melhora da sobrevida dos pacientes com FC, no entanto,
devem ser realizados mais estudos com uma amostra maior e em longo prazo, para
então serem comprovados os efeitos desse método no sistema respiratório desses
pacientes.
Palavras-chave: Fibrose Cística, Reabilitação Pulmonar, Fisioterapia aquática.
7
ABSTRACT
Cystic Fibrosis is a genetic disease of multisystemic that occurs by a change in the
exocrine glands of the body. This pulmonary disease is the main responsible for
morbidity and mortality of these patients, although multisystemic. Disease
progression leads to irreversible damage of the respiratory tract, altering the
mechanics and lung function, causing functional disability, and must interfere with
this process to provide better survival for these patients. This study aimed to verify
the effects of physical therapy in the aquatic environment in a patient with Cystic
Fibrosis. We conducted a case study of an adult patient, 31 years, height 1.69 m,
weight 64.5 kg, male, white, with diagnosis of the disease. The study included 14
sessions of aquatic therapy, lasting for 60 minutes twice a week, which included
exercises for the trunk, arms and legs and breathing techniques. Before and after
training assessments were made for further comparison. After applying the protocol
was obtained satisfactory growth in respiratory muscle strength, the ability to cough,
chest and abdominal expansion and exercise tolerance while maintaining stability in
relation to pulmonary function. Through research it was noted that the aquatic
therapy is beneficial and can be an important treatment on the survival of patients
with Cystic Fibrosis, however, should be further studies with larger samples and
longer term to be challenged, then the effects this method in the respiratory system of
these patients.
Keywords: Cystic Fibrosis, Pulmonary Rehabilitation, Aquatic Therapy.
8
LISTA DE ILUSTRAÇÕES
Figura 1 - Representação do padrão autossômico recessivo da Fibrose Cística.....22
Figura 2 - Efeitos da pressão hidrostática sobre o sistema respiratório.....................49
Figura 3 - Espirometria computadorizada..................................................................52
Figura 4 - Equipamentos para a aferição dos sinais vitais.........................................53
Figura 5 - Manuovacuômetro, clipe nasal, Peak Flow, fita métrica............................54
Figura 6 - Materiais utilizados para o teste de caminhada.........................................54
Figura 7 - Piscina terapêutica.....................................................................................55
Figura 8 - Máquina fotográfica digital.........................................................................55
9
LISTA DE TABELAS
Tabela 1 - Caracterização do Paciente .................................................................... 58
Tabela 2 - Pimáx e Pemáx antes e após tratamento com fisioterapia aquática ........ 63
Tabela 3 - Expansibilidade tóraco-abdominal antes e após o tratamento com
fisioterapia aquática....................................................................................................65
Tabela 4 - Espirometria, pré e pós broncodilatador, antes e após tratamento com
fisioterapia aquática....................................................................................................66
Tabela 5 - Peak flow antes e após tratamento com fisioterapia aquática..................67
Tabela 6 - Teste de caminhada de 6 minutos antes e após tratamento com
fisioterapia aquática....................................................................................................68
10
LISTA DE ABREVIATURAS E SIGLAS
ACAM – Associação Brasileira de Assistência ao Mucoviscidótico
AFE – Aumento de Fluxo Expiratório
bpm – Batimentos por Minuto
ºC – Graus Centígrados
CFTR – Cystic Fibrosis Transmembrane Regulator Protein
Cl- – Cloro
cm – Centímetros
cmH₂O - Centímetros de Água
cpm – Ciclos por Minuto
CVF – Capacidade Vital Forçada
DA – Drenagem Autogênica
DNA – Ácido Desoxirribonucléico
DP – Drenagem Postural
DP – Distância Percorrida
DPN – Diferencial de Potencial Nasal
DPOC – Doença Pulmonar Obstrutiva Crônica
DVO – Distúrbio Ventilatório Obstrutivo
ELTGOL – Expiração Lenta com a Glote Aberta em Decúbito Lateral
EPAP – Pressão Positiva Expiratória Final
FC – Fibrose Cística
FC – Freqüência Cardíaca
FEF 25-75% – Fluxo Expiratório Forçado entre 25 e 75%
FR – Frrqüência Respiratória
IP – Insuficiência Pancreática
Kg – Kilo Grama
L – Litros
L/min – litros por minuto
LSD – Lobo Superior Direito
MEq/l – Miliequivalente por Litros
Mg – Miligrama
mmHg – Milímetros de Mercúrio
11
Na+ – Sódio
OMS – Organização Mundial de Saúde
OOAF – Oscilação Oral de Alta Freqüência
PA – Pressão arterial
Pemáx – Pressão Expiratória Máxima
PF – Peak Flow
PFE – Pico de Fluxo Expiratório
Pimáx – Pressão Inspiratória Máxima
PIP – Ponto de Igual Pressão
SMI – Sustentação Máxima Inspiratória
SBPT – Sociedade Brasileira de Tisiologia e Pneumologia
StO2 – Saturação de Oxigênio
TC – Tomografia Computadorizada
TC6 – Teste de Caminhada de Seis Minutos
TCAR – Técnicas do Ciclo Ativo da Respiração
TEF – Técnica de Expiração Forçada
TEMP – Terapia Manual Passiva
TIR – Tripsina Imunurreativa
VA – Vias Aéreas
VC – Volume Corrente
VEF1 – Volume Expiratório Forçado no Primeiro Segundo
VR – Volume Residual
VRF – Volume Residual Funcional
12
LISTA DE APÊNDICES
Apêndice A - Termo de Consentimento Livre e Esclarecido
Apêndice B - Autorização para a Utilização da Piscina Terapêutica
Apêndice C - Avaliação Fisioterapêutica Respiratória
Apêndice D - Avaliação de Fisioterapia Aquática
Apêndice E - Protocolo de Tratamento Fisioterapêutico em Ambiente Aquático
13
LISTA DE ANEXOS
Anexo A - Aprovação do Comitê de Ética e Pesquisa
Anexo B – Validações do instrumento de pesquisa
Anexo C – Ficha de registro do teste de caminhada
14
SUMÁRIO
1 INTRODUÇÃO ....................................................................................................... 15
2 REFERENCIAL TEÓRICO..................................................................................... 21
2.1 Fibrose Cística................................................................................................... 21
2.1.2 Genética .......................................................................................................... 22
2.1.3 Fisiopatologia ................................................................................................. 23
2.1.4 Manifestações Clínicas .................................................................................. 25
2.1.4.1 Manifestações Respiratórias ...................................................................... 25
2.1.4.2 Manifestações em Outros Sistemas .......................................................... 28
2.1.5 Diagnóstico ..................................................................................................... 29
2.1.6 Tratamento ...................................................................................................... 33
2.1.6.1 Reposição Enzimática e Suporte Nutricional ........................................... 34
2.1.6.2 Tratamento da Doença Pulmonar .............................................................. 35
2.1.7 Fisioterapia Respiratória na Fibrose Cística................................................ 37
2.2 Fisioterapia Aquática ........................................................................................ 45
2.2.1 Os Princípios e Propriedades Físicas e Terapêuticas da Água ................. 45
2.2.2 Efeitos Fisiológicos e Terapêuticos da Imersão e do Exercício em Água 47
3 MATERIAIS E MÉTODOS ..................................................................................... 51
3.1 Caracterização do Estudo ................................................................................ 51
3.2 Caracterização da Amostra e Local de Estudo............................................... 51
3.3 Instrumentos para Coleta de Dados ................................................................ 52
3.4 Procedimentos para Coleta de Dados ............................................................. 55
3.5 Procedimentos para Análise ............................................................................ 57
4 APRESENTAÇÃO E ANÁLISE DOS DADOS....................................................... 58
4.1 Caracterização do Paciente .............................................................................. 58
4.2 Análise e Discussão dos Dados ...................................................................... 61
5 CONCLUSÃO ........................................................................................................ 70
REFERÊNCIAS ......................................................................................................... 72
APÊNDICES ............................................................................................................. 78
ANEXOS ................................................................................................................. 101
15
1 INTRODUÇÃO
A fibrose cística (FC) é a doença genética de padrão hereditário
autossômico recessivo, letal, mais comum em indivíduos caucasóides (DETURK e
CAHALIN, 2007). Trata-se de uma doença crônica, progressiva e grave, cuja
evolução não permitia até pouco tempo atrás que o indivíduo chegasse à
adolescência (DALCIN et al., 2007).
Ela ocorre em conseqüência de mutações no gene responsável por
codificar uma proteína que regula o transporte de íons através da membrana celular
– denominada CFTR (Cystic Fibrosis Transmembrane Condutance Regulator)
(LEMOS et al., 2004). A ausência ou deficiência da atividade da proteína resulta em
diminuição da excreção de cloro das células para a luz das glândulas exócrinas,
ocorrendo um déficit de líquido luminal que provoca a desidratação das secreções,
ocorrendo produção de muco viscoso, o qual acarreta a obstrução dos ductos
dessas glândulas, com eventual destruição dos órgãos (POSTIAUX, 2004).
Há mais de 1.000 mutações descritas no gene da FC, entretanto, a mais
comum é a ∆F508 (ALVES et al., 2007). Em razão da diversidade de mutações
existentes a expressão clínica da doença é muito variada e envolve diversos
sistemas orgânicos. Em geral, caracteriza-se por doença pulmonar obstrutiva
crônica, disfunção pancreática exócrina, doença hepática, problemas na motilidade
intestinal, infertilidade masculina e concentrações elevadas de eletrólitos no suor
acima de 60 mEq/l (DALCIN e SILVA, 2008).
O diagnóstico da fibrose cística ocorre normalmente no nascimento ou na
infância, porém pode ser identificada em idade mais avançada quando os sintomas
começam a interferir em sua qualidade de vida (DETURK e CAHALIN, 2007). Para a
realização do diagnóstico é necessária a presença de pelo menos um achado
fenotípico, história familiar de mucoviscidose ou triagem neonatal positiva,
acompanhada de evidência laboratorial de disfunção da CFTR, teste de suor positivo
ou diferença de potencial nasal positivo, ou ainda pela identificação de duas
mutações conhecidas como causa de FC nos genes CFTR (DALCIN e SILVA, 2008).
Apesar das conseqüências da doença em outros órgãos, a doença
pulmonar é a causa principal de óbitos na FC. As manifestações clínicas pulmonares
ocorrem, normalmente, em nível dos brônquios e bronquíolos. As glândulas
16
mucosas, presentes nessas regiões, produzem secreções muito viscosas e pouco
elásticas que ficam retidas nas vias aéreas, favorecendo a inflamação e a infecção
neste local (POSTIAUX, 2004). Os patógenos mais comuns nesse processo são o
Staphylococcus aureus, Pseudomonas aeruginosa e membros do complexo
Burkholderia cepacia. A inflamação crônica, secundária ao processo infeccioso,
acarreta lesões irreversíveis nas paredes brônquicas, determinando a degradação
da função pulmonar (MAGALHÃES et al., 2004; FREIRE et al., 2008).
O processo inicia normalmente na infância com obstrução progressiva ao
fluxo
aéreo,
levando
a
infecção
e
inflamação
crônica,
bronquiectasias,
hiperinsuflação pulmonar, hipertensão pulmonar e, até mesmo, falência respiratória.
Os pacientes com FC podem ser relativamente assintomáticos antes das alterações
irreversíveis, da colonização por bactérias, inflamação crônica e da progressiva
destruição pulmonar (GALVÃO, 2006).
Os principais sinais e sintomas são infecção respiratória de repetição,
processo inflamatório crônico, tosse constante, produção excessiva de escarro
mucoso, espesso e purulento, presença de sibilância e roncos na ausculta pulmonar,
cianose, baqueteamento digital e tórax hiperinsuflado (OLIVEIRA, 2007).
O desenvolvimento e o agravamento da hiperinsuflação pulmonar alteram
o formato do tórax, deixando o diafragma em desvantagem mecânica, determinando
a perda na pressão inspiratória, ou seja, da força muscular. Essa fraqueza muscular
respiratória pode ser agravada pela desnutrição e quadro de infecção pulmonar, e
pode levar o fibrocístico à fadiga muscular e, ainda, contribui para a dispnéia e
intolerância ao exercício (GALVÃO, 2006).
Os portadores de FC devem ser seguidos por uma equipe multidisciplinar,
constituída principalmente por médico, fisioterapeuta e nutricionista. O tratamento
consiste em ingestão de enzimas pancreáticas antes das refeições e nutrição
adequada. Além da utilização de mucolíticos, antiinflamatórios, broncodilatadores e,
sobretudo, antibioticoterapia para a doença pulmonar. A fisioterapia respiratória é de
extrema importância, pois a insuficiência respiratória é a principal causa de morte
nesses pacientes. O objetivo com o tratamento é a melhora da qualidade de vida e o
aumento da expectativa de vida desses indivíduos, pois a cura para essa
enfermidade ainda não foi descoberta (DETURK e CAHALIN, 2007; MARQUES et
al.,2008).
17
Quanto às intervenções fisioterapêuticas, elas facilitam a remoção de
secreções purulentas e melhoram a função pulmonar. A fisioterapia atua com
diversas técnicas de higiene brônquica para manter a permeabilidade das vias
aéreas e prevenir a inflamação das paredes dos brônquios, diminuindo a limitação
ao fluxo aéreo, melhorando a distribuição da ventilação e prevenindo as lesões das
vias aéreas (ALMEIDA et al., 2008).
Existem muitas modalidades com o objetivo de favorecer a limpeza
pulmonar, entre elas estão às convencionais – Drenagem Postural (DP), Vibração,
Compressão, Vibrocompressão e Tosse – e as modernas, Drenagem Autógena
(DA), Técnica do Ciclo Ativo da Respiração (TCAR), Expiração Lenta com a Glote
Aberta em Decúbito Lateral (ELTGOL), Pressão Expiratória Positiva na Vias Aéreas
(EPAP), Flutter ou Shaker e exercício físico. Antes de qualquer técnica deve ser feita
aerossolterapia para a hidratação das secreções (POSTIAUX, 2004; AZEREDO,
2002).
Além disso, os músculos respiratórios devem ser treinados objetivando o
aumento da força e resistência dos mesmos, melhorando mecânica e a função
pulmonar, prevenindo a fadiga respiratória, reduzindo a dispnéia e melhorando a
capacidade funcional do indivíduo (AZEREDO, 2002; RODRIGUES, 2003).
Em relação ao treinamento desses músculos, a fisioterapia aquática é um
dos recursos utilizados para esse fim em pacientes pneumopatas. A melhora da
força muscular inspiratória em ambiente aquático ocorre devido à influência das
propriedades físicas da água, principalmente da pressão hidrostática. Quando o
indivíduo fica imerso com água na altura do processo xifóide ocorre um aumento no
trabalho respiratório de 60% a 65%, o qual é resultado da resistência à expansão da
caixa torácica e do aumento de sangue central – esses fatores são produzidos pela
pressão hidrostática (IDE et al., 2005). Além de ser uma carga para o músculo
diafragma, também auxilia a fase expiratória (FAGUNDES e SILVA, 2006).
Os
efeitos
fisiológicos
da
água
podem
ser
associados
aos
desencadeados pela prática do exercício físico e pela aplicação de outras técnicas,
tornando as respostas mais complexas (HERNANDES, 2004).
Os pacientes com fibrose cística necessitam de tratamento complexo e
rotineiro que requerem a adesão desses para o resto da vida. Além disso, as
doenças respiratórias crônicas estão associadas com aumento da incidência e
prevalência de ansiedade e depressão, bem como de outras desordens
18
comportamentais (FOGAÇA, 2008). Sabendo disso, a fisioterapia na água beneficia
esses pacientes proporcionando a interação com um ambiente agradável, além de
outros
efeitos
psicológicos,
contribuindo
com
a
continuidade
da
terapia
(HERNANDES, 2004).
A partir da contextualização aqui apresentada formulou-se a seguinte
questão problema: Quais os efeitos da fisioterapia aquática no tratamento das
doenças pulmonares na fibrose cística?
Nesse sentido foram elaboradas as seguintes questões a investigar:
Quais as características dos sujeitos portadores de fibrose cística quanto
à doença pulmonar?
Os pacientes com fibrose cística apresentam manifestações sistêmicas,
as quais ocorrem por disfunção das glândulas de secreções exócrinas. A
manifestação mais importante ocorre no sistema respiratório, por meio de doença
pulmonar obstrutiva crônica, que é a principal causa de morte nesses pacientes.
(MARQUES et al., 2008). A doença tem seu curso clínico pulmonar agravado pela
inflamação crônica e infecções bacterianas nas vias aéreas, que favorecem o
aprisionamento de ar e alteram a complacência do sistema respiratório, ocorrendo
aumento do trabalho respiratório e redução da força dos músculos inspiratórios
(ZANCHET et al. 2006). A doença pulmonar, com o tempo, leva a diminuição da
tolerância ao exercício, ocorrendo um círculo vicioso de inatividade e aumento da
dispnéia (CHAVES et al., 2007).
Quais os efeitos terapêuticos do exercício em água no sistema
respiratório durante a imersão do paciente?
Os resultados decorrentes do exercício em água no sistema respiratório
estão em parte relacionados ao sistema circulatório, pelo fato de haver um aumento
significativo no volume de sangue nos vasos pulmonares, no entanto, os efeitos são
relacionados também a pressão hidrostática da água sobre a caixa torácica. O
resultado de todos esses efeitos juntos é o aumento do trabalho respiratório,
auxiliando na melhora da força da musculatura respiratória (SACCHELLI e et al.,
2007). Além de levar ao aumento da troca gasosa pela melhora da mecânica
ventilatória, elevando a saturação de oxigênio (CAROMANO et al., 2003).
Quais os resultados da fisioterapia aquática na reabilitação pulmonar em
sujeitos com fibrose cística?
A fisioterapia aquática promove muitos benefícios, sendo que alguns são
19
decorrentes da temperatura da água e outros de suas propriedades físicas. Por esse
motivo, os indivíduos que realizam exercícios terapêuticos nesse ambiente têm
muitas vantagens como: ganho de força e resistência muscular em caso de
fraqueza, inclusive da musculatura respiratória; melhora da mecânica ventilatória; e
melhora da conscientização corporal (RUOTI et al., 2007). Além disso, a
cinesioterapia realizada em ambiente aquático proporciona melhora da capacidade
aeróbica, reeducação respiratória, auxílio no retorno venoso, melhora na irrigação
tecidual e estabilidade da pressão arterial (SACCHELLI e cols., 2007). A
hidrocinesioterapia na adaptação cardiorrespiratória em pacientes com FC mostrou
aumento da tolerância ao exercício, frente a esforços submáximos em um estudo
realizado por Santana e Penasso (2005). Acredita-se que com todos esses
benefícios os pacientes fibrocísticos apresentariam melhora de sua expectativa de
vida.
Em relação aos objetivos da pesquisa, tem-se como objetivo geral
analisar os efeitos do tratamento fisioterapêutico em ambiente aquático em um
sujeito com fibrose cística.
Já como objetivos específicos, caracterizar o sujeito portador de fibrose
cística em estudo quanto à doença pulmonar; apontar os efeitos fisiológicos e
terapêuticos da fisioterapia aquática sobre o sistema respiratório em um sujeito com
Fibrose Cística; e verificar o quadro evolutivo por meio de avaliação pré e póstratamento fisioterapêutico na água em um sujeito com fibrose cística.
A morbi-mortalidade dos pacientes com FC deve-se a infecções
pulmonares e suas complicações em 90% dos casos (ALVES et al., 2007). Portanto,
a fisioterapia é essencial no tratamento do paciente com Fibrose Cística. A
descoberta de outras modalidades de tratamento que diminuam a intensidade dos
sintomas e contribuam na terapêutica da doença pulmonar pode trazer grandes
benefícios à saúde do paciente, principalmente quanto ao aumento e qualidade de
sobrevida.
A fisioterapia em ambiente aquático poderia ser um método de escolha
para esse fim. No entanto, foi visto uma carência de estudos sobre o tratamento
fisioterapêutico nesse ambiente, o qual pode proporcionar o treinamento da
musculatura respiratória, melhora da capacidade funcional do indivíduo, além de
auxiliar na remoção de secreções. Sendo assim, é uma modalidade de tratamento
20
que deve ser investigada e comprovada cientificamente em seus benefícios para
melhora da sobrevida e qualidade de vida desses pacientes.
Estudos apontam que na Europa e EUA a incidência da doença varia
entre 1:2.000 e 1:8.000 nascidos vivos. Já no Brasil, a incidência da FC ainda é
desconhecida. Existem estimativas de que 10% do total anual de afetados são
diagnosticados, dando a impressão errônea de que no Brasil a incidência é baixa
(ANTUNES, 2008; OLIVEIRA, 2007; DALLALANA, 1997). Uma das maiores
barreiras existentes para o diagnóstico da FC no Brasil é o fato de a doença ser
pouco conhecida, até mesmo pelos profissionais da área da saúde (LUDWIG NETO,
2008).
Com base nisso, observa-se a necessidade de novos estudos e
divulgação sobre a doença entre os profissionais da área da saúde, para que o
diagnóstico precoce seja feito e o tratamento adequado realizado o mais cedo
possível, adiando a progressão da doença.
A melhora da qualidade de vida e, conseqüentemente, maior sobrevida
dos pacientes com FC está ligada principalmente aos avanços terapêuticos. É de
extrema importância a aderência dos pacientes ao tratamento para que essas
intervenções sejam eficazes, proporcionando menor acometimento por patologias de
origem infecciosa, melhora da função cardiopulmonar e, por conseguinte, redução
do número de internações (FOGAÇA, 2008).
Acredita-se que os indivíduos com Fibrose Cística serão beneficiados com
o estudo por ser uma nova alternativa de tratamento fisioterapêutico, o qual pode
propiciar uma acentuada melhora na função pulmonar. No ambiente aquático os
benefícios do exercício e das técnicas da fisioterapia respiratória estarão associados
aos benefícios fisiológicos da água sobre o corpo imerso, além de ser um ambiente
agradável que contribui para a maior aderência dos pacientes ao tratamento.
21
2 REFERENCIAL TEÓRICO
2.1 Fibrose Cística
A Fibrose Cística (FC) foi descrita por Andersen em 1938 como ‘fibrose
cística do pâncreas’ e tinha até menos de 70 anos atrás um prognóstico quase que
uniformemente fatal no primeiro ano de vida (DALCIN e SILVA, 2008).
A FC é doença hereditária mais comum entre os caucasóides se
comparada às doenças genéticas que levam a óbito ainda na infância. (ALVES et
al.,
2007;
DALLALANA,
1997).
Sua
incidência
na
raça
branca
é
de
aproximadamente 1:2.000 nascidos vivos, enquanto que na raça negra é mais rara,
ocorrendo em 1:17.000 nascimentos e em asiáticos ainda mais rara, 1:90.000
nascimentos. A doença incide em ambos os sexos igualmente (ANTUNES, 2008;
ROSOV, 1999).
Na região sul a incidência da FC é mais próxima da população
caucasiana européia, enquanto em outras regiões diminui para aproximadamente
1:10.000 nascidos vivos, isso ocorre pela falta de estudos epidemiológicos ou de
triagem neonatal nessas regiões (OLIVEIRA, 2007; ROZOV, 1999).
Outro dado interessante é que o número de sujeitos com a doença vem
aumentando. Nos Estados Unidos há 30 anos 8.000 casos eram registrados, até
1991 já havia registros de 18.674 fibrocísticos e em 2004 os números já aumentaram
para 22.714. Estima-se que 91% dos fibrocísticos nascidos vivos estejam
diagnosticados (ANTUNES, 2008).
Conforme estudo realizado com dados de 59 pacientes de Minas Gerais,
a idade média ao diagnóstico era de 3,6 anos. Avanços vêm ocorrendo desde
aproximadamente duas décadas atrás, principalmente no diagnóstico em idade
precoce e a realização de tratamento adequado, o que possibilitou o aumento e
qualidade de sobrevida (RASKIN e FAUCZ, 2001).
Até pouco tempo atrás poucos sujeitos com FC chegavam à vida adulta,
hoje a sobrevida desses aumentou, entretanto, ainda é baixa. Registros norteamericanos apontam que atualmente a idade média de sobrevida é 36,5 anos, e que
43% das pessoas com fibrose cística têm mais de 18 anos (DALCIN e SILVA, 2008).
22
Estudos estimam que pacientes nascidos depois de 2000 tenham a possibilidade de
sobrevivência em mais de 50 anos (BUZZETTI et al., 2009).
2.1.2 Genética
A Fibrose Cística é uma doença genética, hereditária e de padrão
autossômico recessivo (TARANTINO, 1999). Deste modo, para que a criança nasça
com a patologia é preciso que ambos os pais tenham o gene para a Fibrose Cística
(FC), existindo a probabilidade de nascer um filho com a doença (25%), ou saudável
(25%) ou portador assintomático do gene da FC (50%), para cada gestação
(RIBEIRO et al., 2002).
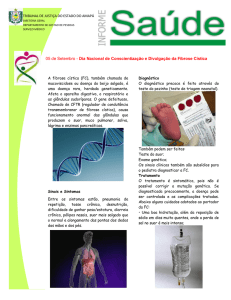
Figura 1: Representação do padrão autossômico recessivo da Fibrose Cística.
Fonte: gentica12aesob.blogspot.com/
O gene conhecido como CFTR (Cystic Fibrosis Transmembrane
Regulator) é responsável pela Fibrose Cística quando está mutado (RASKIN e
FAUCZ, 2001). Esse gene está localizado no braço longo do cromossomo 7, lócus
31q, exon 10, tendo sido identificado com base na análise seqüencial de DNA no
ano de 1989. Existem mais de 1.000 mutações descritas no gene da FC, as quais
levam à alteração na codificação de uma proteína de 1.480 aminoácidos,
denominada CFTR, que é responsável por regular e participar do transporte de íons
através das membranas celulares. O resultado é a ausência ou mau funcionamento
23
dessa proteína, levando a um transporte anormal de íons e eletrólitos (GALVÃO,
2006).
A proteína CFTR pode ter sua função prejudicada, com maior intensidade
ou menor, por diversas formas: por não ser sintetizada; por ocorrer um defeito no
processamento da proteína; por uma desordem na regulação da proteína; por
redução na atividade de condutância de íons através do canal de cloro; por redução
do número de proteínas transcritas; ou por um defeito na estabilidade da proteína na
superfície celular (ROVEDDER, 2006).
Devido a esse grande número de mutações no gene da FC, existe uma
enorme variabilidade clínica da doença (ROSOV, 1999). Dentre as mutações, a mais
comum é a ∆F508, que ocorre pela deleção de três pares de base, acarretando a
perda de um aminoácido fenilalanina na posição 508 da proteína. Esta mutação,
∆F508, é identificada em 60-70% dos pacientes, e é correlacionada com o pior
prognóstico, insuficiência pancreática exócrina e a maior gravidade da doença
pulmonar (DALCIN e SILVA, 2008). Pacientes que são homozigotos para a mutação
∆F508 (∆F508 + ∆F508) desenvolvem a forma mais severa da doença, já os
heterozigotos (∆F508 + outra mutação) apresentam sintomatologia moderada
(TARANTINO, 1997).
2.1.3 Fisiopatologia
Quando há dois alelos com mutações no gene da FC ocorre ausência de
atividade ou deficiência da função da CFTR, provocando redução na excreção do
cloro (Cl) e, conseqüentemente, aumento da eletronegatividade intracelular. Com
isso, ocorre maior fluxo de sódio (Na) para o interior das células epiteliais para
preservar o equilíbrio eletroquímico, seguido de água, por ação osmótica (RIBEIRO
et al., 2002).
Devido a essas alterações no transporte de íons, ocorre a desidratação
das secreções mucosas, tornando-as mais viscosas, o que favorece a obstrução
progressiva de ductos e canalículos que é acompanhada por processo inflamatório
crônico, posterior fibrose e perdas funcionais progressivas dos órgãos de secreção
24
exócrina (pulmões, pâncreas, fígado, intestinos e testículos) (ALVES et al., 2007;
SUZAN, 2006).
As conseqüências fisiológicas relacionadas ao defeito no transporte de
eletrólitos vão ser variadas, dependendo da função exercida pelo epitélio afetado.
Na maioria dos afetados pela FC ocorre a tríade de doença pulmonar obstrutiva
crônica, insuficiência pancreática e eletrólitos elevados no suor (DALLALANA, 1997).
Em relação à doença pulmonar, ela ocorre devido ao fluxo de sódio e de
água para o interior da célula epitelial respiratória ser duas vezes maior que o
normal, ocorrendo desidratação do meio justacelular dentro da luz dos brônquios. O
resultado é a produção de secreções brônquicas excessivamente viscosas, seguida
de diminuição do clearance mucociliar (devido à desidratação do muco) e tosse
ineficaz, ocorrendo retenção das secreções, que obstruem as vias aéreas e
favorecem
a
colonização
por
bactérias
(POSTIAUX,
2004).
Há
grande
suscetibilidade especialmente por alguns microorganismos: Staphilococus aureus,
Haemophilus
influenzae,
Pseudomonas
aeruginosa
e
Burkholderia
cepacia
(MAGALHÃES et al., 2004). O espessamento do muco é agravado pelo processo
infeccioso (POSTIAUX, 2004).
A infecção conduz à inflamação crônica da vias aéreas. O processo
inflamatório endobrônquico leva a lesões irreversíveis, formação de bronquiectasias
e declínio da função pulmonar, podendo chegar à insuficiência respiratória e morte
(ANDRADE et al., 2001).
Uma das hipóteses para a redução da resistência aos patógenos
bacterianos é a inibição da ação das defensinas – peptídeos bacterianos – do trato
respiratório, devido às alterações da concentração de sal na mucosa brônquica
(ROVEDDER, 2006).
Quanto ao envolvimento das glândulas sudoríparas, elas secretam suor
normalmente, contudo, como ocorre impermeabilidade ao cloro pela membrana das
células epiteliais também não acontece reabsorção de sódio, levando à eliminação
de suor com alta concentração de sal, característica mais proeminente da doença.
Já nos indivíduos normais, durante a transpiração insensível e incessante o sódio
junto com o íon cloro são lentamente reabsorvidos nos ductos das glândulas
sudoríparas, sendo eliminado suor com pouco sal (ROSOV, 1999).
No nível do pâncreas há diminuição da secreção de cloro e água junto
com redução da secreção de bicabornato (HCO3), que é cloro-dependente,
25
implicando em secreção pancreática reduzida em volume, com pouca fluidez e
HCO3 insuficiente. Devido a esse processo, as enzimas digestivas ficam retidas no
interior dos ductos pancreáticos, sendo ativadas precocemente, resultando em
destruição tecidual e fibrose. Na insuficiência pancreática as enzimas não são
liberadas para realizar a digestão, ocorrendo má absorção dos nutrientes que
contribui para a deficiência em manter a demanda energética necessária (GALVÃO,
2006).
2.1.4 Manifestações Clínicas
As manifestações clínicas são multissistêmicas por comprometer todas as
glândulas exócrinas do organismo, no entanto, a doença pulmonar é a maior
responsável pela morbidade e mortalidade na fibrose cística (TARANTINO, 1997).
2.1.4.1 Manifestações Respiratórias
As manifestações clínicas em vias aéreas superiores acontecem em
100% dos casos (WEBER e FERRARI, 2008). A maioria dos pacientes são
acometidos por sinusopatia crônica com períodos de reagudizações _ sinusite
(OLIVEIRA, 2007). Eles também podem ser comprometidos por rinite, otite média
crônica ou recorrente, anosmia, defeitos de audição e rouquidão transitória (ROSOV,
1999).
A polipose nasal é uma manifestação freqüente, ocorrendo em 20% dos
casos. Ela pode ser o primeiro sinal da doença, causando obstrução importante, com
necessidade cirúrgica em alguns casos (OLIVEIRA, 2007; WEBER e FERRARI,
2008).
Em relação às vias aéreas inferiores, o quadro clínico é diferenciado de
indivíduo a indivíduo, variando o início dos sintomas, a progressão e a gravidade da
doença. Isso ocorre pela existência de várias mutações na forma homozigota ou
heterozigota (ROSOV, 1999).
26
O comprometimento pulmonar ocorre em praticamente todos os casos,
podendo aparecer no indivíduo com semanas de vida, meses ou anos,
caracterizando-se
por
obstrução
crônica,
em
geral
grave
e
progressiva
(DALLALANA, 1997).
Durante a vida fetal os pacientes apresentam uma composição pulmonar
normal e podem permanecer assintomáticos mesmo após o nascimento até que
ocorram as lesões irreversíveis, infecção, inflamação crônica e degradação da
função pulmonar. A obstrução ao fluxo aéreo tem início na infância e vai
progredindo, levando normalmente a um quadro de bronquite aguda e crônica,
bronquiectasias, hiperinsuflação pulmonar e, tardiamente, hipertensão pulmonar e
falência respiratória (GALVÃO, 2006).
A produção de secreção viscosa, junto com a deficiência da clearence
mucociliar e a ineficácia da tosse são fatores que tornam o paciente incapaz de
limpar o trato respiratório, deixando as secreções retidas em vias aéreas. Esse meio
favorece a colonização por microorganismos de difícil erradicação, ocorrendo
broncopneumonia de repetição e microabscessos. O círculo vicioso de infecção e
inflamação crônicas agrava ainda mais o componente obstrutivo, desenvolvendo
rolhas mucopurulentas nos brônquios e bronquíolos (OLIVEIRA, 2007).
A inflamação crônica, secundária ao processo infeccioso, aumenta o
número de neutrófilos nas vias aéreas, os quais, durante a fagocitose ou logo após
seu processo de degeneração liberam uma enzima denominada elastase, que é
responsável pela destruição da elastina, principal matriz da histoarquitetura
pulmonar, levando a danos das paredes das vias aéreas. Além disso, os neutrófilos
liberam DNA extracelular, sendo que a produção de quantidades excessivas de DNA
nas vias aéreas exacerba a viscosidade do muco (RIBEIRO et al., 2002; PICANÇO
et al., 2007).
Normalmente é após o segundo ano de vida que começam a se formar as
bronquiectasias, devido à ineficácia do paciente em eliminar o processo inflamatório
endobrônquico (RIBEIRO et al., 2002). As bronquiectasias são responsáveis pelo
colapso das vias aéreas, pelo aprisionamento de ar e por áreas focais de pneumonia
hemorrágica. Mais tardiamente, a hipoxemia leva à hipertensão pulmonar e
hipertrofia de câmaras direitas. A fase terminal da doença é caracterizada por
insuficiência respiratória crônica e cor pulmonale. (ROVEDDER et al., 2008). Essas
27
alterações pulmonares acontecem com maior freqüência nos lobos superior e médio
do pulmão direito (DALLALANA, 1997).
O sintoma mais comum nos pacientes fibrocísticos é a tosse produtiva
com abundante secreção pulmonar espessa de difícil expectoração, que pode
ocorrer desde as primeiras semanas de vida. A tosse pode ser acompanhada de
vômitos, podendo ser confundido com tosse coqueluxóide (RIBEIRO et al., 2002). As
crianças normalmente manifestam o comprometimento pulmonar por quadro de
bronquiolite,
infecções
recorrentes
do
trato
respiratório
ou
pneumonias
(ROVEDDER, 2006).
Com o decorrer da doença a morfologia do tórax modifica-se, adquirindo
formato de barril devido ao alçaponamento de ar. Com isso, o diafragma fica em
desvantagem mecânica, determinando a perda na pressão inspiratória, ou seja, da
força muscular. Essa fraqueza muscular respiratória pode ser agravada pela
desnutrição e quadro de infecção pulmonar. O déficit da função muscular respiratória
pode levar o fibrocístico à fadiga respiratória e contribui para a dispnéia e
intolerância ao exercício (GALVÃO, 2006).
Sinais comuns como unhas de relógio e baqueteamento digital surgem
como conseqüência da infecção pulmonar não controlada e hipoxemia crônica
(DALLALANA, 1997). Nas fases mais avançadas os pacientes adquirem enfisema
pulmonar generalizado, broncorréia purulenta, tosse constante, aumento da
freqüência respiratória, dificuldade expiratória e cianose periungueal. Nessa fase
queixam-se de falta de ar durante atividade física ou fisioterapia, progredindo para
falta de ar em repouso (RIBEIRO et al., 2002).
A
doença
pulmonar
manifesta-se
por
freqüentes
períodos
de
exacerbações com bronquites e pneumonias, tendo como sinais e sintomas o
aumento da tosse, aumento da produção de escarro mucoso (espesso e purulento),
febre, anorexia e perda de peso, diminuição da tolerância ao exercício, diminuição
da saturação de oxigênio (StO2), novos achados à ausculta pulmonar e ao raio X de
tórax e redução de mais de 10% no VEF1 (volume expiratório forçado no primeiro
segundo). Na ausculta pulmonar percebe-se a presença de sibilos e roncos pelo
processo obstrutivo da doença (OLIVEIRA, 2007).
Quanto às complicações, elas acontecem em resposta à doença
pulmonar grave e são: bronquiectasias, atelectasias, hemoptises, pneumotórax,
enfisema
progressivo,
osteoartrite
hipertrófica
pulmonar,
aspergilose
28
broncopulmonar alérgica, refluxo gastroesofágico e insuficiência respiratória crônica
e cor pulmonale (ROSOV, 1999).
2.1.4.2 Manifestações em Outros Sistemas
De acordo com o quadro pancreático, duas formas clínicas de FC são
individualizadas: uma que causa insuficiência pancreática, encontrada em 85% dos
pacientes; outra que evolui para suficiência pancreática, presente em 15% dos
casos. A grande maioria dos pacientes homozigotos para a mutação ∆F508 evolui
para insuficiência pancreática, embora o nível de atividade enzimática varie de
indivíduo a indivíduo. Entretanto, quando são heterozigotos, ou seja, quando
apresentam outra mutação associada a ∆F508, o efeito desta pode ser compensado
quando acompanhada de uma mutação mais leve. Contudo, dificilmente o paciente
chegará à vida adulta sem comprometimento pancreático (RASKIN e FAUKS, 2001).
Nos
casos
em
que
há
insuficiência
pancreática,
o
grau
de
comprometimento é variável e progressivo. Esses pacientes comumente apresentam
má digestão e má absorção, tornando-se clinicamente visível quando 90% da função
exócrina do pâncreas se encontram comprometida (ROZOV, 2002). Normalmente
apresentam fezes diarréicas, outras vezes volumosas, com aspecto acinzentado,
odor forte e, eventualmente oleosas. Quando a esteatorréia é acentuada pode
determinar prolapso retal, comum antes do tratamento. O abdômen desses
pacientes é protuberante pela flatulência comum nesses casos (TARANTINO, 1997).
Em relação à nutrição, os indivíduos podem ter má-nutrição proteicocalórica e de vitaminas em conseqüência da má-absorção, resultando em
hipodesenvolvimento pondero-estatural e avitaminoses. Isso ocorre mesmo que
esses pacientes apresentem bastante apetite (quando não estão em vigência de
processo infeccioso) e ingiram alimentos em quantidades adequadas (GASPAR et
al., 2002).
As glândulas mucosas intestinais podem ser acometidas nessa doença
e, em associação com a insuficiência pancreática, podem prejudicar a propulsão do
conteúdo intestinal, resultando ocasionalmente em obstrução. Esta pode instalar-se
na vida intra-uterina ou após o nascimento, chamando-se íleo meconial, ou ainda
29
mais tardiamente como forma de suboclusão, equivalente ao íleo meconial
(RIBEIRO et al., 2002).
Outra manifestação importante é a anormalidade eletrolítica do suor,
que ocorre em 98% dos pacientes com essa doença. A glândula sudorípara secreta
suor muito salgado, que pode se depositar na testa em forma de cristais de sal.
Muitas vezes esse excesso de sal é percebido por meio do beijo, sendo chamado
“beijo salgado”, sendo uma manifestação muito sugestiva de FC. Em temperatura
elevadas, febre ou produção de calor pelo exercício, esses pacientes podem ter
acentuada perda de sódio e cloro pelo suor e vir a desenvolver quadro de
desidratação hipotônica grave. A prostação ao calor pode ser uma das primeiras
manifestações da doença (STIVAL-ALAN, 1995).
Em relação ao sistema genital, os homens com FC têm sua função
sexual normal, porém, são estéreis em 98% dos casos devido à obstrução intrauterina dos vasos deferentes. Já as mulheres podem engravidar, mas a fertilidade é
diminuída pelo muco cervical espesso e pela doença pulmonar (ROSOV, 1999).
Já entre as manifestações hepatobiliares, a mais precoce ocorre nos
primeiros três meses de vida sob a forma de icterícia neonatal colestática
prolongada. Quando isso acontece, é obrigatória a investigação diagnóstica da
mucoviscidose, principalmente se apresentar história familiar da doença. A esteatose
hepática ocorre em 30-60% dos casos e está relacionada à desnutrição, porém, não
apresenta manifestações clínicas. Outros acometimentos, ocasionados pela
obstrução dos ductos intra-hepáticos por secreções espessas, são a cirrose biliar,
patognomônica da FC, encontrada em 10-25% dos casos autopsiados, e, a cirrose
biliar multilobular, identificada em 2-10% dos adolescentes e adultos. Ainda, pode
ocorre ascite, sendo um mau prognóstico da doença (STIVAL- ALAN, 1995).
2.1.5 Diagnóstico
Para o diagnóstico da FC é necessária a presença de pelo menos um
achado fenotípico, história familiar de mucoviscidose ou triagem neonatal positiva,
acompanhada de evidência laboratorial de disfunção da CFTR (regulador da
condutância transmembrana da fibrose cística), teste de suor positivo ou diferença
30
de potencial nasal positivo, ou ainda pela identificação de duas mutações
conhecidas como causa de FC nos genes CFTR. Os achados fenotípicos são:
doença pulmonar obstrutiva crônica; anormalidades gastrointestinais e nutricionais;
síndromes perdedoras de sal; e anormalidades urogenitais masculinas resultando
em azoospermia obstrutiva (DALCIN e SILVA, 2008).
Um bom teste de triagem neonatal, ou teste do pezinho (nome popular),
pode identificar 90 a 95% dos casos de FC. Entretanto, mesmo com resultado
negativo não se deve menosprezar os sinais clínicos da doença, devendo ser feita
uma avaliação diagnóstica incluindo teste do suor e/ou análise do DNA (LUDWIG
NETO, 2008).
Os testes de triagem neonatal são usados para estudos populacionais
para determinar a incidência da FC e, também, para o diagnóstico precoce com
finalidade de melhorar o prognóstico (ROSOV, 1999). O diagnóstico precoce por
meio do teste de atividade da tripsina imunorreativa (TRI) demonstra grandes
benefícios. A TIR é um marcador de insuficiência pancreática, porém pode estar
alterado em outras doenças que afetem esse órgão no período neonatal. O teste é
baseado no elevado nível sanguíneo da TIR, que ocorre devido uma obstrução dos
canalículos pancreáticos, resultando no refluxo de enzimas pancreáticas para a
circulação. O nível de TIR está elevado até cerca de 6 semanas, onde a taxa é de 5
a 10 vezes mais alta em recém-nascidos com FC em relação à dos recém-natos
sem a doença, retornando aos níveis normais após 6 semanas (CABELLO et al.,
2003).
O teste do suor, mesmo com um avanço no conhecimento genético na
Fibrose Cística, continua sendo o teste específico mais confiável para o diagnóstico
da doença. O teste do suor mais confiável é a análise iônica quantitativa de suor
pela pilocarpina, padronizado por Gibson e Cooke. Os valores diagnósticos de
Fibrose Cística estão acima de 60 mEq/l de cloro e sódio. Indivíduos que
apresentarem no teste níveis de íons no suor entre 45-60 mEq/l devem refazer o
teste, pois são considerados duvidosos. Os níveis normais estabelecidos são de até
45 mEq/l. Na ausência de outros critérios clínicos o diagnóstico da FC não deve
basear-se apenas em um único teste de suor positivo. O peso mínimo de suor para a
realização do teste é de 100 mg, sendo a época adequada para a coleta do suor
após um mês de vida, quando a sudorese é suficiente (ROVEDDER, 2006).
31
Quanto aos testes genéticos, a identificação de mutações em cada um
dos genes da CFTR conhecidas como causa da FC, junto com história clínica ou
familiar compatível, estabelece o diagnóstico da doença. Estes testes são de uso
restrito pelo seu alto custo e por nem sempre serem útil para a realização do
diagnóstico da doença. É importante saber que o resultado do teste negativo não
exclui a suspeita da doença pelo fato de existir centenas de subtipos de alterações
genotípicas (RIBEIRO et al., 2002). Existem mais de 1.000 mutações conhecidas
como causa da fibrose cística e os painés comerciais disponíveis para realizar essa
análise só pesquisam uma minoria dessas mutações (DALCIN e SILVA, 2008).
O diagnóstico pré-natal é realizado em famílias que apresentem alto
risco para a FC. O ideal para ser feito o diagnóstico molecular é conhecer as
mutações que os pais apresentam, obter células nucleadas fetais na 10º semana
(por biópsia de vilosidades coriônica) ou na 17º semana (pela aminiocentese). Esse
método permite prever se o feto será doente ou não, no entanto, tem o
inconveniente de apresentar falsos resultados em grande percentual. Nos casos em
que os pais não conhecem a mutação, utiliza-se a análise por meio do polimorfismo
intragênico. Para isso, é preciso que o casal já tenha um filho com FC e que sejam
encontrados polimorfismos informativos (RIBEIRO et al., 2002).
A disfunção da CFTR pode ser diagnosticada pela presença de
anormalidades do transporte iônico no epitélio respiratório, associadas com um
padrão alterado na Diferença de Potencial Nasal (DPN). O sujeito apresentando
DPN aumentada, em associação com quadro clínico ou história familiar positiva,
fundamenta o diagnóstico de FC (DALCIN e SILVA, 2008). O exame compara o
cloro intra e extracelular (LUDWIG NETO, 2008).
Existem alguns exames complementares utilizados na avaliação
diagnóstica inicial, que contribuem de modo secundário para o diagnóstico. Eles são
úteis para avaliar a evolução e gravidade da doença e, também, para planejar
abordagens terapêuticas específicas. Entre esses exames estão: a avaliação da
função pancreática, exames de imagem do tórax e avaliação funcional pulmonar
(DALCIN, SILVA, 2008).
O teste de função pancreática não é específico para a Fibrose Cística,
porém poderá ajudar no esclarecimento do diagnóstico, se utilizado em conjunto
com outros exames. A confirmação da insuficiência pancreática (IP) por meio do
teste pode indicar fibrose cística, já que 90% dos pacientes fibrocísticos apresentam
32
IP. O teste também será importante para identificar a intensidade dessa
complicação, para que a terapia de reposição enzimática seja administrada de
maneira adequada (RIBEIRO et al., 2002). O diagnóstico da insuficiência
pancreática é feito por meio da dosagem da elastase fecal ou então, indiretamente,
pela dosagem de gordura nas fezes (LUDWING NETO, 2008).
As imagens vistas no exame radiológico são dependentes da idade, da
progressão e da gravidade da doença. No início as radiografias do tórax podem não
apresentar alterações, no entanto, com a evolução da doença começam a aparecer
imagens compatíveis com doença pulmonar obstrutiva crônica (ROZOV, 1999). Os
achados
precoces
são:
impactação
mucóide,
espessamento
peribrônquico,
bronquiectasias, atelectasias (em 10-15% dos casos), hiperinsuflação (em mais de
50% dos casos) (FREIRE et al., 2008). Normalmente essas alterações ocorrem com
predominância nos ápices e à direita. Com a progressão da doença começam a
aparecer imagens de bolhas, lesões císticas, fibróticas e abscessos, pneumotórax e
pneumomediastino. Ainda podem ser identificadas imagens como “dedo de luva” ou
nodulares que são características da FC e estão relacionadas com a impactação
mucóide (PEREIRA, 1997).
As provas de função pulmonar são realizadas por meio da espirometria,
a qual consiste em um exame que analisa quali-quantitativamente a função
ventilatória e permite ao profissional da saúde, fisioterapeuta ou médico, conhecer o
grau e o tipo de distúrbio ventilatório que o indivíduo apresenta. A obstrução é
verificada por meio do retardo do fluxo expiratório e pelo aumento acentuado deste
(AZEREDO, 2002).
A evolução da doença é avaliada pelo estudo da função pulmonar por
meio da capacidade vital forçada (CVF), do volume expiratório forçado no
primeiro segundo (VEF1) e do fluxo expiratório forçado entre 25 e 75% da CVF
(FREIRE et al., 2008).
O distúrbio ventilatório que os indivíduos com FC apresentam é
fundamentalmente obstrutivo, contudo, pode aparecer restrição associada em
virtude da fibrose pulmonar na fase final da doença. O dado que mais se altera
precocemente nas provas de função pulmonar é o FEF25% - 75%, sendo que esse valor
reduz em média 8% ao ano, devido ao alçaponamento de ar em áreas pouco
ventiladas dos pulmões. Os demais valores como, CVF, VEF₁ e VEF₁/CVF vão
reduzindo com a progressão da doença (ANDRADE et al., 2001).
33
Os pacientes podem ser classificados de acordo com as diretrizes
brasileiras para testes de função pulmonar em três divisões de acordo com a
quantificação do distúrbio: distúrbio ventilatório obstrutivo (DVO) leve ou ausente,
VEF1% > 60% do previsto; DVO moderado, VEF1% entre 40-60% do previsto; e
DVO grave, VEF1% < 40% do previsto (ZIEGLER et al., 2007; SBPT, 2002).
2.1.6 Tratamento
Com a descoberta do gene da fibrose cística (FC) foi possível
compreender os mecanismos do transporte iônico e estudar a proteína (CFTR) em
sua forma normal e mutada. Assim, com o conhecimento das bases moleculares e
da fisiopatologia da doença, abriram-se perspectivas de um tratamento eficaz, sendo
um passo importante para uma futura cura dessa doença. Enquanto não existe
tratamento específico para a FC, o tratamento se baseia na terapêutica dos sintomas
e na correção das disfunções orgânicas (DALLALANA, 1997; RASKIN e FAUKZ,
2001;).
Por se tratar de uma doença complexa e multissistêmica, o tratamento
deve ser realizado em centros especializados para cuidados em FC e com
abordagem multidisciplinar, onde cada profissional em sua área ofereça o suporte
necessário (OLIVEIRA, 2007; VILLELA et al., 2007).
Considerando-se a patogenia dessa doença, o tratamento deve ser
iniciado precocemente, desde o diagnóstico, com um programa de tratamento
vigoroso e contínuo, com o objetivo de prevenir infecções e complicações e evitar a
progressão das lesões pulmonares como também de outros órgãos acometidos,
permitindo uma sobrevida maior e de melhor qualidade. Além disso, o paciente e a
família devem receber desde cedo suporte psicológico e socioeconômico (ROSOV,
1999; DALCIN e SILVA, 2008).
O tratamento deve dar ênfase aos aspectos clínicos e a gravidade de
cada caso, sendo individualizado (ROSOV, 1999). Contudo, consiste basicamente
no uso de antibióticos, para combater as repetidas infecções pulmonares; na
reposição enzimática; no suporte nutricional e na remoção das secreções
pulmonares por meio da fisioterapia (FRACON, 2001).
34
2.1.6.1 Reposição Enzimática e Suporte Nutricional
Na fibrose cística os ductos pancreáticos são obstruídos, impedindo a
chegada de enzimas pancreáticas até o duodeno. Logo que a identificação da
insuficiência pancreática é feita, deve-se iniciar o tratamento com reposição de
enzimas, evitando o agravamento da desnutrição (RIBEIRO et al., 2002).
A
dosagem
de
enzimas
pancreáticas
é
ajustada
conforme
as
necessidades individuais, podendo ser controlada pelo aspecto das fezes, curva
ponderal, ou dosagem de gorduras nas fezes (DALLALANA, 1997).
Se o paciente continuar apresentando sinais e sintomas de má-absorção
as doses devem ser incrementadas. No entanto, não se sabe a segurança de doses
entre 2.500 e 6.000 U/Kg/refeição/dia, e acima desta dose é descrito que existe o
risco de colonopatia fibrosante. Algumas vezes, mesmo com terapêutica enzimática
adequada, pode persistir um grau de má absorção devido a inativação do duodeno
por pH baixo, sendo recomendado o uso de antiácido para melhorar a
biodisponibilidade (OMS, 2001).
Para que a reposição enzimática seja bem aproveitada é ideal que as
refeições sejam dadas em “blocos”, a cada 3-4 horas, evitando-se comer pequenas
quantidades fora de hora, ingerindo as enzimas imediatamente antes de todas as
refeições e ajustando a dose conforme a quantidade e qualidade dos alimentos.
Além disso, devem ser observadas mudanças no padrão das fezes e ganho de peso
(RIBEIRO et al., 2002).
Quanto à dieta na FC, é recomendado que seja hipercalórica e
hiperprotéica, com valores aumentados ou normais de lipídios, balanceada para as
necessidades de crescimento e desenvolvimento adequado. Isso porque pacientes
com esse quadro apresentam hipermetabolismo devido à má absorção intestinal,
aumento do trabalho respiratório e da utilização da energia em nível celular
(DALLALANA, 1997).
Em
relação
à
oferta
calórica,
deve
estar
30-50%
acima
das
recomendações diárias e, quanto ao conteúdo protéico, a ingestão deve ser 2-3
vezes maior que o normal. Pacientes que apresentam relação peso/estatura menor
que 85% e têm dificuldade em ganhar peso devem introduzir na dieta
35
suplementação lipídica de 40%, com óleo vegetal cru ou triglicerídeos de cadeia
média, podendo determinar aumento da curva ponderal (ROSOV, 1999).
O trabalho dietético tem por finalidade melhorar ou manter adequado o
estado nutricional do paciente, quebrando o ciclo vicioso de desnutrição-infecção,
pois o estado nutricional e a função pulmonar têm grande correlação (ROSOV, 1999;
GASPAR et al., 2002).
Quanto à absorção de vitaminas lipossolúveis, também está diminuída em
pacientes com FC, sendo necessária a suplementação das vitaminas A, D, K, E e do
complexo B (ROSOV, 1999).
É necessário, ainda, que se faça a profilaxia e o controle das perdas
salinas dessas pessoas. Para isso, em dias muito quentes, ou em crises de
hipertermia ou durante exercícios intensos, é preciso que seja feita a administração
adicional de cloreto de sódio: 1g/dia em menores de um ano, 2g/dia no 2º e 3º ano
de vida e 3-4g/dia quando acima de 4 anos de idade. No entanto, quando a
desidratação ocorre, deve-se recorrer à administração de soluções salinas por via
endovenosa (DALLALANA, 1997).
2.1.6.2 Tratamento da Doença Pulmonar
A fibrose cística, embora seja uma doença multissistêmica, tem como
principal causa de morbi-mortalidade o envolvimento pulmonar. Sabendo disso, a
terapêutica adequada deve ser empregada o mais cedo possível para que a
progressão da doença pulmonar seja retardada (DALCIN e SILVA, 2008).
O tratamento da doença pulmonar consiste em antibióticoterapia, agentes
antiinflamatórios, agentes mucolíticos, broncodilatadores, fluidificação das secreções
pulmonares, fisioterapia respiratória, exercício físico, suplementação de oxigênio e
transplante de pulmão (FREIRE et al. , 2008).
Quanto aos antibióticos, são utilizados com muita freqüência, visando à
erradicação
da
bactéria
(DALLALANA, 1997).
e,
principalmente,
a
melhora
da
sintomatologia
É importante que seja feito o diagnóstico bacteriológico
seqüencial das secreções, com perfil de sensibilidade aos antibióticos. Os patógenos
36
especificamente relacionados com a FC são P. aeruginosa, S.aureus e a B. cepacia,
sendo eles os principais alvos do tratamento antibiótico (ROSOV, 1999).
O tratamento das exacerbações pulmonares, que ocorrem devido a
infecções respiratórias, exposição a poluentes atmosféricos ou hiperreatividade,
pode ser realizado com antibióticos por via oral, por via intravenosa ou por inalação
dependendo da gravidade das manifestações clínicas. Quando as exacerbações são
mais graves é indicado o tratamento antibiótico por via intravenosa, por 14-21 dias,
normalmente com hospitalização do paciente (DALCIN, SILVA, 2008).
A Pseudomonas tem sido encontrada em mais de 80% dos indivíduos
com a FC e está relacionada ao mau prognóstico, relatando que uma vez instalada
nas vias aéreas, a erradicação dessa bactéria não ocorre com o uso de antibióticos,
eles apenas reduzem o número de colônias dessas. A utilização dos antibióticos é
direcionada sob a forma de demanda, profilaxia ou de manutenção e baseia-se na
colonização e infecção ou quando estiverem presentes exacerbações das
manifestações pulmonares (RIBEIRO et al., 2002).
Quanto aos antiinflamatórios, entre eles corticosteróides e ibuprofen,
podem ser usados para diminuir a resposta imune, pois esta não é capaz de
promover esterilização da vias aéreas e, ainda, é prejudicial in loco, pela destruição
progressiva do parênquima, Entretanto, existem alguns paraefeitos importantes
associados ao uso desses medicamentos que devem ser levados em consideração
(ROSOV, 1999).
Em relação aos agentes mucolíticos, a N-acetil-cisteína apresenta ação
antioxidante.
Em
decorrência
disso,
é
provável
que
possa
ser
utilizada
beneficamente sobre as lesões inflamatórias. No entanto, não existem pesquisas
suficientes sobre o seu uso regular e em longo prazo em pacientes com FC. Outro
agente mucolítico usado no tratamento da FC é a DNase recombinante humana
(dornase alfa), esta é responsável pela hidrólise do DNA extracelular _ derivado da
desintegração dos neutrófilos recrutados para o trato respiratório pelo processo
infeccioso _ reduzindo a viscosidade do muco. Estudos têm mostrado melhora da
função pulmonar, diminuição do risco de exacerbações e redução do uso de
antibioticoterapia quando utilizadas doses e período corretos, por via inalatória, com
equipamento inalatório adequado. Além disso, são associadas a poucos efeitos
adversos (DALLALANA, 1997).
37
São utilizadas também as soluções salinas hipertônicas (3-7%). Elas
são administradas por meio de nebulização, aumentando o transporte ciliar,
melhorando as propriedades reológicas do muco e melhorando a hidratação da
superfície das vias aéreas. Com isso, ocorre melhora do clearance mucociliar e da
função pulmonar em curto período de tempo em pacientes fibrocísticos (OLIVEIRA,
2007).
A hiper-reatividade brônquica é comum em pacientes com FC. Devido a
isso os broncodilatadores estão sendo utilizados como parte do tratamento desses
indivíduos. Entre os agentes mais freqüentemente usados estão os agonistas beta2adrenérgicos, que são empregados normalmente antes da fisioterapia respiratória
para facilitar a clearance mucociliar, apresentando benefícios para a maioria dos
pacientes por meio da melhora funcional (RIBEIRO et al., 2002).
Em relação ao uso de oxigênio, é importante que seja feita a
monitorização de gases arteriais, devendo ser utilizado apenas em casos de
hipoxemia e em concentrações mínimas suficientes para o alivio da sintomatologia.
O uso desse recurso é importante para retardar a progressão da hipertensão
pulmonar, reverter a policetemia, aumentar a sobrevida, diminuir o número de
internações hospitalares, aumentar o desempenho psicomotor e melhorar a
tolerância ao exercício físico (ROSOV, 1999).
Já quanto ao tratamento cirúrgico, este pode ser necessário e incluir a
ressecção pulmonar em pacientes que apresentem comprometimento localizado em
um ou dois lobos pulmonares (DALLALANA, 1997). No entanto, devem ser medidos
os riscos-benefício de uma cirurgia. Outro tipo de tratamento cirúrgico é o
transplante pulmonar, sendo a última opção de tratamento para esses pacientes.
Este recurso tem como limitação a disponibilidade de órgãos doados e equipes
especializadas. Segundo alguns estudos, a sobrevida de pacientes transplantados
foi de 85% no primeiro ano e 67% no segundo ano (RIBEIRO et al., 2002).
2.1.7 Fisioterapia Respiratória na Fibrose Cística
A fisioterapia respiratória é globalmente recomendada para pacientes com
fibrose cística (FC) (OLIVEIRA, 2007). Ela constitui importante tratamento da doença
38
pulmonar, visando remover o muco viscoso e o exsudato causado pelas infecções
pulmonares, sendo reconhecida como o principal tratamento não farmacológico
(FRACON, 2001).
Sua importância no tratamento de fibrocísticos foi reconhecida na década
de 50, e a partir daí vem sendo parte integrante e mantém-se em evidência no
tratamento do comprometimento pulmonar (DALLALANA, 1997).
Desde o diagnóstico, mesmo com comprometimento pulmonar mínimo ou
assintomático, deve ser instituído um programa de cuidados diários em casa,
incluindo atividade física espontânea, própria da idade, com treinamento regular de
algum esporte, escolhido pela criança e, ainda, medidas de fluidificação e higiene
brônquica adequada por meio de fisioterapia (ROSOV, 1999). A fisioterapia
respiratória para os pacientes com fibrose cística atua em diversos aspectos como
no aumento da clearance mucociliar, melhora da força muscular respiratória,
melhora da função pulmonar e do condicionamento físico. As intervenções utilizadas
para isso são manobras de higiene brônquica, exercícios respiratórios, reabilitação
pulmonar, cinesioterapia entre outros.
O principal objetivo de um tratamento fisioterapêtico na FC é a
desobstrução brônquica pelo fato desses pacientes apresentarem quadro obstrutivo
das vias aéreas por secreções brônquicas aumentadas e espessas, que contribuem
para as inflamações e infecções, pneumonias de repetição e conseqüente
comprometimento da função pulmonar (VILLELA et al., 2007; ACAM, 2008).
Os
métodos
fisioterapêuticos
desobstrutivos
são
utilizados
para
prevenção e tratamento das complicações pulmonares, atuando na facilitação do
clearance mucociliar para manter a permeabilidade das vias aéreas e prevenir a
inflamação das paredes dos brônquios, diminuindo a limitação ao fluxo aéreo,
melhorando a distribuição da ventilação e promovendo o melhor uso da musculatura
respiratória (ALMEIDA et al., 2008; AZEREDO et al., 2000).
Existem muitas modalidades com o objetivo de favorecer a limpeza
pulmonar, entre elas estão às convencionais – Drenagem Postural (DP), Vibração,
Compressão, Vibrocompressão e Tosse – e as modernas, Drenagem Autógena
(DA), Técnica do Ciclo Ativo da Respiração (TCAR), Expiração Lenta com a Glote
Aberta em Decúbito Lateral (ELTGOL), Pressão Expiratória Positiva na Vias Aéreas
(EPAP), Flutter ou Shaker e exercício físico. Sendo que, antes de qualquer técnica
39
deve ser feita aerossolterapia para a hidratação das secreções (POSTIAUX, 2004;
AZEREDO, 2002).
Segundo alguns estudos, todas as técnicas desobstrutivas alcançaram a
sua eficácia em relação à mobilização de secreção pulmonar (VILLELA et al., 2007).
Quanto à escolha do método adequado deve ser considerada a idade do paciente, a
aceitação por parte dele e a gravidade da doença, facilitando assim o sucesso e a
adesão ao tratamento (OLIVEIRA, 2007).
Além das técnicas de desobstrução pulmonar, os músculos respiratórios
devem ser treinados objetivando o aumento da força e resistência dos mesmos,
melhorando mecânica e a função pulmonar, prevenindo a fadiga respiratória,
reduzindo a dispnéia e melhorando a capacidade funcional do indivíduo (AZEREDO,
2002; RODRIGUES, 2003).
Em relação à freqüência das sessões de fisioterapia devem ser realizadas
de acordo com as necessidades de cada paciente (DALLALANA, 1997). As técnicas
de higiene brônquica devem ser executadas entre 2 a 6 vezes ao dia, com tempo de
duração em média de 20 a 30 minutos para cada sessão, dando ênfase ao
segmentos pulmonares mais comprometidos (ROSOV, 1999). Os exercícios
respiratórios devem ser realizados diariamente e com horários específicos, de modo
a se tornar rotina na vida desses indivíduos, porém, com o cuidado de não
atrapalhar suas atividades normais (ACAM, 2008).
A fisioterapia respiratória na FC consiste em um conjunto de exercícios e
manobras que auxiliam para um melhor funcionamento do sistema respiratório como
um todo (ACAM, 2008).
Em relação à drenagem postural (DP) é um recurso usado pelos
fisioterapeutas há muitos anos. Esse método consiste em usar a força da gravidade,
colocando o paciente em uma posição capaz de facilitar o fluxo das secreções das
vias aéreas distais até a traquéia, sendo então eliminadas pela tosse. A freqüência
recomendada para sua utilização é de duas a três vezes ao dia, alternando as
posições para drenagem dos diferentes segmentos pulmonares (AZEREDO et al.,
2000; OLIVEIRA, 2007).
Para que a técnica seja efetiva o paciente deve ser orientado quanto à
mesma, ter suas vias aéreas superiores permeáveis, estar bem hidratado e com
fluidificação adequada do muco brônquico. Além disso, devem ser monitorizados os
sinais vitais antes, durante e após a drenagem e respeitar os períodos de
40
alimentação. Ainda, para que ela se torne mais eficaz, é necessário adotar outras
condutas terapêuticas em associação como a tosse técnica, huff, percussão e
vibração manual torácica, EPAP e flutter (PRESTO e PRESTO, 2005).
A percussão torácica é um método de desobstrução e consiste na
aplicação coordenada de golpes manuais ou eletro mecânico na região do tórax. Ela
proporciona a propagação de ondas de energia mecânica que são aplicadas na
parede torácica e transmitidas aos pulmões. O objetivo com esta é deslocar o muco
da parede dos brônquios, removendo-o por meio do fluxo aéreo expiratório, do ponto
distal da via aérea até o seu ponto proximal, ocorrendo a eliminação para o meio
externo pela tosse voluntária ou reflexa (AZEREDO et al., 2000; COSTA, 1999). Este
recurso é tema de muitas controvérsias, alguns autores tentam comprovar que sua
aplicação leva a microatelectasias e podem precipitar o broncoespasmo, outros,
afirmam que a percussão manual favorece o transporte mucociliar e o deslocamento
de secreções pulmonares (PRESTO e PRESTO, 2005).
A vibração manual trata-se de movimentos rítmicos, rápidos e com
intensidade suficiente para causar a vibração em nível bronquial. Esta técnica é
aplicada com as mãos espalmadas sobre o tórax, impulsionando movimentos
vibratórios, com o membro superior em contração isométrica, durante a fase
expiratória (OLIVEIRA, 2007; COSTA, 1999). Essa é uma técnica de grande eficácia,
principalmente se aplicada junto com a compressão torácica manual expiratória,
denominando-a de vibrocompressão (AZEREDO, 2002). Ela pode ser realizada
com o paciente em decúbito dorsal ou em decúbito lateral esquerdo ou direito,
dependendo da localização dos roncos pela ausculta pulmonar (AZEREDO et al.,
2000; PRESTO e PRESTO, 2005).
O objetivo com essa modalidade terapêutica é facilitar o deslocamento do
muco brônquico pela modificação de suas propriedades físicas (tixotropismo) e pelo
aumento do transporte mucociliar, estimulando o reflexo da tosse. A freqüência
necessária para que isso ocorra é de 13 hertz, difícil de ser conseguida com a
manobra manual. Por ser uma técnica menos brusca que a tapotagem e a
percussão, ela pode ser aplicada em qualquer caso e em tempo suficiente para que
haja expectoração (COSTA, 1999;).
A técnica Expiração Lenta com a Glote Aberta em Decúbito Lateral
(ELTGOL) consiste na desobstrução brônquica com expiração lenta. Para a
realização da técnica é preciso que o paciente seja posicionado em decúbito lateral,
41
com o pulmão a ser desobstruído infralateral. Ele deve ser orientado a fazer
expirações lentas e totais, partindo do volume corrente (VC) até o volume residual
(VR), com o uso de um bucal para garantir que a glote permaneça aberta durante o
procedimento. O fisioterapeuta fica atrás do paciente e exerce uma pressão
abdominal infralateral com uma das mãos e uma pressão sobre o gradil costal
supralateral com a outra mão, durante a expiração, proporcionando uma espécie de
torção no tronco do paciente (POSTIAUX, 2004).
Como manobras de compressão têm-se: Aumento do Fluxo Expiratório
(AFE) e Terapia Manual Passiva (TEMP). A AFE é uma manobra de desobstrução
brônquica, que consiste em uma expiração ativa ou passiva junto com um
movimento toracoabdominal sincrônico realizado pela compressão manual do
fisioterapeuta, durante fase expiratória do paciente, tendo seu início após o platô
inspiratório (ABREU et al., 2007; MACHADO, 2008).
Já a TEMP é uma manobra realizada por meio da mobilização passiva da
caixa
torácica,
com
compressão
regional
do
tórax
na
fase
expiratória,
acompanhando o movimento do gradil costal. O principal objetivo com essa técnica é
promover
a
aceleração
do
fluxo
expiratório
e
facilitar
a
desobstrução
broncopulmonar. Além disso, ela pode ser utilizada para auxiliar o huffing (PRESTO
e PRESTO, 2005; ABREU et al., 2007).
A Técnica do Ciclo Ativo da Respiração (TCAR) é uma combinação de
três componentes individuais. Sendo o primeiro o exercício de expansão torácica,
que consiste em três a quatro respirações profundas com ênfase na inspiração,
associadas à sustentação máxima inspiratória (SMI). Segundo, técnicas de
expiração forçada (TEF), realizando uma a duas expirações forçadas com a glote
aberta. E o terceiro, períodos de controle da ventilação (controle diafragmático),
respirando no volume-corrente de forma relaxada e suave. Estudos envolvendo esta
técnica apontaram benefícios na remoção de secreção pulmonar e na função
pulmonar dos pacientes com FC. (OLIVEIRA, 2007).
A drenagem autogênica (DA) foi desenvolvida por Chevaillier na Bélgica
e consiste em um sistema de três fases respiratórias, que visa melhores fluxos
brônquicos com o uso de expirações lentas. A DA tem como objetivo a mobilização
de secreção por meio do alcance de fluxo aéreo elevado em diferentes segmentos
brônquicos (PRYOR e WEBBER, 2002). Esta técnica pode ser realizada com o
indivíduo na posição mais confortável e efetiva para ele, de preferência sentado. Ela
42
envolve uma inspiração lenta e diafragmática, uma pausa inspiratória de 3 a 4
segundos, seguida de fluxo expiratório não forçado, na maior velocidade possível,
mantendo a glote aberta (POSTIAUX, 2004). A primeira fase consiste em volumes
pulmonares baixos para deslocar secreções distais. A segunda envolve volumes
pulmonares médios para a coleta de secreções na vias aéreas médias. Já a última
fase utiliza volumes pulmonares altos para a eliminação das secreções das vias
aéreas centrais (PRESTO e PRESTO, 2005; PRYOR e WEBBER, 2002).
Estudos comparando a DA com a TCAR em pacientes com FC,
concluíram que ambas são efetivas na remoção de secreções desses indivíduos,
porém com a DA foi obtido melhor resultado na VEF1 e com a TCAR foi observada
melhora na CVF (OLIVEIRA, 2007).
A Oscilação Oral de Alta Freqüência (OOAF) pode ser obtida por meio
do Flutter ou do shaker, aparelhos portáteis, pequenos e simples, usados na
desobstrução brônquica. (VILLELA et al., 2007;). Os dispositivos consistem em uma
tubulação plástica em forma de cachimbo, com uma esfera de aço pesada localizada
em seu interior, acima de um cone. Durante a expiração, a esfera se movimenta ao
longo da superfície do cone criando uma pressão expiratória positiva e uma
oscilação vibratória do ar dentro das vias aéreas. Com isso, ocorre redução da
viscosidade do muco e, ainda, o reflexo da tosse pode ser estimulado, favorecendo
o deslocamento e eliminação das secreções pulmonares, sendo este o principal
objetivo com o uso desse aparelho. (VILLELA et al., 2007; OLIVEIRA, 2007;
PRESTO e PRESTO, 2005).
Em um estudo realizado por Ribeiro et al em 2006, foi comparada a
eficácia do Flutter e do shaker, dois aparelhos utilizados que apresentam
características semelhantes. Eles foram testados em pacientes com FC, sendo
colhidas as secreções expectoradas e medindo o peso seco e úmido dessas
secreções. A conclusão com esse estudo foi que o uso do shaker mostrou-se tão
efetivo quanto o uso do Flutter para as variáveis analisadas. Além disso, as
freqüências cardíacas e respiratória e a StO2 não tiveram diferenças significativas
entre esses dispositivos (SUZAN, 2006).
A Pressão Positiva Expiratória Final (EPAP) é uma maneira de ofertar
PEEP. Ele é composto por uma válvula unidirecional conectada a uma máscara
facial, sendo vinculada no orifício expiratório da válvula uma forma qualquer de
resistor que determinará a PEEP. No sistema EPAP a fase inspiratória é realizada
43
sem nenhuma ajuda externa, ela é gerada por uma pressão negativa
subatmosférica, já a expiração é realizada contra uma resistência, que pode variar
de 10 a 20 cmH2O, tornando a pressão positiva ao seu final (AZEREDO et al., 2000;
OLIVEIRA, 2007).
Os resultados da aplicação do EPAP no sistema respiratório são: variação
na pressão intra-alveolar, aumento da capacidade residual funcional (CRF),
recrutamento alveolar, diminuição do shunt intrapulmonar e remoção das secreções
brônquicas. Com o uso desse sistema ocorre o aumento da oxigenação arterial,
melhora da complacência pulmonar e treinamento muscular respiratório (AZEREDO
et al., 2000).
A Técnica de Expiração Forçada (TEF) substitui as técnicas expiratórias
lentas quando as secreções se deslocam das vias aéreas médias até as vias aéreas
proximais, que constituem seu principal local de ação. Essa técnica tem como
objetivo auxiliar na remoção de secreções brônquicas e minimizar a compressão
dinâmica e colapso das vias aéreas decorrentes da expulsão brusca e forçada do ar.
Essa técnica inclui em seu mecanismo o aparecimento de um ponto de igual pressão
no trajeto brônquico, que modifica as características do escoamento de ar e, assim,
da mobilização de secreções nas vias aéreas (POSTIAUX, 2004; MACHADO, 2008).
A técnica consiste na combinação de um ou dois esforços respiratórios
(huffing), que são feitos com a glote aberta, partindo de um volume pulmonar médio
para baixo volume pulmonar, promovendo a eliminação das secreções localizadas
em vias aéreas mais distais, ou, pode ser realizado um huff de volume maior,
mobilizando as secreções de vias aéreas mais centrais. Após, devem ser seguidos
de um período de relaxamento com respiração diafragmática (PRESTO e PRESTO,
2005; MACHADO, 2008).
Quanto à tosse, é resultado de um complexo reflexo iniciado com
ativação dos receptores das vias aéreas por estímulos irritantes, tendo como função
a remoção de substâncias estranhas e secreção acumulada. Por esse motivo ela é
considerada um importante mecanismo de defesa pulmonar, principalmente em
situações patológicas que geram acúmulo de secreção na árvore traqueobrônquica.
A tosse é considerada a parte mais importante da terapia de higiene brônquica, pois
a maioria das técnicas só auxilia no deslocamento das secreções até as vias aéreas
centrais. O fisioterapeuta recorre a esse recurso para expulsar da árvore
traqueobrônquica proximal todo o material indesejado como as secreções e outras
44
partículas inaladas. Seus benefícios na eliminação das secreções são devido ao
aumento da pressão positiva pleural e por meio da produção de alta velocidade do
fluxo nas vias aéreas (BARROS e MEDEIROS, 2008).
Quando há diminuição do reflexo de tosse, este deve ser provocado por
meio de um estímulo mecânico na região da traquéia, pois se sabe que a maior
parte dos receptores da tosse estão localizados na mesma. Esse estímulo pode ser
feito manualmente na região superior da traquéia e na região cervical posterior ou,
pode ser realizado com auxílio de um cotonete, na cavidade nasal, no palato ou na
epiglote (COSTA, 1999).
Quanto ao treinamento físico, constitui elemento essencial nos
programas de reabilitação pulmonar, pois a doença pulmonar reflete em intolerância
ao exercício, deteriorando a qualidade de vida e predispondo à mortalidade
(MACHADO, 2008). A habilidade dos pacientes com FC pode estar prejudicada pela
presença da doença pulmonar e desnutrição protéico-calórica, resultando em
diminuição da massa muscular e, conseqüentemente, rápido surgimento de fadiga
muscular durante o exercício, afastando-os dessas atividades. Com isso, ocorre a
progressivo descondicionamento físico, ocorrendo dispnéia em associação com
esforços físicos cada vez menores (CHAVES et al., 2007).
Os indivíduos com fibrose cística que participam de alguma atividade
física regular em conjunto com a terapia padrão usufruem de muitos benefícios
como: aumento da quantidade de água do muco pulmonar, desobstrução brônquica,
diminuição da resistência à insulina, melhora da composição corporal, aumento da
auto-estima, melhora do desenvolvimento ósseo, diminuição da degradação
protéica, melhora da função imunológica e diminuição da freqüência cardíaca de
repouso (CHAVES et al., 2007, VILLELA et al., 2007). O exercício é respeitável
coadjuvante nas medidas de higiene brônquica, pois aumenta o clearance mucociliar
(DALCIN e SILVA, 2008).
Os exercícios aeróbicos como caminhar, correr, pedalar e nadar podem
ser recomendados seguramente para crianças e adolescentes com FC, que
apresentem comprometimento pulmonar de leve a moderado. Além dos benefícios
cardiopulmonares, a prática de atividade aeróbica regular proporciona melhora da
tolerância ao exercício e sensação de bem-estar. E ainda, o declínio da função
pulmonar é bem mais lento nesses indivíduos (CHAVES et al., 2007). Por todos
45
esses benefícios, justifica-se a utilização de exercício físico regular como parte do
tratamento de pacientes com FC (VILLELA et al., 2007).
Em relação ao treinamento dos músculos respiratórios, deve ser
realizado em pacientes com fibrose cística para aumentar a força e endurance
desses músculos. Esses indivíduos apresentam alteração da força contrátil devido à
desvantagem mecânica pela hiperinsuflação pulmonar e pelo quadro de desnutrição
(ZANCHET et al., 2006). Os músculos respiratórios são os responsáveis pelo
adequado funcionamento do sistema respiratório, além disso, sua disfunção da
musculatura respiratória pode contribuir para a intolerância ao exercício, dispnéia e
falência respiratória. Assim, o treinamento deve ser instituído o mais cedo possível
em caso de pressão inspiratória máxima ≤60cmH2O, sendo obtido por meio de
estímulos apropriados de sobrecarga, especificidade e reversibilidade (MACHADO,
2008).
2.2 Fisioterapia Aquática
A aplicação da água como finalidade terapêutica é um recurso importante
da fisioterapia, sendo utilizadas piscinas aquecidas para o tratamento de diversas
disfunções. As propriedades físicas da água e os efeitos da imersão, associados aos
exercícios, devem ser compreendidos para que as intervenções da fisioterapia
aquática sejam potencializadas (CARREGARO e TOLEDO, 2008).
O ambiente aquático torna-se precioso no tratamento de diversas
patologias crônicas por proporcionar benefícios não só físicos, mas também
psicológicos. Um dos objetivos principais com o tratamento na água é o bem-estar
do indivíduo, integrando corpo e mente (BIASOLI e MACHADO, 2006).
2.2.1 Os Princípios e Propriedades Físicas e Terapêuticas da Água
A água pode existir no estado sólido, líquido ou gasoso. Entretanto, para
a realização da hidroterapia é em meio líquido que serão obtidos os maiores
46
benefícios decorrentes de suas propriedades físicas (BATES e HANSON, 1998).
Os princípios da física irão interferir nos exercícios terapêuticos realizados
em ambiente aquático, por isso devem ser conhecidos para que os programas sejam
planejados de forma segura e efetiva (BATES e HANSON, 1998). As propriedades
físicas advindas da água são: densidade, flutuação, tensão superficial, viscosidade,
calor específico, refração e pressão hidrostática (CAMPION, 2000).
A água apresenta uma determinada densidade, a qual é defina como a
quantidade de massa por unidade de volume. Como a gravidade específica da água
é igual a 1, todo corpo ou objeto que for colocado no meio aquático e apresentar
densidade menor que a água flutuará ou caso seja maior afundará. Quanto à
flutuação, é definida como a força que atua contrária à gravidade, sendo que essa
força será igual ao volume de água deslocado pelo corpo imerso. Outra propriedade
da água é a viscosidade, a qual pode ser definida como a resistência do líquido em
deslocar-se, ou seja, o líquido oferece uma resistência ao corpo quando este se
movimenta (KOURY, 2000). A tensão superficial é resultado da união entre as
moléculas da superfície de um líquido, oferecendo resistência ao movimento quando
parte do corpo “quebra” a superfície da água. Em relação à refração, “é a deflação
de um raio de luz quando ele passa de um meio para outro de densidade diferente”,
sendo o motivo pelo qual a aparência de um corpo ou objeto fica alterada na água
(BATES e HANSON, 1998).
Uma das propriedades físicas da água é o calor específico, este deve ser
considerado, pois é caracterizado pela transferência constante de calor no contato
do corpo com a água. Essa transferência pode ocorrer tanto por condução como por
convecção. A determinação para uma temperatura favorável vai depender da
quantidade de calor produzido pelo corpo e da temperatura da água. Como na
prática de exercícios vigorosos o corpo produz muito calor deve-se optar por uma
temperatura entre 28º e 30ºC, já em exercícios menos intensos a temperatura
sugerida é entre 33º e 35ºC (BATES e HANSON, 1998). Alguns autores sugerem
que a temperatura da água pode influenciar a sinergia ou coordenação da contração
dos músculos respiratórios (ANSTEY e ROSKELL, 2000).
A pressão hidrostática é considerada a propriedade física que proporciona
mais vantagens (FABRIS, 2003). A água realiza pressão em todas as direções,
assim, quando um corpo está submerso fica exposto a uma determinada pressão,
que depende da força por unidade de área. A pressão que a água exerce sobre o
47
corpo imerso é alterada pela densidade do líquido e pela profundidade, pois a coluna
de líquido sobre o corpo é que será responsável pela pressão, conseqüentemente, a
pressão exercida será maior quanto maior a profundidade (CARREGARO e
TOLEDO, 2008). A pressão realizada pela água é a propriedade que atua
diretamente sobre o sistema pulmonar. Quando o corpo está submerso em posição
vertical ele sofre a ação dessa pressão principalmente sobre a caixa torácica, pois
esta se movimenta a cada ciclo respiratório, resultando em efeitos fisiológicos no
sistema respiratório (FAGUNDES e SILVA, 2006).
2.2.2 Efeitos Fisiológicos e Terapêuticos da Imersão e do Exercício em Água
O ambiente aquático é muito diferente do ambiente terrestre. Quando
imerso nesse meio o organismo realiza uma série de adaptações fisiológicas em
conseqüência das diferentes propriedades físicas a que é submetido. Os efeitos
fisiológicos proporcionados pela imersão ocorrem em todos os sistemas do corpo,
assim como no sistema cardiovascular, respiratório e renal (CAROMANO et al.,
2003).
Os efeitos fisiológicos da água são associados aos efeitos procedentes do
exercício proposto e sua intensidade, da temperatura da água, da profundidade e da
duração do tratamento (BIASOLI e MACHADO, 2006).
Em relação à resposta do sistema cardiovascular, quando o corpo fica
submerso em ambiente aquático com água em temperatura acima de 34ºC acontece
inicialmente uma vasoconstrição e aumento da pressão arterial (PA), porém, em
seguida ocorre a vasodilatação e redução da PA, ocorrendo redistribuição do fluxo
sanguíneo e melhor aporte sanguíneo para os músculos. Esse efeito é importante no
tratamento de hipertensos, significando melhor tolerância ao exercício em ambiente
aquático (FABRIS, 2003).
Quando em imersão, 700 ml de sangue dos membros inferiores são
desviados para a parte superior do corpo, o tórax. Isso ocorre pela ação da pressão
hidrostática, que causa aumento no retorno venolinfático e, conseqüentemente,
aumento de 60,0% do volume central. Com isso, o débito cardíaco aumenta de 30,0
a 32,0% e a freqüência cardíaca diminui em pelo menos 10 batimentos por minuto
48
(RUOTI et al., 2000). O aumento do retorno venoso ocorre porque a pressão
hidrostática é exercida de forma igual, em um sentido horizontal, em toda parte do
corpo e aumenta de acordo com a maior profundidade e a densidade do fluido
(ANSTEY e ROSKELL, 2000). Assim, quando um indivíduo está em pé dentro da
água a pressão maior se dará nos pés (BIASOLI e MACHADO, 2006).
Parte das respostas cardiovasculares é atribuída ao reflexo de mergulho,
as quais incluem bradicardia, vasoconstrição periférica e desvios do sangue para os
órgãos vitais. Esse processo ocorre em situações diferentes como molhar a face,
imergir o corpo com a cabeça para fora da água e imersão total com apnéia. O efeito
bradicárdico da imersão pode ser aumentado quando a imersão corporal é
associada à imersão da face ou da cabeça (RUOTI et al., 2000).
Quanto aos efeitos da imersão no sistema respiratório, estão em parte
relacionados ao sistema circulatório, pois há um aumento significativo de volume
sanguíneo nos vasos pulmonares. Entretanto, as alterações observadas na função
respiratória estão ligadas principalmente à compressão sobre a caixa torácica e
abdômen, ocasionada pela ação da pressão hidrostática (SACCHELLI et al., 2007).
A pressão hidrostática age sobre o tórax alterando a mecânica e a função
pulmonar devido a ele ser maleável e movimentar-se a cada ciclo respiratório. Ao
ficar imerso com a cabeça para fora da água ocorre um aumento na atividade e no
comprimento dos músculos respiratórios, a pressão da água atua como uma
resistência ao músculo diafragma durante a inspiração e o eleva auxiliando na
expiração (FAGUNDES e SILVA, 2006). A pressão média que atua sobre a caixa
torácica no final de uma expiração é de 21,0 cmH₂O, com água na altura do pescoço
(CAROMANO et al., 2003).
Durante a imersão com água na altura dos ombros a pressão hidrostática
faz com que ocorra o movimento da caixa torácica para dentro, movimento do
diafragma para cima e um desvio de sangue dos membros inferiores para o tórax,
sendo que essas alterações associadas contribuem para uma diminuição dos
volumes pulmonares. A capacidade vital e a capacidade pulmonar total reduzem
cerca de 5% a 10% e a capacidade residual funcional em aproximadamente 1l (60%
a 70%). A redução da capacidade vital se deve principalmente à compressão da
caixa torácica pela ação da pressão hidrostática. O aumento do trabalho elástico
(pela redistribuição de sangue ao tórax) e a ação da pressão hidrostática sobre a
caixa torácica são responsáveis pelo aumento do trabalho respiratório em 65,0%,
49
pois a resistência ao fluxo aéreo é aumentada (CAROMANO et al., 2003; RUOTI et
al., 2000).
Figura 2: Efeitos da pressão hidrostática sobre o sistema respiratório.
Fonte: Becker e Cole, (2000).
Um programa de exercícios em ambiente aquático, então, resulta em um
significante desafio de carga de trabalho para o aparelho respiratório, aumentando a
eficiência deste caso o tempo gasto no condicionamento aquático seja suficiente
para atingir os ganhos de força dos músculos da respiração (BECKER e COLE,
2000). Entretanto, deve-se ter cuidado com pessoas com capacidade vital inferior a
1.500 ml, pois a compressão sobre a caixa torácica causa alteração da capacidade
pulmonar, podendo acarretar dispnéia e sensação de mal estar (FABRIS, 2003).
Outro fator que contribui para a melhor função muscular respiratória é o
relaxamento da musculatura devido à água aquecida, que pode ser decorrente da
vosodilatação, beneficiando pessoas com espasticidade ou tensão muscular
acentuada (CARREGARO e TOLEDO, 2008).
Quanto aos efeitos no sistema renal, têm-se o aumento da diurese com
perda de volume plasmático, sódio e potássio. Esse aumento no débito urinário
ocorre devido ao aumento do fluxo sanguíneo renal, explicado pelo mecanismo
compensador homeostásico, pois ocorre distensão atrial esquerda, resultando em
aumento do transporte de sódio tubular, da excreção de sódio e, conseqüentemente,
de água. Outros fatores que auxiliam no aumento da diurese é a supressão do
sistema endócrino que regula a função renal e a supressão do sistema hormonal.
Em situações em que o tratamento em ambiente aquático dure aproximadamente
uma hora, os efeitos da imersão podem persistir por até várias horas depois da
50
imersão, sendo recomendada a ingestão de líquido (SACCHELLI et al., 2007;
BECKER e COLE, 2000; CAROMANO et al., 2003).
Quanto à resposta ao exercício terapêutico me ambiente aquático, a
alteração na freqüência cardíaca e na taxa de captação de oxigênio durante
exercício em ambiente aquático comparado com em terra, vão depender da
intensidade, do modo do exercício, da profundidade e da temperatura da água
(RUOTI et al., 2003). O treinamento em água ou em terra, tendo a mesma
intensidade metabólica, não difere quanto a capacidade de adaptação da captação
do oxigênio, entretanto, a freqüência cardíaca pode ser reduzida em 20bpm quando
os exercícios são realizados em água aquecida (CAROMANO et al., 2003). Em
relação à pressão arterial, ela diminui quando o corpo está imerso, devido à
vasodilatação das artérias que reduz a resistência periférica. Entretanto, quando o
paciente sai da piscina e encontra-se em repouso os sinais vitais voltam ao normal
(SKINNER
e
THOMSON,
1985).
Em
um
estudo
sobre
os
efeitos
da
hidrocinesioterapia na adaptação cardiorrespiratória, em pacientes com fibrose
cística, foi observado melhora da tolerância ao exercício frente a esforços
submáximos (SANTANA e PENASSO, 2005).
51
3 MATERIAIS E MÉTODOS
Neste capítulo será feita a caracterização do estudo e da amostra, após
serão citados e descritos os instrumentos e procedimentos para coleta de dados e
em seguida os procedimentos para análise.
3.1 Caracterização do Estudo
Com referência aos conceitos de Luciano (2001), a pesquisa classifica-se
como aplicada no que diz respeito à natureza. Já em relação ao problema é
quantitativa. No que se refere aos objetivos é descritiva e, por fim, em relação aos
procedimentos é estudo de caso, bibliográfica, levantamento e experimental.
3.2 Caracterização da Amostra e Local de Estudo
O estudo de caso foi realizado com um indivíduo com a presença da
doença Fibrose Cística, residente na cidade de Criciúma. Esse indivíduo foi
encontrado por meio de lista fornecida pela Associação Catarinense de Assistência
ao Mucoviscidótico (ACAM, 2008).
Quanto aos critérios de inclusão, foram adotados: apresentar diagnóstico
de Fibrose Cística, aceitar participar do estudo e ser maior de idade, independente
de sexo, estatura, raça, massa corporal ou ocupação.
Já os critérios de exclusão: exacerbação da doença durante o estudo,
doença cardíaca descompensada, gestantes, doenças infecciosas, erupções
cutâneas, capacidade vital menor que 1,5 litros, todas as outras contra-indicações da
fisioterapia aquática e faltar em mais de duas sessões.
O paciente do estudo, portador de fibrose cística, 31 anos, do sexo
masculino, raça branca, foi submetido ao tratamento fisioterapêutico em ambiente
52
aquático, na piscina terapêutica da clínica de fisioterapia da UNESC, a qual é
aquecida à 34ºC, com ambiente climatizado a 25º C.
3.3 Instrumentos para Coleta de Dados
Foi utilizado na pesquisa o Espirômetro® computadorizado (VITATRACE
VT 130 SL), usado para realizar o teste de função pulmonar. Com esse equipamento
foram registrados a Capacidade Vital Forçada (CVF), o Volume Expiratório Forçado
no primeiro segundo (VEF1), a relação VEF1/CVF e o Fluxo Expiratório Forçado
entre 25-75% (FEF₂₅-75%) pré e pós broncodilatador. A prova de função pulmonar foi
utilizada antes e após o término do tratamento fisioterapêutico em ambiente
aquático.
Figura 3: Espirômetro computadorizado
Fonte: Da pesquisadora
O Oxímetro® NONIN Ônix Dedo (Comercial Médica) foi utilizado no
estudo para a verificação da saturação de oxigênio (StO2) e freqüência cardíaca
(FC) do paciente no início e imediatamente no final de cada sessão de fisioterapia
para controle dos sinais vitais.
Também foi utilizado um estetoscópio simples (ACCUMED) para fazer a
ausculta pulmonar sempre antes de cada atendimento para identificação do
murmúrio vesicular e presença de ruídos adventícios. Este acessório também foi
utilizado para verificação da pressão arterial.
O esfigmomanômetro (ACCUMED) foi utilizado no estudo, consistindo em
um sistema para compressão arterial usado para medida indireta da pressão arterial,
53
verificando tanto a pressão sistólica quanto da pressão diastólica. O parelho foi
usado no controle da pressão arterial do paciente antes e depois de cada
atendimento.
Figura 4: Equipamentos para a aferição dos sinais vitais: estetoscópio,
esfigmomanômetro e oxímentro
Fonte: Da pesquisadora
Outro equipamento usado foi o Manovacuômetro® (Comercial Médica),
com o objetivo de verificar a força dos músculos respiratórios por meio da avaliação
das medidas da pressão inspiratória máxima (Pimáx) e da pressão expiratória
máxima (Pemáx). A aferição foi realizada três vezes, sendo considerado o maior
valor da Pimáx e da Pemáx. Estes valores foram registrados antes e após o
tratamento em ambiente aquático.
O Peak Flow Meter® (ASSES) foi utilizado para verificar o pico de fluxo
expiratório e, assim, analisar a capacidade de tosse do paciente. Para isso foram
realizadas três manobras de expiração forçada precedidas de inspiração profunda,
sendo considerada a de maior valor. Esse procedimento foi feito antes e após o
tratamento fisioterapêutico em ambiente aquático.
O clipe nasal foi usado pelo paciente para a oclusão nasal na realização
da espirometria, da manuvacuometria e do Peak Flow.
A fita métrica com padrão de 1,50m designada flexível e graduada em
centímetros e milímetros foi usada para verificar a expansibilidade torácica e
abdominal na avaliação e reavaliação, sendo medida a circunferência na altura da
linha axilar, xifóide e umbilical, durante uma expiração total e uma inspiração total.
Além de todos esses acessórios e equipamentos foi utilizada uma ficha de
avaliação fisioterapêutica respiratória (apêndice C) avaliada por três professores
com especialização em fisioterapia cardiorrespiratória (anexo B), e uma avaliação de
fisioterapia aquática (apêndice D).
54
Figura 5: Manuovacuômetro, clipe nasal, Peak Flow, fita métrica
Fonte: Da Pesquisadora
Para o teste de caminhada de seis minutos (TC6) foram utilizados os
equipamentos: trena, para a medida do percurso; fita adesiva para delimitar o
percurso; cronômetro para a marcação do tempo de caminhada; ficha de registro
para teste de caminhada (anexo C); oxímetro e aparelho de pressão para aferição
dos sinais vitais antes e após o teste; e escala de Borg para dispnéia e fadiga. O
TC6 foi realizado na avaliação e reavaliação do paciente.
Figura 6: Materiais utilizados no teste de caminhada
Fonte: Da pesquisadora
O protocolo de tratamento em ambiente aquático (apêndice E) foi
desenvolvido na piscina terapêutica localizada na Clínica de Fisioterapia da UNESC.
Ela possibilita o tratamento em três níveis de profundidade, com água na
temperatura de 34ºC e climatização a 25ºC. A piscina é coberta, apresenta 5 metros
de largura e 8 metros de comprimento e conta com escada e rampa para a entrada
na mesma. Para a realização do tratamento foram utilizados flutuadores, resistores e
clipe nasal. Foram necessárias roupas adequadas para a entrada nesse ambiente.
55
Figura 7: Piscina terapêutica
Fonte: Da pesquisadora
Os materiais que foram utilizados são de propriedade da UNESC, sendo
disponibilizados para a realização do estudo.
Para registro das imagens foi utilizada uma máquina fotográfica digital
(SONY Cyber-shot), 7.2 mega pixels, Full HD 1080, zoom óptico 4x, Super
SteadyShot + ISO 3200.
Figura 8: Máquina fotográfica digital
Fonte: Da Pesquisadora
3.4 Procedimentos para Coleta de Dados
Os procedimentos para coleta de dados foram divididos em etapas para
melhor clareza dos mesmos.
Inicialmente foi realizado o encaminhamento do projeto para o Comitê de
Ética e Pesquisa da UNESC, sendo aprovado sob parecer 80/2009 (anexo A).
56
Na seqüência, foi efetivado o contato por telefone com o paciente para
convidá-lo para uma reunião, onde foi apresentada a pesquisa e passadas as
orientações necessárias ao participante quanto à coleta de dados, local, datas e
horários de comparecimento para a realização das avaliações e sessões de
fisioterapia. O sujeito foi informado também, para melhor esclarecimento, a respeito
do tempo de cada sessão e do tempo que teria que disponibilizar para o estudo,
além de se deixado claro do critério de exclusão por falta nas sessões. Após o
esclarecimento do paciente em relação ao estudo foi coletada a assinatura no termo
de consentimento livre e esclarecido – TCLE (apêndice A). O responsável pela
clínica de fisioterapia da UNESC também foi informado do estudo, assinando um
termo permitindo a utilização da piscina terapêutica para aplicação do protocolo
(apêndice B).
Após esses procedimentos foi iniciada a fase de preparação da coleta,
deixando os materiais organizados e o local pronto para iniciar os atendimentos.
No primeiro dia o paciente realizou a avaliação fisioterapêutica
respiratória, incluindo manuovacuometria, peak-flow, cirtometria e espirometria. A
espirometria foi realizada com o paciente sentado, com clipe nasal para oclusão
nasal, sendo orientado a expirar pela boca o mais rápido e o mais forte possível
após uma inspiração profunda. Foram realizadas três expirações forçadas
precedidas por inspiração profunda antes e após 10 minutos da utilização do
broncodilatador. A melhor das três curvas foi escolhida.
No dia seguinte compareceu para realizar o teste de caminhada de seis
minutos, sendo orientado quanto à forma de realização do mesmo. O paciente
caminhou em um corredor com distância de percurso definida em 30 metros,
visivelmente demarcada. O ritmo da caminhada foi imposto pelo paciente, porém foi
orientado a caminhar o mais depressa possível. Ao término dos seis minutos foi
anotada a distância percorrida. Quanto aos sinais vitais, foram aferidos
imediatamente antes e após o teste.
Após a avaliação em solo, foi realizada a avaliação na água quanto à
ambientação do paciente nesse meio. Nos dias seguintes, foram realizadas as
sessões de fisioterapia aquática, as quais foram realizadas duas vezes por semana,
por sete semanas, totalizando 14 sessões. Cada sessão foi realizada no tempo de
sessenta minutos, divididos entre aquecimento, técnicas de fisioterapia respiratória,
exercícios para tronco, membros superiores e inferiores e técnicas de relaxamento e
57
alongamento (principalmente da musculatura acessória da respiração). O protocolo
de atendimento foi adaptado de Sacchelli et al. (2007) (apêndice E).
No final, realizadas todas as sessões, foi feita a reavaliação do paciente
para posterior comparação com a avaliação inicial.
3.5 Procedimentos para Análise
Os dados foram tabulados e analisados no programa Microsoft Excel para
melhor entendimento dos resultados e arranjados e expostos por meio de tabelas.
Após isso, foram discutidos conforme a literatura pesquisada. Também foi realizado
o cálculo da média aritmética e do desvio padrão pelo Microsoft Excel.
58
4 APRESENTAÇÃO E ANÁLISE DOS DADOS
4.1 Caracterização do Paciente
Foi realizado um estudo de caso do paciente J. C. M., 31 anos, nascido
em 20/03/1978, do sexo masculino, raça branca, apresentando diagnóstico de
fibrose cística (FC) com manifestações respiratórias e digestivas.
Tabela 1: Caracterização do Paciente
CARACTERÍSTICAS DO PACIENTE
Variável
Característica
Gênero
Masculino
Raça
Branca
Peso (Kg)
64,5
Altura (m)
1,65
Faixa Etária Atual (anos)
31
Faica Etária ao Diagnóstico
(anos)
7
Mutação genética
∆F508/outra
Fonte: Dados da Pesquisadora
Em relação à sobrevida, observa-se que até pouco tempo atrás poucos
sujeitos com FC chegavam à vida adulta. Atualmente, registros norte-americanos
apontam que a idade média de sobrevida é 36,5 anos, e que 43% das pessoas com
fibrose cística têm mais de 18 anos (ANTUNES, 2008). Estudos estimam que
pacientes nascidos depois de 2000 tenham a possibilidade de sobrevivência em
mais de 50 anos (BUZZETTI et al., 2009). O paciente em estudo apresenta faixa
etária dentro da média de sobrevida atual.
Quanto à incidência da fibrose cística, a prevalência é maior em brancos
com incidência de aproximadamente 1:2.000 nascidos vivos, enquanto é
considerada rara em outras raças, sendo em negros 1:17.000 nascimentos e em
asiáticos 1:90.000. Já em relação ao gênero, ocorre igualmente em ambos os sexos
(LEMOS et al., 2004). O paciente estudado confirma a literatura quanto à raça.
Ele recebeu o diagnóstico de Fibrose Cística aos 7 anos de idade.
Comumente a FC é diagnosticada na infância, aproximadamente só 8% dos casos
59
são diagnosticados após os 10 anos de idade. Quando o diagnóstico ocorre na
infância a doença tem uma expressão fenotípica menos grave e o indivíduo
apresenta aumento e qualidade de sobrevida (LEMOS et al., 2004, CABELLO et al.,
2003). Conforme estudo realizado com dados de 59 pacientes de Minas Gerais, a
idade média ao diagnóstico era de 3,6 anos (RASKIN e FAUCZ, 2001).
Quanto ao diagnóstico, o que induziu a suspeita da doença no paciente
em estudo foram as manifestações gastrintestinais _ propulsão intestinal, barriga
edemaciada, diarréia e fezes fétidas _ deficiência do ganho de peso e estrutura, suor
salgado e formação de cristais de sais na pele. O diagnóstico foi realizado por meio
dos achados fenotípicos (anormalidades gastrintestinais e nutricionais e síndrome
perdedora de sal), teste de suor positivo e exame do pâncreas. Em relação à história
familiar, diz não ter caso de Fibrose Cística na família.
Segundo a literatura, para o diagnóstico da FC é necessária a presença
de pelo menos um achado fenotípico, história familiar de mucoviscidose ou triagem
neonatal positiva, acompanhada de evidência laboratorial de disfunção da CFTR
(regulador da condutância transmembrana da fibrose cística), teste de suor positivo
ou diferença de potencial nasal positivo, ou ainda pela identificação de duas
mutações conhecidas como causa de FC nos genes CFTR (DALCIN e SILVA, 2008).
Apenas com 13 anos de idade o paciente realizou o teste genético _
sendo identificadas duas mutações no gene da CFTR, ∆F508 associada à outra
mutação. Conforme a literatura existe mais de 1.000 mutações descritas, sendo a
mais comum a ∆F508, identificada em 60-70% dos pacientes e correlacionada com o
pior prognóstico, insuficiência pancreática exócrina e a maior gravidade da doença
pulmonar (DALCIN e SILVA, 2008). Pacientes que são homozigotos para a mutação
∆F508 (∆F508 + ∆F508) desenvolvem a forma mais severa da doença, já os
heterozigotos (∆F508 + outra mutação) apresentam sintomatologia moderada
(RASKIN e FAUCZ, 2001).
Devido ao grande número de mutações existentes, na forma homo ou
heterozigota, o quadro clínico é diferenciado de indivíduo a indivíduo, variando o
início dos sintomas, a progressão e a gravidade da doença (ROSOV, 1999). Os
sintomas pulmonares desse paciente só manifestaram-se há aproximadamente sete
anos. Ele relatou que nesse tempo apresentou colonização por P. aeruginosa e por
S. aureus. No exame de cultura para germes comuns, realizado no dia 25 de maio
de 2009, por meio do escarro, o microorganismo isolado foi Acinetobacter sp.
60
O comprometimento pulmonar ocorre em praticamente todos os casos,
podendo aparecer no indivíduo com semanas de vida, meses ou anos. Alguns
pacientes são oligossintomáticos por vários anos, o que não impede a progressão
silenciosa para bronquiectasias. Quanto aos microorganismos, a suscetibilidade de
colonização endobrônquica ocorre especialmente por Staphilococus aureus,
Haemophilus
influenzae,
Pseudomonas
aeruginosa
e
Burkholderia
cepacia
(RIBEIRO et al., 2002). O caso do paciente vai de encontro à literatura, pois por
muitos anos ele permaneceu assintomático com progressão silenciosa da doença e
também corrobora quanto aos microorganismos encontrados.
Quanto à tomografia computadorizada do tórax (TC) realizada no dia 25
de maio de 2009, foram identificadas imagens de bronquiectasias cilíndricas, com
paredes espessadas, localizadas nos lobos superiores e no segmento superior do
lobo inferior direito. Presença de nódulos centrolobulares e obliteração da luz de
alguns brônquios, inferindo impactação mucóide. Área de atenuação de vidro fosco,
adjacentes aos brônquios obliterados no segmento posterior do lobo superior direito
– LSD, que pode representar discreto infiltrado intersticial peribrônquico. Áreas de
aprisionamento aéreo nos lobos superiores, nas imagens obtidas com técnica de
expiração forçada. Presença de linfonodo na estação pré-vascular de 0,8 cm, no seu
menor eixo.
A tomografia computadorizada do tórax (TC) em pacientes com FC
permite a avaliação de anormalidades sutis e de difícil identificação por exames
radiológicos. Os achados freqüentes na TC desses pacientes são imagens de
impactação mucóide, identificadas na TC como estruturas tubulares, espessamento
brônquico, bronquiectasias – inicialmente cilíndricas e císticas nos casos mais
avançados – e aprisionamento de ar, predominantemente no lobo superior do
pulmão direito (PEREIRA, 1997). Tais achados correspondem aos encontrados na
TC do paciente estudado.
Ao exame físico o paciente se mostrou colaborativo, com pele de
coloração pálida, cianose periférica, eupnéico, realizando respiração mista com
frenação labial e padrão ventilatório abdominal. Os sinais vitais durante a avaliação
foram: freqüência cardíaca (FC) de 63 bpm, freqüência respiratória (FR) de 17 cpm,
pressão arterial sistêmica de 120/80 mmHg e saturação de oxigênio (StO₂) de 96%.
Na ausculta pulmonar apresentou murmúrio vesicular diminuído em ambos os
pulmões. Ele apresenta baqueteamento digital, tórax hiperinsuflado, ângulo de
61
Charpy brevelíneo e abdômen globoso. O paciente refere dispnéia apenas quando
realiza grandes esforços, por exemplo, quando sobe escadas ou corre,
principalmente ao final do dia. Apresenta tosse produtiva com pouca expectoração,
sendo secreção purulenta, e é mais freqüente no período da tarde.
Com o decorrer da doença a morfologia do tórax modifica-se, adquirindo
formato de barril devido à hiperinsuflação pulmonar pela obstrução brônquica. Sinais
comuns como unhas de relógio e baqueteamento digital surgem como conseqüência
da infecção pulmonar não controlada e hipoxemia crônica. Nas fases mais
avançadas os pacientes adquirem enfisema pulmonar generalizado, broncorréia
purulenta, tosse constante, aumento da freqüência respiratória, dificuldade
expiratória e cianose periungueal. Nessa fase queixam-se de falta de ar durante
atividade física ou fisioterapia, progredindo para falta de ar em repouso
(DALLALANA, 1997).
Quanto ao tratamento fisioterapêutico, não tem sido uma rotina na vida
desse paciente. As manifestações pulmonares iniciaram há aproximadamente sete
anos, o que levou o paciente a começar a realizar tratamento fisioterapêutico,
porém, realizou por apenas dois anos, entre fisioterapia a domicílio com
fisioterapeuta e clínica de fisioterapia, em média três vezes por semana, uma vez ao
dia, sendo que já faz um ano e meio que não realiza nenhum tratamento
fisioterapêutico.
4.2 Análise e Discussão dos Dados
O paciente J. C. M. foi submetido a 14 sessões de tratamento
fisioterapêutico em ambiente aquático, com duração de 60 minutos, duas vezes na
semana. Nesse ambiente, com o indivíduo imerso com água na altura do ombro,
foram realizadas técnicas de fisioterapia respiratória (manobra manual de
compressão, huffing e padrão respiratório diafragmático com freno labial), exercícios
para tronco, membros superiores e membros inferiores e alongamento da
musculatura acessória. Segundo Velloso e Jardim (2006), indivíduos com doença
pulmonar crônica, quando submetidos a treinamento de membros superiores e
inferiores referem melhora da dispnéia ao realizarem suas atividades de vida diária.
62
Os princípios da física irão interferir nos exercícios terapêuticos realizados
em ambiente aquático, por isso devem ser conhecidos para que os programas sejam
planejados de forma segura e efetiva (BATES e HANSON, 1998). As propriedades
físicas advindas da água são: densidade, flutuação, tensão superficial, viscosidade,
calor específico, refração e pressão hidrostática (CAMPION, 2000). Devido a maior
redistribuição sanguínea para os músculos durante a imersão, eles se contraem
mais facilmente e têm sua função melhorada (SKINNER e THOMSON, 1985).
Em relação aos sinais vitais, SpO₂, FC e PA, foram verificados
imediatamente antes e após cada sessão de fisioterapia, sendo que sofreram
pequenas alterações. A média da SpO₂ antes de cada sessão foi de 96,71% (±
1,14), da FC 70,21bpm (± 4,74) e PA 116/77mmHg (±6/6) e após SpO₂ 95,79%
(±1,76), FC 79,64bpm (±6,49) e PA 114/74mmHg (±7/7). Observou-se que os
valores médios dessas já se apresentavam normais anteriormente as sessões e
mantiveram-se normais. Esses dados foram registrados apenas para controle do
paciente.
De acordo com Ruoti et al. (2000), a alteração na FC e na taxa de
captação de oxigênio durante exercício em ambiente aquático comparado com em
terra, vão depender da intensidade, do modo do exercício, da profundidade e da
temperatura da água. Segundo Caromano et al. (2003), o treinamento em água ou
em terra, tendo a mesma intensidade metabólica, não diferem quanto a capacidade
de adaptação da captação do oxigênio, entretanto, a freqüência cardíaca pode ser
reduzida em 20bpm quando os exercícios são realizados em água aquecida.
Conforme Skinner e Thomson (1985), a pressão arterial diminui quando o corpo está
imerso, devido à vasodilatação das artérias que reduz a resistência periférica.
Entretanto, quando o paciente sai da piscina e encontra-se em repouso os sinais
vitais voltam ao normal.
Quanto à força muscular respiratória, foi avaliada por meio do
manuovacuômetro antes e após o tratamento fisioterapêutico em ambiente aquático,
registrando-se os valores da pressão inspiratória máxima (Pimáx) e pressão
expiratória máxima (Pemáx). As variáveis Pimáx e Pemáx apresentaram aumento
após o tratamento (tabela 2).
63
Tabela 2: Pimáx e Pemáx antes e após tratamento com fisioterapia aquática.
Manuovacuometria
Antes Após
Pimáx (cmH₂O)
-60
-75
Pemáx (cmH₂O)
50
60
Fonte: Dados da Pesquisadora
A Fibrose Cística é uma doença que altera a função pulmonar. Isso
acontece em conseqüência da inflamação e infecção crônicas das vias aéreas, que
as obstruem favorecendo o aprisionamento aéreo, ocorrendo modificação da
complacência pulmonar, aumento do trabalho respiratório, encurtamento muscular e
conseqüentemente, redução da força da musculatura inspiratória (ZANCHET et al.,
2006). Em pacientes que apresentam doença pulmonar obstrutiva crônica, que é o
caso dos portadores de FC, a hiperinsuflação pulmonar faz com que o diafragma
seja deslocado caldalmente, diminuindo seu comprimento de repouso e, assim, sua
capacidade de gerar pressão (MACHADO, 2008).
Desse modo, as doenças que acometem o sistema respiratório podem
modificar a força de contração dos músculos ventilatórios, a qual pode ser
classificada quanto à intensidade e quantificação da perda como: fraqueza muscular
respiratória (Pimáx = -70 a -45 cmH₂o), fadiga muscular respiratória (Pimáx = -40 a 25 cmH₂O) e falência muscular respiratória (Pimáx = < -20 cmH₂O). O diagnóstico
precoce da fraqueza muscular é essencial para que o fisioterapeuta faça um
protocolo de treinamento físico geral e, principalmente, da musculatura respiratória
(AZEREDO, 2002). Já é consenso que o treinamento da musculatura inspiratória é
de extrema importância para pacientes com Pimáx ≤ -60cmH₂O (MACHADO, 2008).
O paciente em estudo, conforme à literatura, apresentou diagnóstico funcional de
fraqueza da musculatura respiratória na avaliação, com Pimáx de -60 cm H₂O,
saindo do limite de fraqueza após o tratamento com fisioterapia aquática, obtendo
Pimáx de -75 cmH₂O.
Acredita-se que os ganhos encontrados na Pimáx do paciente após a
reabilitação pulmonar em ambiente aquático tenham ocorrido em razão das
propriedades físicas da água que atua aumentando o esforço dos músculos
respiratórios. Isso se explica, pois, quando o indivíduo fica imerso até a altura do
apêndice xifóide ocorre aumento do trabalho respiratório de 60% a 65%, devido à
resistência durante a expansão pulmonar na fase inspiratória e pelo aumento do
volume sanguíneo no tórax – resultados da pressão hidrostática (IDE et al., 2005).
64
Esta é considerada como uma carga para o diafragma durante a inspiração, sendo
um exercício para esse músculo, além de favorecer a fase expiratória, resultando em
melhora da mecânica ventilatória (FAGUNDES e SILVA, 2006). Segundo Becker e
Cole (2000), a eficiência do sistema respiratório pode ser aumentada se o tempo
gasto no condicionamento aquático for suficiente para atingir os ganhos de força.
Em relação à força muscular expiratória, qualquer fraqueza desses
músculos prejudica a eficácia da tosse, o que interfere na depuração e favorece a
retenção de secreções pulmonares, facilitando o desenvolvimento de infecções.
Conseqüentemente à incapacidade de eliminar secreções podem ser desenvolvidas
atelectasias e pneumonias, as quais são as causas mais comuns de fadiga
respiratória (POSTIAUX, 2004). Portanto, uma melhoria da Pemáx seria de grande
importância clínica, já que os músculos expiratórios precisam estar íntegros para
realizar manobras de expiração forçada, como a tosse, mecanismo de defesa do
nosso organismo. Conforme Presto e Presto, (2005) a Pemáx do paciente em estudo
apresentava-se reduzida na avaliação em relação aos valores de normalidades
previstos para homens entre 20 e 80 anos (Pemáx = 268 - 1,03 x idade), tendo
obtido o valor de 50cmH₂O. Após o programa de fisioterapia aquática sofreu um
pequeno aumento, obtendo 60cmH₂O, entretanto continuou com fraqueza da
musculatura expiratória. Conforme Ide et al., (2005), os benefícios expiratórios
podem ter ocorrido pela maior mobilidade tóraco-abdominal e melhor mecânica
respiratória devido à eficiência e mudança na estrutura dos músculos inspiratórios.
Contudo, relata que alguns estudos não verificaram aumento da Pemáx após
treinamento em ambiente aquático. Outro fator que pode ter influenciado no
aumento da força muscular expiratória foram os exercícios para fortalecimento
abdominal durante o protocolo proposto.
Quanto à expansibilidade tóraco-abdominal, obteve-se um aumento após
o tratamento com fisioterapia aquática (tabela 3). Esse resultado pode ser devido a
melhora do fortalecimento muscular respiratório, que promoveu maior eficiência
desses músculos e melhora da mecânica ventilatória, contribuindo para um aumento
da amplitude dos movimentos toráco-abdominais (GALVÃO, 2006). Outro fator que
contribui para a mecânica respiratória é o relaxamento da musculatura devido à
água aquecida, que pode ser decorrente da vosodilatação, beneficiando pessoas
com espasticidade ou tensão muscular acentuada (CARREGARO e TOLEDO,
65
2008). Segundo Becker e Cole (2000), a circunferência da caixa torácica é diminuída
em aproximadamente 10% durante a imersão pela ação da pressão hidrostática.
Tabela 3: Expansibilidade tóraco-abdominal antes e após tratamento com
fisioterapia aquática
Cirtometria
Inicial Final
Axilar (cm)
2
4
Xifóide (cm)
4
5
Umbilical (cm)
5
6
Fonte: Dados da Pesquisadora
Sabe-se que aproximadamente 90% dos pacientes com Fibrose Cística
(FC) morrem em função da doença pulmonar. Apesar de a doença cursar com
deterioração progressiva, a realização de tratamento adequado pode adiar essa
progressão (DALCIN e SILVA, 2008). Em decorrência disso, a espirometria torna-se
um instrumento de grande importância no monitoramento da evolução da queda da
função pulmonar e na avaliação da melhora em frente a variadas medidas de
tratamento (MORROW et al., 2008).
A prova de função pulmonar foi realizada com o paciente em estudo por
meio da espirometria antes e após o tratamento com fisioterapia aquática – sendo
analisada por meio dos valores obtidos, pré e pós-broncodilatador, da Capacidade
Vital Forçada (CVF), do Volume Expiratório Forçado no primeiro segundo (VEF₁), da
relação VEF₁/CVF e do Fluxo Expiratório Forçado entre 25 e 75% (FEF₂₅
-
₇₅%)
(tabela 4). De acordo com as diretrizes para testes de função pulmonar, o distúrbio
do paciente foi classificado pelo valor do VEF₁ como Distúrbio Ventilatório Obstrutivo
(DVO) moderado (RODRIGUES et al., 2002). Nesta pesquisa, a fisioterapia aquática
não demonstrou influenciar na melhora da função pulmonar, apesar do aumento da
força muscular respiratória e melhora da mecânica ventilatória.
66
Tabela 4: Espirometria, pré e pós-broncodilatador, antes e após tratamento
com fisioterapia aquática.
Espirometria
Antes
Após
Antes
S/BD
S/BD
C/BD
CVF
71.2
70.2
77,5
VEF₁
44.3
43.7
49,5
VEF₁/CVF 62.5
62.5
64,1
FEF25-75 % 16.6
16.6
16,9
Fonte: Dados da Pesquisadora
Após
C/BD
76,4
48,9
63,5
19,0
O distúrbio ventilatório que os indivíduos com FC apresentam é
fundamentalmente obstrutivo, contudo, pode aparecer restrição associada em
virtude da fibrose pulmonar na fase final da doença. O dado que mais se altera
precocemente nas provas de função pulmonar é o FEF₂₅ - ₇₅%, sendo que esse valor
reduz em média 8% ao ano, devido ao alçaponamento de ar em áreas pouco
ventiladas dos pulmões. Os demais valores como, CVF, VEF₁ e VEF₁/CVF vão
reduzindo com a progressão da doença (ANDRADE et al., 2001). O paciente
apresenta redução acentuada do FEF₂₅
-
₇₅%, como também dos valores da CVF,
VEF₁ e VEF₁/CVF.
Várias literaturas sugerem que a hidroterapia pode ser utilizada para
aumentar em longo prazo a função respiratória através da melhoria da capacidade
vital (CV), expansão torácica e controle da respiração (ANSTEY e ROSKELL, 2000).
Segundo estudo realizado, o exercício aeróbico praticado por um período
de três meses, com freqüência mínima de três vezes na semana, com tempo de 50
minutos cada sessão, mostraram resultado estatísticos nas variáveis espirométricas
– Capacidade Vital(CV), Volume Expiratório Forçado em um segundo (VEF1),
Fluxo Expiratório Forçado entre 25% e 75% (FEF25%-75%), Fluxo Expiratório
Forçado
em 25%
(FEF25%)
e
em
50% (FEF50%)
do
grupo
experimental
(TAVARES et al., 2008). Nessa pesquisa não foi obtida melhora da função pulmonar,
o que pode ter sido pelo tempo curto de estudo e também por ter sido aplicado no
inverno, estação que normalmente leva à exacerbação da doença.
Galvão (2006), em seu estudo com pacientes com fibrose cística, não
observou melhora da função pulmonar após treinamento muscular inspiratório com
threshold.
67
Santana e Penasso (2005) relataram um estudo no qual os pacientes
ficaram sem tratamento fisioterapêutico por um período de três semanas
apresentando redução significativa de todos os parâmetros da espirometria, inclusive
aumento da limitação ao fluxo aéreo. O paciente em estudo com o tratamento de
fisioterapia em ambiente aquático manteve-se estável em relação à avaliação inicial.
Quanto ao Peak Flow (PF), ele é utilizado na detecção e na avaliação
precoce da obstrução brônquica, sendo importante para que a terapêutica adequada
seja empregada o mais cedo possível, impedindo o agravamento do processo
obstrutivo. Além disso, é usado para determinar se a tosse do paciente é eficaz
(PRESTO e PRESTO, 2005; MACHADO, 2008).
O pico de fluxo expiratório (PFE), analisado por meio do Peak Flow, foi
verificado antes e depois do programa de fisioterapia aquática com o intuito de
verificar a eficiência da tosse. O paciente apresentou processo obstrutivo no teste,
com valor de PFE de 300 L/min, sendo que o parâmetro de normalidade previsto em
relação ao sexo, estatura e idade é de 577 L/min (PRESTO e PRESTO, 2005). Na
segunda mensuração, após o programa de fisioterapia aquática, obteve-se aumento
desse valor para 390 L/min, porém continuando abaixo dos limites de normalidade
(tabela 5). A melhora dessa variável pode ter ocorrido pelo aumento da força
muscular respiratória e pode ser correlacionada com a melhor eficácia da tosse.
Tabela 5: Peak Flow antes e após tratamento com fisioterapia aquática.
Peak flow
Antes Após
PFE (L/min)
300
390
Fonte: Dados da Pesquisara
A manobra para o alcance do fluxo expiratório máximo é esforçodependente, podendo ocorrer alterações dos valores devido ao comprometimento da
massa e força muscular e aos episódios de infecções respiratórias, fatores presentes
em pacientes com FC, fazendo com que não correspondam verdadeiramente à
intensidade dos distúrbios ventilatórios (CAMARGOS e QUEIROZ, 2002).
Em relação ao Teste de Caminhada de 6 minutos (TC6), foi realizado pelo
paciente antes e após o tratamento de fisioterapia aquática. Foram anotados, após o
término dos 6 minutos de caminhada, os valores da Freqüência Cardíaca (FC),
68
Freqüência Respiratória (FR), Pressão Arterial Sistêmica (PA), Borg de dispnéia e de
fadiga, Pico de Fluxo Expiratório (PFE) e distância percorrida (DP) (tabela 6).
Tabela 6: Teste de caminhada de 6 minutos antes e após tratamento com
fisioterapia aquática.
Teste de caminhada de 6 minutos
Antes
Após
DP (m)
638
682
FC (bpm)
90
85
PAS (mmHg)
130
110
SpO₂ (%)
98
97
PFE (L/min)
340
450
Borg Dispinéia
1
2
Borg Fadiga
4
3
Fonte: Dados da Pesquisadora
O valor previsto para a distância percorrida em 6 minutos em um indivíduo
normal, em relação à estatura, sexo, idade e peso do paciente em estudo é 791,
96m (SBPT, 2007).
Os avanços no tratamento e diagnóstico da FC levaram a uma maior
sobrevida desses indivíduos, contudo, com o aumento da idade também vieram o
aumento das limitações, principalmente, a piora progressiva da função pulmonar
com diminuição da capacidade cardiorrespiratória (ZIEGLER et al., 2007). Conforme
Chave et al. (2007), os pacientes com FC apresentam descondicionamento físico
progressivo devido à inatividade pela dispnéia, ocorrendo um círculo vicioso, onde a
dispnéia começa a aparecer em esforços cada vez menores.
O TC6 está sendo utilizado para avaliar a capacidade funcional do
indivíduo com doenças crônico-degenerativas, assim como de fibrocísticos,
estimando a tolerância do paciente frente às atividades de vida diária. Além de ser
usado para analisar se os pacientes então respondendo as intervenções de
reabilitação (COELHO et al., 2007).
As crianças com fibrose cística apresentam diminuição do desempenho
aeróbico e, conseqüentemente, redução da distância percorrida em cargo da
alteração da função pulmonar (COELHO et al., 2007). Em um estudo realizado com
25 pacientes fibrocísticos adultos com doença pulmonar leve e moderada (média do
VEF₁ de 69±23)%, foi evidenciado um desempenho normal quanto á distância
percorrida, já em outro estudo com paciente com maior comprometimento (VEF₁ de
69
51,1±27) a distância percorrida foi inferior (ZIEGLER et al., 2007).
Rodrigues e
Viegas (2002) em seu estudo com pacientes com DPOC, observaram que existe
correlação entre as variáveis funcionais respiratórias e o TC6 e que os indivíduos
que apresentam maior distância percorrida possuem uma maior sobrevida. Apesar
de a literatura relacionar a piora da função pulmonar com a redução da capacidade
funcional do indivíduo, o paciente em estudo apresentou boa tolerância ao exercício.
Ele percorreu a distância de 638m no TC6 antes da fisioterapia aquática e 682 m
após, ocorrendo um aumento de 50 m na distância percorrida do pré para o póstratamento.
A diferença mínima clinicamente importante (DMCI) após intervenções para
o TC6 foi estimada entre 54 e 80 metros. De fato, para um determinado
indivíduo ser considerado como realmente respondedor a uma determinada
intervenção, o TC6 deveria variar pelo menor 86 metros para estarmos
estatisticamente confiantes de que houve uma melhora real (SBPT, 2007, p.
9).
Entretanto, em um indivíduo com pouca limitação na avaliação basal 86
metros pode ser um valor inalcançável, já que a distancia percorrida é finita, pois não
é permitido correr durante o teste (SBPT, 2007). O paciente do estudo apresentou
pouca limitação na avaliação basal, sendo 50m um valor considerável.
Segundo Rodrigues (2003), para que os ganhos clínicos sejam
considerados significativos é preciso que ocorra um aumento de no mínimo 50m na
distância percorrida.
Em um estudo sobre os efeitos da hidrocinesioterapia na adaptação
cardiorrespiratória em pacientes com FC, realizado por Santana e Penasso (2005),
foi observado melhora da tolerância ao exercício, frente a esforços submáximos.
70
5 CONCLUSÃO
Os pacientes com fibrose cística são caracterizados por doença
multissistêmica, mas que afeta especialmente o sistema respiratório. A doença
pulmonar é obstrutiva crônica, que limita o fluxo aéreo e favorece o aprisionamento
de ar, deixando os pacientes hiperinsuflados, resultando em diminuição da força
muscular respiratória. Essa fraqueza torna os pacientes predispostos à fadiga
respiratória e, junto com o descondicionamento físico progressivo comum nesses
pacientes, leva a limitação da capacidade funcional frente a esforços submáximos.
As prováveis razões para a melhora da sobrevida dos pacientes com
fibrose cística são devido à crescente capacidade de diagnóstico precoce e, assim,
tratamento adequado principiado. A fisioterapia deve ser iniciada ao diagnóstico
mesmo que os sintomas sejam mínimos ou não existam, sendo considerada
essencial no tratamento dessa doença. A terapêutica deve ser direcionada para a
eliminação de secreções da vias aéreas e ao treinamento da musculatura específica
da respiração e não específica. A água possui propriedades físicas importantes,
sendo um meio propício para a realização do treinamento funcional do sistema
respiratório.
A pesquisa realizada foi um estudo de caso com um paciente com fibrose
cística, sendo que foram comparadas as avaliações realizadas antes e após o
tratamento com fisioterapia aquática. O paciente foi avaliado quanto sua função
pulmonar, força muscular respiratória, expansibilidade torácica, capacidade de tosse
e capacidade funcional. Ele realizou 14 sessões de fisioterapia em ambiente
aquático, a qual se constituiu de técnicas da fisioterapia respiratória e exercícios de
resistência para tronco, membros inferiores e superiores. Pode-se perceber com o
estudo aumento satisfatório da força muscular respiratória, da expansibilidade
torácica, da capacidade de tosse e da tolerância ao exercício. Já a função pulmonar
verificada por espirometria não apresentou melhora, entretanto, foi satisfatório por
manter-se estável em um período de inverno com grande variação de temperatura,
fator que normalmente agrava a saúde pulmonar desses pacientes. Além do que,
sabe-se que quando o indivíduo com fibrose cística fica três semanas sem
fisioterapia os valores da espirometria regridem significativamente, tendo sido um
resultado satisfatório por ter sido mantido os parâmetros da primeira avaliação.
71
A melhora da força muscular em ambiente aquático explica-se pelo
aumento do trabalho respiratório nesse ambiente, ocasionado pela resistência
imposta pela água aos músculos inspiratórios e pelo aumento do volume sanguíneo
central. Os músculos responsáveis pela inspiração aumentam o seu comprimento
ficando em vantagem contrátil quando com água na altura do tórax. Outro fator que
influencia é a água aquecida, a qual proporciona maior distribuição sanguínea aos
músculos, tornando-os mais relaxados. O aumento da força dos músculos
inspiratórios reflete na melhora da mobilidade torácica, o que acaba auxiliando
também na maior eficiência dos músculos expiratórios, contribuindo para a tosse.
Assim, exercícios terapêuticos realizados em piscina aquecida parecem um meio
propício para o treinamento e melhora da capacidade respiratória em pacientes com
fibrose cística, colaborando para a melhora sintomatológica, principalmente na
tolerância aos exercícios submáximos.
A fisioterapia aquática é importante, sobretudo por ser realizada em um
ambiente que proporciona prazer e alivia o estresse, sendo efetiva não só na
melhora da função respiratória, mas também na qualidade de vida.
Esse estudo mostrou uma proposta de tratamento em ambiente aquático
para pacientes com fibrose cística, sendo um recurso que pode ser utilizado em
benefício dos pacientes com essa doença, visando à melhora da expectativa e da
qualidade de vida. Acredita-se que os resultados encontrados no estudo poderiam
ser melhores se fosse dada continuidade ao tratamento, obtendo-se um tempo maior
de treinamento. Além de ser essencial uma amostra maior para que a pesquisa seja
significativa. Dessa forma, novos estudos devem ser realizados para dar
continuidade ao trabalho, utilizando um maior número de pacientes e por um período
prolongado, para que então sejam verificados os benefícios específicos que o
treinamento em ambiente aquático pode proporcionar aos fibrocísticos.
72
REFERÊNCIAS
ABREU, Luiz Carlos de et al. Uma visão da prática da fisioterapia respiratória:
ausência de evidência não é evidência de ausência. Arq Med ABC 32(Supl. 2):S768. 2007.
ACAM, Associação Catarinense de Assistência ao Mucoviscidótico. Disponível
em: http://www.acam.org.br/fibrose_tratamento.asp. Acesso em: 20 de novembro de
2008.
ALMEIDA, Ana Carolina da Silva et al.. Fisioterapia. In: LUDWIG NETO, Norberto.
SANTA CATARINA Superintendência dos Hospitais Públicos Estaduais Hospital
Infantil Joana de Gusmão. Fibrose cística: enfoque multidisciplinar. Florianópolis:
Secretaria de Estado da Saúde, 2008. 622 p.
ALVES, Crésio de Aragão Dantas et al. Diabetes melito: uma importante comorbidade da fibrose cística. J Bras Pneumol. 2007;33(2):213-221.
ANDRADE, Elenara da Fonseca et al.. Avaliação evolutiva da espirometria na fibrose
cística. J Pneumol 27(3) – mai-jun de 2001.
ANSTEY, Karen H.; ROSKELL, Carolyn. Hydrotherapy: Detrimental or beneficial to
the respiratory system? Physiotherapy January 2000/vol 86/no 1.
ANTUNES, Evandro Thomsen. Epidemiologia. In: LUDWIG NETO, Norberto. SANTA
CATARINA Superintendência dos Hospitais Públicos Estaduais Hospital Infantil
Joana de Gusmão. Fibrose cística: enfoque multidisciplinar. Florianópolis:
Secretaria de Estado da Saúde, 2008. 622 p.
AZEREDO, Carlos Alberto Caetano. Fisioterapia respiratória moderna. 4 ed. São
Paulo: Manole, 2002. 495 p.
AZEREDO, Carlos Alberto Caetano; QUEIROZ, Alberto M. de; POLYCARPO,
Monclar Ramalho. Manual prático de fisioterapia respiratória. Rio de Janeiro:
Laboratório da respiração e biofeedback, 2000. 325 p.
BARROS, Luana Souto; MEDEIROS, Eduardo Bauzer. Revisão do tratamento
fisioterapápico na tosse ineficaz: uso da tosse mecanicamente assistida (cought
assist). FisioBrasil, Rio de Janeiro, v.12, n.90, p.13-23, ago. 2008.
BATES, A; HANSON, N. Exercícios Aquáticos Terapêuticos. São Paulo , Editora
Manole, 1998.
BECKER, Bruce E.; COLE, Andrew J. (Editor). Terapia aquática moderna. São
Paulo: Manole, 2000. 186 p.
BIASOLI, Maria Cristina; MACHADO, Christiane Márcia Cassiano. Hidroterapia:
aplicabilidades clínicas. RBM - Rev. Bras. Med. - Vol. 63 - nº 5 - maio – 2006.
73
BUZZETTI, R., et al.. An overview of international literature from cystic fibrosis
registries:1. Mortality and survival studies in cystic fibrosis. Journal of Cystic
Fibrosis 8 (2009) 229–237.
CABELLO, Giselda M. K., et al. Rastreamento da fibrose cística usando-se a análise
combinada do teste de IRT neonatal e o estudo molecular da mutação ∆F508.
Jornal Brasileiro de Patologia e Medicina Laboratorial. Rio de Jan, V.39, n.1.
p.15-20, 2003.
CAMARGOS, Paulo A.M.; QUEIROZ, Mônica V.N.P.. Pico de fluxo expiratória na
avaliação da função pulmonar na fibrose cística. Jornal de Pediatria - Vol. 77, Nº1,
2002.
CAMPION, M. R. Hidroterapia: Princípios e prática. São Paulo: Ed. Manole, 2000.
CARREGARO, Rodrigo Luiz; TOLEDO, Aline Martins de et al. Efeitos Fisiológicos e
Evidências Científicas da Eficácia da Fisioterapia Aquática. Revista Movimenta; Vol
1, N 1. 2008.
CAROMANO, Fátima A.; THEMUDO FILHO, Mário Roberto F.; CANDELORO,
Juliana Monteiro. Efeitos Fisiológicos da Imersão e do Exercício na Água. Revista
Fisioterapia Brasil - ano 4 - nº 1 - jan/2003.
CHAVES, Celia Regina Moutinho de Miranda et al . Exercício aeróbico, treinamento
de força muscular e testes de aptidão física para adolescentes com fibrose cística:
revisão da literatura. Rev. Bras. Saude Mater. Infant. , Recife, v. 7, n. 3, set.
2007 . Disponível em: <http://www.scielo.br. Acesso em: 17 nov. 2008.
COELHO, Cristiane Cenachi, et al.. Análise comparativa e reprodutibilidade do teste
de caminhada com carga progressiva (modificado) em crianças normais e em
portadoras de fibrose cística. J Bras Pneumol. 2007;33(2):168-174.
COSTA, Dirceu. Fisioterapia respiratória básica. São Paulo: Atheneu,
Atheneu,1999. 127 p.
DALCIN, Paulo de Tarso Roth, et al. Adesão ao tratamento em pacientes com
fibrose cística. J Bras Pneumol. 2007;33(6):663-670.
DALCIN, Paulo de Tarso Roth; SILVA, Fernando Antônio de Abreu e. Fibrose cística
no adulto: aspectos diagnósticos e terapêuticos. J Bras Pneumol. 2008;34(2):107117.
DALLALANA, Trotta Ludma. Fibrose Cística. In: TARANTINO, Afonso Berardinelli.
Doenças Pulmonares. 4 ed. Rio de Janeiro: Guanabara Koogan, 1997.
DETURK, William E.; CAHALIN, Lawrence P. Fisioterapia cardiorrespiratória:
baseada em evidências. Porto Alegre: Artmed, 2007. 734 p.
FABRIS, Lisiane. Propriedades físicas e terapêuticas da água - efeitos fisiológicos da
imersão - uma revisão bibliográfica. 53 p. Monografia (Especialização Lato Sensu
em Fisiologia do exercício) - Universidade do Extremo Sul Catarinense, 2003.
74
FAGUNDES, Alessandra de Almeida; SILVA, Robson Fernandes. Efeitos da Imersão
em água aquecida sobre o sistema respiratório. Fisioterapia em Movimento,
Curitiba, v.19, n.4, p. 113-118, out./dez., 2006.
FOGAÇA, Hamilton Rosendo. Qualidade de Vida e Fibrose Cística. In: LUDWIG
NETO, Norberto. SANTA CATARINA Superintendência dos Hospitais Públicos
Estaduais Hospital Infantil Joana de Gusmão. Fibrose cística: enfoque
multidisciplinar. Florianópolis: Secretaria de Estado da Saúde, 2008. 622 p.
FRACON, Juliana de F. Avaliação de crianças com fibrose cística após 12 meses de
fisioterapia respiratória = Evaluation of children.... Fisioterapia Brasil, Rio de
Janeiro: v.2, n.5 , p. 289-294,, set./out., 2001.
FREIRE, Ivanice Duarte; ABREU E SILVA, Fernando Antônio de; ARAUJO, Manuel
Ângelo de. Comparação entre provas de função pulmonar, escore de ShwachmanKulczycki e escore de Brasfield em pacientes com fibrose cística. J. bras.
pneumol., São Paulo, v. 34, n. 5, maio 2008 . Disponível em:
<http://www.scielo.br/ Acesso em: 23 nov. 2008.
GALVÃO, Fábio. Avaliação do treinamento muscular inspiratório em pacientes com
fibrose cística através do uso do threshold IMT. Dissertação de Mestrado.
Faculdade de Ciências Médicas. Universidade Estadual de Campinas, 2006.
GASPAR, Maria Cristina A. et al . Resultado de intervenção nutricional em crianças e
adolescentes com fibrose cística. J. Pediatr. (Rio J.) , Porto Alegre, v. 78, n.
2, abr. 2002 . Disponível em: <http://www.scielo.br/. Acesso em: 02 nov. 2008.
HERNANDES, Aparecida Nidia. Influência da Fisioterapia Aquática na Função
Pulmonar de Pacientes com Espondilite Anquilosante: Série de Casos. Monografias
do Curso de Fisioterapia – Unioeste, n. 01-2004.
IDE, Maiza Ritomy, et al.. Effects of na aquatic versus non-aquatic respiratory
exercise program on the respiratory muscle strength in healthy aged persons.
Clinics 60(2):151-158, 2005.
KOURY, J.M; SIEPIERSKI, S.P. Programa de Fisioterapia Aquática: um guia para
a reabilitação ortopédica. São Paulo: Manole, 2000.
LEMOS, Antônio Carlos M., et al.. Fibrose cística em adultos: aspectos clínicos e
espirométricos. Jornal Brasileiro de Pneumologia 30(1) Jan/Fev de 2004.
LUCIANO, Fábia Liliã. Metodologia científica e da pesquisa. Criciúma: Ed. do
autor, 2001.
LUDWIG NETO, Norberto. SANTA CATARINA Superintendência dos Hospitais
Públicos Estaduais Hospital Infantil Joana de Gusmão. Fibrose cística: enfoque
multidisciplinar. Florianópolis: Secretaria de Estado da Saúde, 2008. 622 p.
MACHADO, Maria da Glória Rodrigues. Bases da fisioterapia respiratória: terapia
intensiva e reabilitação. Rio de Janeiro: Guanabara Koogan, 2008.
75
MAGALHAES, Marcelo et al . Prevalência de bactérias potencialmente patogênicas
em espécimes respiratórios de fibrocísticos do Recife. J. Bras. Patol. Med. Lab. ,
Rio de Janeiro, v. 40, n. 4, ago. 2004 . Disponível em: <http://www.scielo.br/.
Acesso em: 05 nov. 2008.
MARQUES, Cristiano et al.. Doença Pulmonar. In: LUDWIG NETO, Norberto.
SANTA CATARINA Superintendência dos Hospitais Públicos Estaduais Hospital
Infantil Joana de Gusmão. Fibrose cística: enfoque multidisciplinar. Florianópolis:
Secretaria de Estado da Saúde, 2008. 622 p.
MORROW, Brenda M. et al.. Melhoras na função pulmonar de uma população com
fibrose cística em um país em desenvolvimento. Jornal de Pediatria. Vol. 84, Nº5,
2008.
OLIVEIRA, Elizngela Navarro de. Fibrose Cística. In: SARMENTO, George Jerre
Vieira. Fisioterapia respiratória em pediatria e neonatologia. Barueri, SP: Manole,
2007. 531 p.
Organização Mundial de Saúde (OMS). Protocolo Clínico e Diretrizes Terapêuticas.
Fibrose Cística: Enzimas Pancreáticas. Portaria SAS/MS nº 263, de 18 de julho de
2001.
PEREIRA, Mônica Corso. A tomografia computadorizada de alta resolução na
avaliação das doenças pulmonares difusas. Tese de Mestrado. Faculdade de
Ciências Médicas. Universidade Estadual de Campinas, 1997.
PICANÇO, Patrícia Salerno de Almeida e cols. Fisioterapia Aquática nas Doenças
Respiratórias Obstrutivas. In: SACCHELLI, Tatiana; ACCACIO, Letícia Maria Pires;
RADL, André Luis Maierá. Fisioterapia aquática. Barueri, SP: Manole, 2007. 350 p.
POSTIAUX, Guy. Fisioterapia respiratória pediátrica: o tratamento guiado por
ausculta pulmonar. 2. ed Porto Alegre: Artmed, 2004. 301 p.
PRESTO, Bruno Lombaerde Varella; PRESTO, Luciana Damázio de Noronha.
Fisioterapia respiratória: uma nova visão. 2. ed. rev. e ampl Rio de Janeiro: Ed. do
Autor, 2005. 406 p.
PRYOR, Jennifer A; PRYOR, Jennifer A; WEBBER, Barbara A. Fisioterapia para
problemas respiratórios e cardíacos. 2.ed Rio de Janeiro: Guanabara Koogan,
2002. 366 p.
RAMOS, Camila Sacchelli e cols. Efeitos Fisiológicos da Imersão. In: SACCHELLI,
Tatiana; ACCACIO, Letícia Maria Pires; RADL, André Luis Maierá. Fisioterapia
aquática. Barueri, SP: Manole, 2007. 350 p.
RASKIN, Salmo; FAUCZ, Fábio Rueda. Aspectos Genéticos da Fibrose Cística. In:
CARAKUSHANSKY, Gerson. Doenças genéticas em pediatria. Rio de Janeiro:
Guanabara Koogan, 2001. 503 p.
76
RIBEIRO, Jose Dirceu; RIBEIRO, Maria Ângela G. de O.; RIBEIRO, Antonio
Fernando. Controvérsias na fibrose cística – do pediatra ao especialista. J Pediatr
(Rio J) 2002; 78 (Supl.2): S171-S186: cystic fibrosis, respiratory tract diseases, child.
RODRIGUES, Joaquim Carlos, et al.. Diretrizes para Testes de Função Pulmonar
2002. Capítulo: Provas de Função Pulmonar em Crianças e Adolescentes. J
Pneumol 28(Supl 3) – outubro de 2002.
RODRIGUES, Sérgio Leite. Reabilitação pulmonar: conceitos básicos. São Paulo:
Manole, 2003.
RODRIGUES, S L; VIEGAS, JR. Estudo de correlação entre provas funcionais
respiratórias e o teste de caminhada de seis minutos em pacientes com portadores
de doença pulmonar obstrutiva crônica. J Pneumol 28(6) – Nov-dez de 2002.
ROVEDDER, Paula Maria Eidt et al. Ecocardiograma Doppler, Saturação de
Oxigênio e Capacidade Submáxima de Exercício em Pacientes com Fibrose Cística.
Dissertação de Mestrado. Faculdade de Medina da UFRGS. Programa de PósGraduação em Medicina: Ciências Médicas. 2006.
ROVEDDER, Paula Maria Eidt et al . Infecção bacteriana crônica e indicadores
ecocardiográficos de hipertensão pulmonar em pacientes com fibrose cística. J.
bras. pneumol. , São Paulo, v. 34, n. 7, jul. 2008 . Disponível em:
<http://www.scielo.br/. Acesso em: 22 out. 2008.
ROZOV, Tatiana. Doenças pulmonares em pediatria: diagnóstico e tratamento.
São Paulo: Atheneu, 1999.
RUOTI, Richard G.; MORRIS, David M.; COLE, Andrew J. Reabilitação aquática.
São Paulo: Manole, 2000. 463 p.
SACCHELLI, Tatiana; ACCACIO, Letícia Maria Pires; RADL, André Luis Maierá.
Fisioterapia aquática. Barueri, SP: Manole, 2007. 350 p.
SANTANA, Maximiliano Eduardo Ferreira; PENASSO, Poliana. Repercussão de um
programa de hidrocinesioterapia aeróbica sistêmica na adaptação cardiorrespiratória
em pacientes portadores de fibrose cística. Trabalho de Conclusão de Curso.
Universidade de Franca, 2005.
SUZAN, Ana Beatriz B.M. Comparação entre a eficácia de dois aparelhos utilizados
na fisioterapia respiratória em pacientes com fibrose cística. Dissertação de
Mestrado. Faculdade de Ciências Médicas. Universidade Estadual de Campinas.
2006.
SKINNER, A.T.; THOMSON, A.M. DUFFIELD: Exercícios na água. São Paulo:
Manole, 1985.
Sociedade Brasileira de Pneumologia e Tisiologia. Diretrizes para Testes de Função
Pulmonar. J Pneumol. 2002; 28(3): 1-221.
Sociedade Brasileira de Pneumologia e Tisiologia (SBPT). Temas em revisão. Teste
77
de caminhada e do degrau. sbpt.org.br, dezembro de 2007.
STIVAL-ALAM, Adriana et al. Atuação primária da fisioterapia na fibrose cística
infantil. Fisioterapia em Movimento, Curitiba , v.7, n.2 , p.25-45, out./mar./1995.
TARANTINO, Affonso Berardinelli. Doenças pulmonares. 4 ed. Rio de Janeiro:
Guanabara Koogan, 1997.
TAVARES, Caroline Paggiaro, et al.. Influência Da Atividade Física Regular Pela
Prática De Voleibol e Handebol Na Força Muscular Respiratória De Atletas Jovens
Do Sexo Feminino. 6º Simposio de Ensino de Graduação, UNIMEP. Ciencia
Tecnologia e Sociedade. Set/Out/2008.
VELLOSO, M.; JARDIM, JR. Funcionalidade do paciente com doença pulmonar
obstrutiva crônica e técnicas de conservação de energia. J. Bras. Pneumol., São
Paulo, v. 32, n.6, dez. 2006.
VILLELA, Márcia Maria de; FABRIANI, Cristiana Barrozo; MAYWORM, Sandra H.
Aplicabilidade da oscilação de alta frequência (flutter) na desobstrução bronquica em
portadores de fibrose cística. Revista Fisio&Terapia, Rio de Janeiro , v.10,n.57 , p.
26-28, ago. 2007.
WEBER, Silke Anna Thereza; FERRARI, Giesela Fleischer. Incidência e evolução da
polipose nasal em crianças e adolescentes com fibrose cística. Rev. Bras.
Otorrinolaringol. , São Paulo, v. 74, n. 1, fev. 2008 . Disponível em:
<http://www.scielo.br. Acesso em: 17 nov. 2008.
ZADAI, Cynthia Coffin. Reabilitação do paciente com doença pulmonar obstrutiva
crônica. In: IRWIN, Scot.; TECKLIN, Jan Stephen. Fisioterapia cardiopulmonar. 1
ed. São Paulo: Manole, 1997.
ZANCHET, Renata Cláudia, et al.. Influência do método Reequilíbrio
toracoabdominal sobre a força muscular respiratória de pacientes com fibrose
cística. J Bras Pneumol. 2006;32(2):123-9.
ZIEGLER, Bruna et al. Capacidade submáxima de exercício em pacientes
adolescentes e adultos com fibrose cística. J Bras Pneumol. 2007;33(3):263-269.
78
APÊNDICES
79
APÊNDICE A – TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
80
81
APÊNDICE B – AUTORIZAÇÃO PARA A UTILIZAÇÃO DA PISCINA
TERAPÊUTICA
82
83
APÊNDICE C – AVALIAÇÃO FISIOTERAPÊUTICA RESPIRATÓRIA
84
UNIVERSIDADE DO EXTREMO SUL CATARINENSE – UNESC
CURSO DE FISIOTERAPIA
ROTEIRO DE AVALIAÇÃO FISIOTERAPÊUTICA RESPIRATÓRIA
Acadêmica:
Data:
1. Dados Pessoais:
Número Registro no Estudo:
Nome:
*Idade:
*Sexo: ( ) Masculino
*Raça: ( ) Branca
( ) Feminino
( ) Negra
( ) Asiática
*Data do nascimento:
*Localidade:
*UF:
*País:
*Profissão:
*Área:
*Escolaridade: ( ) Primário
*Estado Civil: ( ) Solteiro
( ) Secundário
( ) Casado
( ) Colegial/Técnico
( ) esquitado/Divorciado
( ) Universitário
( ) Viúvo
*Endereço: Rua/Av/Al:
Nº:
Bairro:
Cidade:
UF:
Cep:
Tel: ( )
2 Anamnese
2.1 História da Doença Atual:
*Quando foi diagnosticada a doença Fibrose Cística?
( ) criança
( ) adulto
Idade:
*O que levou a suspeitar de Fibrose Cística?
( ) Manifestações Respiratória
Quais:
( ) Manifestações Gastrintestinais
Quais:
( )Deficiência do ganho de peso e estrutura
( ) Suor salgado (“beijo salgado”)
( ) Manifestação hepatobiliar
Qual?
85
*Como foi realizado o diagnóstico:
( ) Achados fenotípicos: ( ) DPOC
( ) Ílio meconial ao nascimento
( ) Anormalidades gastrointestinais e nutricionais
( ) Síndromes perdedoras de sal
( ) Anormalidades urogenitais masculinas
( ) História familiar de Fibrose Cística
( ) Triagem neonatal (teste do pezinho)
( ) Exame laboratorial: disfunção da CFTR
( ) Teste de suor positivo
( ) Diferença de potencial nasal
( ) Identificação de duas mutações nos genes CFTR
2.2 Hábitos de vida:
Fumante: ( ) Sim
Quantidade:
cigarros/dia
Há quanto tempo:
mês(es)
( ) Não
Já fumou antes: ( ) Sim
Quantidade:
Período
/
cigarros/dia
/
Até
Há qto tempo parou:
/
/
mês(es)
( ) Não
Fumante passivo: ( ) Sim
( ) Não
Possui hábito de ingerir bebidas alcoólicas:
( ) Sim
( ) Não
Obs.:
Faz algum tipo de dieta alimentar:
( ) Sim
Qual tipo:
Há qto tempo?
mês(es).
Orientação: ( ) médica
( ) nutricionista
( ) própria
( ) Não
Faz atividade física:
( ) Inatividade física
( ) Atividade física leve
( ) 1 vez por semana
( ) outros
86
( ) Atividade física moderada
( ) 2 vezes por semana
( ) Atividade física intensa
( ) 3 vezes por semana
( ) Atividade física muito intensa
( ) + de 3 vezes por semana
Qual atividade? ( ) aeróbica
( ) musculação
( ) outros _____________
Obs:
2.3 Apresenta familiares com Fibrose Cística?
( ) Sim
Qual parentesco?
( ) Não
2.4 Apresenta outras doenças associadas?
( ) Sim
Quais?
( ) Não
Doenças pregressas?
( ) Sim Quais:
( ) Não
2.5 Já apresentou quadro de desidratação?
( ) Sim
Estação do ano:
( ) Não
2.6 Já apresentou infecção respiratória?
( ) Sim
Quantas vezes?
Qual bactéria?
No último ano, quantas vezes?
Última vez (data):
( ) Ainda apresenta
Qual bactéria?
( ) Não
2.7 Faz uso de medicamentos?
( ) Sim
Quais:
( ) Não
(
(
(
(
) S. aureus
) H. Influenzae
) P. aeruginosa
) Burkholderiacepacea
(
(
(
(
) S. aureus
) H. Influenzae
) P. aeruginosa
) Burkholderiacepacea
87
2.8 Outros tratamentos?
( ) Sim
( ) Fisioterapia respiratória
Quantas vezes/dia:
Local: ( )a domicílio (orientado)
( )a domicílio (fisioterapeuta)
( )em hospital (fisioterapeuta)
( )em clínica (fisioterapeuta)
Adesão:______________________________________________
( ) Oxigenoterapia
Obs.:
( ) Suporte nutricional
Obs.:
( ) não
2.9 Cirurgia?
( ) sim
Quais:
( ) não
3 Exame Físico:
Inspeção e Palpação:
FC:
StO2:
bpm. FR:
% PA:
cipm.
Altura
cm
Peso
mmHg
Pimáx:
Pemáx:
cm/H2O
cm/H2O
Peak-flow:
Ausculta Pulmonar:
Murmúrio Vesicular: ( ) Presente
( ) Diminuído
Ruídos adventícios: ( ) Sibilos
( ) Abolido
( ) Aumentado
( ) Roncos
( ) Estertores
Local:__________________________________________________________
Percussão:
Frêmito tóraco-vocal:
Cirtometria: Axilar:
Xifóide:
Abdominal:
Kg
88
3.1 Sinais e sintomas:
( ) Tosse
( ) produtiva
( ) seca
Freqüência:
Quantidade de secreção: ( ) pequena
( ) média
( ) grande
Característica da secreção: ( ) mucóide
( ) espumosa
( ) purulenta
( ) outros_____________________________
( ) Cianose
( ) central
( ) periférica
( ) Utiliza musculatura acessória
Grau:
( ) Apresenta tiragem
( ) supra-clavicular
( ) intercostais
( ) diafragmática
( ) sub-costal
( ) unilateral ( ) bilateral
( ) Baqueteamento digital
( ) Frenação labial
Respiração:
( ) nasal
( ) oral
( ) misto
Ritmo respiratório:
( ) eupnéia
( ) Taquipnéia
( ) Bradipnéia
Padrão Ventilatório:
( ) Abdominal
( ) Torácico
( ) Toracoabdominal
( ) Paradoxal
Dispnéia: ( ) repouso
( ) pequenos esforços
( ) médios esforços ( ) grandes esforços
Escala modificada de Borg (CAVALLAZZI, el tal., 2005).
Tipo de tórax:
( ) normal
( ) tonel
( ) Cifoescoliótico
( ) Pectus carinatum
( ) Escoliótico
Ângulo de Charp: ( ) Brevelíneo
( ) Longelíneo
Tipo de abdomem: ( ) Globoso
( ) Deprimido
( ) Pectus excavatum
( ) Cifótico
( ) Normolíneo
( ) Sem alterações
89
3.2 Exames complementares (data e laudo médico):
Espirometria:
Data:
Laudo: ( ) Distúrbio Ventilatório Obstrutivo
( ) Distúrbio Ventilatório Restritivo
Grau: ( ) leve ( ) moderado ( ) grave
VEF1 (%):
CVF:
VEF1/CVF:
FEF25-75%:
Radiografia do tórax: ( ) sim
( ) não
Data:
Laudo:
Tomografia Computadorizada do Tórax: ( ) sim
Data:
Laudo:
Outros exames:
4 Teste funcional:
Teste de caminhada de seis minutos (TC6):
Distância percorrida:
Borg de dispnéia:
SpO₂:
FC:
PA:
PF:
( ) não
90
APÊNDICE D – AVALIAÇÃO DE FISIOTERAPIA AQUÁTICA
91
ROTEIRO DE AVALIAÇÃO FISIOTERAPÊUTICA AQUÁTICA
(Adaptada de BARBOSA et al., 2006)
Data: ___/___/___
Avaliador:________________________________
Supervisão:________________________________________
DADOS PESSOAIS:
1. Nome:________________________________________________________
2. Sexo: ( ) F ( )M
3. Idade:
BIOTIPO DO PACIENTE:
4. ( ) Longilíneo 5. ( ) Brevilíneo
8. ( ) Atlético
6. ( ) Normolíneo
ATIVIDADES AQUÁTICAS PRÉVIAS:
Tipo: 9. ( ) Natação 10. ( ) Hidroginástica
12. ( ) Outras 13. ( ) Nenhuma
11. ( ) Hidroterapia
PRESENÇA DE CONTRA-INDICAÇÕES
Contra-indicações Absolutas:
14.( ) Fístulas cutâneas
15.(
16.( ) Micose cutânea
17.(
18.( ) Coronáriopatias instáveis
19.(
20.( ) Náusea ou vômito
21.(
22.( ) Muito debilitado
23.(
24.( ) Febre
25.(
26. ( ) Insuficiência respiratória grave 27.(
28. ( ) Nenhuma
29. (
30.( ) Câncer
) Feridas infectadas
) Otite
) Tuberculose
) HAS grave
) Infecção urinária
) Afecções agudas
) Queimaduras graves
) Úlceras varicosas
Contra-indicações Relativas:
31.( ) Hipersensibilidade aos produtos da piscina
33.( ) Alergia ao cloro
35.( ) Hipertireoidismo
37.( ) Perfuração de tímpano
39.( ) Patologias vasculares periféricas
41.( ) Epilepsia ou disfagia
DADOS VITAIS:
42. PA: _________________mmHg
44. Peso:________________
7. ( ) Obeso
32. (
34. (
36. (
38. (
40. (
) Imunodeficiência
) Hidrofobia
) Incontinência
) Uso de tala
) Nenhuma
43. FC:_______________ bpm
45. Altura:_____________
TIPO DE ENTRADA NA PISCINA:
46. ( ) Independente pela escada
47. ( ) Frontal pela borda sem apoio
48. ( ) Independente pelo degrau
49. ( ) Pela borda com rotação lateral
50. ( ) Frontal pela borda com apoio em axila
51. ( ) Elevador
92
52. ( ) Frontal pela borda com apoio parcial em cotovelo
53. ( ) Frontal pela borda com apoio em mão
54. ( ) Outras
ATITUDE DO PACIENTE NA ÁGUA:
Submerge:
55. ( ) Boca
56. ( ) Rosto
57. ( ) Total
58. ( ) Não submerge
Medo d’água:
59. ( ) Sim
60. ( ) Não
Expiração dentro d’água: 61. ( ) Boca
62. ( ) Nariz
63. ( ) Ambos
64. ( ) Não expira
TIPO DE DESLOCAMENTO:
Avaliar segundo Escala dos níveis de aprendizagem para habilidades motoras
funcionais (ISRAEL, 2000).
Graduação
5
4
3
2
1
Classificação
TA – totalmente alcançada
FSA – faz sem ajuda
CAP – com ajuda parcial (1 ou 2 apoios)
CAT – com ajuda total (mais de 2 apoios)
NF – não faz
FLUTUABILIDADE
TIPO
Prono
Supino
OBSERVAÇÃO
93
APÊNDICE E – PROTOCOLO DE TRATAMENTO EM AMBIENTE AQUÁTICO
94
ROTEIRO DO TRATAMENTO DE FISIOTERAPIA AQUÁTICA
(ADAPTADO DE SACCHELLI et al., 2007)
O protocolo de tratamento foi adaptado de Sacchelli et al. (2007), sendo
acrescentado o item: técnicas de desobstrução brônquica.
A aplicação do tratamento fisioterapêutico em ambiente aquático em um
paciente com fibrose cística objetiva principalmente a melhora da força muscular
inspiratória e da capacidade funcional do indivíduo, em um ambiente agradável que
propicie a aderência desses pacientes ao tratamento.
O protocolo será realizado por meio de técnicas de fisioterapia respiratória
e de exercícios para os membros superiores e inferiores e de tronco, além de
alongamento da musculatura envolvida na respiração. O programa de fisioterapia
aquática será realizado em piscina aquecida à 34ºC, com climatização do local à
25ºC, sendo utilizados os níveis dois e três da piscina.
As sessões de fisioterapia aquática contarão com progressão ao longo do
tratamento, por meio do aumento do tempo e ritmo de cada exercício e inclusão de
novos, sendo que a primeira fase irá compreender da primeira a sétima sessão e a
segunda fase será determinada da oitava até a décima quinta sessão. A segunda
fase foi determinada porque se considera que compreende a etapa intermediária do
tratamento com vistas a sua conclusão. Os exercícios serão realizados na
intensidade máxima do indivíduo, sendo que a progressão se dará de acordo com a
limitação do paciente.
No intervalo dos exercícios será orientado o paciente para a realização do
padrão ventilatório diafragmático e para que inspire pelo nariz e expire pela boca
com freno-labial, visando à melhora da mecânica diafragmática, fortalecimento da
musculatura inspiratória e aumento do tempo expiratório.
Os materiais utilizados na piscina serão clipe nasal, flutuadores,
caneleiras e halteres.
PRIMEIRA FASE
Sessões 1,2 e 3
Os exercícios das sessões 1,2 e 3 serão realizados no tempo de 30
segundos cada, com o mesmo tempo para o repouso entre um exercício e outro. Os
exercícios têm como objetivo a melhora da resistência física do paciente, visando à
melhora da sensação de dispnéia nas atividades diárias.
Adaptação e Aquecimento
Para a adaptação e aquecimento do paciente no ambiente aquático será
realizada uma caminhada durante cinco minutos, sendo que os joelhos deverão
estar semi-fletidos, os quadris encaixados e água no nível do processo xifóide. A
caminhada deverá ser de intensidade leve e passos largos, associada a movimentos
dos membros superiores de adução e abdução horizontal. A respiração solicitada
durante o exercício será a realização de inspiração nasal e expiração com frenolabial, assim como nos outros exercícios.
95
Aquecimento
Técnicas para desobstrução brônquica
Será realizada a manobra manual de compressão da caixa torácica, para
aumento do fluxo expiratório. O paciente ficará em ortostatismo, joelhos semiflexionados e quadril encaixado, com as costas apoiada na parede da piscina e com
água na altura do apêndice xifóide. O terapeuta se posicionará em frente ao
paciente e colocará suas mãos sobre o tórax do mesmo, no sentido das costelas,
exercendo uma pressão durante a fase expiratória para baixo e medialmente, para
acelerar o fluxo expiratório. A cada cinco manobras o paciente realiza respiração
diafragmática por 30 segundos e então as manobras são reiniciadas. Serão
realizadas quatro séries. Após o paciente será orientado a fazer o huffing para
eliminar as secreções, o qual consiste em uma expiração forçada com a glote aberta
(MACHADO, 2008).
Cinesioterapia
1- O paciente realizará abdução e adução de membros superiores (MMSS), sendo
que durante a abdução as palmas das mãos deverão ser mantidas em supino e na
adução em prono, visando o aumento da resistência ao movimento.
Abdução e adução de MMSS
2- O paciente fará exercício de flexão e extensão de joelhos alternadamente sentado
no tablado.
3- O paciente realizará flexão e extensão dos ombros, sendo que as palmas das
mãos deverão estar voltadas para cima durante a flexão e para baixo na extensão.
96
4- Realização de flexão e extensão de quadril com joelhos fletidos. Nesse exercício
o paciente fica agachado com água no nível dos ombros, segurando na barra e
fazendo elevação alternada dos joelhos.
5- O indivíduo fará flexão e extensão de cotovelos, sendo que durante a flexão as
palmas das mãos ficam voltadas para cima e na extensão para baixo.
6- Realização de movimentos de bicicleta no nível três da piscina, com auxílio de
flutuadores por 5 minutos.
Movimento de bicicleta com flutuador
7- Será realizada a rotação de tronco, na qual o paciente ficará em pé, com os
joelhos semi-flexionados, quadril encaixado e água na altura do apêndice xifóide. O
paciente flexionará os ombros a 90º com os cotovelos estendidos, segurando um
espaguete e realizará a rotação de tronco para ambos os lados.
Rotação de tronco
8- No final, para desaquecimento o paciente fará uma caminhada pela piscina por 3
minutos, com passadas normais e lentas.
Relaxamento (7 minutos)
1- Ao final dos exercícios serão realizados os alongamentos de trapézio e
esternocleidomastóideo. O paciente será posicionado em supino, com espaguete
disposto na região poplítea e na região da 12ª vértebra torácica. O alongamento será
mantido por 30 segundos de ambos os lados. Para o alongamento de trapézio, o
terapeuta realizará apoio na região occipital e no ombro, separando lentamente
estes dois pontos, promovendo o deslizamento das fáscias. Já no alongamento do
esternocleidomastóideo, o terapeuta realiza pressão na origem e na inserção desse
músculo e faz uma leve rotação da cervical, proporcionando alongamento da
musculatura. Após, será realizado alongamento da musculatura lateral do tronco.
97
Alongamento de trapézio
Alongamento de esternocleidomastóideo
Alongamento de tronco lateral
2- Em seguida, será realizada a pompage respiratória com o paciente na mesma
posição do exercício anterior. O terapeuta posicionará uma das mãos sob a região
occipital e outra sobre o esterno, a primeira irá tracionar a cervical durante a
inspiração e, ao final dessa, a mão sobre o esterno fornecerá um estímulo no
processo xifóide com a última falange do terceiro dedo, marcando o final da
inspiração e o começo da expiração, a qual será realizada com auxílio da
compressão sobre o esterno.
Pompage respiratória
98
3- Na seqüência, paciente na mesma posição, o terapeuta realizará apoio na região
occipital e promoverá movimentos de inclinação lateral de pescoço, fazendo com
que o indivíduo deslize pela água.
Deslizamento pela água
4- Para finalizar a sessão o paciente em ortostase, com os joelhos semi-flexionados
e água na altura do apêndice xifóide realizará padrão ventilatório diafragmático,
inspirando pelo nariz e expirando pela boca lentamente por 1 minuto.
Sessões 4, 5, 6 e 7
O aquecimento e os relaxamentos continuam os mesmos da primeira
fase. O tempo de cada exercício e o tempo de intervalo entre um e outro continua de
30 segundos cada. Nessas sessões (4, 5, 6 e 7) serão mantidos os exercícios das
sessões anteriores e acrescentados os exercícios a seguir.
1- Será incluído exercício respiratório com o paciente imergindo e expirando
embaixo da água fazendo bolhas. Antes de iniciar era colocado o clipe nasal.
Preparação para a imersão
2- O indivíduo realizará abdução e adução horizontal de membros superiores, sendo
que na abdução as palmas das mãos deverão estar voltadas para fora, no sentido
do movimento, e na adução para dentro.
2- Realização de abdução e adução de membros inferiores (MMII) no nível três da
piscina com auxílio de flutuadores.
99
Abdução e adução de MMII
3- O paciente, agachado na piscina, realizará flexão e extensão de quadril colocando
uma perna na parede de cada vez, enquanto a outra se mantém no chão.
SEGUNDA FASE
Sessões 8, 9 e 10
O aquecimento e os relaxamentos continuam os mesmos da primeira
fase. As sessões 8,9 e 10 consistem dos mesmos exercícios anteriores, porém será
progredido o tempo para 1 minuto para cada exercício e para o repouso entre um
exercício e outro.
1- Será incluído o exercício de abdominal, que será realizado com o paciente no
canto da piscina, apoiado no corrimão, fazendo movimento de flexão e extensão do
quadril com os joelhos flexionados.
Abdominal
2- O exercício de flexão e extensão do quadril com o paciente sentado terá
acrescimento de resistência com caneleira de 1Kg.
3.2 Sessões 11, 12, 13 e 14
Essas serão as últimas sessões, onde os exercícios serão mantidos e
realizados no mesmo tempo, porém serão feitas adaptações de alguns exercícios,
citadas abaixo.
1- O paciente passará a realizar o exercício para quadríceps com flexão e extensão
do joelho e quadril em ortostase, no momento da extensão do joelho e quadril
100
deverá empurrar o espaguete para baixo com o pé, dando maior resistência ao
exercício. O paciente fará a expiração ao fazer o esforço contra o espaguete e irá
inspirar na volta do movimento.
Exercício para o quadríceps
2- No exercício de adução e abdução horizontal de ombro fazer uso de pesinhos
para aumentar a resistência.
3- Realizar o exercício de flexão e extensão de cotovelo com o ombro em abdução
de 90º e em rotação neutra, com utilização de pesinhos.
Exercício de flexão e extensão de cotovelo
101
ANEXOS
102
ANEXO A – APROVAÇÃO DO COMITÊ DE ÉTICA E PESQUISA
103
104
ANEXO B – VALIDAÇÕES DO INSTRUMENTO DE PESQUISA
105
106
107
108
ANEXO C – FICHA PARA REGISTRO DO TESTE DE CAMINHADA
109