UNIÃO EDUCACIONAL DO PLANALTO CENTRAL
FACULDADES INTEGRADAS DA UNIÃO EDUCACIONAL DO PLANALTO CENTRAL
Aprovadas pela Portaria SESu/MEC Nº 368/2008 de 19/05/2008 (DOU 20/05/2008)
Profa. Dra. Lízia Lenza Campos
Aula Prática 2
Preparações Microscópicas a Fresco e Fixada
I. INTRODUÇÃO
Preparações microscópicas compreendem técnicas
onde espécimes microbianos são colocados sobre
lâminas, possibilitando a observação ao
microscópio. Duas técnicas gerais permitem a
obtenção de material adequado para o exame
microscópico. Uma é a suspensão de
microrganismos em meio líquido onde podem ser
examinados vivos, com o auxílio ou não de
corantes vitais; na outra as células microbianas
são fixadas pelo calor e corados com corantes
químicos específicos. A visualização microscópica
a fresco dos micro-organismos é difícil devido ao
seu reduzido tamanho e índice de refração que se
aproxima ao da água o que os torna praticamente
incolores quando suspensos em meio aquoso.
Apesar da dificuldade de visualização, as
preparações microscópicas a fresco são úteis para
observar viabilidade e atividades celulares como
motilidade e fissão binária, e também observar o
tamanho e a forma natural das células
microbianas, pois as preparações fixadas que
utilizam o calor e a exposição a substâncias
químicas durante a coloração provocam distorções
na morfologia das células. Nesta prática serão
preparadas lâminas a fresco de amostras, contendo
grupos distintos de micro-organismos, tais como
bactérias, algas, protozoários e leveduras. Onde,
poderemos observar a grande diversidade das
células microbianas no tamanho e na forma, bem
como verificar a ocorrência ou não de motilidade.
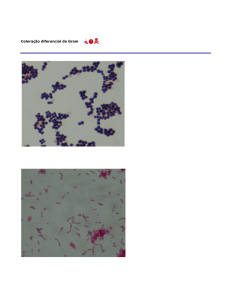
Nas preparações fixadas, o método de GRAM é
o mais utilizado. A coloração de Gram é a
técnica de coloração diferencial mais importante
e utilizada em bacteriologia. As bactérias coradas
por esta técnica pertencem a duas categorias
distintas: Gram-positivas e Gram-negativas. A
diferença básica entre os dois grupos é resultado
da estrutura de suas paredes celulares.
OBJETIVOS:
Preparar lâminas a fresco para observação microscópica de algumas amostras de bactérias, leveduras,
protozoários
Familiarizar os alunos com a técnica de coloração diferencial usando como exemplo a coloração
proposta por Christian Gram;
Focalizar as preparações;
Utilizar óleo de imersão;
Esquematizar as morfologias celulares observadas.
I.
MATERIAIS:
- Microscópios binoculares; Bateria de corantes para coloração de GRAM: Lugol; Cristal
violeta; etanol; fucsina; picetas com água; óleo de imersão; bico de bunsen; Alça de platina;
Descarte de lâminas; material isolado pelos estudantes na aula anterior.
Suspensão de bactérias: E. coli e S.aureus.
Leveduras de fermento de pão em suspensão aquosa, amostras de água estagnada (pode pegar
do curral).
-
Solução de azul de metileno
lâminas, lamínulas e pipetas Pasteur.
II. A - PROCEDIMENTO PARA COLORAÇAO A FRESCO
1. Colocar sobre a lâmina limpa uma gota do material a examinar. Ao observar leveduras colocar antes, sobre a
lâmina, uma gota de azul de metileno (corante vital) e depois uma gota da suspensão de leveduras para
evitar a contaminação do corante com o micro-organismo!
2. Encostando um dos bordos da lamínula na gota
de ar entre a lâmina e lamínula.
deixe-a descer suavemente para evitar a formação de bolhas
3. Focalize conforme procedimento descrito no item
microscópio ótico.
abaixo : Observação de micro-organismos ao
4. Procure campos onde os organismos exibem motilidade, utilizando os parafusos do “charriot”.
5. Observe as diferenças entre os microrganismos focalizados e desenhe-os, considerando tamanho, forma e
coloração.
6. Após a observação descarte a lâmina e lamínula nas bandejas com detergente e desinfetante colocadas na
bancada lateral .
7. Terminada a observação, desligue a luz; gire o revólver para encaixar a objetiva de menor aumento, passando
pela objetiva de 10x; abaixe a platina e retire a lâmina.
Observação de microrganismos ao microscópio ótico
1. Destrave o microscópio, movimentando a TRAVA;
2. Gire o REVÓLVER, encaixando a OBJETIVA de menor aumento (4x);
3. Coloque a lâmina sobre a PLATINA e prenda-a com a presilha (certifique-se de que a lâmina esteja bem
encaixada);
4. Acenda a luz do microscópio;
5. Regule a quantidade de luz com o DIAFRAGMA e abaixando o CONDENSADOR. (Para organismos mais
transparentes diminua a luminosidade regulando a abertura do diafragma e abaixando o condensador);
6. Levante a platina, movimentando o MACROMÉTRICO e o MICROMÉTRICO até o seu ponto máximo;
7. Olhando pela ocular e utilizando o parafuso macrométrico, abaixe lentamente a platina até que o material a
ser observado
possa ser visualizado. Corrigir a
focalização, utilizando somente o parafuso
MICROMÉTRICO;
8. Encaixe a objetiva de 10x e faça o ajuste da focalização com o micrométrico;
9. Observe o material, selecione uma determinada área, e encaixe a objetiva de 40x.
10. Trave o microscópio e ajuste a focalização sempre com o parafuso micrométrico.
ATENÇÃO: Não levante a platina do microscópio (movimentando o macrométrico para frente) com a
objetiva de maior aumento encaixada!!
II.
B- PROCEDIMENTO EXPERIMENTAL PARA GRAM:
a) Com o auxílio de uma alça de platina esterilizada retirar uma gota de suspensão bacteriana;
b) Preparar um esfregaço homogêneo e delgado sobre uma lâmina;
c) Esperar secar e fixar com o calor passando a lâmina, com o lado do esfregaço virado para cima, três
vezes sobre a chama da lamparina;
d) Cobrir
o
esfregaço
com
corante
cristal
e) violeta por 1 minuto;
f) Escorrer o corante e cobrir com solução fixadora lugol por 1 minuto;
g) Escorrer o lugol e lavar com água destilada;
h) Lavar rapidamente com o agente diferenciador etanol (10-15 segundos) e em seguida com água
destilada
i) Cobrir o esfregaço com solulção corante fucsina de Ziehl 1:10 ou safranina por 30 segundos;
j) Lavar com água destilada e secar suavemente com papel higiênico;
k) Observar ao microscópio com aumento de 10, 40 e 100X. Não esquecer de aplicar o óleo de
imersão quando for usar a lente de 100X.
III.
EXERCÍCIOS
a) Qual o princípio da técnica de coloração de gram? Qual o objetivo desta técnica.
b) Qual o motivo para que as bactérias gram negativas tornem-se vermelhas e as gram positivas
tornem-se roxas?
c) Desenhe a morfologia das bactérias visualizadas especificando a cor assumida por elas.
d) Compare as paredes celulares das bactérias Gram-positivas e Gram-negativas.
e) Por que algumas células de levedura se colorem de azul e outras permanecem incolores quando
utilizamos o corante vital azul de metileno?
f) Quais são as vantagens e desvantagens da observação de lâminas em preparações a fresco?
IV. REFERÊNCIAS BIBLIOGRÁFICAS
1. NEDER, R.N. Microbiologia: manual de laboratório. São Paulo. Nobel. 1992. 138p.
2. PELCZAR, M., REID, R., CHAN, E.C.S. Microbiologia. São Paulo. Mc Graw-Hill do Brasil, 1980,
v.1. 566p.
V. RESULTADOS
Nome:.....................................................................Nº Matrícula......................Turma.............
Preparações à fresco: Desenhe os campos observados fazendo distinção entre as diversas amostras de
microrganismo, com relação à forma, tamanho, e motilidade.
Leveduras
Água de alface
(bactérias)
Identificação da célula
Aumento
Água de alface
(protozoário)
Exibe Motilidade?
GRAM
VIII. Normas de Segurança
Use calçados fechados, não use saias ou bermudas. Pessoas que tenham cabelos
longos devem mante-los presos enquanto estiverem no laboratório.
Usar jaleco de manga longa, luvas e óculo de proteção;
Não fume, coma ou beba nos laboratório;
Não retorne reagentes aos frascos originais, mesmo que não tenham sido usados. Evite
circular com eles pelo laboratório
Não use nenhum equipamento em que não tenha sido treinado ou autorizado a utilizar.
Caminhe com atenção e nunca corra no laboratório;
Não leve a mão à boca ou aos olhos quando estiver manuseando produtos químicos;
Objetos pessoais como bolsas, blusas, e outros, não devem ser guardados em cima das
bancadas;
Brincadeiras são absolutamente proibidas nos laboratórios;
As substâncias inflamáveis devem ser manipuladas em locais distantes de fontes de
aquecimentos;
Dedique especial atenção a qualquer operação que necessite aquecimento prolongado
ou que desenvolva grande quantidade de energia.
Siga corretamente o roteiro de aula e não improvise, pois improvisações podem causar
acidentes, use sempre materiais e equipamentos adequados.
Em caso de acidentes, mantenha a calma e chame o professor ou técnico responsável;
Não há palavras e nem frases que possam nos manter seguros, há somente
ações.