Química em Solventes não Aquosos
Prof. Fernando R. Xavier
UDESC 2013
Reações químicas podem acontecer em cada uma das fases ordinárias da
matéria (gasosa, líquida ou sólida).
Exemplos:
Grande parte das reações químicas ocorrem em solução aquosa, porém a
água, mesmo possuindo propriedades incríveis, não é o único solvente a
disposição dos químicos.
Em química orgânica, uma grande variedade
de solventes orgânicos polares e não-polares
são comumente empregados no dia a dia do
laboratório.
Ex.:
Hidrocarbonetos,
álcoois,
éteres, nitrilas, etc...
Já em química inorgânica, além dos solventes orgânicos, é comum a
utilização de solventes inorgânicos tais como NH3(l), H2SO4, SO2(l), CO2(l),
dentre outros.
Pontos importantes na escolha de um solvente devem ser verificados tais
como pontos de fusão e ebulição, constante dielétrica e sua polaridade.
Quanto maior o valor da constante dielétrica (D) de um solvente, maior seu
poder de solvatação.
Exemplos:
P.E. (oC)
D
d (g mL-1)
Hexano
69
1,9
0,655
0,0 D*
Éter etílico
35
4,3
0,713
1,15 D
Acetona
56
21
0,786
2,88 D
Etanol
79
24,6
0,789
1,69 D
Água
100
80
1,000
1,85 D
Solvente
*D = Debye
Fórmula
𝝁
Exemplo prático:
Como a água possui uma alta constante dielétrica (D = 80), ao
dissolvermos NaCl neste solvente para dar origem aos íons solvatados
Na+(aq) e Cl-(aq), a respectivas forças eletrostáticas entre cátion-ânion são
reduzidas a cerca de 1% se comparado a atração na ausência de solvente.
Amônia (NH3)
•
É um dos meios não-aquosos inorgânicos mais estudados, e, suas propriedades
como solvente são similares às da água (exceto para o valor de D = 22,7). DNH3 <<
DH2O
•
A amônia é menos polar que a água, logo, não possui a capacidade de solubilizar
compostos de caráter iônico elevado. Entretanto, é capaz de solubilizar compostos
de polaridade mais baixa (ex.: íons I- e SCN-).
Tabela comparativa das propriedades fisico-químicas da água e amônia
H2O
NH3
P. Ebulição
100 0C
-33,4 0C
P. Fusão
0 oC
-77,7 oC
Densidade
1,00 g mL-1 (4 oC)
0,68 g mL-1 (-33 oC)
Cte. Dielétrica
81,7 ε0 (18 oC)
22,7 ε0 (-50 oC)
Cond. Esp.
4 × 10-8 (18 oC)
1 × 10-11 (18 oC)
Viscosidade
1,01 cp (20 oC)
0,254 cp (-33 oC)
Reações químicas em Amônia
Reações de precipitação:
Em água temos:
Em amônia temos:
•
Como o AgCl é um composto menos polar que o KCl, em amônia, este será
solubilizado e o KCl irá precipitar por não haver intereções adequadas entre soluto
e solvente.
Reações de neutralização:
Para relembrar - Reação de auto-hidrólise da água:
•
Qualquer substância que é capaz de aumentar a concentração de H3O+ em água é
considerado um ácido e, qualquer substância que é capaz de aumentar a
concentração de OH- em água é considerada uma base;
Para a auto-hidrólise da amônia temos:
•
Qualquer substância que é capaz de aumentar a concentração de NH4+ em amônia
é considerado um ácido, e, qualquer substância que é capaz de aumentar a
concentração de NH2- em amônia é considerada uma base;
Reações de neutralização:
Exemplo 1: Adição de HCl ou NaOH em água.
ácido
base
Exemplo 2: Adição de NH4I ou KNH2 em amônia.
ácido
base
Reações de neutralização:
Exemplo 3: Reação de neutralização em amônia entre NH4I (ácido) e KNH2 (base).
•
Como qualquer outra reação ácido-base, o iodeto de amônio (ácido) reage com o
amideto de potássio (base) para formar iodeto de potássio (sal) e amônia, que o
solvente em questão.
•
Ácidos considerados tipicamente fracos em meio aquoso (Ka < 1,0 × 10-2)
comportam-se como ácidos fortes reagindo completamente com a amônia
(solvente).
Considerando o meio aquoso, qual é o ácido mais forte entre HCl, H2SO4 e HClO4?
Resposta: Nenhum! Todos possuem exatamente a mesma força!
•
Como todos se dissociam completamente forçando a protonação do solvente
(água) para gerar a espécie H3O+ a água nivela a força ácida dos ácidos em
questão.
•
Ácido acético: ácido fraco
Nivelamento da força ácida pelo solvente (amônia)
•
Como todas as reações indicam um aumento da concentração de íons NH4+
todos são considerados ácidos (protonação do solvente) para gerar a espécie NH4+.
Mesma força ácida
•
Moléculas que, normalmente, não apresentam caráter ácido em água podem
comportar-se como tal em amônia.
•
Em linhas gerais, a amônia nivela quaisquer substâncias com tendências
ácidas e aumenta significativamente a acidez de moléculas de baixa acidez.
Muitas bases consideras fortes em água são consideradas fracas ou insolúveis em
amônia.
•
Bases extremamente fortes em amônia são niveladas pelo íon amideto (NH2-).
Ácido Sulfúrico (H2SO4)
•
Sua principal característica como solvente não-aquoso é o valor de sua constante
dielétrica (DH2SO4 > DH2O), logo, pode dissolver compostos extremamente polares
(compostos iônicos).
•
Como ponto negetivo vale destacar sua alta viscosidade (25 maior que a água).
Tabela comparativa entre as propriedades fisico-químicas da água e ácido sulfúrico
H2O
H2SO4
P. Ebulição
100 0C
300 0C (decomp.)
P. Fusão
0 oC
10,4 oC
Densidade
1,00 g mL-1 (4 oC)
1,83 g mL-1 (25 oC)
Cte. Dielétrica
81,7 ε0 (18 oC)
110 ε0 (20 oC)
Cond. Esp.
4 × 10-8 (18 oC)
1 × 10-2 (25 oC)
Viscosidade
1,01 cp (20 oC)
24,54 cp
Para a auto-hidrólise do ácido sulfúrico temos:
•
A espécie H3SO4+ é indicativo da formação de um próton solvatado
(extremamente ácido). O ânion HSO4- é considerado uma base, pois pode aceitar
prótons.
•
Qualquer substância que é capaz de aumentar a concentração de H3SO4+ em
ácido sulfúrico é considerado um ácido, e, qualquer substância que é capaz de
aumentar a concentração de HSO4- em ácido sulfúrico é considerada uma base;
Exemplo 4: Adição qualquer substância mais ácida que o solvente (ácido sulfúrico)
irá protoná-lo e aumentar a concentração de íons H3SO4+.
ácidos
•
Podemos avaliar se uma espécie química pode protonar outra em função de seus
valores de pKa. Assim: Se o pKa do ácido sulfúrico (solvente) é -3,5, qualquer
substância com pKa mais baixo que este será considerada ácida (ácido
trifluorometanosilfônico, por exemplo pKa = -14). Por outro lado, qualquer
substância de pKa maior que -3,5 será considerada uma base e será protonada
pelo ácido sulfúrico.
base
pKa (água) = 15,7
Tabela de pKa de algumas subtâncias
Exercício 1: Considerando o ácido fosfórico como um solvente, indique uma
substância que terá um comportamento ácido e um com comportamento básico
neste solvente.
Exemplo 5: O KHSO4 é considerado uma base forte em H2SO4 puro, pois aumenta a
concentração de íons HSO4- em solução.
base
Exemplo 6: Substâncias que são básicas em água serão básicas em H2SO4.
base
Exercício 2: Considerando os ácidos acético e nítrico e seus respectivos valores de
pKa (tabela anterior), estes são considerados em meio aquoso, ácidos fraco e forte,
respectivamente. Quais serão seus comportamentos se o solvente for ácido sulfúrico
ao invés de água?
•
Poucas substâncias se comportam com ácidos fortes quando o solvente é o ácido
sulfúrico. Uma delas é o ácido tetrakis(hidrogenosulfato)bórico – HB(HSO4)4.
Esta substância pode ser preparada através do seguinte processo e, é estável apenas
em solução:
•
Substâncias que apresentam caráter fortemente ácido em meios também
fortemente ácidos são denominadas superácidos e são considerados fortes
agentes protonantes.
•
Compostos a base de flúor e antimônio são típicos superácidos.
Os superácidos
•
Podem ser definidos como todo e qualquer composto que seja capaz de protonar o
ácido sulfúrico concentrado. São tipicamente líquidos viscosos e corrosivos
podendo ser 1018 vezes mais ácidos que o H2SO4.
•
Podem ser sintetizados quando, em quantidades equimolares, são unidos um
poderoso ácido de Lewis e um poderoso ácido de Brønsted.
Exemplos: União entre o pentafluoreto de antimônio (SbF5, ácido de Lewis potente) e
os ácidos fluorídrico anidro (HF) ou fluorossulfônico (HSO3F), potentes ácidos de
Brønsted.
O ácido mágico de Olah (Nobel em química 1994)
•
Formado a partir de uma mistura equimolar entre o HSO3F e SbF5 em condições
anidras. Seu poder protonante é tão poderoso que esta mistura é capaz de protonar
até
mesmo
hidrocarbonetos
quimicamente inertes.
(ex.
parafinas),
substâncias
consideradas
•
O superácido mais forte conhecido até o momento é a mistura entre HF anidro e o
pentafluoreto de antimônio (SbF5).
•
Devido a sua base conjugada SbF6- ser extremamente fraca sua interação com o
íon H+ é extremamente débil. Por outro lado o HF2+ é extremamente instável e
assim o próton fica praticamente isolado “H+”. Esta mistura é cerca de 1016 mais
ácida que o H2SO4.
As superbases
•
São aceptores de prótons mais eficientes que o OH-.
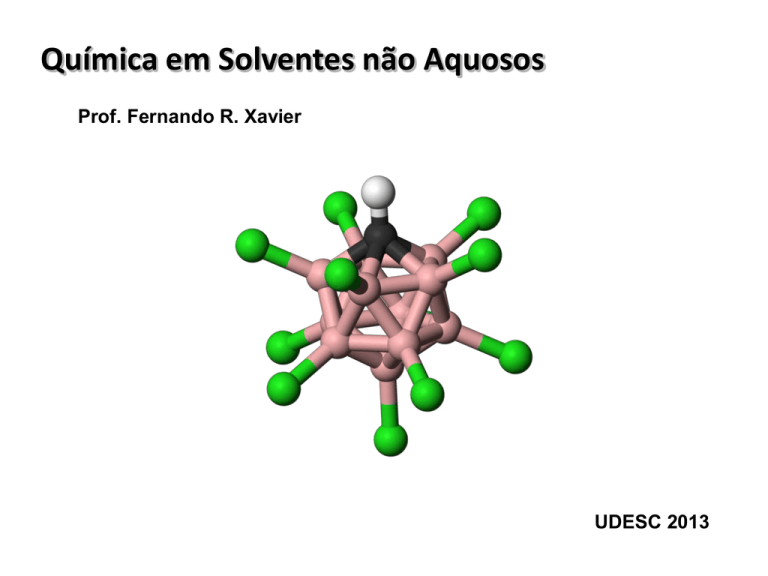
O carborano superácido
•
É super ácido inorgânico onde uma gaiola de átomos
de boro tem um de seus átomos substituído por um
carbono. Todos os demais átomos de boro estão
ligados a átomos de cloro formando a espécie
H(CHB11Cl11).
•
Este composto é 106 vezes mais ácido que o ácido sulfúrico concentrado e anidro,
porém, não possui características corrosivas.
•
É a única substância capaz de protonar o fulereno C60.
Solventes não-próticos
•
Tem como principal característica a ausência de prótons a serem transferidos, ou
seja, não sofrem protonação ou desprotonação.
•
São classificados em 03 (três grandes grupos):
Não-polares (não solvatam íons);
Altamente polares, porém não ionizantes;
Altamente polares e auto ionizantes;
Hexano
DMF
Solventes não-polares
•
O uso de solventes não-polares se torna útil quando tem-se a necessidade de que
o solvente não interaja de maneira forte com o soluto em questão.
Exemplos: Hidrocarbonetos em geral, CCl4, etc...
Sódio metálico
Potássio metálico
Solventes polares não-ionizantes
•
Acetonitrila (ACN), dimetilformamida (DMF), dimetilsulfóxido (DMSO) e dióxido de
enxofre (SO2) são bons exemplos desta classe. Estes solventes são raramente
ionizados (auto-protólise) e normalmente atuam como boas bases de Lewis.
Exemplos: Formação de complexos.
Solventes polares ionizantes
•
Nesta terceira classe, os solventes são altamente reativos, podendo reagir com
vidro (silica), eletrodos e ainda dissolver ouro ou platina.
As reações possuem subprodutos...
•
Sais que contenham fluoretos (F-) pode transferir este ânion para o BrF3 e gerar
soluções condutoras.