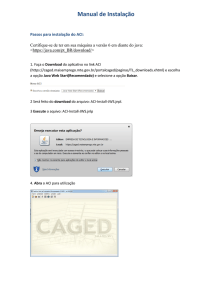
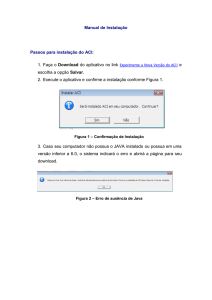
GUILHERME BRASILEIRO DE AGUIAR
TRATAMENTO ENDOVASCULAR DAS LESÕES
VASCULARES CAROTIDOCAVERNOSAS
Dissertação apresentada ao Curso de PósGraduação da Faculdade de Ciências
Médicas da Santa Casa de São Paulo para
obtenção do título de Mestre em Pesquisa em
Cirurgia.
São Paulo
2013
GUILHERME BRASILEIRO DE AGUIAR
TRATAMENTO ENDOVASCULAR DAS LESÕES
VASCULARES CAROTIDOCAVERNOSAS
Dissertação apresentada ao Curso de PósGraduação da Faculdade de Ciências
Médicas da Santa Casa de São Paulo para
obtenção do título de Mestre em Pesquisa em
Cirurgia.
Área de Concentração: Reparação Tecidual
Orientador:
Prof. Dr. José Carlos Esteves Veiga
Coorientador:
Prof. Dr. Mario Luiz Marques Conti
São Paulo
2013
FICHA CATALOGRÁFICA
Preparada pela Biblioteca Central da
Faculdade de Ciências Médicas da Santa Casa de São Paulo
Aguiar, Guilherme Brasileiro de
Tratamento endovascular das lesões vasculares
carotidocavernosas./ Guilherme Brasileiro de Aguiar. São Paulo, 2013.
Dissertação de Mestrado. Faculdade de Ciências Médicas da
Santa Casa de São Paulo – Curso de Pós-Graduação em Pesquisa
em Cirurgia.
Área de Concentração: Reparação Tecidual
Orientador: José Carlos Esteves Veiga
Coorientador: Mário Luiz Marques Conti
1. Fístula carotídeo-cavernosa/terapia 2. Embolização terapêutica
3. Lesões das artérias carótidas
BC-FCMSCSP/61-13
DEDICATÓRIA
A meus pais, Ivo e Isalita,
pelo amor incondicional que me proporcionou as condições
para meu desenvolvimento pessoal e profissional.
Dedicatória
AGRADECIMENTOS
À Irmandade da Santa Casa de Misericórdia de São Paulo e à Faculdade de
Ciências Médicas da Santa Casa de São Paulo, pela oportunidade do
desenvolvimento profissional, científico e acadêmico.
À CAPES, pela bolsa concedida durante a realização deste projeto.
Ao Prof. Dr. José Carlos Esteves Veiga, Professor Livre-Docente da Faculdade de
Ciências Médicas da Santa Casa de São Paulo e Chefe da Disciplina de
Neurocirurgia da Irmandade da Santa Casa de Misericórdia de São Paulo,
Orientador desta Dissertação, pela confiança, oportunidade e incentivo que foram
fundamentais para o desenvolvimento deste projeto. Seu exemplo e dedicação
estimulam todos a sua volta; minha admiração, respeito e gratidão!
Ao Prof. Dr. Mario Luiz Marques Conti, Professor Assistente da Faculdade de Ciências
Médicas da Santa Casa de São Paulo, Coorientador desta dissertação, meu mentor
e responsável por minha formação na área de Neurorradiologia Intervencionista,
pela paciência, constante incentivo e ensinamento ao longo desses anos. Sem sua
ajuda, nada disso seria possível. Esta conquista também é sua!
Ao Dr. João Miguel de Almeida Silva e ao Dr. Rodrigo Becco de Souza, Residentes
da Disciplina de Neurocirurgia da Irmandade da Santa Casa de Misericórdia de São
Paulo, pelo incansável apoio e companheirismo, pelo incentivo e ajuda na
elaboração desta dissertação.
Ao Dr. Alexandre Bossi Todeschini, Residente da Disciplina de Neurocirurgia da
Irmandade da Santa Casa de Misericórdia de São Paulo, pela ajuda na elaboração
da parte gráfica deste trabalho.
Ao Prof. Dr. Marcus André Acioly, ao Dr. Edgar Manuel Garcete Fariña e ao Dr.
Samuel Robson Moreira Rêgo, grandes amigos, pelo exemplo e companheirismo ao
longo dos anos.
Agradecimentos
Ao Dr. Maurício Jory, pelos ensinamentos transmitidos ao longo desses anos que
foram fundamentais para a elaboração deste trabalho.
Ao Dr. Juan Antonio Castro Flores, pela colaboração com imagens para esta
dissertação.
Aos Dr. Sérgio Guerrero, ao Dr. Marcos Fortunato e ao Dr. Ricardo Rezende, amigos
e colegas de trabalho, pelo apoio e prestatividade.
Ao Dr. Eduardo André Goulart de Alcântara e ao Dr. Daniel Gomes Gonçalves Neto,
Estagiários do Serviço de Neurocirurgia Endovascular da Irmandade da Santa Casa
de Misericórdia de São Paulo, pelos cuidados com os pacientes envolvidos no
presente projeto.
Ao Dr. Lidiomar Lemos de Magalhães Filho, Anestesista da Irmandade da Santa
Casa de Misericórdia de São Paulo, pela participação na condução da maioria dos
casos envolvidos neste projeto.
Aos Residentes da Disciplina de Neurocirurgia da Irmandade da Santa Casa de
Misericórdia de São Paulo, pelo apoio e pela ajuda no acompanhamento dos
pacientes envolvidos neste projeto.
Aos Professores e Médicos do Serviço de Neurocirurgia HUPE-UERJ, em especial ao
Prof. Dr. Carlos Telles, Dr. Alexandre Martins Cunha, Dr. Elington Lannes Simões, Dra.
Maud Parise, Dr. Flávio Nigri, Dr. José Ricardo Pinto, Prof. Henrique Goldberg, Prof.
Eduardo de Faria Góes, pelos ensinamentos e pelo empenho na minha formação
neurocirúrgica e incentivo constante ao meu aprimoramento profissional.
Aos membros da Secretaria da Pós-Graduação da Faculdade de Ciências Médicas
da Santa Casa de São Paulo, em especial ao Sr. Daniel Gomes, pelas orientações,
auxílio e esclarecimentos ao longo desta jornada.
A Dário Vaz Bacelar da Silva, pela inestimável contribuição na elaboração das
figuras dessa dissertação.
Agradecimentos
A meus pais, Ivo e Isalita, e a meu irmão e cunhada, João Marcelo e Érika, pelo
amor, companheirismo e compreensão de toda vida. A Anna Maria e Marianna,
pela força que me proporcionam a cada novo sorriso.
A Deus, que me permitiu realizar o sonho de ter esse trabalho concluído.
Agradecimentos
“Não é o fim, nem o começo do fim. É apenas o fim do começo”.
(Winston Churchill)
“Quem não sabe o que busca, não identifica o que acha”.
(Immanuel Kant)
“Experiência é o nome que cada indivíduo dá a seus próprios erros”.
(Oscar Wilde)
Citação
ABREVIATURAS E SÍMBOLOS
ACE – Artéria carótida externa
ACI – Artéria carótida interna
ACIc – Artéria carótida interna cavernosa
AGC – Angiografia cerebral
AIC – Aneurisma intracavernoso
DM – Dura-máter
EPDC – Espiras de platina com destaque controlado
F – French
FCC – Fístula carotidocavernosa
FCCd – Fístula carotidocavernosa direta
HSAe – Hemorragia subaracnóidea espontânea
NC – Nervo craniano
RM – Ressonância magnética
SC – Seio cavernoso
SPI – Seio petroso inferior
ST – Sela turca
TC – Tomografia computadorizada
TCE – Traumatismos cranioencefálicos
VOI – Veia oftálmica inferior
VOS – Veia oftálmica superior
Abreviaturas e Símbolos
SUMÁRIO
1 – INTRODUÇÃO ...............................................................................................
1
1.1– Revisão da literatura ................................................................................
3
1.1.1 – Histórico ...........................................................................................
3
1.1.2 – Anatomia do seio cavernoso e da artéria carótida interna
cavernosa .......................................................................................
5
1.1.3 – Fístulas carotidocavernosas diretas ................................................
10
1.1.3.1 – Epidemiologia ...........................................................................
11
1.1.3.2 – Apresentação clínica ................................................................
12
1.1.3.3 – Diagnóstico ...............................................................................
15
1.1.3.4 – Tratamento ...............................................................................
18
1.1.4 – Aneurismas Intracavernosos ...........................................................
24
1.1.4.1 – Epidemiologia ...........................................................................
25
1.1.4.2 – Apresentação clínica ................................................................
26
1.1.4.3 – Diagnóstico ...............................................................................
29
1.1.4.4 – Tratamento ...............................................................................
32
2 – OBJETIVO .....................................................................................................
38
3 – CASUÍSTICA E MÉTODO .............................................................................
40
3.1 – O Estudo .................................................................................................
41
3.2 – Os procedimentos endovasculares .........................................................
44
3.2.1 – O exame angiográfico inicial ............................................................
44
3.2.2 – O procedimento para tratamento endovascular das FCCs .............
45
3.2.3 – O procedimento para tratamento endovascular dos aneurismas
intracavernosos ...............................................................................
48
4 – RESULTADOS ..............................................................................................
54
5 – DISCUSSÃO ..................................................................................................
76
6 – CONCLUSÕES …………………………………………………………………..
89
7 – REFERÊNCIAS BIBLIOGRÁFICAS ……………………………………………
91
RESUMO …………………………………………………………………………..
100
ABSTRACT ...................................................................................................
102
APÊNDICE ....................................................................................................
104
Sumário
1. INTRODUÇÃO
2
O tratamento de lesões comprometendo o seio cavernoso (SC) sempre se
constituiu desafiador aos neurocirurgiões. Desde que Dolenc descreveu de maneira
compreensiva a anatomia microcirúrgica(1), o conhecimento da região do SC
difundiu-se, possibilitando o desenvolvimento de novas técnicas no tratamento de
afecções da base do crânio.
O crescente conhecimento da anatomia topográfica relacionada à artéria
carótida interna (ACI) e de suas relações com ossos, dura-máter (DM), espaços
venosos e nervos cranianos (NC) mudou os rumos da atuação neurocirúrgica em
lesões do SC(1). Com o desenvolvimento de modernas técnicas de intervenção
neuroendovascular ampliou-se a gama de opções terapêuticas de afecções
vasculares comprometendo o SC. No entanto, persistem ainda controvérsias em
relação ao tratamento.
A fim de que o tratamento dessas lesões seja eficaz, é necessário, além do
conhecimento anatômico, estudos de neuroimagem pormenorizados da região e o
estabelecimento de critérios na escolha do modo mais adequado de tratar cada
situação.
O tratamento endovascular dessas lesões apresentou diversas alterações nos
últimos anos, especialmente em decorrência do aparecimento de novos recursos
técnicos(2). Assim, a constante avaliação de sua eficácia se faz necessária com o
intuito de se obter os melhores resultados possíveis, associado à taxas
progressivamente menores de morbimortalidade. Considerando-se a constante
evolução no tratamento das doenças vasculares carotidocavernosas, propusemonos a realizar esse estudo para avaliar os resultados das técnicas empregadas na
atualidade.
Introdução
3
1.1 - Revisão da literatura
1.1.1 - Histórico
Admite-se que a primeira descrição do SC foi feita por Ridley* em 1695 citado
por Bedford (1966)(3), que notou o posicionamento da ACI junto à sua parede lateral.
Ridley observou ainda a presença de um interstício venoso entre a ACI e a hipófise,
e a existência de comunicação deste espaço venoso com estrutura similar do lado
oposto. Deste modo, o termo “seio circular” foi sugerido em seu livro e usado
algumas vezes ulteriormente(3).
A denominação “seio cavernoso” foi utilizada pela primeira vez por Winslow **
(1732), citado por Bedford (1966)(3), descrevendo a presença de numerosos
filamentos e trabeculações que conferiam ao interior do seio a aparência plexiforme.
Tal aspecto permitiu a Winslow a comparação do interior do seio àquele exibido pelo
corpo cavernoso do pênis, sendo assim criada a designação “seio cavernoso”, que
passou a ser utilizada na literatura. Essa visão atrasou de forma significativa a
abordagem dessa região, pois se considerou praticamente impossível realizar a
hemostasia de um espaço composto de sangue e com muitas trabéculas (4). O
referido autor também destacou, ainda, que a ACI ficaria imersa no sangue do SC
juntamente com os NCs III, IV, V e VI(3).
Desde as suas primeiras descrições, o SC era considerado um canal venoso
trabeculado que envolve determinados segmentos da ACI e do nervo abducente (3).
Os estudos anatômicos que se seguiram mantiveram alguns conceitos originais,
mas contradições ocorreram principalmente no que diz respeito aos demais NCs
*
Ridley H. The anatomy of the brain. London: S. Smith & B. Walford; 1695. APUD Bedford MA. The
"cavernous" sinus. Br J Ophthalmol. 1966; 50:41-6.(3)
**
Winslow JB. Exposition anatomique de La structure Du corps humain. London: Prevost; 1732.
APUD Bedford MA. The "cavernous" sinus. Br J Ophthalmol. 1966; 50:41-6.(3)
Introdução
4
relacionados ao SC e à constituição de suas paredes e dos ramos emitidos pela ACI
intracavernosa(5,6,7). Com a introdução da microcirurgia e com o desenvolvimento de
novas técnicas e acessos cirúrgicos(5,6,8), conhecimento maior e mais pormenorizado
a respeito do SC pôde ser obtido nos últimos 50 anos, não satisfazendo apenas
interesses acadêmicos, mas contemplando implicações práticas.
Browder (1937)(9) e Parkinson (1965)(5) realizaram as primeiras intervenções
sobre o SC. Ambos os relatos tinham como objetivo o tratamento de fístulas
carotidocavernosas (FCC). Parkinson (1965)(5) em seu relato pioneiro dispunha da
experiência obtida por seu departamento a partir da dissecação de 200 SCs em
peças de autópsia, tendo feito observações valiosas, ainda hoje consideradas a
base fisiopatológica das FCCs(10). As descrições cirúrgicas de Parkinson (1965) (5) e
Dolenc (1983)(11) propuseram a identificação de reparos anatômicos que auxiliariam
na exploração cirúrgica do SC, com pontos de entrada cirúrgica caracterizados como
figuras geométricas que são adotados até hoje por muitos cirurgiões na exploração
dessa região(12).
As descrições anatômicas e microcirúrgicas mais pormenorizadas do SC
foram publicadas a partir do final dos anos 70. Harris, Rothon Jr (1976) (6), por meio
da dissecação de 50 SCs com magnificação, definiram relações importantes do
mesmo com estruturas adjacentes e observaram a frequência de aparecimento dos
principais ramos da artéria carótida interna cavernosa (ACIc). Umansky, Nathan
(1982)(7) publicaram estudo minucioso da parede lateral do SC e dos elementos
neurais a ela relacionados, destacando-se os NCs oculomotor, troclear e trigêmeo.
Taptas(13) destacou em 1982 que o SC não seria apenas um canal venoso
trabeculado, mas uma rede venosa extradural e irregular na base do crânio. Já
Rothon Jr (2002)(10), Parkinson (1990)(14) e Hakuba et al (1989)(15) sugeriram que o
Introdução
5
SC seria composto tanto por um espaço venoso trabeculado quanto por uma rede
de canais venosos no espaço extradural parasselar.
Os acessos cirúrgicos para o SC são realizados para o tratamento de
algumas doenças, incluindo-se tumores e aneurismas cerebrais(16). Entretanto,
apesar de hoje a anatomia do SC ser bem definida, o procedimento cirúrgico para
abordagem ao SC permanece reconhecido como procedimento desafiador e não
familiar para muitos neurocirurgiões(16).
1.1.2 Anatomia do seio cavernoso e da artéria carótida interna cavernosa
Os dois SCs estão localizados próximo ao centro do crânio, em ambos os
lados da sela turca (ST), da glândula hipófise e do seio esfenoidal (10). Os SCs são
estruturas venosas na fossa craniana média formados por envoltório de DM. O
envoltório dural contém estruturas neurovasculares(16), destacando-se o segmento
intracavernoso da ACI e seus ramos, e representa o local de confluência venosa de
diversas regiões, incluindo-se: cérebro, cerebelo, tronco encefálico, face, olho,
órbita, nasofaringe, mastoide e orelha média(6,17). O SC pode ser visto como uma
extensão extradural parasselar(18) que tem como limites a fissura orbitária superior
anteriormente e o dorso da ST posteriormente, possuindo comunicação livre com os
seios basilar, seio petroso superior, seio petroso inferior (SPI) e intracavernoso (10).
Kehrli et al (1996) (18) enfatizaram a natureza extradural do SC em seus estudos.
Os nervos oculomotor, troclear e o ramo oftálmico, da primeira divisão do
nervo trigêmeo, cursam na parede lateral do SC. Já o nervo abducente cursa
medialmente ao ramo oftálmico, entre este último e a ACI(10). O ramo maxilar,
segunda divisão do nervo trigêmeo, forma a margem inferior da parede lateral do
SC, cursando paralelamente ao ramo oftálmico(7) (Fig.1).
Introdução
6
Figura 1 - Peça de dissecção anatômica do seio cavernoso mostrando os elementos
vasculares e neurais após a dissecção do componente meníngeo (AOft – artéria oftálmica;
ACIc – artéria carótida interna cavernosa; NC III – nervo oculomotor; NC VI – nervo
abducente; V1 – ramo oftálmico do nervo trigêmeo; V2 – ramo maxilar do nervo trigêmeo;
V3 – ramo mandibular do nervo trigêmeo) (Cortesia: Dr. Juan Castro Flores).
De maneira geral, o SC possui teto e três paredes: lateral, medial e posterior.
O teto relaciona-se com as cisternas da base, a parede lateral com o lobo temporal,
a parede posterior com a fossa craniana posterior e a parede medial com a ST,
hipófise e osso esfenoide(16). As paredes lateral e medial unem-se inferiormente ao
nível da margem superior do ramo maxilar do nervo trigêmeo(16).
O teto do SC é contínuo com o diafragma da sela, que recobre a ST sobre a
glândula hipófise(19). O teto é formado pela DM que reveste a margem inferior do
processo clinóideo anterior e pela porção de DM conhecida como triângulo
oculomotor, localizado entre os processos clinóideos anterior e posterior e o ápice
petroso temporal. Recebe este nome por ser a região onde o nervo oculomotor
penetra no SC(10,19).
Introdução
7
A parede posterior do SC é ampla e tem como limite superior a dobra
petroclinóidea, que liga a clinoide posterior ao ápice petroso. A margem inferior
limita-se a fissura petroclival, na junção dos ossos temporal e esfenoide. A margem
lateral da parede posterior localiza-se medialmente ao óstio do cavo de Meckel; já a
borda lateral da parede posterior é situada junto à margem lateral do dorso da sela.
O nervo abducente entra no SC abaixo do ligamento petroesfenoidal e, portanto,
pela parede posterior do mesmo(10,20).
A parede medial do SC é formada pela DM que constitui a parede lateral da
ST e cobre a superfície lateral do corpo do osso esfenoide. Já a parede lateral tem
como limites a margem lateral da fissura orbitária superior anteriormente e a borda
medial do cavo de Meckel posteriormente. A parede lateral é formada pela
condensação das bainhas dos nervos oculomotor, troclear e oftálmico, que se unem
para penetrar na fissura orbitária superior(7,10).
Quanto à relação com estruturas ósseas adjacentes sabe-se que o SC está
localizado na superfície lateral do corpo do osso esfenoide(8). O SC se estende a
partir da margem da lateral da ST no sentido inferior e lateral, atravessando o corpo
do esfenoide até a sua junção com a asa maior(10). Os limites inferiores não
alcançam as margens dos forames oval, redondo ou espinhoso. Entretanto, seu
assoalho localiza-se posteriormente ao forame redondo e anteriormente ao forame
oval(16). O processo clinóideo anterior posiciona-se acima da porção anterossuperior
do SC e sua retirada é passo importante para determinados acessos cirúrgicos,
particularmente no tratamento de aneurismas da ACIc(11).
As conexões venosas do SC permitem a afluência de grande área do cérebro,
crânio, face e olhos(17). Aspecto de importância clínica a ser destacado é a
drenagem para o SC das veias oftálmica superior (VOS) e oftálmica inferior (VOI).
Introdução
8
Esta última pode drenar diretamente para o SC ou por meio da VOS. Pela ausência
de válvulas venosas no interior do SC, o sentido do fluxo pode facilmente ser
revertido, principalmente diante da presença de fluxo arterial em seu interior,
conforme ocorre nos casos das FCCs, sejam diretas ou indiretas(5,17,21). Este fluxo
reverso explica a ampla possibilidade de manifestações oculares das FCCs (5).
A ACI em sua classificação mais recente é dividida em sete segmentos,
conforme proposto por Bouthillier et al (1996)(22). Esta classificação descreve toda a
extensão da artéria e usa escala numérica no sentido do fluxo sanguíneo. Deste
modo, estabeleceu-se a divisão da ACI da seguinte maneira: C1, cervical; C2,
petrosa; C3, lácera; C4, cavernosa; C5, clinóidea; C6, oftálmica; e C7,
comunicante(22) (Fig. 2). Portanto, o segmento cavernoso da ACI corresponde ao
quarto segmento ou C4(22). Tal segmento se inicia na margem superior do ligamento
petrolingual, logo após a ACI emergir do forame lacerado(13). Em geral, o segmento
cavernoso da ACI tem uma primeira porção cervical, a curvatura posterior, a porção
horizontal com sentido anterior e a curvatura anterior até terminar no anel dural
proximal, composto pela junção do periósteo medial e inferior do processo clinóideo
anterior(22,23,24). A ACI é envolvida em seu trajeto intracavernoso por: tecido areolar,
tecido adiposo, plexo simpático e plexo venoso (14,23,25). Está fixada, portanto, apenas
pelo anel ósseo, o que não evita o deslocamento da artéria em determinadas
circunstâncias(10). A ACIc é separada do nervo trigêmeo antes da entrada no SC
apenas por DM em 84% dos casos, sendo que nos 16% restantes a separação é
feita apenas por delgada lâmina óssea(6).
Introdução
9
Figura 2 - A – Representação esquemática da ACI mostrando sua segmentação segundo
Bouthillier(22) [modificado de Osborn(26)]; B – angiografia carotídea (em incidência lateral) com
seus segmentos assinalados; (Segmentos: C1 - cervical; C2 - petroso; C3 - lácero; C4 cavernoso; C5 - clinóideo; C6 - oftálmico; C7 - comunicante).
Os ramos da ACIc são: o tronco meningo-hipofisário, a artéria do seio
cavernoso inferior e as artérias capsulares de McConnel. Estas últimas são
responsáveis pela vascularização da cápsula da hipófise e do assoalho da sela(4,6,10).
De acordo com Harris, Rhoton Jr (1976)(6), a artéria oftálmica e a artéria meníngea
dorsal podem ser ramos da ACIc em 8% e 6% das situações, respectivamente(6). Os
três ramos principais do tronco meningo-hipofisário são: a artéria tentorial, a artéria
meníngea dorsal e a artéria hipofisária inferior(10,26). A artéria tentorial é o ramo mais
frequente do tronco meningo-hipofisário, presente em 100% dos casos, tendo sido
identificada por Bernasconi, Cassinari (1957)(27) como a responsável pela irrigação
dos meningeomas de tenda do cerebelo.
Parkinson constatou que as FCC espontâneas, em geral decorrentes de
ruptura aneurismática, tendem a ocorrer na junção de um dos ramos com a
Introdução
10
carótida(5,10). Já as fístulas traumáticas, secundárias a lacerações da ACI ou de um
de seus ramos intracavernosos, podem ter mais de uma origem e localizam-se mais
comumente na porção anterior do SC(5,10).
1.1.3 - Fístulas carotidocavernosoas diretas
As FCCs são comunicações anormais entre a artéria carótida e o SC(2,28-35).
Elas podem ser classificadas de diversas maneiras. De acordo com a etiologia,
podem ser traumáticas ou espontâneas(30,31,36); hemodinamicamente elas podem
representar lesões de alto ou de baixo fluxo(28,30,31,35); e angiograficamente, as FCCs
podem ser classificadas em diretas – quando a fístula é proveniente diretamente da
ACI - ou indiretas – quando a fístula é oriunda de ramos durais da artéria
carótida(30,31).
A classificação angiográfica é amplamente utilizada, podendo determinar o
prognóstico e orientar o planejamento do tratamento. Fornece ainda um método
objetivo para o agrupamento das FCCs(31). As FCCs são subdivididas em quatro
subgrupos, de acordo com o suprimento arterial da fístula. O subtipo A corresponde
a uma comunicação direta entre a ACI e o SC, representando assim, a Fístula
carotidocavernosa direta (FCCd). Os subtipos B, C e D representam as fístulas
indiretas, e são chamadas atualmente de fístulas durais. No subtipo B, a fístula
ocorre entre ramos meníngeos da ACI e o SC. O subtipo C é representado pela
comunicação anormal entre ramos meníngeos da artéria carótida externa (ACE) e o
SC. Já no subtipo D, que é o mais comum dentre todas as fístulas, há uma
comunicação anormal com o SC através de ramos arteriais provenientes tanto da
ACI quanto da ACE(31).
Introdução
11
Assim, a FCCd representa geralmente uma lesão de alto fluxo, com a saída
de sangue de um compartimento de alta pressão – a ACI – para um compartimento
de baixa pressão – o SC(29,31,36,37). Isso ocorre geralmente através de um orifício
único no segmento cavernoso da ACI(31). Além disso, as FCCd são geralmente
traumáticas, ao passo que as indiretas são, na sua maioria, espontâneas (30,36,38). As
FCCs indiretas podem estar relacionadas à trombose de seios venosos cranianos,
alterações hormonais ou cirurgias cranianas prévias(36). A grande maioria das FCCd
é de origem traumática(30,36,39). Aproximadamente um quarto dessas lesões ocorre
espontaneamente, geralmente causada por rotura de aneurisma intracavernoso
(AIC)(31,39).
1.1.3.1 – Epidemiologia
As FCCd, pós-traumáticas, representam afecção rara, ocorrendo somente em
0,17 – 1,01% dos traumatismos cranioencefálicos (TCE)(32,37,40,41). Podem ocorrer
em consequência de TCEs fechados ou abertos, em havendo lesão direta da
ACI(29,32,33,40,41). No entanto, a maioria das FCCd resulta de lesão craniana fechada,
associada à fratura de base do crânio(39,42,43). As FCCd são mais comuns em
pacientes jovens, masculinos, que representam o grupo mais comumente acometido
por TCE(31). No entanto, traumas cranianos em pessoas de qualquer idade podem
resultar no surgimento de FCCd(31).
A ACI é fixada entre o forame lácero e o processo clinóideo anterior por meio
de ligamentos durais. Quando ocorre o TCE, as forças de estiramento, algumas
vezes acompanhadas por espículas ósseas penetrantes, podem causar lesão à ACI
entre seus pontos de fixação(31). Geralmente, a laceração é única e unilateral. Mais
raramente, essa lesão pode ser múltipla e bilateral(31,37,38).
Introdução
12
Embora classicamente tenha etiologia traumática, a FCCd pode resultar de:
lesões iatrogênicas em cirurgias transesfenoidais ou procedimentos endovasculares;
deficiências do colágeno como na Síndrome de Ehlers-Danlos; rotura de
AIC(31,38,39,44,45); e dissecções, em casos de osteogenesis imperfecta ou de displasia
fibromuscular(31).
1.1.3.2 - Apresentação Clínica
A apresentação clínica das FCCd pode ser bastante variada, muitas vezes se
assemelhando à apresentação de doenças neurológicas, tais como: esclerose
múltipla, tumores cerebrais, ou acidente vascular encefálico(46).
Apesar de as FCCd se instalarem de maneira aguda, os sintomas podem ser
insidiosos e potencialmente graves(31,46). As manifestações clínicas surgem
tardiamente após a hipertensão venosa atingir níveis críticos, o que pode levar
semanas para acontecer(46). Além disso, a exuberância do quadro clínico está mais
relacionada ao padrão de drenagem venosa do que ao tamanho da fístula (31). Pode
haver comprometimento dos NCs III, IV, V e VI, causando paralisia na motricidade
ocular extrínseca e diplopia, além do surgimento de cefaleia, dor retro-ocular, perda
visual e até mesmo hemorragia intracraniana(46). A deterioração da visão ocorre
devido a combinação de redução da perfusão arterial e hipertensão venosa,
acompanhada de glaucoma e piora de perfusão da retina(28,31). A isquemia cerebral,
relacionada ao fenômeno de “roubo vascular” parece ser excepcionalmente rara, e
ocorre somente em pacientes com variações anatômicas no direcionamento do fluxo
sanguíneo pelo polígono de Willis(31). Há ainda relatos de hemorragia subaracnóidea
espontânea (HSAe) causada por FCCd(47). Esse aspecto está relacionado à
transmissão da hipertensão venosa para veias corticais adjacentes à lesão.
Introdução
13
A FCCd é formada pelo extravasamento de sangue da ACI para o SC. Assim,
há o fluxo sanguíneo de um compartimento de alta pressão para um compartimento
de baixa pressão. Essa comunicação anormal leva ao aumento da pressão no SC
com consequente compressão de seu conteúdo, incluindo os NCs III, IV, V e
VI(2,30,31,48). O envolvimento desses nervos resulta em oftalmoplegia, alterações na
sensibilidade da face, ptose palpebral e fotofobia (31,48). Além disso, a ocorrência de
oftalmoplegia é facilitada pelo surgimento de edema das estruturas intraorbitárias e
perioculares(31). (Fig. 3, 4). A hipertensão venosa leva ao ingurgitamento das veias
oftálmicas, causando a tríade clássica da FCCd: sopro ocular, quemose (Fig. 5) e
exoftalmo pulsátil(4,28,31,48). Deste modo, a pressão intracavernosa pode ser
transmitida para o SC contralateral através dos seios intercavernosos, resultando em
déficits oculares bilaterais(31,46).
Figura 3 - Paciente com FCCd apresentando ptose palpebral, edema periocular e
hipermemia conjuntival, além de paresia na motricidade ocular extrínseca.
Introdução
14
Figura 4 - Paciente com FCCd apresentando edema periocular, proptose ocular e
hipermemia conjuntival.
Figura 5 - Paciente com FCCd apresentando intensa hiperemia ocular, associada à
quemose.
Introdução
15
Os sintomas costumam ter melhora significativa após o tratamento, muitas
vezes com resolução em horas ou dias. A melhora completa, no entanto, pode
demorar semanas ou meses para ocorrer(31). Assim, a duração dos sintomas parece
ser um importante fator prognóstico. Os pacientes com sintomatologia prolongada
apresentam recuperação satisfatória tardiamente(31).
1.1.3.3 – Diagnóstico
O diagnóstico de FCCd baseia-se na sua apresentação clínica, assim como
em exames de neuroimagem(46). A tomografia computadorizada (TC) de crânio sem
contraste pode evidenciar proptose ocular, ingurgitamento e tortuosidade da VOS e
alargamento do SC envolvido(46) (Fig. 6). A ressonância magnética (RM) encefálica
mostra achados similares à TC, porém com uma melhor definição, sendo
particularmente útil na classificação das FCCs(46) (Fig. 7). A TC e RM têm
importância também na avaliação do parênquima encefálico, na identificação de
possíveis lesões traumáticas ou mesmo isquêmicas associadas(31). Além disso, a TC
em cortes coronais é bastante utilizada na avaliação de possíveis lesões ósseas da
base do crânio(31).
Introdução
16
Figura 6 - TC de crânio em corte axial (A,B,C – sem contraste; D,E,F – após a injeção de
contraste venoso) mostrando alargamento do SC esquerdo, proptose ocular e
ingurgitamento da VOS.
Figura 7 - RM de encéfalo (cortes axiais em T1 com contraste) de paciente com FCCd à
direita mostrando proptose ocular direita e ingurgitamento da VOS desse lado.
Introdução
17
O melhor exame para o diagnóstico e classificação das FCCs é a angiografia
cerebral (AGC)(31,33) (Fig. 8). Ela é realizada com o intuito de se identificar a
localização e o tamanho da fístula, assim como sua drenagem venosa (31). Além
disso, por esse método, torna-se possível a identificação de lesões vasculares
associadas, tais como pseudoaneurismas ou varizes de SC, as quais também
demandam tratamento(31). Como se trata de lesão de alto fluxo, muitas vezes é difícil
a visibilização da morfologia do orifício fistuloso. Com o objetivo de se obter imagem
mais pormenorizada, realiza-se a manobra de Allcock, que consiste na compressão
da ACI ispilateral à fístula, com injeção de contraste pela artéria vertebral ou mesmo
pela ACI contralateral(31) (Fig. 9).
Figura 8 - AGC (em perfil) de pacientes distintos mostrando opacificação precoce do SC e
da VOS, confirmando o diagnóstico de FCCd.
Introdução
18
Figura 9 - Angiografia vertebral esquerda (em perfil), com compressão carotídea ispilateral,
mostrando opacificação venosa precoce do SC acometido por FCCd (Manobra de Allcock).
1.1.3.4 – Tratamento
As FCCd são lesões de alto fluxo, podendo estar relacionadas com:
sangramento intracraniano, perda visual, exposição corneana ou até mesmo
epistaxe fatal(31,46), sendo assim, seu tratamento está sempre indicado. O tratamento
deve ser o mais precoce possível e, reforçando tal afirmativa, Halbach et al (1987)(49)
identificaram algumas situações de alto risco que demandam tratamento urgente.
Essas incluem: surgimento de hemorragia intracraniana, epistaxe, aumento da
pressão intraocular,
redução da
acuidade visual e proptose rapidamente
Introdução
19
progressiva.
Assim, por definição, toda FCCd deve ser prontamente submetida a
tratamento. No passado, antes do desenvolvimento das técnicas endovasculares, o
tratamento desse tipo de lesão era realizado por meio da ligadura da ACI ou pela
realização de “trapping”, muitas vezes com sequelas graves e sem ocasionar o
fechamento da fístula(29,31,50). Atualmente, o tratamento endovascular é a modalidade
de escolha(29,31,34,35). Uma vez tratada a lesão, a pressão no SC se normaliza,
possibilitando a regressão dos sintomas (46). O tratamento medicamentoso deve ser
também prontamente instituído na forma de cuidados locais com os olhos, enquanto
não se obtém a reversão do quadro(31).
No que concerne ainda à instituição do tratamento precoce, de acordo com
Mercado et al (2011)(38), diversos autores afirmam que se deve aguardar entre uma
e duas semanas do início dos sintomas para que seja instituído o tratamento
endovascular(38). Eles afirmam que, devido ao trauma craniano recente, a ACI pode
apresentar grande reatividade à navegação endovascular, o que ocasionaria maior
risco de lesão endotelial(38). Ainda de acordo com esses mesmos autores, alguns
casos necessitariam de tratamento na fase aguda, geralmente devido ao risco
iminente de hemorragia intracraniana pela hipertensão venosa(38), ou devido à rápida
deterioração da visão(46).
O tratamento ideal da FCCd é a exclusão da fístula da circulação, com
preservação da patência da ACI(31,32,35,38,40,41). A partir da década de 1970, a técnica
passou a ser realizada com sucesso por meio de balões destacáveis (31,37,51).
Atualmente, vários materiais e estratégias diferentes têm sido utilizados no
tratamento das FCCd(31,37). Assim, essas lesões podem ser tratadas com sucesso
tanto pela via arterial quanto pela venosa, e até mesmo pela via transorbitária
Introdução
20
(através da VOS)(31).
O “padrão ouro” no tratamento é através da via transarterial, com oclusão da
fístula e preservação do fluxo sanguíneo da ACI. Isso é conseguido pelo
posicionamento
de
um
balão
de
látex
no
SC,
ocluindo
o
orifício
fistuloso(31,32,34,40,41,44,52). No entanto, em alguns países como os Estados Unidos da
América, os balões destacáveis não são utilizados(37), sendo necessário um outro
tipo de técnica. Além disso, há índice de insucesso da oclusão seletiva da fístula
com balão que chega a 10%(31,53,54,55). Muitas vezes, a falência dessa técnica ocorre
devido ao pequeno tamanho do orifício fistular, impossibilitando a passagem do
balão; ou mesmo pelo pequeno tamanho do SC, o que impossibilitaria a adequada
insuflação do balão(31). A navegação do microcateter para atingir a fístula também
pode ser um fator limitante a essa opção, especialmente se a fístula estiver
localizada no segmento C4 da ACIc, devido à ocorrência de ângulo de entrada muito
agudo na ACI(31). A presença de espículas ósseas pode levar à perfuração do balão
durante sua insuflação(56), o que também representa uma limitação a essa técnica.
Outro fator complicador relacionado à utilização da técnica de oclusão da
fístula com
balão,
seria
o
surgimento
de
complicações
tromboembólicas
relacionadas ao procedimento, geralmente causadas pela manipulação do balão,
com lesão endotelial adjacente(31). Em associação a essa técnica tem se observado,
em pacientes com FCCs complexas, a presença de FCCs residuais, ou mesmo
recorrentes, assim como a formação de pseudoaneurismas. Esses aspectos estão
associados à oclusão incompleta do orifício(40,41).
Apesar de não tão difundida, há a possibilidade de oclusão seletiva do SC,
preservando-se a patência da ACI, por meio da utilização de espiras de platina com
destaque controlado (EPDC) – “coils”, que são liberadas de maneira controlada no
Introdução
21
interior do SC(31,37,57). Tal técnica pode ser incrementada com uso de líquidos
adesivos (cianoacrilatos) ou Onyx® [agente embólico líquido (ev3, Irvine, CA)], para
tentar obter a oclusão da fístula(31,58). Embora as possibilidades de sucesso sejam
maiores com essa associação, deve-se lembrar da eventualidade de ocorrência de
refluxo do agente líquido para a ACI, com consequente embolia distal no território
carotídeo e possíveis sequelas isquêmicas(31).
Embora o objetivo do tratamento vise a preservação do fluxo da ACI(31,38,40,41),
isso nem sempre é possível. Em situações onde não se conseguiu a oclusão
seletiva da fístula, seja com balão ou com EPDC, há a opção da oclusão definitiva
da ACI para o fechamento da fístula(31,37) realizada também por via transarterial.
Dessa forma, quando é realizada com balões, esses devem ser posicionados
ocluindo o pertuito da fístula, de forma a interromper seu fluxo(31,37). Quando é
realizada com espiras de platina, estas são liberadas dentro do SC, mas também
ocluindo a ACI, de forma a impedir sua migração distal e garantido a oclusão da ACI.
Uma vez que o fluxo da ACI está quase exclusivamente direcionado à fístula,
não é necessária a realização de teste de oclusão da ACI previamente à oclusão da
ACI(31). Contudo, em pacientes que apresentam boa opacificação do parênquima
cerebral distalmente à fistula, o teste de oclusão da ACI é recomendado antes que
se proceda a oclusão terapêutica. Se o paciente não tolerar a oclusão, outro método
de tratamento deve ser adotado(31), como por exemplo a realização de “bypass”
vascular por cirurgia aberta.
Embora o tratamento padrão da FCCd seja realizado, na maioria das vezes,
por via arterial, através da oclusão seletiva da fístula com balão e preservação da
patência da ACI, a embolização do SC afetado utilizando espiras de platina,
acessando a região pela rota transvenosa, tem sido utilizada atualmente devido
Introdução
22
principalmente à segurança na sua execução e às altas taxas de sucesso
alcançadas(38,52,57).
O acesso através da veia jugular e SPI ipsilaterais é a via venosa mais
utilizada para acesso ao SC afetado(31,34,38,59). Após o posicionamento do
microcateter, a oclusão do SC, e consequentemente da fístula, pode ser realizada
com uso de balão destacável, espiras destacáveis, adesivos tissulares, Onyx®
[agente embólico líquido (ev3, Irvine, CA)], ou mesmo com uma combinação dessas
técnicas(31,60). Durante o procedimento, um cateter deve ser posicionado na ACI para
injeção do meio de contraste e subsequente localização da fístula e do SC, assim
como para confirmar a oclusão da fístula. Em casos de impossibilidade da utilização
do SPI ipsilateral, outras vias venosas podem ser utilizadas, tais como o SPI
contralateral, as veias do plexo pterigoide, a VOS e até mesmo as veias corticais, via
seio esfenoparietal(31).
Essa via transvenosa, embora anatomicamente favorável, não é isenta de
complicações(31,38). A protrusão de espiras para a ACI pode ocorrer, especialmente
em fístulas grandes(38), mas essa complicação pode ser minimizada com a utilização
de balão para proteção, posicionado na ACI durante a liberação das espiras. Existe
possibilidade de hemorragia subaracnóidea, especialmente pela lesão dos seios
petrosos ou veias corticais durante a manipulação dos cateteres (31,38), assim como
pela alteração hemodinâmica provocada pela mudança no padrão de drenagem
venosa ocorrida com o uso de agentes embólicos(31). Ainda, há o risco de paralisia
transitória dos nervos oculomotor e abducente pelo efeito compressivo promovido no
SC(38).
Outra possibilidade é acesso ao SC comprometido através da órbita, por meio
da punção direta da VOS(31). Nos casos de FCCs, essa veia geralmente está
Introdução
23
congesta, facilitando o acesso àquele compartimento para a oclusão da lesão.
O mais recente avanço no tratamento endovascular das FCCd é a utilização
de “stents” recobertos, que proporcionam a oclusão da fístula e preservação do fluxo
da ACI(31,37,40,41,61). Essa técnica transarterial não só preserva como também
remodela a ACI e objetiva simplificar o procedimento endovascular, reduzindo o
tempo do procedimento e os custos envolvidos no tratamento das FCCd(40,41).
Utiliza-se uma prótese expansível de PTFE (Teflon), podendo-se obter maiores
taxas de oclusão completa da fístula, assim como reduzir a incidência de
recorrências e formação de pseudoaneurismas, tendo em vista a completa cobertura
do orifício fistular(17,18,39). Há ainda relatos da utilização de “stents” diversores de
fluxo com sucesso no tratamento de uma FCCd traumática (62).
Quando comparado às técnicas consagradas de embolização utilizando-se de
espiras, Wang et al (2012a)(40) apontam algumas vantagens na utilização do “stent”
recoberto. A saber: o posicionamento do “stent” é um procedimento simples e
rápido, não há o risco de herniação ou migração da espira, há desaparecimento do
efeito de massa e da compressão local e não há formação de pseudoaneurismas.
Ainda, segundo os mesmos autores, a utilização de “stents” no manejo das FCCsd,
ao invés do uso de espiras ou balões, proporciona aumento substancial nas taxas de
oclusão da fístula e cura anatômica, eliminando as possibilidades de recanalização e
reduzindo os custos de eventual retratamento de lesões recorrentes. Para Yin et al
(2013)(63), em estudo prospectivo não randomizado publicado em 2012, os
resultados angiográficos e clínicos obtidos com a utilização de “stents” recobertos
são superiores aos obtidos com a utilização de balões destacáveis.
Há, no entanto, algumas desvantagens da utilização desses “stents” no
manejo das FCCd(31,37,40,41). Há o risco de trombose tardia do “stent”, que pode ser
Introdução
24
minimizado
com
a
correta
instituição
de
terapia
anticoagulante
/
antiagregante(31,37,40,41,61). A desvantagem é que essa terapia não pode ser utilizada
em pacientes na fase aguda do trauma. A dificuldade de navegação e liberação dos
“stents” em vasos de pequeno calibre e geralmente tortuosos é a maior limitação da
técnica, mas que vem sendo cada vez mais superada com a utilização de novos
materiais especialmente desenvolvidos para os vasos intracranianos(37).
Cho et al (2011)(37) relataram a ocorrência de hemorragia cerebral após a
utilização de “stent” recoberto. Essa complicação pode ocorrer pelo mecanismo de
reperfusão(37). A teoria da reperfusão foi descrita por Spetzler como uma possível
causa de hemorragia intracraniana após ressecção de malformações arteriovenosas
cerebrais, devido à perda da autorregulação, com aumento do fluxo local associado
ao edema de estruturas adjacentes (37). Ainda, segundo os mesmos autores Cho et al
(2011)(37), numerosos relatos têm associado a teoria da reperfusão com o
surgimento de hemorragias intracranianos ocorridas após diversas técnicas de
revascularização, incluindo-se endarterectomias de carótida e “bypass”. Existem
outros fatores envolvidos na gênese desse fenômeno, dentre os quais a possível
liberação de radicais livres, com lesão endotelial, ou a resposta simpática local (37).
1.1.4 - Aneurismas intracavernosos
Os AIC representam de 3 a 11% de todos os aneurismas intracranianos e
cerca de 14% dos aneurismas da ACI(64-67). Eles podem se originar de qualquer
segmento da ACIc, porém são comumente originados do segmento horizontal,
estando projetados anteriormente e lateralmente(65,68). Essa localização preferencial
está relacionada com a origem dos três ramos arteriais mais comumente
encontrados nesse segmento: a artéria capsular de McConnell’s, o tronco
Introdução
25
inferolateral e o tronco menigo-hipofisário(65). Essa observação sugere que o
estresse hemodinâmico existente nessas ramificações estejam envolvidos na
gênese desses aneurismas(65). No entanto, a etiologia aterosclerótica e as
dissecções arteriais também estão envolvidas no surgimento dos AIC(65).
Os aneurismas de ACIc são completamente extradurais e, diferentemente das
lesões intradurais, apresentam baixo risco de evoluir com HSAe, apresentando
assim, morbimortalidade significativamente menor(69,70). Essas lesões representam
entidade distinta, podendo produzir sintomas compressivos em NCs (65,71). Também
podem apresentar sintomas relacionados a eventual rotura, com o surgimento de
FCC, epistaxe ou, eventualmente, HSAe, dependendo da extensão da lesão em
relação à DM(71).
1.1.4.1 – Epidemiologia
A prevalência de aneurismas da ACIc na população não é estimada de forma
exata(72). Certamente, os dados existentes são subestimados, pois a melhoria dos
métodos de imagem não invasivos tem propiciado detecção mais frequente desses
aneurismas(72). Além disso, existe número reduzido de estudos relacionados a esta
doença, não abrangendo, portanto, uma grande quantidade de pacientes
acometidos(72).
Diversos estudos apontam maior incidência dos aneurismas de ACIc em
mulheres(64,65,67,68,71). Essas lesões geralmente são manifestadas por efeitos
compressivos, cujos sintomas acometem preferencialmente indivíduos na 5ª e 6ª
décadas de vida(65).
Introdução
26
1.1.4.2 - Apresentação clínica
Os AIC podem permanecer assintomáticos ou se manifestar com sintomas
causados pelo efeito compressivo, acometendo os NCs II, III, IV, V e VI(64,67,73),
dependendo da direção do seu crescimento e de sua dimensão (Fig.10,11,12).
Nessas condições, pode haver o aparecimento de dor retro-orbitária, diplopia,
oftalmoparesia, oftalmoplegia, neuropatia trigeminal, ou mesmo a combinação
destas(71). Para Vasconcellos et al (2008)(65) os sintomas mais frequentes na sua
casuística foram cefaleia, seguida por diplopia(65,68). Esses sintomas podem ocorrer
de forma gradual ou mesmo agudamente(71). Nesta última apresentação o início
abrupto dos sintomas é devido à rápida expansão da lesão, provavelmente pela
dissecção da parede aneurismática(71).
Introdução
27
Figura 10 - Fotografia de paciente com AIC evidenciando ptose palpebral esquerda.
Figura 11 - Fotografia de paciente com AIC à direita, mostrando alteração na função do NC
VI, com déficit na abdução do olho direito.
Introdução
28
Figura 12 - Fotografia de paciente com AIC à esquerda evidenciando paresia na
motricidade ocular extrínseca desse lado, além de semi-ptose palpebral esquerda.
As manifestações oculares estão diretamente relacionadas ao tamanho do
aneurisma e à ocorrência de trombose em seu interior (74). Para Choulakian et al
(2010)(75), o aparecimento de sintomas relacionados à compressão dos NCs ocorre
geralmente em aneurismas maiores que 17 mm. Assim, o crescimento aneurismático
pode ocorrer após hemorragias recorrentes localizadas entre o trombo e a parede
aneurismática, ou mesmo devido à lenta expansão da parede aneurismática
verdadeira(74). No entanto, o curso da disfunção dos NCs causadas por AICs parece
ser variável, algumas vezes com progressão e outras com regressão espontânea
dos sintomas(71).
Além disso, a relação entre alterações nos sintomas e o tamanho do
aneurisma não está clara. Embora os sintomas possam melhorar ou piorar sem
alterações significativas no tamanho do aneurisma, o aumento do tamanho dos
aneurismas geralmente está associado a piora dos sintomas (64). Isso sugere que os
NCs são subitamente afetados por compressão direta ou por isquemia tecidual(64)
nessas situações.
A trombose espontânea de um aneurisma gigante ocorre em 13 a 20% dos
casos, podendo envolver a trombose concomitante do vaso portador (74). Os fatores
envolvidos nesse processo estão relacionados à razão entre o volume do aneurisma
e seu colo, à idade do aneurisma e, especialmente, a fatores hemodinâmicos no
vaso portador(74). Embora a progressão da trombose pareça ser o curso habitual
desses aneurismas, a história natural dos aneurismas de ACIc não é completamente
conhecida(71). Desse modo, mesmo em lesões totalmente intracavernosas, que
pareçam ter um curso benigno, há a possibilidade de rotura resultando em
hemorragia subdural, HSAe ou mesmo hemorragia intracerebral, potencialmente
Introdução
29
fatais(64).
Outras manifestações são: a FCCd, após rotura do aneurisma no SC(64); a
ocorrência de lesão expansiva intrasselar, causando hiperprolactinemia(76); ou até
mesmo por epistaxe(77). O risco estimado de HSAe no entanto é baixo, estimado em
0.2–0.4% ao ano(71).
1.1.4.3 – Diagnóstico
O diagnóstico dos AIC segue padrão diferente dos demais aneurismas
intracranianos. Enquanto a maioria dos aneurismas cerebrais são manifestados por
HSAe, os aneurismas de ACIc manifestam-se geralmente por meio de sintomas
compressivos em NCs III, IV, V e VI(64,73). Dessa forma, a suspeita da presença de
um AIC se faz a partir do surgimento do quadro de cefaleia retro-ocular, diplopia e
oftalmoparesia(71). Também podem ocasionar hiperestesia álgica ou hipoestesia em
face(71). Esse quadro geralmente é insidioso, mas em algumas situações pode ter
um início abrupto(71).
Os sintomas iniciais dos AIC não se diferenciam dos ocasionados por
qualquer lesão expansiva intracavernosa. Portanto, a investigação inicial consiste na
realização de TC (Fig. 13) e RM (Fig. 14) encefálica, que evidenciarão processo
expansivo intracavernoso, adjacente à ACI, com continuidade do fluxo dessa artéria.
Além disso, comumente nas lesões maiores, será evidenciada ainda a presença de
trombos no interior do aneurisma(4).
Introdução
30
Figura 13 - TC de crânio (corte axial sem contraste) mostrando lesão expansiva
intracavernosa à direita, hiperdensa em relação ao parênquima cerebral, compatível com
AIC gigante.
Figura 14 - RM de encéfalo (axial T1) mostrando lesão expansiva em topografia de SC à
direita, hiperintensa em relação ao parênquima cerebral, compatível com AIC gigante.
Introdução
31
A partir da suspeita da presença de uma lesão vascular, a investigação
procede de maneira habitual para qualquer aneurisma intracraniano, sendo a AGC
(Fig. 15) o “padrão ouro” para sua confirmação(78,79). Outros métodos incluem a
angiotomografia e a angioressonância (Fig. 16) que têm sido utilizados como
alternativas menos invasivas para o diagnóstico e seguimento dessas lesões(78,79). É
importante
mencionar
ainda,
que
significante
parcela
dos
aneurismas
intracavernosos, especialmente os menores que 15 mm(75), são diagnosticados de
forma incidental, quando da realização de exames de neuroimagem por indicações
diversas.
Figura 15 - Angiografia carotídea (A – incidência frontal / B – incidência lateral) de pacientes
distintos evidenciando aneurismas gigantes no segmento cavernoso da ACI.
Introdução
32
Figura 16 - Angioressonância de vasos encefálicos mostrando AIC à direita.
1.1.4.4 - Tratamento
A indicação de tratamento para aneurismas de ACIc é questionável, e
qualquer decisão a seu favor deve ser avaliada cuidadosamente tendo em vista o
pouco conhecimento que se tem sobre a história natural desta afecção e o potencial
risco associado a seu tratamento(72). Há pouca evidência científica que suporte o
tratamento de aneurismas assintomáticos de ACIc, independente de seu tamanho.
Assim, certamente, não há indicação de intervenção terapêutica em caso de
pequenos AICs, especialmente na população idosa (72).
Em relação aos aneurismas sintomáticos da ACIc, a indicação de seu
tratamento é questionável quando os sintomas são estáveis e bem tolerados,
Introdução
33
principalmente em pacientes idosos(72). Por outro lado, uma intervenção terapêutica
é bem aceita para os pacientes com sintomas neurológicos progressivos, com dor
de difícil controle, e principalmente, para aneurismas rotos (72). O objetivo do
tratamento seria, portanto, o alívio dos sintomas relacionados aos NCs (73). É
importante mencionar ainda, que o curso clínico desses pacientes é bastante
variável, e assim, a indicação do melhor momento para instituir o tratamento invasivo
pode mudar com a alteração dos sintomas apresentados(71).
A maioria dos pacientes sintomáticos apresenta melhora clínica ou mesmo
cura dos déficits de NCs induzidos por AICs gigantes após o seu tratamento, seja
por oclusão da ACI, ou mesmo por embolização endossacular do aneurisma (4,71).
Isso geralmente ocorre no primeiro ano após o tratamento (71), especialmente se o
tratamento é instituído precocemente(4). No entanto, o processo de melhora é
dependente de diversos fatores como a duração prévia dos sintomas antes do
tratamento, do inicio agudo ou gradual dos sintomas, do grau de disfunção dos NCs
e da presença de fatores de risco microvascular, entre os quais hipertensão arterial,
diabetes e idade avançada(71).
O tratamento ideal de qualquer aneurisma é a sua exclusão da circulação,
com preservação da patência da artéria portadora(80). Isso pode ser alcançado por
meio de microcirurgia vascular ou por técnicas endovasculares. A terapêutica
endovascular de aneurismas intracranianos evoluiu significativamente nas últimas
duas décadas, sobretudo após os resultados favoráveis de estudos randomizados
como o “International Study of Subarachnoid Aneurysm Treatment” terem sido
apresentados(81). Contudo, apesar dos avanços técnicos que se observaram,
importantes limitações continuam a dificultar a terapêutica endovascular de
aneurismas específicos, tais como os de colo largo, os gigantes ou de morfologia
Introdução
34
não sacular (fusiformes)(81).
Tendo em vista o curso relativamente benigno dos aneurismas de ACIc,
qualquer tratamento empregado para essas lesões deve ter baixa taxa de
complicações, com razoável possibilidade de melhora clínica nos pacientes
sintomáticos(70,71). Em suma, as alternativas empregadas para o seu manejo incluem
a embolização endossacular com EPDC, a oclusão da ACI com ou sem realização
de “bypass”(70,71,82-84), ou, mais recentemente, a utilização de “stents” diversores de
fluxo(81,85).
A oclusão proximal de um vaso foi descrita por Hunter*, em 1784, para o
tratamento de aneurisma de artéria popliteal (citado por Rathore et al, 2012)(86). Em
1809, Cooper** relatou a utilização de ligadura carotídea para um paciente com
aneurisma de artéria carótida extracraniana (citado por Elhammady et al, 2010)(80).
Somente em 1885, Horsely*** relatou o sucesso no tratamento de um aneurisma
intracraniano por meio de ligadura da ACI (citado por Elhammady et al, 2010) (80).
Em 1969, uma grande série de 461 pacientes submetidos a ligadura de carótida foi
publicada por Sahs, Locksley****, sendo reportada mortalidade de 20,7% e taxa de
30% de infartos cerebrais (citado por Rathore et al, 2012) (86). Desde então essa
opção vem sendo utilizada para o manejo de aneurismas de ACI, especialmente os
intracavernosos. Nos seus primórdios, a oclusão da carótida era realizada de
*
Hunter em 1794 APUD Rathore YS, Chandra PS, Kumar R, Singh M, Sharma MS, Suri A, Mishra
NK, Gaikwad S, Garg A, Sharma BS, Mahapatra AK. Monitored gradual occlusion of the internal
carotid artery followed by ligation for giant internal carotid artery aneurysms. Neurol India. 2012;
60:174-9. (86).
**
Cooper 1809 APUD Elhammady MS, Wolfe SQ, Farhat H, Aziz-Sultan MA, Heros RC. Carotid artery
sacrifice for unclippable and uncoilable aneurysms: endovascular occlusion Vs common carotid artery
ligation. Neurosurgery. 2010; 67:1431–7. (80).
***
Horsely 1885 APUD Elhammady MS, Wolfe SQ, Farhat H, Aziz-Sultan MA, Heros RC. Carotid
artery sacrifice for unclippable and uncoilable aneurysms: endovascular occlusion Vs common carotid
(80)
artery ligation. Neurosurgery. 2010; 67:1431–7. .
****
Sahs, Locksley 1969 APUD Rathore YS, Chandra PS, Kumar R, Singh M, Sharma MS, Suri A,
Mishra NK, Gaikwad S, Garg A, Sharma BS, Mahapatra AK. Monitored gradual occlusion of the
internal carotid artery followed by ligation for giant internal carotid artery aneurysms. Neurol India.
2012; 60:174-9. (86).
Introdução
35
maneira progressiva, utilizando um instrumento conhecido como “clamp de
Selverstone”(67,86).
Somente
com
o
desenvolvimento
da
neurorradiologia
intervencionista nos moldes atuais, a partir da década de 1990, essa oclusão passou
a ser realizada preferencialmente por via endovascular. Para muitos autores, a
despeito dos recentes avanços na terapêutica endovascular, o tratamento padrão
para os AICs gigantes continua a ser a oclusão endovascular da ACI proximalmente
à lesão(73,84,87).
A oclusão carotídea para o tratamento de aneurismas de ACIc é realizada
após a realização de teste de oclusão da ACI. Esse teste foi introduzido por
Serbinenko, em 1974(67,88), e consiste na oclusão temporária da ACI com balão,
enquanto são observados eventuais alterações ao exame neurológico seriado e o
sincronismo dos tempos de opacificação venosa à AGC(71). Esse teste provou ser útil
em predizer possíveis isquemias agudas ou tardias após a oclusão da ACI (71). Caso
seja constatada a não tolerância do paciente ao fechamento do vaso, esse não
poderá ter seu fluxo interrompido sem a realização de “bypass”. É sabido ainda que
até 22% dos pacientes que passaram no teste de oclusão desenvolverão algum tipo
de déficit relacionado a isquemia cerebral após ser efetivada a oclusão carotídea (89).
Vários estudos reportam melhoras de 84-90% dos sintomas após a oclusão
da ACI para esses aneurismas(73). Isso ocorre porque haveria a redução da pressão
dentro do aneurisma, com consequente diminuição da compressão dos NCs
(73)
. No
estudo de Vasconcellos et al (2008)(65), os autores puderam observar uma melhora
de 70% dos sintomas relacionados aos NCs e de 100% para a dor retro-ocular após
a oclusão endovascular da ACI. Potenciais complicações da oclusão da ACI seriam
o surgimento de déficits pela redução de fluxo sanguíneo, ou o surgimento de
aneurismas em outras localizações por causa do aumento compensatório do fluxo
Introdução
36
cerebral nas artérias do polígono de Willis(73,90).
Uma outra opção para o tratamento de AICs consiste na oclusão
endossacular do aneurisma com “coils”, preservando o fluxo da ACI, com ou sem a
utilização de “stent”(73,75,84,91). Essa alternativa poderia reduzir as eventuais
complicações associadas à oclusão da carótida, embora o efeito de massa causado
pelos “coils” possa piorar os sintomas relacionados à compressão de NCs(73,84). Essa
alternativa é tecnicamente mais fácil em aneurismas menores, porém de extrema
dificuldade
quando
empregada
para
aneurismas
gigantes,
parcialmente
trombosados e sem colo definido(73). No estudo de Morita et al (2011)(73), os autores
não obtiveram melhora importante nos sintomas compressivos dos NCs após a
embolização endossacular e, devido a isso, os mesmos sugerem a oclusão da ACI
como tratamento de escolha para os AICs maiores. Já para Choulakian et al
(2010)(75), a embolização endossacular deve ser considerada como primeira escolha
no manejo dessa condição.
Mais recentemente, os “stents” diversores de fluxo têm sido empregados para
o tratamento de aneurismas cerebrais de difícil manejo por técnicas endovasculares
habituais(92-94), como em casos de aneurismas gigantes, nos de colo largo, e
naqueles parcialmente trombosados. O uso de “stents” no tratamento de aneurismas
intracranianos foi proposto pela primeira vez no início dos anos 90(81,85) com três
principais objetivos: reconstruir a anatomia arterial, alterar a circulação na região do
colo aneurismático e favorecer a integração subintimal do “stent”(81). Inicialmente
foram desenvolvidos para propiciar uma reconstrução geométrica do vaso portador,
facilitando a liberação e a adequada compactação dos “coils” no interior do saco
aneurismático(85).
Com o desenvolvimento dos dispositivos diversores de fluxo, uma nova
Introdução
37
modalidade no tratamento dos aneurismas cerebrais vem se estabelecendo. Assim,
o manejo atual dos aneurismas intracranianos objetiva a reconstrução da parede
arterial e consequente correção do distúrbio hemodinâmico associado(95). Os “stents”
de fluxo são liberados no vaso portador, reduzindo o fluxo sanguíneo no saco
aneurismático até o ponto de estagnação, produzindo trombose gradual e
remodelação neointimal, preservando o fluxo nas artérias adjacentes e nas
perfurantes(92,93,95,96).
Diversos estudos vêm relatam vantagens na utilização dos “stents” diversores
de fluxo no tratamento de aneurismas de difícil embolização endossacular (92,93),
como é o caso dos aneurismas gigantes intracavernosos. Para Lylyk et al (2009)(93),
utilizando-se o “stent” Pipeline® (PED; ev3, Irvine, California) foi possível obter taxa
de oclusão aneurismática próxima de 100% em período de 12 meses de
seguimento, com baixas taxas de complicações e mantendo o fluxo do vaso
portador. As principais complicações relacionadas a essa técnica são os eventos
hemorrágicos ou isquêmicos, sejam precoces ou tardios, numa taxa esperada de até
2%(95).
Dessa forma, a tendência atual aponta para a utilização dos “stents” de fluxo
como alternativa promissora para o tratamento dos AICs, já que promovem completa
e duradoura oclusão do saco aneurismático, assim como remodelagem endoluminal
definitiva na artéria acometida(92,97). A maioria dos estudos atuais confirma essa
afirmativa, indicando seu uso para aneurismas com colo largo, fusiformes, grandes e
gigantes, e mesmo nos parcialmente trombosados, com taxa de morbimortalidade
entre 5 e 10%(95), que é considerada baixa, dada a morbimortalidade naturalmente
elevada imputada a essas lesões. No entanto, esse método ainda não é acessível a
todos os pacientes pelo alto custo.
Introdução
38
2. OBJETIVO
39
O presente trabalho tem como objetivo avaliar o tratamento endovascular das
lesões vasculares que acometem a artéria carótida interna intracavernosa.
Objetivo
40
3. CASUÍSTICA E MÉTODO
41
Este estudo teve seu projeto aprovado pelo Comitê de Ética em Pesquisa em
Seres Humanos da Irmandade da Santa Casa de Misericórdia de São Paulo,
protocolo N˚ 197/10, em 03/09/2010 (Apêndice 1), assim como seu Termo de
Consentimento Livre e Esclarecido (Apêndice 2).
3.1 - O estudo
Trata-se de estudo descritivo, de caráter retrospectivo e prospectivo, onde
foram avaliados 39 pacientes com lesões vasculares envolvendo a ACI no seu
segmento cavernoso, dos quais 36 foram submetidos a tratamento endovascular
pela Disciplina de Neurocirurgia do Hospital Central da Santa Casa de Misericórdia
de São Paulo, no período compreendido entre 01 de janeiro de 2008 à 31 de
dezembro de 2011. A avaliação retrospectiva se deu por meio de revisão de
prontuários. A avaliação prospectiva foi realizada por meio de consultas
ambulatoriais. Todos os pacientes tiveram seguimento ambulatorial pelo período
mínimo de um ano. As consultas ambulatoriais foram realizadas nos meses 1, 3, 6, 9
e 12 após o procedimento terapêutico, e o resultado final, os sinais e sintomas
apresentados ao final de 12 meses de seguimento foram anotados em protocolo de
estudo e em planilhas.
Os critérios de inclusão foram:
- pacientes com diagnóstico de FCCd submetidos a tratamento endovascular;
- pacientes com AIC com dor incoercível e/ou sintomas de III, IV, V ou VI NCs com
duração menor ou igual há seis meses e submetidos a tratamento endovascular.
Os critérios adotados para exclusão foram:
- recusa do paciente (ou responsável) em participar do projeto de pesquisa;
Casuística e Método
42
- preenchimento incompleto do prontuário, com impossibilidade de avaliação das
variáveis do estudo;
- pacientes com AIC assintomático;
- pacientes com AIC com sintomas de III, IV, V ou VI NCs com duração maior que
seis meses;
- pacientes com AIC com teste de oclusão positivo para déficit neurológico;
- pacientes com AIC associado a aneurisma intracraniano em outra localização,
não tratado.
Desta forma, cada paciente do estudo foi avaliado quanto à presença de dor
antes e após o tratamento. Foi verificado o comprometimento dos NCs acometidos
na região do SC (III, IV, V e VI) e registrado se houve melhora após a instituição do
tratamento.
Os pacientes com FCCd foram avaliados ainda quanto à possível etiologia
traumática da lesão, assim como mecanismo de trauma e o tempo decorrido entre o
trauma e o tratamento. Nesse mesmo grupo de pacientes, foram observadas a
presença de proptose e hiperemia ocular e sua melhora após o tratamento.
Nos pacientes com AICs, foram estudados a eventual etiologia traumática da
lesão, a presença de outros aneurismas e o surgimento de aneurismas “de novo” ou
novos déficits neurológicos durante o seguimento ambulatorial. Para os pacientes
com AIC, foi indicado tratamento somente para os que apresentavam sintomas há
menos de seis meses e/ou dor incoercível.
Assim, se havia déficit de determinado NC antes do tratamento, este foi
anotado como “disfunção”; se não havia déficit, foi assinalado como “preservado”.
Após o tratamento, considerou-se “disfunção” de NC caso não tenha ocorrido
melhora no déficit; “disfunção leve” em havendo melhora parcial; e foi registrado
Casuística e Método
43
como “preservado” quando não havia comprometimento, ou quando houve melhora
completa do déficit do nervo acometido.
Quantos às FCCd, a dor, a hiperemia ocular e a proptose foram anotadas
antes do tratamento como “não” quando ausentes e “sim” caso presentes. Após o
tratamento, estes mesmos sinais e sintomas foram assinalados com “não” quando
ausentes ou melhora completa; “sim” quando estivessem presentes sem melhora em
relação à avaliação inicial; e considerados “presente em menor intensidade” quando
ocorreu melhora parcial.
Em relação à dor nos AICs, a sua ocorrência foi classificada da seguinte
maneira: “incoercível” ou de “forte intensidade” quando não cedia com uso de
analgésico comum (dipirona ou paracetamol); “moderada intensidade” quando cedia
com uso de analgésicos comum; “leve intensidade” quando era suportável e não era
necessário o uso constante de analgésicos; e “sem dor” quando ausente.
Além dos parâmetros acima mencionados, foram registrados os dos dados
referentes à idade e ao gênero dos pacientes, lateralidade da lesão e tipo de
intervenção utilizada para seu tratamento. As complicações resultantes do
tratamento
endovascular
foram
avaliadas
quanto
à
piora
neurológica
ou
complicações técnicas e também foram registradas em protocolo de estudo.
Os dados obtidos foram incluídos em planilhas e apresentados em forma
descritiva, tabelas e gráficos.
Casuística e Método
44
3.2 - Os procedimentos endovasculares
3.2.1 - O exame angiográfico inicial
Os pacientes foram submetidos a exames diagnósticos e procedimentos
terapêuticos realizados no Serviço de Diagnóstico por Imagem do Hospital Central
da Santa Casa de Misericórdia de São Paulo em aparelho de angiografia cerebral
Philips V3000, que possui arco rotatório possibilitando a realização de múltiplas
angulações, recursos de sobreposição de máscaras ósseas e congelamento de
imagens com contraste durante fluoroscopia (“road-mapping”).
Os exames foram realizados sob anestesia local com Xylocaína 2%, através
de punção da artéria femoral comum e progressão de introdutor vascular valvulado
com mecanismo antirrefluxo, com 4 ou 5 French (F) de calibre, pela técnica de
Seldinger(98). Foram utilizados cateteres Vertebral, Simmons II ou Head Hunter 4 ou
5F, apoiados por guia hidrofílico 0,035”. Foi utilizado contraste iodado não iônico de
baixa osmolaridade.
O estudo angiográfico inicial incluía a avaliação das ACIs, ACEs e vertebrais
nos tempos arterial, capilar e venoso, por meio da realização de incidências em
posteroanterior, perfil e oblíquas. Nos AIC a análise das angiografias com múltiplas
incidências foi realizada utilizando-se sobreposição de máscaras ósseas permitindo
a visibilização das clinoides para confirmação da localização infraclinóidea dos
mesmos.
Foram avaliados os seguintes parâmetros:
- patência das artérias constituintes do polígono de Willis nos pacientes com
aneurismas cerebrais, com enfoque especial às artérias comunicantes posterior e
Casuística e Método
45
anterior, por meio de compressão carotídea cruzada ou compressão carotídea
durante injeção de contraste pelas artérias da circulação posterior;
- tamanho dos aneurismas: de acordo com sua medida em mm, os aneurismas
foram classificados em pequenos (até 10 mm), grandes (11 a 25 mm) e gigantes
(maiores que 25 mm), tomando-se como referência o diâmetro da ACI no
segmento supraclinóideo (cerca de 4 mm);
- forma dos aneurismas: saculares ou fusiformes;
- existência e dimensão do colo dos aneurismas;
- nos casos de FCCd foi realizada manobra de Allcoock (31)para tentar dimensionar o
orifício fistular e obter sua localização precisa;
- nos pacientes com FCCd, foi avaliada a fase capilar do território carotídeo
acometido, para avaliação de “roubo” do fluxo pela fístula;
- lateralidade dos aneurismas ou das fístulas;
- verificação de lesões associadas (outros aneurismas, aterosclerose intracraniana e
das bifurcações carotídeas).
Após a avaliação clínica e dos exames de imagem, era proposto e explicado o
tratamento. Caso concordasse, era assinado o termo de consentimento. Os casos
foram realizados pelos médicos e estagiários da equipe de Neurocirurgia
Endovascular.
3.2.2 - O procedimento para tratamento endovascular das FCCs
Os procedimentos foram realizados sob anestesia geral e iniciavam-se com a
realização de punção da artéria femoral comum e progressão, pela técnica de
Seldinger(98), de introdutor vascular valvulado 6F com mecanismo antirrefluxo. A
Casuística e Método
46
seguir, os pacientes eram então submetidos à heparinização sistêmica, utilizando-se
heparina sódica, em dose inicial de 110 UI/Kg e manutenção com 20 UI/Kg/h.
Progrediu-se então um cateter guia Envoy XB® (Cordis Neurovascular, Miami
Lakes, Fla) 6F, apoiado em guia hidrofílico, que era posicionado na ACI originária da
fístula. Realizávamos estudo angiográfico inicial para avaliar a fase capilar do
território carotídeo acometido e eventual “roubo” do fluxo pela fístula. Caso existisse
dependência do suprimento da artéria acometida, e houvesse falha na oclusão da
fístula (Fig. 17, 18), o teste de oclusão deveria ser considerado antes do fechamento
da carótida lesada, conforme aponta a literatura consultada(31). Posteriormente,
progrediu-se, por cateterismo coaxial, um microcateter Magic MADPE® (Balt,
Montmorency, França) montado com balão Goldball® (B1 ou B2)
(Balt,
Montmorency, França ). O balão era então insuflado e, após confirmação da oclusão
da FCC e patência da ACI, era destacado no seio cavernoso, ocluindo o orifício da
fístula. Em alguns casos, foi necessária a colocação de um segundo balão
destacável para a oclusão da fístula.
Quando não se conseguiu posicionar o balão e obter a oclusão seletiva da
FCC, ou nas situações de falha no tratamento inicial, era considerada a oclusão do
pertuito fistular, através da oclusão carotídea. Conforme ressaltado anteriormente, o
teste de oclusão com balão poderia ser realizado antes da oclusão definitiva. Para
isso, um balão destacável era insuflado e posicionado na ACI junto ao orifício
fistular, de forma a ocluir a artéria e a fístula. Após isso, um balão de segurança, era
progredido e posicionado imediatamente proximal ao primeiro. Inicialmente era
insuflado o primeiro balão junto ao pertuito fistular, e a seguir, insuflado o balão de
segurança. Posteriormente, destacava-se o primeiro balão junto à fístula. O balão de
segurança servia como apoio, para evitar a eventual migração do primeiro balão,
Casuística e Método
47
quando tracionássemos o microcateter para destacá-lo. A seguir, liberava-se o balão
de segurança.
Figura 17 - Angiografia carotídea esquerda em incidência frontal (A) e perfil (B)
demonstrando FCCd de alto fluxo, e mínimo fluxo residual para o território carotídeo
esquerdo.
Figura 18 - Angiografia carotídea esquerda em incidência lateral (A) e frontal (B)
demonstrando FCCd, com importante opacificação concomitante do território carotídeo
esquerdo, demonstrando a dependência do fluxo dessa artéria.
Casuística e Método
48
Em um paciente, que já possuía a ACI ocluída, a FCC foi acessada através
da artéria comunicante anterior. Para isso, um cateter guia Envoy XB® (Cordis
Neurovascular, Miami Lakes, Fla) 6F foi posicionado na ACI contralateral. A FCC foi
acessada com um microcateter Excelsior 1018® (Boston Scientific, Natick, EUA),
apoiado por um microguia Transend Platinum® (Boston Scientific, Natick, EUA)
0,014” e ocluída com EPDC - GDC® (Boston Scientific, Natick, EUA) e MicroPlex
Coiling System (MicroVention, Inc., Aliso Viejo, CA).
Em todos os casos, realizava-se controle angiográfico final da ACI tratada, da
carótida contralateral e das vertebrais. A heparinização sistêmica era então
interrompida e revertida a ação da heparina ativa utilizando-se 1 ml de protamina
para cada 1000 UI de heparina a ser revertida.
Os pacientes eram encaminhados à Unidade de Terapia Intensiva
imediatamente após o procedimento e mantidos por no mínimo 24 horas sob
monitorização neurológica.
3.2.3 - O procedimento para tratamento endovascular dos aneurismas
intracavernosos
Todos os pacientes com AIC foram tratados com oclusão da ACI portadora,
após realização de teste de oclusão da ACI não demonstrar positividade para
déficits neurológicos.
Os procedimentos foram realizados sob anestesia local e iniciavam-se com a
realização de punção das artérias femorais comuns e progressão, pela técnica de
Seldinger(98), de introdutor vascular valvulado 6F à direita e 5F à esquerda com
mecanismos antirrefluxo. Os pacientes eram então submetidos a heparinização
sistêmica conforme já descrito anteriormente para o tratamento das FCCd.
Casuística e Método
49
O procedimento era iniciado com o teste de oclusão (Fig. 19), conforme
protocolo de nossa Instituição, que representa o modelo preconizado por Frudit
(1997)(67). Durante o teste, os pacientes foram monitorizados por um neurocirurgião
e um anestesista. Os pacientes foram mantidos sob monitorização com oxímetro de
dedo, cardioscópio, pressão arterial média não-invasiva e acesso venoso periférico.
Após o aceso arterial, um cateter guia Envoy XB® (Cordis Neurovascular,
Miami Lakes, Fla) 6F era posicionado na ACI portadora do AIC. Por este, progrediase cateter com balão Ultrasoft® 6X20 (Boston Scientific, Natick, EUA) apoiado por
microguia Transend Platinum® (Boston Scientific, Natick, EUA) 0,014”, ambos
posicionados no segmento petroso da ACI. Paralelamente, pelo acesso femoral à
esquerda, era progredido um cateter diagnóstico Simmons II ou Vertebral para
realização dos controles angiográficos.
Realizava-se injeção do meio de contraste durante fluoroscopia e “congelavase” esta imagem. Procedia-se a insuflação do balão sob “road-mapping”, o que
permitia o controle da insuflação do balão sem distensão das paredes da carótida. O
cateter guia era mantido sob infusão contínua de solução fisiológica 0,9% contendo
heparina (5000 UI para 500 ml) através do orifício distal. A partir do momento da
insuflação do balão iniciava-se a cronometragem do teste de oclusão, com duração
de 30 minutos, durante os quais eram realizadas avaliações neurológicas e
angiográficas.
Os exames neurológicos eram realizados aos 0, 10, 20 e 30 minutos de teste
de oclusão e incluíam:
- avaliação do aparecimento de sintomas subjetivos (por exemplo, cefaleia ou
turvação visual);
- avaliação do nível de consciência;
Casuística e Método
50
- avaliação da orientação temporal e espacial;
- avaliação da força muscular nos 4 membros;
- avaliação subjetiva da sensibilidade;
- avaliação da linguagem: solicitava-se ao paciente a enunciação de seu nome, dos
dias da semana e dos meses do ano e a nomeação de objetos simples conhecidos
por ele, a realização de ordens simples e complexas, realização de cálculos e
avaliação da compreensão de sentenças, levando-se em conta o nível sociocultural
de cada paciente.
A oclusão carotídea era confirmada por angiografia carotídea ipsilateral ao
aneurisma (Fig. 19D e E), observando-se, eventualmente, a existência de
opacificação da carótida interna supraclinóidea através de anastomoses com a
carótida externa.
Eram realizadas sequencialmente angiografias carotídeas contralaterais (Fig.
19A, B e C) e vertebrais (Fig. 19F), observando-se a patência das artérias
comunicantes anterior e posterior. Especial atenção era dada à existência de retardo
circulatório no hemisfério cerebral temporariamente ocluído, levando-se em
consideração os tempos (fases) arterial, capilar e venoso das angiografias (Fig. 19A,
B e C).
Admitiu-se como satisfatório retardo de até dois segundos no aparecimento
das primeiras veias do hemisfério com o suprimento carotídeo ocluído em relação ao
hemisfério oposto.
Casuística e Método
51
Figura 19 - Teste de oclusão da artéria carótida interna esquerda. A-C - angiografia
carotídea direita em incidência frontal; A – fase arterial; B – fase capilar; C – fase venosa; D
– injeção do meio de contraste na artéria carótida comum esquerda, demonstrando a
oclusão da ACI esquerda (perfil); E – posicionamento do balão insuflado na ACI esquerda
(perfil); F – injeção do meio de contraste na artéria vertebral esquerda, durante o teste de
oclusão, demonstrando a patência da artéria comunicante posterior e opacificação do
território carotídeo esquerdo, assim como da ACI esquerda supraclinóidea e do AIC.
Foram considerados negativos os testes de tolerância à oclusão em que não
ocorreu aparecimento de déficit neurológico e positivos aqueles em que ocorreu
aparecimento de qualquer alteração no exame neurológico. Neste caso o balão foi
esvaziado imediatamente, o teste de oclusão interrompido e o paciente excluído do
nosso estudo.
Nos pacientes com teste de tolerância à oclusão negativos para déficits,
procedia-se à irrigação da carótida interna abaixo do balão com solução fisiológica
através do cateter para diagnóstico, esvaziava-se e retirava-se o balão utilizado para
teste. A seguir, era progredido um conjunto de microcateter Excelsior 1018® (Boston
Scientific, Natick, EUA), apoiado em microguia Transend Platinum® (Boston
Scientific, Natick, EUA) 0,014” ou um microcateter Vasco® 18 (Balt Extrusion,
Montmorency, França) apoiado por microguia Steel® (Balt Extrusion, Montmorency,
Casuística e Método
52
França) 0,012”, que eram posicionados no interior do aneurisma. A partir dai foram
liberadas EPDC - GDC® (Boston Scientific, Natick, MA) e MicroPlex Coiling System
(MicroVention, Inc., Aliso Viejo, CA) de forma a ocluir a ACI e o aneurisma.
Em dois pacientes com diagnóstico de pseudoaneurisma intracavernoso, a
oclusão da ACI foi obtida por meio de balões destacáveis. Assim, após o teste de
oclusão,
foram
Montmorency,
progredidos
França),
sucessivamente
montados
em
dois
balões
Goldball®
(Balt,
cateteres
Magic
MADPE®
(Balt,
Montmorency, França) com mandril próprio. O primeiro balão era posicionado e
insuflado na ACI cavernosa, imediatamente antes do segmento acometido pelo
aneurisma. Simultaneamente, um balão de segurança era posicionado e insuflado
proximalmente ao primeiro balão. A seguir, destacava-se o primeiro balão e após, o
balão de segurança.
Em um único paciente, com diagnóstico de pseudoaneurisma após lesão
inadvertida da ACI durante neurocirurgia, o teste de oclusão e o procedimento
terapêutico foram realizados sob anestesia geral, pois o mesmo foi encaminhado
anestesiado do centro cirúrgico à sala de angiografia cerebral. Assim, os critérios
adotados para confirmar a negatividade do teste de oclusão foram basicamente os
critérios angiográficos mencionados anteriormente.
Em todos os casos, realizava-se controle angiográfico final da ACI tratada, da
carótida contralateral e das vertebrais. A heparinização sistêmica era interrompida e
revertida a ação da heparina ativa utilizando-se 1 ml de protamina para cada 1000
UI de heparina.
Os pacientes eram encaminhados à Unidade de Terapia Intensiva
imediatamente após o procedimento e mantidos por 24 horas em decúbito
horizontal, sob hidratação endovenosa e sob controle rigoroso da pressão arterial.
Casuística e Método
53
No primeiro dia pós-operatório era realizada a elevação gradual e progressiva do
decúbito dos pacientes até a posição sentada, sempre sob supervisão de médico da
equipe de neurocirurgia endovascular e, não havendo intercorrências, recebiam alta
da UTI no final do dia. No segundo dia os pacientes podiam levantar-se e ficar em
pé com auxílio, sob supervisão médica.
Casuística e Método
54
4. RESULTADOS
55
O tratamento endovascular das fístulas carotidocavernosas foi realizado em
10 pacientes, sendo quatro do gênero masculino e seis do feminino (Fig. 20). A
média de idade dos pacientes tratados foi de 35,3 anos, apresentando os limites de
variação entre 10 e 66 anos (Fig. 21 e Tab. 1). Das FCCs tratadas, seis localizavamse à esquerda e quatro à direita (Tab. 1). A história de trauma prévio foi constatada
em nove (90%) pacientes, com mecanismos diversos de trauma (Tab. 2). Em três
pacientes houve perda de consciência e coma após o trauma (Tab. 2), denotando
trauma de maior gravidade.
40%
60%
Masculino
Feminino
Figura 20 - Gráfico: distribuição por gênero dos pacientes com FCCd.
Resultados
56
Figura 21 - Gráfico: distribuição das idades dos pacientes com FCCd.
Tabela 1 – Distribuição das idades, gêneros e lateralidade das FCCd tratadas.
Iniciais
Idade
Gênero
Lado
AMAR
51 anos
Feminino
Direita
ASL
30 anos
Feminino
Esquerda
BMS
10 anos
Feminino
Esquerda
FFS
39 anos
Masculino
Esquerda
LCF
66 anos
Feminino
Direita
MAE
28 anos
Masculino
Esquerda
SMFS
30 anos
Masculino
Esquerda
SAL
45 anos
Feminino
Direita
MBSS
28 anos
Feminino
Esquerda
PFAJ
26 anos
Masculino
Direita
Resultados
57
Tabela 2 – Distribuição dos pacientes com FCCd de acordo com a existência de
TCE e mecanismo de trauma.
Iniciais
Idade
Trauma
Mecanismo de trauma
Coma após
o trauma
AMAR
51 anos
Não
------
Não
ASL
30 anos
Sim
Acidente de moto sem capacete
Sim
BMS
10 anos
Sim
Acidente automobilístico
Sim
FFS
39 anos
Sim
Impacto de pneu no crânio
Não
LCF
66 anos
Sim
Queda de própria altura
Não
MAE
28 anos
Sim
Acidente automobilístico
Não
SMFS
30 anos
Sim
Acidente de moto
Não
SAL
45 anos
Sim
Trauma cirúrgico direto
Não
MBSS
28 anos
Sim
Acidente de moto sem capacete
Sim
PFAJ
26 anos
Sim
Acidente de moto
Não
A média do intervalo de tempo entre o trauma e o tratamento definitivo neste
grupo de pacientes foi de 6,94 meses, variando de um a 21 meses (Fig. 22). A
oclusão da ACI foi o método empregado em sete casos, sendo que em cinco destes
foi realizada por balão (Fig. 23) e em dois por meio de EPDC. Os três casos
restantes foram tratados com a oclusão da própria fístula por balão (Fig. 24). No
total, foram realizados 13 intervenções para tratamento de 10 pacientes (Tab. 3).
Resultados
58
Figura 22 - Gráfico: tempo decorrido entre o trauma e o tratamento da FCCd.
Figura 23 - Tratamento endovascular de paciente com FCCd por meio de oclusão da ACI
direita com balão. Em A, observa-se o primeiro balão posicionado junto ao orifício fistuloso e
um segundo balão de segurança. Em B, angiografia carotídea esquerda em incidência
frontal mostrando opacificação satisfatória das artérias cerebrais anterior e média
contralaterais.
Resultados
59
Figura 24 - Angiografia carotídea esquerda antes (A e B) e após (C-F) o tratamento
endovascular da FCCd. A e B: opacificação precoce do SC esquerdo, com desvio do fluxo
sanguíneo cerebral; C e D: opacificação normal do hemisfério cerebral esquerdo após o
tratamento; E e F: angiografia carotídea demonstrando o posicionamento do balão (seta)
dentro do SC esquerdo (A-C-E: incidência frontal; B-D-F: incidência lateral).
Resultados
60
Tabela 3 – Distribuição dos pacientes com FCCd de acordo com o intervalo de
tempo decorrido após o trauma, o número e a modalidade do procedimento
terapêutico definitivo empregado.
Iniciais
Intervalo de
tempo do
trauma até
tratamento
AMAR
Trauma
Número de
procedimentos
endovasculares
terapêuticos
Procedimento
definitivo
Não
2
Oclusão ACI com
balão
ASL
19 meses
Sim
1
Oclusão seletiva da
fístula com balão
BMS
21 meses
Sim
1
Oclusão ACI com
EPDC
FFS
3 meses
Sim
1
Oclusão seletiva da
fístula com balão
LCF
1,5 meses
Sim
1
Oclusão ACI com
balão
MAE
4 meses
Sim
1
Oclusão ACI com
balão
SMFS
1 mês
Sim
1
Oclusão seletiva da
fístula com balão
SAL
1 mês
Sim
1
Oclusão ACI com
EPDC
MBSS
9 meses
Sim
3
Oclusão ACI com
balão
PFAJ
3 meses
Sim
1
Oclusão ACI com
balão
Resultados
61
Em dois pacientes submetidos a oclusão da ACI para tratamento definitivo da
FCC, foram necessários mais de um procedimento. Em um paciente foi conseguida
a oclusão seletiva da FCC com balão (Fig. 25), e melhora clínica por 24 horas. Após
o retorno da sintomatologia, a paciente repetiu AGC que evidenciou reaparecimento
da FCC, provavelmente por rotura do balão, sendo realizada a oclusão da ACI e da
FCC para seu tratamento definitivo. Fato semelhante ocorreu em outra paciente, que
foi submetida a duas oclusões seletivas da FCC. Houve melhora temporária dos
sintomas, sendo necessário um terceiro procedimento para oclusão da ACI e da
FCC para o tratamento definitivo. Uma das pacientes submetida à oclusão da ACI e
da fístula com EPDC apresentou a FCC após cirurgia transesfenoidal. Essa paciente
havia sido submetida inicialmente à oclusão da ACI proximal para tratamento de um
pseudoaneurisma, e desenvolveu tardiamente uma FCC. Posteriormente, o acesso
à ACI cavernosa foi obtido pela ACI contralateral, através da artéria comunicante
anterior. Assim, atingiu-se a FCC e realizou-se sua embolização. Uma paciente
submetida à oclusão seletiva da fístula evoluiu com formação de pseudoaneurisma
em ACI cavernosa, sem necessidade de nova intervenção (Fig. 26).
Resultados
62
Figura 25 - Radiografias simples de crânio em incidências frontal (A) e lateral (B) após
tratamento endovascular de FCCd evidenciando o posicionamento do balão (seta) no
interior do SC.
Resultados
63
Figura 26 - Angiografia carotídea esquerda em incidência frontal antes (A) e após (B-E) o
tratamento endovascular de FCCd. Em C, observa-se o aspecto final, após o procedimento,
com o balão insuflado no interior do SC; em D e E observa-se pseudoaneurisma em ACIc;
em E, observa-se, além do pseudoaneurisma, a válvula do balão posicionado no interior do
SC.
Resultados
64
A avaliação prévia dos pacientes portadores de FCC evidenciou que a dor
estava presente em nove deles, ausente, portanto, em apenas um caso. A hiperemia
ocular, a proptose e o comprometimento do nervo oculomotor estavam presentes em
todos os pacientes, sendo que em um a disfunção desse nervo era leve (Fig. 27,
28). O nervo troclear estava com sua função alterada em quatro pacientes, o
trigêmeo em um e o nervo abducente em sete (Fig. 28).
Figura 27 - Gráfico: manifestações clínicas nos pacientes portadores de FCCd antes e após
o tratamento endovascular.
Após a intervenção terapêutica final, notou-se que todos os pacientes
apresentavam-se sem dor ou proptose ocular (Fig. 29). Observamos hiperemia
ocular residual discreta em dois pacientes (Fig. 27). A função do nervo oculomotor
se manteve alterada em três pacientes, sendo considerada leve em todos. O
comprometimento do nervo troclear se manteve em um paciente, também em grau
leve. A disfunção do nervo trigêmeo se manteve no único paciente que a possuía
Resultados
65
antes da intervenção. Em relação ao déficit do nervo abducente, houve melhora total
em quatro pacientes e parcial nos três restantes, do total de sete acometidos (Fig.
28).
100%
90%
80%
70%
60%
50%
40%
30%
20%
10%
0%
10
30
10
10
30
40
70
100
90
70
90
90
70
60
30
III NC pré III NC IV NC préIV NC pós V NC pré V NC pós VI NC préVI NC pós
pós
Disfunção leve
Disfunção
Preservado
Figura 28 - Gráfico: função dos NCs nos pacientes com FCCd antes e após o tratamento
endovascular.
Figura 29 - Fotografia de paciente antes (A) e após (B) o tratamento endovascular de FCCd,
demonstrando importante melhora no edema palpebral à esquerda.
Resultados
66
O tratamento endovascular de aneurismas do segmento cavernoso da artéria
carótida interna foi realizado em 26 pacientes. Nesse pacientes, a história de trauma
prévio foi constatada em três (11,5%) pacientes (Fig. 30) que possuíam, portanto,
pseudoaneurisma traumático, representando um grupo à parte. Além desses, outros
três pacientes portadores de AIC gigantes foram submetidos a teste de oclusão,
porém apresentaram déficits durante sua realização, não sendo, portanto,
candidatos a oclusão terapêutica da ACI. Assim, esses pacientes não foram
incluídos no presente trabalho.
Figura 30 - Gráfico: distribuição dos pacientes com AIC de acordo com a etiologia do
aneurisma.
No grupo dos pacientes com aneurismas não traumáticos, dois eram do
gênero masculino e 21 do feminino (Fig. 31). A média de idade dos pacientes
tratados foi de 54,35 anos, variando de 24 a 70 anos (Fig. 32). Dos aneurismas
tratados, 13 localizavam-se à esquerda e 10 à direita (Tab. 4).
Resultados
67
Figura 31 - Gráfico: distribuição por gênero dos pacientes com AIC não traumáticos.
Figura 32 - Gráfico: distribuição das idades dos pacientes com AIC.
Resultados
68
Tabela 4 – Distribuição dos pacientes com AIC por gênero, idade e lateralidade da
lesão.
Iniciais
Gênero
Idades
Lado
ABS
Feminino
61 anos
ESQ
ALS
Feminino
67 anos
DIR
ABS
Feminino
49 anos
ESQ
BRM
Feminino
49 anos
ESQ
BPF
Feminino
64 anos
ESQ
DSS
Feminino
67 anos
ESQ
EBA
Masculino
24 anos
ESQ
JPS
Feminino
61 anos
ESQ
LCM
Feminino
29 anos
DIR
MS
Feminino
39 anos
DIR
MCGC
Feminino
52 anos
ESQ
MCGC
Feminino
57 anos
DIR
MFSA
Feminino
55 anos
DIR
MJAL
Feminino
48 anos
ESQ
MJJM
Feminino
64 anos
ESQ
MPF
Feminino
53 anos
DIR
MRSA
Feminino
52 anos
DIR
NPF
Feminino
57 anos
ESQ
NSM
Masculino
54 anos
DIR
PFS
Feminino
70 anos
DIR
RPFB
Feminino
58 anos
ESQ
SMOS
Feminino
64 anos
DIR
ZFA
Feminino
56 anos
ESQ
Resultados
69
Observamos que todos os 23 pacientes do grupo de aneurismas espontâneos
apresentavam aneurismas gigantes, ou seja, com diâmetro maior que 25 mm.
Somente uma paciente desse grupo (3,9%) possuía outro aneurisma no momento
do diagnóstico, localizado na ACI contralateral, junto à origem da artéria
comunicante posterior (Fig. 33A e B) (Tab. 5). Esse aneurisma foi submetido à
clipagem
microcirúrgica
previamente
à
oclusão
terapêutica
da
ACI.
Interessantemente, essa mesma paciente apresentou HSAe seis meses após a
oclusão da ACI, sendo diagnosticado um novo aneurisma no topo da artéria basilar.
Essa lesão é chamada, portanto de aneurisma “de novo”, e foi submetida a
embolização com EPDC na ocasião do seu diagnóstico (Fig. 33C e D).
Figura 33 - A – Angiografia carotídea direita, em incidência frontal, durante teste de oclusão
de ACI esquerda mostrando aneurisma no segmento comunicante da ACI direita; B –
angiografia vertebral esquerda, em incidência towne, durante teste de oclusão de ACI
esquerda, não evidenciando aneurisma em artéria basilar; C – angiografia vertebral
esquerda realizada seis meses após oclusão de ACI esquerda mostrando aneurisma em
topo de artéria basilar; D – angiografia vertebral esquerda evidenciando oclusão do
aneurisma de topo de artéria basilar.
Resultados
70
Tabela 5 – Distribuição dos AIC de acordo com seu tamanho, presença de outros
aneurismas, procedimento terapêutico empregado para tratamento e o surgimento
de déficits após o tratamento.
Iniciais
Tamanho do
aneurisma
Outros
aneurismas
ABS
Gigante
Não
ALS
Gigante
Não
ABS
Gigante
Não
BRM
Gigante
Não
BPF
Gigante
Não
DSS
Gigante
Não
EBA
Gigante
Não
JPS
Gigante
Sim
LCM
Gigante
Não
MS
Gigante
Não
MCGC
Gigante
Não
MCGC
Gigante
Não
MFSA
Gigante
Não
MJAL
Gigante
Não
MJJM
Gigante
Não
MPF
Gigante
Não
MRSA
Gigante
Não
NPF
Gigante
Não
NSM
Gigante
Não
PFS
Gigante
Não
RPFB
Gigante
Não
SMOS
Gigante
Não
ZFA
Gigante
Não
Procedimento
terapêutico
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Oclusão ACI com
EPDC
Déficits novos
após
tratamento
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Não
Sim
Não
Não
Não
Resultados
71
A opção terapêutica empregada em todos os pacientes desse grupo foi a
oclusão da ACIc portadora da lesão com EPDC, após o teste de oclusão ser
negativo para déficits (Fig. 34). Uma paciente, mesmo tendo o teste de oclusão da
ACI negativo para déficits, evoluiu com déficit motor contralateral ao lado ocluído
cerca de 72 horas após o procedimento, sendo a única complicação observada
nesse grupo de pacientes.
Figura 34 - A – EPDC na topografia do SC e ACI; B e C – angiografia carotídea (em perfil)
mostrando oclusão da ACI e opacificação da ACE; D – angiografia vertebral (em perfil) após
oclusão de ACI evidenciando opacificação parcial do território carotídeo correspondente.
Na avaliação pré-operatória a dor retro-orbitária e periocular estava presente
em 21 casos (91,3%), sendo caracterizada como de forte intensidade ou incoercível
(não responsiva a analgésicos comuns) em 12 pacientes (52,1%) e de moderada
intensidade nos nove pacientes restantes (39,1%) (Fig. 35). O comprometimento do
Resultados
72
nervo oculomotor ipsilateral ao aneurisma foi observado em 21 pacientes (91,3%). A
lesão do nervo troclear foi vista em 11 pacientes (47,8%), sendo considerada leve
em um destes. Observamos o comprometimento do nervo trigêmeo em 10 pacientes
(43,4%) e o comprometimento do nervo abducente foi constatado em 19 pacientes
(82,6%) (Fig. 36).
Figura 35 - Gráfico: presença de dor retro-orbitária em pacientes portadores de AIC antes e
após o tratamento endovascular.
Na avaliação pós-operatória constatamos a ausência de dor em 15 pacientes
(65,2%). A sintomatologia álgica estava presente em oito casos (34,8%), sendo
caracterizada como de moderada intensidade em dois (8,7%) e de leve intensidade
em seis pacientes (26,1%) (Fig. 35). Antes do tratamento, a dor retro-orbitária estava
presente em 91,3% dos pacientes. Após o tratamento, observamos que a dor estava
presente em somente 34,8%, e com intensidade menor. O comprometimento do
nervo oculomotor manteve-se presente em 11 pacientes (47,8%), sendo que em
Resultados
73
sete com menor intensidade em relação à avaliação precedente ao tratamento. O
nervo troclear manteve-se clinicamente alterado em três pacientes, todos em menor
intensidade. A lesão do nervo trigêmeo manteve-se evidente em quatro pacientes,
também todas em menor intensidade. A disfunção do nervo abducente pôde ser
constatada em 11 pacientes após a intervenção, sendo que em nove com menor
intensidade (Fig. 36).
Figura 36 - Gráfico: função dos NCs em pacientes com AIC antes e após o tratamento
endovascular.
Três pacientes portadores de pseudoaneurisma traumático da ACIc foram
tratados com oclusão de ACI. A oclusão da ACIc com balões foi feita em dois
pacientes (Fig. 37) e com EPDC em um paciente. Desses, a etiologia iatrogênica foi
observada em um caso, decorrendo de abordagem prévia da região selar por
método endoscópico transesfenoidal. Essa mesma paciente evoluiu posteriormente
com a formação de FCCd, sendo, portanto, incluída em dois grupos desse trabalho.
Resultados
74
Figura 37 - Em A, posicionamento dos balões em ACI após sua oclusão (perfil). Em B,
angiografia carotídea (incidência lateral) confirmando oclusão da ACI na sua origem.
Nesse subgrupo de pacientes com pseudoaneurisma foram incluídos
pacientes com idades de 32, 35 e 42 anos, correspondendo, portanto, a idades
geralmente acometidas por TCE. Um único paciente foi submetido a tratamento
imediatamente após a lesão traumática, ainda durante mesmo ato anestésico,
correspondendo ao caso que sofreu lesão durante procedimento cirúrgico e,
portanto, não foram anotadas queixas relativas a déficits de NCs.
Um outro paciente apresentava somente déficit de VI nervo antes do
tratamento; o último paciente desse subgrupo apresentava déficit de NCs III e VI,
além de dor retro-ocular. Após o tratamento, todos os pacientes ficaram livres de
sintomas (Tab. 6).
Resultados
75
Tabela 6 – Distribuição dos pacientes com pseudoaneurisma de ACIc de acordo
com a idade, lateralidade da lesão, o procedimento empregado para o tratamento e
a sintomatologia prévia e após o tratamento endovascular.
Iniciais
Idade
(anos)
Lado
FNC
42
ESQ
RSB
32
ESQ
SAO
35
DIR
Procedimento
terapêutico
Oclusão ACI
com balões
Oclusão ACI
com EPDC
Oclusão ACI
com balões
Dor
Antes do tratamento
Déficit
NC
NC
NC
III
IV
V
NC
VI
Dor
Após o tratamento
Déficit
NC
NC
NC
III
IV
V
NC
VI
S
S
N
N
S
N
N
N
N
N
N
N
N
N
S
N
N
N
N
N
N
N
N
N
N
N
N
N
N
N
Legenda: S – sim; N – não; ESQ – esquerdo; DIR - direito.
Resultados
76
5. DISCUSSÃO
77
As FCCs diretas representam lesões de alto fluxo, correspondendo ao subtipo
A da classificação das fístulas carotidocavernosas(31). As FCCd geralmente têm
etiologia traumática(29,35,37), como encontrado em 90% dos pacientes do presente
estudo. O único paciente com esse diagnóstico que não tinha histórico de trauma
craniano, supostamente apresentou a fístula por rotura de um aneurisma
intracavernoso. Tal situação é bem documentada na literatura, respondendo por até
25% das FCCs diretas de origem não traumática(30,38).
As FCCd ocorrem geralmente em pacientes jovens, do gênero masculino(30),
tendo em vista que esse é o grupo mais frequentemente acometido por TCE.
Diferentemente, a distribuição por gênero encontrada no grupo de pacientes em
nossa pesquisa predominou em 60% dos casos no gênero feminino. Por outro lado,
a média de idade dos pacientes tratados, que foi de 35,3 anos, corrobora os dados
obtidos da literatura(30,31). Uma paciente, embora não tenha correlação com TCE,
apresentou FCCd após laceração inadvertida da ACI, durante cirurgia para
ressecção de tumor de base do crânio. Tal etiologia também está bastante
documentada na literatura(30,37,38,44,99).
Em nossa casuística, vários mecanismos de trauma foram apontados como
responsáveis pelo TCE, notadamente os acidentes de trânsito. Em alguns casos o
traumatismo craniano foi seguido de perda de consciência e coma, o que expressa a
implicação de mecanismos de trauma de maior gravidade.
A única paciente que não tinha etiologia traumática apresentou esvaziamento
do balão empregado para a oclusão seletiva da FCC no segundo dia após o
procedimento. Tal fato demandou uma nova sessão terapêutica com necessidade de
oclusão da ACI. O esvaziamento do balão, muitas vezes causado por perfuração do
mesmo é descrito geralmente em associação às FCCs de origem traumática, nas
Discussão
78
quais espículas ósseas oriundas de fraturas na base do crânio (38,41,42) podem causar
a perfuração do balão locado no SC, principalmente no momento em que é
insuflado.
O tempo decorrido entre o início da sintomatologia e o tratamento
endovascular da lesão foi de até 21 meses. No entanto, deve ser lembrado que os
pacientes atendidos em nosso serviço são provenientes de diversos estados do
país, por vezes de localidades sem acesso a médicos especialistas, e
encaminhados sem diagnóstico confirmado. Alguns desses pacientes tiveram
períodos de recuperação neurológica prolongada antes de ser firmado o diagnóstico
de FCCd.
Nesse contexto, pudemos observar também que os pacientes que
permaneceram sem tratamento por períodos mais prolongados, têm menor
possibilidade de melhora dos sinais e sintomas apresentados, especialmente quanto
a motricidade ocular e a hiperemia conjuntival, embora sem comprovação estatística
significativa. Tal observação confirma o exposto na literatura(31) e reforça assim a
importância de um diagnóstico precoce dessa condição, para a realização do
tratamento em período de tempo adequado.
Os dados da literatura demonstram uma exuberância clínica na apresentação
das FCCd(46). Em nossa casuística pudemos observar os mais diversos sinais
clínicos, tais como hiperemia conjuntival e proptose ocular, que estavam presentes
em todos os pacientes do presente estudo. Além disso, a dor retro-ocular era um
sintoma frequente, presente em 90% dos pacientes tratados. As taxas de
comprometimento de NCs encontradas nesta pesquisa são similares às descritas
nas publicações da mesma natureza(2,30,48), assim como a melhora dos sintomas
após o tratamento, notadamente da dor e da proptose ocular.
Discussão
79
Alguns pacientes evoluíram com oftalmoplegia. Tal fato é explicado mais
comumente pelo acometimento dos NCs responsáveis pela motricidade ocular
extrínseca(2,30). No entanto, essa condição é facilitada pelo surgimento de edema
das estruturas intraorbitárias e perioculares gerado pela ingurgitamento venoso(31).
Além disso, embora seja uma condição descrita(47), nenhum dos nossos pacientes
evoluiu com hemorragia intracerebral.
A suspeita diagnóstica de FCCd é baseada nos achados clínicos(45). Quando
há a hipótese dessa condição, geralmente a TC de crânio é solicitada como primeiro
exame de imagem, podendo evidenciar a proptose ocular e, na fase contrastada, o
ingurgitamento venoso e a tortuosidade da veia oftálmica envolvida, assim como dos
SCs(45). Foi o que ocorreu com os pacientes do presente estudo. Todos, a partir da
sintomatologia apresentada, foram submetidos à TC de crânio que mostrou as
alterações acima mencionadas, em maior ou menor grau. A sequência diagnóstica é
baseada na realização de AGC, que além de confirmar a presença da fístula e de
sua drenagem venosa, é de fundamental importância para sua classificação e
planejamento terapêutico(30,32). Ainda, é útil na pesquisa de outras lesões vasculares
associadas, tais como: pseudoaneurismas e varizes nos SCs(30), ou mesmo
trombose de outros seios venosos. Todos os pacientes do presente estudo seguiram
essa sequência diagnóstica, sendo ainda, submetidos à manobra de Allcoock(30), no
intuito de localizar a FCC e tentar estimar suas dimensões.
No que concerne ao manejo dessas lesões, uma vez diagnosticada a fístula,
todos os casos foram encaminhados para tratamento endovascular. Embora haja
relato na literatura de casos de cura espontânea de FCCd(100), não há espaço na
atualidade para a dúvida a respeito da indicação ou não do tratamento das FCCd,
pois já está bem estabelecido que todos os casos devem ser tratados (31,46). Há
Discussão
80
também consenso em relação à indicação da intervenção endovascular para tal
tratamento(31,37,51). Atualmente, os autores divergem basicamente em relação à
necessidade ou não da realização do tratamento imediatamente após o diagnóstico
da fístula, e quanto à melhor técnica endovascular a ser empregada.
Para alguns autores, entre os quais Halbach et al (1987)(49), o tratamento
deve ser precoce, principalmente se houver o surgimento de hemorragia
intracraniana, epistaxe, aumento da pressão intraocular, redução da acuidade visual
ou proptose rapidamente progressiva. Os autores que advogam a realização de
tratamento em uma fase mais tardia, cerca de uma a duas semanas após o início
dos sintomas, afirmam que, devido ao trauma recente, a ACI pode apresentar uma
grande reatividade à navegação endovascular, o que ocasionaria maior risco de
lesão endotelial(38). Em nosso estudo os pacientes foram tratados em fase tardia,
não expressando o fato de optar por uma das vertentes envolvidas. Tal situação se
deve basicamente ao longo tempo decorrido entre o início dos sintomas e o
encaminhamento
dos
pacientes
para
o
nosso
serviço
de
Neurocirurgia
Endovascular, refletindo realidade já mencionada anteriormente.
Uma vez indicado o tratamento endovascular, o tratamento ideal da FCCd é a
exclusão da fístula da circulação, com preservação do fluxo sanguíneo pela
ACI(31,32,35,38,40,41) e esse foi o objetivo buscado em todos os nosso casos. Assim,
como diretriz do nosso serviço, tentou-se o posicionamento de balão destacável de
látex dentro do SC para oclusão seletiva da fistula como procedimento inicial para
todos os pacientes. No entanto, a oclusão seletiva da FCCd, com preservação do
fluxo pela ACI só foi conseguida de forma definitiva em 30% dos pacientes. Nossa
alta taxa de insucesso (70%) na preservação do fluxo da ACI diverge
significativamente do que está registrado na literatura, que prevê uma taxa de
Discussão
81
insucesso em torno de 10-20%(53-55). Há algumas possíveis explicações para tal fato.
A causa mais comum de insucesso da oclusão seletiva da FCCd com balão é a
presença de espículas ósseas no interior do SC, que resultariam na perfuração e
esvaziamento do balão após o seu posicionamento no SC(56). Como mencionado
anteriormente, isso ocorre habitualmente no momento da insuflação do balão. Em
nossa casuística, não tivemos casos de perfuração do balão no momento de sua
insuflação. Além disso, um dos nossos casos apresentou esvaziamento do balão,
em fase tardia, correspondendo ao único da nossa casuística que não foi envolvido
em TCE. Outra explicação aceitável, e que condiz com a realidade encontrada
durante
os
nossos
procedimentos
terapêuticos,
seria
a
dificuldade
do
posicionamento do balão no interior do SC. Tal situação pode estar relacionada ao
pequeno tamanho do SC, o que dificultaria a insuflação adequada do balão (31), ou
mesmo às grandes dimensões do orifício fistuloso, que pode ter progredido durante
o longo tempo decorrido até o diagnóstico e tratamento dessas lesões.
Os pacientes submetidos à oclusão da FCCd com balão não apresentaram
complicações significativas. Não ocorreram fístulas residuais ou complicações
tromboembólicas que, embora raras, são descritas na literatura(31). No entanto, uma
paciente evoluiu com formação de pseudoaneurisma intracavernoso, que manteve
seu tamanho estável durante o seguimento angiográfico em dois anos. A formação
do pseudoaneurisma pode estar associada à oclusão incompleta do orifício
fistuloso(40,41).
Nos casos de insucesso na oclusão seletiva da fístula, os pacientes eram
candidatos à oclusão terapêutica da ACI. Na maioria dos casos, isso foi realizado
com o posicionamento de balões destacáveis ocluindo o pertuito fistular e a ACI.
Nesses pacientes, o fluxo da ACI estava direcionado quase que exclusivamente à
Discussão
82
fístula, não se fazendo necessário, portanto, a realização do teste de oclusão(31).
Não observamos complicações relacionadas à oclusão da ACI nesse subgrupo de
pacientes.
No grupo de pacientes portadores de AIC, houve uma nítida predominância
do gênero feminino, registrada em 84,6% dos casos. Tal situação está de acordo
com as publicações existentes(64,65,67,68,71), embora não exista uma explicação
conhecida para tal peculiaridade. Essas lesões costumam acometer pacientes na 5°
e 6° décadas de vida(65), manifestando-se comumente por sintomas compressivos
dos NCs(64,67,73). Em nossa amostra, a média de idade da apresentação dos
sintomas foi de 52,2 anos, o que está de acordo com os demais trabalhos
consultados na literatura(65,73,85). Se for considerado somente o grupo de pacientes
com AIC não traumáticos, a média de idade dos pacientes foi de 54,4 anos. O
aumento da faixa etária desse subgrupo é esperado, tendo em vista que as lesões
não traumáticas acometem pacientes mais idosos(65) enquanto as lesões traumáticas
incidem mais frequentemente em jovens.
Os aneurismas intracavernosos habitualmente têm sua gênese ligada a
fatores hemodinâmicos e ateroscleróticos(65). Uma pequena parcela dos casos pode
estar associada à TCE ou a lesões diretas da ACI(65), sendo, nessas situações,
denominados de pseudoaneurismas traumáticos. A etiologia traumática envolve
pacientes jovens, coincidindo com o grupo mais acometido por TCE. Na nossa
casuística, tivemos três pacientes com diagnóstico de pseudoaneurisma traumático,
representando 11,5% dos casos. Dois deles ocasionados por traumatismo craniano
fechado e somente um por lesão cirúrgica inadvertida da ACI. Esses pacientes
tinham idades entre a 3ª e 4ª décadas de vida.
Discussão
83
Todos os casos, a exceção de uma paciente previamente mencionada que
sofreu lesão direta da ACI durante ato cirúrgico, foram diagnosticados a partir da
sintomatologia de compressão dos NCs comprometidos na na região do SC. Essa é
a forma de apresentação mais comum desses aneurismas de acordo com as
publicações pesquisadas(64,65,67,73). Assim, os pacientes apresentavam um quadro
clínico de dor retro-ocular, diplopia, oftalmoparesia e neuropatia trigeminal em graus
diferentes de acometimento. Os mesmos sinais e sintomas foram encontrados por
outros autores que pesquisaram aneurismas envolvendo a ACIc (64,73). Embora seja
descrito na literatura(64,71), nenhum dos AIC do presente estudo se manifestou por
HSAe. De acordo com nosso protocolo angiográfico, é possível determinar o
posicionamento do aneurisma em relação à clinoide anterior. Assim, estimando-se
que sua localização é inferior ao anel dural, o risco de que essa lesão produza uma
HSAe é extremamente baixo(69), tornando, portanto, a indicação de seu tratamento
com base somente na apresentação clínica.
A HSAe proveniente de uma AIC constitui fenômeno raro(69). Quando
presente, ela decorre com maior frequência da expansão dos aneurismas para o
espaço subaracnóideo através da dura-máter. Esta expansão ocorre mais
frequentemente nos aneurismas com origem no segmento C2 da ACI, pelo fato da
parede medial do SC ser mais fina. Outro mecanismo para sua ocorrência seria a
erosão da parede lateral pelos aneurismas gigantes, ou ainda da parede medial,
ocasionando hemorragia através do diafragma selar. A erosão das paredes durais
do SC pode causar além de HSAe, hematoma subdural em raros casos (67).
De acordo com Choulakian et al (2010)(75), para apresentar sintomas
compressivos dos NCs, os AIC devem ter diâmetros maiores que 15 mm. Na
amostra do presente trabalho, 23 de 26 aneurismas, o que representa 88,5%, foram
Discussão
84
considerados gigantes, confirmando tal afirmação. Os três aneurismas restantes
eram, na verdade, pseudoaneurismas, tendo sua sintomatologia associada também
ao trauma craniano.
De acordo com Vasconcellos et al (2008)(65), os sintomas relacionados a
aneurismas intracavernosos mais comumente encontrados foram, em ordem
decrescente de frequência: cefaleia, diplopia por disfunção do IV NC, dor retroorbital, déficit visual e fotofobia. No grupo de pacientes do referido trabalho, o NC
mais afetado foi o abducente(65). Nos pacientes do presente estudo, os NCs mais
comumente afetados, em ordem decrescente de frequência foram: oculomotor,
abducente, troclear e trigêmeo. Ainda, a dor retro-orbitária esteve presente em
84,6% dos pacientes, sendo considerada incoercível em 46,2% dos casos. No
tocante ao quadro álgico, esse grupo de pacientes com dor intensa foi o mais
beneficiado com o tratamento, tendo em vista que nenhum paciente apresentava dor
incoercível após a terapia endovascular. A melhora na sintomatologia de NCs, obtida
com o tratamento endovascular, está de acordo com a encontrada na literatura (4,71).
Houve melhora na função de pelo menos um NC em todos os pacientes. Essa alta
taxa de melhora clínica é justificada também pelo fato de o tratamento ter sido
instituído em tempo precoce, quando os sintomas tinham menos que seis meses de
duração. Essa situação representou um dos critérios de inclusão no nosso estudo, e
acreditamos tratar-se de um dos fatores prognósticos mais importantes na avaliação
da sintomatologia dos AIC.
Em relação à sequência diagnóstica empregada, a maioria dos pacientes com
AIC chegou ao nosso serviço com queixas relativas à compressão de NCs, tais
como diplopia e oltalmoplegia dolorosa. Esses pacientes foram submetidos
inicialmente a TC de crânio, sendo observada, na maioria das vezes, a presença de
Discussão
85
lesão expansiva intracavernosa, adjacente à ACI, com fluxo arterial. Para
complementação diagnóstica, à semelhança do que se preconiza na literatura(78,79),
era realizada RM de encéfalo, que pôde caracterizar melhor a lesão, assim como
identificar a presença de trombos intra-aneurismáticos. Em sequência, a AGC era
realizada com o intuito de confirmação diagnóstica e planejamento terapêutico,
muitas vezes já associada ao teste de oclusão da ACI.
Desde a concepção do presente trabalho, só foram incluídos pacientes
submetidos a tratamento endovascular de AIC por meio da oclusão da ACI. Assim,
todos os candidatos a tratamentos, foram submetidos previamente a teste de
oclusão da ACI, conforme já descrito previamente. Estudos mostram que dos
pacientes submetidos à oclusão carotídea, sem terem sido submetidos previamente
ao teste de oclusão da mesma, aproximadamente 25% desenvolviam infartos
cerebrais e cerca de 12% faleciam em consequência da oclusão de uma das ACI.
Após a incorporação do teste de oclusão, essas porcentagens foram reduzidas
drasticamente(88). Não está definido na literatura qual o percentual de pacientes que
não toleram a oclusão de uma das carótidas. Na nossa amostra, foram realizados 29
testes de oclusão da ACI e somente três pacientes, representando 10,3%,
apresentaram déficits após a oclusão temporária da ACI. Esses pacientes foram
excluídos do estudo.
O teste de oclusão da ACI, por si só, representa uma segurança à realização
do procedimento de oclusão carotídea. No entanto, mesmo pacientes que tolerem
adequadamente esse teste podem desenvolver ulteriormente algum tipo de déficit
relacionado à oclusão da artéria(89). Em nossa casuística, somente uma paciente
apresentou quadro de isquemia tardia, com hemiparesia contralateral à carótida
ocluída. Isso representou uma incidência de 3,8% de déficit após a oclusão unilateral
Discussão
86
da ACI. Esse valor está abaixo do esperado, com base nos dados da literatura, que
apontam uma taxa de até 22%(28,88,89). Para minimizar as chances de ocorrência de
eventos isquêmicos ou hipofluxo após a oclusão da carótida, alguns autores
preconizam que o teste de oclusão seja sempre potencializado por hipotensão
arterial induzida, ou realizado em conjunto com SPECT, ou TC de perfusão com
xenônio(88). Entretanto, acredita-se não excluir completamente a ocorrência de
eventos isquêmicos tardios, sendo esperada taxa de até 10% de possibilidade de
surgimento de déficits tardios relacionados à oclusão(86). É possível que a
sensibilização do teste de oclusão conforme acima mencionado pudesse ter
contraindicado a oclusão arterial na única paciente desse estudo que evoluiu com
déficit tardio.
Porém, é válido mencionar que a oclusão terapêutica da ACI para os AIC
representa
um
procedimento
de
baixa
morbimortalidade,
levando-se
em
consideração que as alternativas, principalmente a clipagem microcirúrgica ou a
realização de “bypass” vascular, que por si, apresentam taxa de morbidade em torno
de 5-10% e mortalidade em 3-10% dos casos (86).
O tratamento dos AIC por meio da oclusão da ACI, embora não represente a
opção considerada ideal, é considerada por muitos autores como o tratamento de
escolha para esse tipo de lesão(73,84,87), registrando-se melhora até 90% dos
sintomas compressivos de NCs(73). Em nossa amostra, todos os pacientes
apresentaram melhora, em maior ou menor grau, de pelo menos um NC acometido.
Essa constatação foi atribuída à ocorrência de trombose intra-aneurismática, com
consequente redução volumétrica da lesão.
A eficácia da oclusão carotídea para induzir a trombose do aneurisma é
inversamente proporcional ao grau de circulação colateral existente(80,86). Assim,
Discussão
87
quanto mais proximal for o aneurisma da ACI, menor o potencial de influência de um
eventual fluxo colateral e, portanto, maior seria a expectativa de sucesso no
tratamento dessa lesão por meio da oclusão do vaso portador(80). Dessa forma, a
oclusão carotídea tende a ser mais efetiva para aneurismas do segmento petroso e
cavernoso por causa do pequeno número e calibre dos ramos arteriais. Aneurismas
do segmento oftálmico (paraclinóideos) também podem ser tratados por meio de
oclusão da ACI, no entanto, as chances de trombose são menores, especialmente
devido à presença do fluxo retrógrado pela artéria oftálmica(80,87).
Acredita-se que a oclusão da ACI seja mais efetiva do que a oclusão da
artéria carótida comum para o tratamento dos AIC (86), embora a oclusão em uma ou
outra
localização
esteja
associada
a
incidências
similares
de
trombose
aneurismática, redução no volume do aneurisma e redução das taxas de
sangramento(86). No presente estudo, todos os pacientes foram submetidos à
oclusão seletiva da ACI, considerando-se que a preservação do fluxo na ACE pode
ser importante para a manutenção de um fluxo cerebral adequado. A despeito disso,
alguns autores(80) acreditam que as taxas de complicações isquêmicas sejam
maiores após a oclusão da ACI do que após a oclusão da carótida comum.
Embora não tenha sido realizado nos pacientes do presente estudo, existem
outras opções para o tratamento endovascular dos AIC. O uso de “stents” diversores
de fluxo surgiu como alternativa, na busca pelo modelo de tratamento ideal dessas
lesões, já que objetiva excluir o aneurisma da circulação, preservando-se o fluxo
sanguíneo pela ACI(80,92-94). Embora possa vir a representar o tratamento padrão no
tratamento dos AIC, mesmo a utilização desses “stents” pode ser seguida de
complicações isquêmicas ou hemorrágicas(95), muitas vezes fatais. Outras opções,
como a embolização endossacular dos AIC, embora tente preservar a o fluxo da
Discussão
88
ACI, não mostrou benefício importante em relação à sintomatologia relacionada à
compressão de NCs(73), talvez por não permitir uma redução volumétrica importante
dos aneurismas após sua trombose.
Outro aspecto relacionado à oclusão terapêutica da ACI no tratamento dos
AIC é a potencial sobrecarga hemodinâmica da circulação intracraniana, podendo
levar ao surgimento de aneurismas “de novo”(80,90). A definição de aneurisma “de
novo” é o surgimento de um novo aneurisma em outra localização, inexistente
previamente quando avaliadas as artérias por angiografia ou por exploração
cirúrgica(90). Acredita-se que 1 a 10% dos pacientes submetidos à oclusão carotídea
desenvolverão aneurismas “de novo”, o que claramente representa taxa superior à
esperada para a população em geral(80). Sua formação provavelmente é resultante
da interface entre fatores hemodinâmicos e deficiência estrutural da parede
arterial(90). Assim, o estresse hemodinâmico gerado pela oclusão carotídea
presumivelmente induz a formação do aneurisma por sobrecarregar alguns
territórios vasculares(90). Além disso, a presença de múltiplos aneurismas está
associada ao surgimento de novas lesões aneurismáticas, contribuindo para a teoria
da ocorrência concomitante de uma fraqueza estrutural da parede dos vasos (90).
Notadamente, a única paciente da nossa casuística que desenvolveu aneurisma “de
novo” durante o presente estudo, foi o único caso de aneurismas múltiplos. Essa
observação vem de encontro aos dados disponíveis na literatura
(80,90)
.
Discussão
89
6. CONCLUSÕES
90
Com base na análise dos resultados obtidos nas condições de realização do
presente estudo, podemos concluir que:
-
O tratamento endovascular das FCCs proporcionou melhora dos sintomas
de dor retro-ocular, proptose e hiperemia;
-
O tratamento endovascular das FCCs proporcionou melhora dos sintomas
relacionados ao acometimento dos NC III, IV e VI;
-
Nos
pacientes
com
aneurismas
intracavernosos,
o
tratamento
endovascular mostrou melhora do quadro álgico, especialmente naqueles
em que a dor era incoercível;
-
Nos
pacientes
com
aneurismas
intracavernosos,
o
tratamento
endovascular mostrou melhora dos sintomas relacionados aos NCs IV, V
e, principalmente, III e VI;
-
O tratamento endovascular das FCCs e aneurismas da ACIc mostrou ser
um método seguro, com baixos índices de complicações.
Conclusões
91
8. REFERÊNCIAS BIBLIOGRÁFICAS
92
01. Tedeschi H, Oliveira E, Tzu WH, Rhoton Jr AL. Tratamento cirúrgico das lesões
na região do seio cavernoso. Temas atuais em neurocirurgia (SONESP), 2004.
Disponível em: http://www.neurodiagnose.com.br/seio-cavernoso.pdf
02. Ducruet AF, Albuquerque FC, Crowley RW, McDougall CG. The evolution of
endovascular treatment of carotid cavernous fistulas: a single-center experience.
World Neurosurg. [In press 2013].
3. Bedford MA. The "cavernous" sinus. Br J Ophthalmol. 1966; 50:41-6.
4. Caldas JGMP. Tratamento endovascular das fístulas e aneurismas da região do
seio cavernoso. Tese (Livre-Docência). São Paulo: Faculdade de Medicina da
Universidade de São Paulo; 2002.
5. Parkinson D. A surgical approach to the cavernous portion of the carotid artery.
Anatomical studies and case report. J Neurosurg. 1965; 23:474-83.
6. Harris FS, Rhoton AL Jr. Anatomy of the cavernous sinus: a microsurgical study. J
Neurosurg. 1976; 45:169-80.
7. Umansky F, Nathan H. The lateral wall of the cavernous sinus. With special
reference to the nerves related to it. J Neurosurg. 1982; 56:228-34.
8. Rhoton AL Jr, Hardy DG, Chambers SM. Microsurgical anatomy and dissection of
the sphenoid bone, cavernous sinus and sellar region. Surg Neurol. 1979; 12:63-104.
9. Browder J. Treatment of carotid artery cavernous sinus fistula: report of a case.
Arch Ophthalmol 1937; 18:95-102.
10. Rhoton AL Jr. The supratentorial cranial space: microsurgical anatomy and
surgical approaches. Neurosurgery. 2002; 51(4):S1-S410.
11. Dolenc V. Direct microsurgical repair of intracavernous vascular lesions. J
Neurosurg. 1983; 58:824-31.
12. Isolan GR, Krayenbühl N, de Oliveira E, Al-Mefty O. Microsurgical anatomy of the
cavernous sinus: measurements of the triangles in and around It. Skull Base. 2007;
17:357-67.
13. Taptas JN. The so-called cavernous sinus: a review of the controversy and its
implications for neurosurgeons. Neurosurgery. 1982; 11:712-7.
14. Parkinson D. Surgical anatomy of the lateral sellar compartment (cavernous
sinus). Clin Neurosurg. 1990; 36:219-39.
15. Hakuba A, Tanaka K, Suzuki T, Nishimura S. A combined orbitozygomatic
infratemporal epidural and subdural approach for lesions involving the entire
cavernous sinus. J Neurosurg. 1989; 71:699-704.
Referências Bibliográficas
93
16. Yasuda A, Campero A, Martins C, Rhoton AL Jr, de Oliveira E, Ribas GC.
Microsurgical anatomy and approaches to the cavernous sinus. Neurosurgery. 2005;
56(1 Suppl):4-27.
17. Inoue T, Rhoton AL Jr, Theele D, Barry ME. Surgical approaches to the
cavernous sinus: a microsurgical study. Neurosurgery. 1990; 26:903–32.
18. Kehrli P, Maillot C, Wolff MJ. The venous system of the lateral sellar
compartment (cavernous sinus): a histological and embryological study. Neurol Res.
1996; 18:387-93.
19. Umansky F, Valarezo A, Elidan J. The superior wall of the cavernous sinus: a
microanatomical study. J Neurosurg. 1994; 81:914-20.
20. Ziyal IM, Salas E, Wright DC, Sekhar LN. The petrolingual ligament: the anatomy
and surgical exposure of the posterolateral landmark of the cavernous sinus. Acta
Neurochir (Wien). 1998; 140:201-4.
21. van Dijk JM, terBrugge KG, Willinsky RA, Wallace MC. Clinical course of cranial
dural arteriovenous fistulas with long-term persistent cortical venous reflux. Stroke.
2002; 33:1233-6.
22. Bouthillier A, van Loveren HR, KellerJT. Segments of the internal carotid artery: a
new classification. Neurosurgery. 1996; 38:425-32.
23. Dolenc VV. A combined epi- and subdural direct approach to carotid-ophthalmic
artery aneurysms. J Neurosurg. 1985; 62:667-72.
24. van Loveren HR, Keller JT, el-Kalliny M, Scodary DJ, Tew JM Jr. The Dolenc
technique for cavernous sinus exploration (cadaveric prosection). Technical note. J
Neurosurg. 1991; 74:837-44.
25. Hosoya T, Kera M, Suzuki T, Yamaguchi K. Fat in the normal cavernous sinus.
Neuroradiology. 1986; 28:264-6.
26. Osborn AG, Jacobs JM, Maack J. Osborn: diagnostic cerebral angiography. 2nd
ed. Philadelphia; Lippincott Williams & Wilkins. 1999. 462p.
27. Bernasconi V, Cassinari V. Caratteristsche angiografiche dei meningiomi del
tentorio. angiografiche dei meningiomi del tentorio. Radiol Med (Torino). 1957;
43:1015-26.
28. Grumann AJ, Boivin-Faure L, Chapot R, Adenis JP, Robert PY. Ophthalmologic
outcome of direct and indirect carotid cavernous fistulas. Int Ophthalmol. 2012;
32:153-9.
29. Ellis JA, Goldstein H, Connolly ES Jr, Meyers PM. Carotid-cavernous fistulas.
Neurosurg Focus. 2012; 32: E9.
Referências Bibliográficas
94
30. Kim JW, Kim SJ, Kim MR. Traumatic carotid-cavernous sinus fistula
accompanying abducens nerve (VI) palsy in blowout fractures: missed diagnosis of
'white-eyed shunt'. Int J Oral Maxillofac Surg. 2013; 42:470-3.
31. Kanamalla US, Jungreis CA, Kochan JP. Direct carotid cavernous fistula. In:
Hurst RW, Rosenwasser RH. (eds). Interventional neuroradiology. New York: Informa
Healthcare; 2008. p. 231-8.
32. Malan J, Lefeuvre D, Mngomezulu V, Taylor A. Angioarchitecture and treatment
modalities in posttraumatic carotid cavernous fistulae. Interv Neuroradiol. 2012;
18:178-86.
33. Aissa A, Arous A, Alouini R, Taktak J, Allani M. Traumatisme balistique
occasionnant une fistule carotido-caverneuse. J Fr Ophtalmol. 2012; 35: 722.e1-4
34. Pang PF, Jiang ZB, Zhou B, Li ZR, Huang MS, Zhu KS, et al. Diagnosis and
treatment of carotid-cavernous fistula: analysis of 28 patients. Zhonghua Yi Xue Za
Zhi. 2012; 92:1458-62.
35. Gemmete JJ, Ansari SA, Gandhi DM. Endovascular techniques for treatment of
carotid-cavernous fistula. J Neuroophthalmol. 2009; 29: 62-71.
36. Uehara T, Tabuchi M, Kawaguchi T, Mori E. Spontaneous dural carotid
cavernous sinus fistula presenting isolated ophthalmoplegia: evaluation with MR
angiography. Neurology. 1998; 50: 814-6.
37. Cho KC, Seo DH, Choe IS, Park SC. Cerebral hemorrhage after endovascular
treatment of bilateral traumatic carotid cavernous fistulae with covered stents. J
Korean Neurosurg Soc. 2011; 50:126-9.
38. Mercado GB, Irie K, Negoro M, Moriya S, Tanaka T, Ohmura M, et al.
Transvenous embolization in spontaneous direct carotid-cavernous fistula in
childhood. Asian J Neurosurg. 2011; 6:45–8.
39. Barrow DL, Spector RH, Braun IF, Landman JA, Tindall SC, Tindall GT.
Classification and treatment of spontaneous carotid cavernous sinus fistulas. J
Neurosurg. 1985; 62: 248-56.
40. Wang YL, Ma J, Ding PX, Li YD, Han XW, Wu G. Treatment of post-traumatic
carotid-cavernous fistulas with the Willis covered stent. A preliminary prospective
study. Interv Neuroradiol. 2012a; 18:172-7.
41. Wang YL, Ma J, Li YD, Ding PX, Han XW, Wu G. Application of the Willis covered
stent for the management of posttraumatic carotid-cavernous fistulas: an initial
clinical study. Neurol India. 2012b; 60:180-4.
42. Newton TH, Hoyt WF. Dural arteriovenous shunts in the region of the cavernous
sinus. Neuroradiology. 1970; 1:71–81.
Referências Bibliográficas
95
43. Debrun GM, Vinuela F, Fox AJ, Davis KR, Ahn HS. Indications for treatment and
classification of 132 carotid-cavernous fistulas. Neurosurgery. 1988; 22:285–9.
44. Wang Q, Chen G. Endovascular treatment of bilateral multiple carotid-cavernous
fistulas in a patient with Ehlers-Danlos Syndrome. J Neurol Surg A Cent Eur
Neurosurg. [In press 2012].
45. Doğan S, Salman MC, Deren O, Geyik S. Carotid-cavernous fistula in term
pregnancy due to spontaneous rupture of carotid-cavernous aneurysm. Obstet
Gynaecol Res. 2012; 38:427-30.
46. Kaplan JB, Bodhit AN, Falgiani ML. Communicating carotid-cavernous sinus
fistula following minor head trauma. Int J Emerg Med. 2012; 5:10.
47. Asano T, Houkin K, Moriwaki T, Niiya Y, Mabuchi S. Case of direct carotidcavernous fistula presenting with subarachnoid hemorrhage. No Shinkei Geka. 2012;
40:235-9.
48. Kocer N, Kizilkilie O, Albayram S, Adaletli I, Kantarci F, Islak C. Treatment of
iatrogenic internal carotid artery laceration and carotid cavernous fistula with
endovascular stent-graft placement. AJNR Am J Neuroradiol. 2002; 23: 442–6.
49. Halbach VV, Hieshima GB, Higashida RT, Reicher M. Carotid cavernous fistulae:
indications for urgent therapy. AJR Am J Roentgenol. 1987; 149:587-93.
50. Sanders MD, Hoyt WF. Hypoxic ocular sequelae of carotid-cavernous fistulae.
Study of the causes of visual failure before and after neurosurgical treatment in a
series of 25 cases. Br J Ophthalmol. 1969; 53:82–97.
51. Lewis A, Tomsick TA, Tew JJ Jr. Management of 100 consecutive direct carotidcavernous fistulas: results of treatment with detachable balloons. Neurosurgery.
1995; 36:239-44.
52. Gonzalez LF, Chalouhi N, Tjoumakaris S, Jabbour P, Dumont AS, Rosenwasser
RH. Treatment of carotid-cavernous fistulas using intraarterial balloon assistance:
case series and technical note. Neurosurg Focus. 2012; 32:E14.
53. Halbach VV, Higashida RT, Barnwell SL, Dowd CF, Hieshima GB. Transarterial
platinum coil embolization of carotid-cavernous fistulas. AJNR Am J Neuroradiol.
1991; 12:429–33.
54. Halbach VV, Higashida RT, Hieshima GB, Hardin CW, Yang PJ. Transvenous
embolization of direct carotid cavernous fistulas. AJNR Am J Neuroradiol. 1988;
9:741–7.
55. Moron FE, Klucznik RP, Mawad ME, Strother CM. Endovascular treatment of
high-flow carotid cavernous fistulas by stentassisted coil placement. AJNR Am J
Neuroradiol. 2005; 26:1399–404.
Referências Bibliográficas
96
56. Horton JA, Jungreis CA, Stratemeier PH. Sharp vascular calcifications and acute
balloon rupture during embolization. AJNR Am J Neuroradiol. 1991; 12:1070–3.
57. Luo CB, Teng MM, Chang FC, Lin CJ, Guo WY, Chang CY. Transarterial
detachable coil embolization of direct carotid-cavernous fistula: immediate and longterm outcomes. J Chin Med Assoc. 2013; 76:31-6
58. Yu Y, Huang Q, Xu Y, Hong B, Zhao W, Deng B, et al. Use of onyx for
transarterial balloon-assisted embolization of traumatic carotid cavernous fistulas: a
report of 23 cases. AJNR Am J Neuroradiol. 2012; 33:1305-9.
59. Bing F, Albrieux M, Vinh Moreau-Gaudry V, Vasdev A. Cavernous sinus fistula
treated through the transvenous approach: report of four cases. J Neuroradiol. 2009;
157:265-9.
60. Zenteno M, Santos-Franco J, Rodríguez-Parra V, Balderrama J, Aburto-Murrieta
Y, Vega-Montesinos S, et al. Management of direct carotid-cavernous sinus fistulas
with the use of ethylene-vinyl alcohol (Onyx) only: preliminary results. J Neurosurg.
2010; 112:595-602.
61. Kalyanpur TM, Narsinghpura K, Yadav M, Mehta P, Paul K, Cherian M. Covered
coronary stent grafts as a treatment option for carotid-cavernous fistulas: our initial
experience. Neurol India. 2011; 59:895-8.
62. Nadarajah M, Power M, Barry B, Wenderoth J. Treatment of a traumatic carotidcavernous fistula by the sole use of a flow diverting stent. J Neurointerv Surg. [In
press 2012].
63. Yin B, Sheng HS, Wei RL, Lin J, Zhou H, Zhang N. Comparison of covered stents
with detachable balloons for treatment of posttraumatic carotid-cavernous fistulas. J
Clin Neurosci. 2013; 20:367-72.
64. Iwaisako K, Toyota S, Ishihara M, Shibano K, Harada Y, Iwatsuki K, Yoshimine T.
Intracerebral hemorrhage caused by ruptured intracavernous carotid artery aneurysm
– case report. Neurol Med Chir (Tokyo). 2009; 49:155-8.
65. Vasconcellos LP, Flores JAC, Veiga JCE, Conti MLM, Shiozawa P. Presentation
and treatment of carotid cavernous aneurysms. Arq Neuropsiquiatr. 2008; 66:189-93.
66. Majidi S, Grigoryan M, Tekle WG, Watanabe M, Qureshi AI. Feasibility of using
intravascular ultrasonography for assessment of giant cavernous aneurysm after
endovascular treatment: a technical report. J Vasc Interv Neurol. 2012; 5:6-9.
67. Frudit ME. Aneurismas do segmento intracavernosos da artéria carótida interna:
tratamento com balões destacáveis. Dissertação (Mestrado). São Paulo:
Universidade Federal de São Paulo; 1997.
68. Vasconcellos LP, Flores JAC, Conti MLM, Veiga JCE, Lancellotti CLP.
Spontaneous thrombosis of internal carotid artery: A natural history of giant carotid
cavernous aneurysms. Arq Neuropsiquiatr. 2009; 67:278-83.
Referências Bibliográficas
97
69. Lee N, Jung JY, Huh SK, Kim DJ, Kim DI, Kim J. Distinction between intradural
and extradural aneurysms involving the paraclinoid internal carotid artery with T2Weighted three-dimensional fast spin-echo magnetic resonance imaging. J Korean
Neurosurg Soc. 2010; 47: 437-41.
70. Eddleman CS, Hurley MC, Bendok BR, Batjer HH. Cavernous carotid aneurysms:
to treat or not to treat? Neurosurg Focus. 2009; 26:4.
71. van Rooij WJ. Endovascular treatment of cavernous sinus aneurysms. AJNR Am
J Neuroradiol. 2012; 33:323–26.
72. ter Brugge KG. Commentary: Cavernous sinus segment internal carotid artery
aneurysms: whether and how to treat. AJNR Am J Neuroradiol. 2012; 37:327–8.
73. Morita K, Sorimaghi T, Ito Y, Nishino K, Jimbo Y, Kumagai T, Fujii Y. Intraaneurysmal coil embolization for large or giant carotid artery aneurysms in the
cavernous sinus. Neurol Med Chir (Tokyo). 2011; 51: 762-6.
74. Baldawa SS, Pendharkar H, Menon GR, Nair SR. Case report: Thrombosed giant
cavernous carotid artery aneurysm secondary to cervical internal carotid artery
dissection: An unusual entity. Indian J Radiol Imaging. 2011; 21:225–7.
75. Choulakian A, Drazin D, Alexander MJ. Endosaccular treatment of 113
cavernous carotid artery aneurysms. J Neurointerv Surg. 2010; 2:359-62.
76. Faje AT, Tritos NA. Cavernous carotid artery aneurysm: a rare cause of
intrasellar mass and hyperprolactinemia. J Clin Endocrinol Metab. 2012; 97:723–4.
77. Davies A, Dale O, Renowden S. Spontaneous rupture of an intra-cavernous
internal carotid artery aneurysm presenting with massive epistaxis. J Laryngol Otol.
2011; 125:1070-2.
78. Andrade GC, Teixeira PAD, Alves HFP, Donato EE, Moreira CAA, Faria RCS,
Dias LAA. Diagnóstico dos aneurismas cerebrais por angiotomografia tridimensional.
Arq Neuropsiquiatr. 2003; 61:74-8.
79. Pierot L, Portefaix C, Rodriguez-Régent C, Gallas S, Meder JF, Oppenheim C.
Role of MRA in the detection of intracranial aneurysm in the acute phase of
subarachnoid hemorrhage. J Neuroradiol. [In press 2013].
80. Elhammady MS, Wolfe SQ, Farhat H, Aziz-Sultan MA, Heros RC. Carotid artery
sacrifice for unclippable and uncoilable aneurysms: endovascular occlusion Vs
common carotid artery ligation. Neurosurgery. 2010; 67:1431–7.
81. Baptista T, Fragata I, Ribeiro C, Reis J. Sistemas de derivação de fluxo no
tratamento de aneurismas intra-cranianos – resultados aos seis meses de
seguimento. Acta Med Port. 2012; 25:13-6.
Referências Bibliográficas
98
82. Ohtaki S, Mikami T, Iihoshi S, Miyata K, Nonaka T, Houkin K, Mikuni N. Strategy
for the treatment of large-giant aneurysms in the cavernous portion of the internal
carotid artery. No Shinkei Geka. 2013; 41:107-15.
83. Murai Y, Mizunari T, Umeoka K, Tateyama K, Kobayashi S, Teramoto A. Radial
artery grafts for symptomatic cavernous carotid aneurysms in elderly patients. Neurol
India. 2011; 59: 537-41.
84. Xu DS, Hurley MC, Batjer HH, Bendok BR. Delayed cranial nerve palsy after
coiling of carotid cavernous sinus aneurysms: case report. Neurosurgery. 2010;
66:1215-6.
85. Szikora I, Berentei Z, Kulcsar Z, Marosfoi M, Vajda ZS, Lee W, Berez A, Nelson
PK. Treatment of intracranial aneurysms by functional reconstruction of the parent
artery: the Budapest experience with the Pipeline Embolization Device. AJNR Am J
Neuroradiol. 2010; 31:1139–47.
86. Rathore YS, Chandra PS, Kumar R, Singh M, Sharma MS, Suri A, Mishra NK,
Gaikwad S, Garg A, Sharma BS, Mahapatra AK. Monitored gradual occlusion of the
internal carotid artery followed by ligation for giant internal carotid artery aneurysms.
Neurol India. 2012; 60:174-9.
87. Abe H, Takemoto K, Higashi T, Inoue T. Surgical treatment for aneurysms in the
cavernous-petrous portion of the internal carotid artery. Acta Neurochir Suppl. 2011;
112:77-83.
88. Field M, Jungreis CA, Chengelis N, Kromer H, Kirby L, Yonas H. Symptomatic
cavernous sinus aneurysms: management and outcome after carotid occlusion and
selective cerebral revascularization. AJNR Am J Neuroradiol. 2003; 24:1200-7.
89. Ko JK, Lee TH, Lee JI, Choi CH. Endovascular treatment using graft-stent for
pseudoaneurysm of the cavernous internal carotid artery. J Korean Neurosurg Soc.
2011; 50: 48-50.
90. Suzuki MTM, Aguiar GB, Jory M, Conti MLM, Veiga JCE. De novo basilar tip
aneurysm. Case report and literature review. Neurocirugía. 2011; 22: 251-4.
91. Chan HW, Haliasos N, Derakhshani S, Vindlacheruvu R, Chawda S. Delayed
caroticocavernous fistula after stent-assisted coil embolization of intracavernous
carotid aneurysm: should we manage conservatively? Acta Neurochir (Wien). 2011;
153:1291-5.
92. Fiorella D, Lylyk P, Szikora I, Kelly ME, Albuquerque FC, McDougall CG, Nelson
PK. Curative cerebrovascular reconstruction with the Pipeline embolization device:
the emergence of definitive endovascular therapy for intracranial aneurysms. J
Neurointerv Surg. 2009; 1:56-65.
Referências Bibliográficas
99
93. Lylyk P, Miranda C, Ceratto R, Ferrario A, Scrivano E, Luna HR, Berez AL, Tran
Q, Nelson PK, Fiorella D. Curative endovascular reconstruction of cerebral
aneurysms with the pipeline embolization device: the Buenos Aires experience.
Neurosurgery. 2009; 64:632-43.
94. Mustafa W, Kadziolka K, Anxionnat R, Pierot L. Direct carotid-cavernous fistula
following intracavernous carotid aneurysm treatment with a flow-diverter stent: a case
report. Interv Neuroradiol. 2010; 16: 447-50.
95. Wong GK, Kwan MC, Ng RY, Yu SC, Poon WS. Flow diverters for treatment of
intracranial aneurysms: current status and ongoing clinical trials. J Clin Neurosci.
2011; 18:737-40.
96. D'Urso PI, Lanzino G, Cloft HJ, Kallmes DF. Flow diversion for intracranial
aneurysms: a review. Stroke. 2011; 42:2363-8.
97. Fiorella D, Woo HH, Albuquerque FC, Nelson PK. Definitive reconstruction of
circumferential, fusiform intracranial aneurysms with the pipeline embolization device.
Neurosurgery. 2008; 62:1115-21.
98. Seldinger SI. Catheter replacement of the needle in percutaneous arteriography:
a new technique. Acta Radiol. 1953; 39:368-76.
99. Conti MLM, Aguiar GB, Veiga JCE, Santos ARL, Lazarini PR, Jory M, et al.
Endovascular treatment of iatrogenic pseudoaneurysm and delayed carotidcavernous fistula following trans-sphenoidal surgery. Rev Chil Neurocir. 2012;
38:147-50.
100. Kwon HJ, Jin SC. Spontaneous healing of iatrogenic direct carotid cavernous
fistula. Interv Neuroradiol. 2012; 18:187-90.
Referências Bibliográficas
100
RESUMO
101
Aguiar, Guilherme Brasileiro de. Tratamento endovascular das lesões vasculares
carotidocavernosas. Dissertação (Mestrado). São Paulo, 2013.
Introdução: O tratamento das lesões comprometendo o seio cavernoso sempre se
constituiu desafiador para os neurocirurgiões. O tratamento endovascular dessas
lesões apresentou diversas alterações nos últimos anos, especialmente em
decorrência do aparecimento de novos materiais. O presente trabalho tem como
objetivo avaliar a eficácia do tratamento endovascular de lesões vasculares da
artéria carótida interna, segmento cavernoso, realizado em nosso serviço, por meio
da eventual melhora dos sintomas oculares, dos déficits dos nervos cranianos e da
dor. Métodos: Trata-se de estudo descritivo, de caráter retrospectivo e prospectivo.
Foram avaliados os pacientes com diagnóstico de aneurisma na artéria carótida
interna cavernosa ou fístula carotidocavernosa direta submetidos a tratamento
endovascular. Além dos dados referentes à idade e o gênero dos pacientes, foram
avaliadas variáveis relacionadas à doença e os sinais e sintomas de apresentação,
assim como o tipo de intervenção utilizado para seu tratamento. Resultados: Foram
incluídos no estudo 26 pacientes com aneurismas intracavernosos e 10 com fístulas
carotidocavernosas direta. Todos os aneurismas foram tratados com oclusão da
artéria carótida interna. As fístulas carotidocavernosas foram tratadas com oclusão
da artéria carótida interna em sete casos e com oclusão seletiva da fístula nos três
casos restantes. Houve melhora da dor e da proptose ocular em todos os pacientes
com fístula carotidocavernosa. Nos pacientes com aneurismas intracavernosos, a
incidência de dor retro-orbitária foi de 84,6% para somente 30,8% após o
tratamento. Após o tratamento endovascular, houve melhora importante na
disfunção dos nervos cranianos acometidos nos dois grupos de pacientes,
principalmente do nervo oculomotor. Conclusão: o tratamento endovascular
proporcionou importante melhora dos pacientes selecionados para estudo, em
especial nos critérios dor e disfunção do nervo oculomotor. A abordagem
endovascular se mostrou efetiva, com baixas taxas de complicações associadas.
Palavras-chave: Fístula carotídeo-cavernosa/terapia; Embolização terapêutica;
Lesões das artérias carótidas.
Resumo
102
ABSTRACT
103
Aguiar, Guilherme Brasileiro de. Endovascular treatment of the carotid-cavernous
vascular lesions. Dissertation (Master’s Degree). São Paulo, 2013.
Introduction: The treatment of lesions which compromise the cavernous sinus has
always constituted a challenge for neurosurgeons. The endovascular treatment of
these lesions has presented diverse alterations over the last few years, especially
due to the arisal of new materials. The present study has the objective of evaluating
the efficacy of endovascular treatment of vascular lesions in the internal carotid
artery, cavernous segment, performed at our service as per the eventual
improvement in the ocular symptoms, cranial nerve deficits and pain. Methods: This
is a descriptive study, retrospective and prospective in nature. Patients with a
diagnosis of aneurysm in the cavernous internal carotid artery or direct carotidcavernous fistula submitted to endovascular treatment were evaluated. In addition to
the data on patient age and gender, variables related to the disease and presentation
signs and symptoms, as well as the type of intervention used for treatment, were
evaluated. Results: The study included 26 patients with intracavernous aneurysms
and 10 with direct carotid-cavernous fistulas.
All aneurysms were treated with
occlusion of the internal carotid artery. The carotid-cavernous fistulas were treated
with the occlusion of the internal carotid artery in seven cases and with selective
fistula occlusion in the remaining three. There was an improvement in pain and
ocular proptosis in all of the patients with carotid-cavernous fistula. In the patients
with intracavernous aneurysms, the incidence of retroorbitary pain went from 84,6%
to a mere 30,8%, following the treatment. Following endovascular treatment, there
was an important improvement in the dysfunction of cranial nerves, compromised in
both patient groups, mainly in the oculomotor nerve. Conclusion: The endovascular
treatment provided an important improvement in the patients selected for the study,
especially in the criteria pain and oculomotor nerve dysfunction. The endovascular
approach proved effective, with a low rate of associated complications.
Keywords: Carotid-cavernous fistula/therapy; Therapeutic embolization; Carotid
artery injuries
Abstract
104
APÊNDICE
105
APÊNDICE 1
APROVAÇÃO DO COMITÊ DE ÉTICA
Apêndice
106
APÊNDICE 2
TERMO DE COMPROMISSO LIVRE E ESCLARECIDO
Apêndice
107
Apêndice
108
APÊNDICE 3
Declaração de Potencial Conflito de Interesse
O autor declara nenhum tipo de vínculo empresarial, nem tampouco conflito
de interesse a respeito dos materiais e método utilizados neste estudo, ou dos
resultados especificados neste trabalho.
Apêndice