Qualidade microbiológica e bactérias
acidúricas em bebidas não alcoólicas
Maristela S. Nascimento
Conteúdo programático
Microrganismos indicadores
Salmonella
Bactérias deteriorantes
Báctérias lácticas
Bactérias acéticas
Grupo Bacillus
Alicyclobacillus
Clostrídios butíricos
Legislação
Ministério da Agricultura (Inst. Norm. n.1, 07/01/00)
Produto
Determinação
Polpa de fruta “in natura” Bolores e leveduras
Polpa de fruta
conservada quim. ou
tratada term.
Limite
(UFC ou NMP/g)
5,0x103
Coliformes fecais
1,0
Salmonella (25g)
Ausente
Bolores e leveduras
2,0x103
Coliformes fecais
1,0
Salmonella (25g)
Ausente
Legislação
ANVISA (RDC n.12, 02/01/01) – Grupo 17
Produto
Determinação
Limite
Sucos, refrescos, néctar
prontos para consumo
Coliformes 35ºC (em 50ml)
Sucos concentrados*
Coliformes 35ºC (em 50ml)
Ausente
Salmonella (25ml)
Ausente
Suco desidratado
Ausente
Coliformes 35ºC
10/g
Salmonella (25g)
Ausente
Xarope
Coliformes 35ºC
10/g
Pó para refresco
Coliformes 35ºC
1/g
Suco “in natura”
Coliformes 45ºC
100/ml
Salmonella (25ml)
Suco pasteurizado e
refrigerado
Coliformes 45ºC
Salmonella (25ml)
Ausente
10/ml
Ausente
Microrganismos Indicadores
Grupos ou espécies de microrganismos que, quando presentes
em um alimento, podem fornecer informações sobre
deterioração, contaminação de origem fecal e provável presença
de patógenos, podendo indicar condições sanitárias inadequadas
durante o processamento, armazenamento e distribuição do
alimento.
(Franco & Landgraf, 2003)
COLIFORMES TOTAIS
Família Enterobacteriaceae: Escherichia, Citrobacter,
Enterobacter, Klebsiella
Bacilos gram-negativos, não esporulados
Fermentam lactose com produção de gás a 35-37ºC/24-48h
Não indicam necessariamente contaminação fecal ou
presença de enteropatógenos
Coliformes Termotolerantes e Escherichia coli
Hábitat primário: trato intestinal
Fermentam lactose com produção de gás a 44,5 - 45,5ºC / 24h
90% de E. coli e algumas cepas de Enterobacter e Klebsiella
Processamento, armazenamento, higienização ou
manipulação inadequados
Recontaminação pós-processamento
pH 4 a 9
Tº 7 a 46ºC
Escherichia coli
EPEC – enteropatogênica clássica, gastroenterite em recém
nascidos e lactentes
EIEC – enteroinvasora, semelhante a shigelose
ETEC – enterotoxigênica, diarréia dos viajantes
EHEC – entero-hemorrágica, colite hemorrágica evoluindo
para síndrome urêmica hemolítica (HUS), sorotipo
O157:H7
Metodologia
Método de Número Mais Provável (NMP)
Série de 3 tubos
Presença/Ausência em 50ml
Lauril Sulfato Triptose (LST)
5 tubos de 10ml
Simples ou duplo
35ºC/24-48h
Verde Brilhante Bile (VB): 35ºC/24-48h
EC: 45,5ºC/24h
Tabela com inoculação de 0,1 - 0,01 e 0,001g ou ml de amostra
Confirmação E. coli
Caldos com fator de fluorescência
Ágar Levine Eosina Azul de Metileno (L-EMB)
35ºC/24h
Confirmação E. coli
Bioquímica (IMVIC)
Indol : + ou VM: +
VP: -
Citrato: -
INDICADORES GERAIS
Aeróbios mesófilos e psicrotróficos.
Quando presentes em número elevado nos alimentos
podem causar deterioração e/ou redução da vida-deprateleira
Fornecem informações gerais sobre as condições
durante o processamento e armazenamento do alimento
AERÓBIOS MESÓFILOS
FAO/OMS: 104 - 105 (máx permitido)
A maioria das bactérias patogênicas são mesófilas: alta
contagem indica que houve condições para multiplicação de
patógenos
Metodologia
plaqueamento em profundidade ou superfície
técnica de filtração por membrana
OSA: 30ºC/48h
AERÓBIOS PSICROTRÓFICOS
Não há padrão estabelecido
Inclui alguns patógenos (Listeria, Yersinia) e
deteriorantes (Hafnia)
Metodologia
plaqueamento em superfície
PCA: 7ºC/10dias
Salmonella
Família Enterobacteriaceae
Bastonete Gram-negativo
Não esporulado
Anaeróbio facultativo
Sensibilidade microbiana
Temperatura: 5º a 47ºC
pH: 3,8 a 9,5
Aw: 0,94
Concentração de NaCl: 8%
Classificação
Duas espécies
S. enterica com 6
subespécies
S. bongori
2501 sorotipos
Antígenos somáticos
Antígenos flagelares
Características da Doença
S. Typhi: Febre tifóide
S. Paratyphi A, B e C: Febre entérica
Febre alta, diarréia, vômito, septicemia, sangramentos
Mortalidade: 10%
Reservatório: homem
Dose infectante: 103
Mesma sintomatologia, mais branda
Salmonelose (S. enterica enterica)
Diarréia, febre, dores abdominais e vômito
Mortalidade: 1 a 15%
Dose infectante: >106
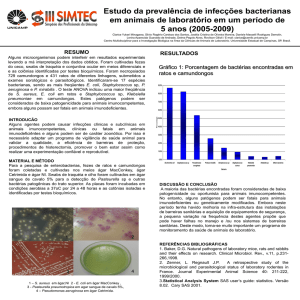
Epidemiologia
Flórida (2001): Salmonella Anatum, suco não pasteurizado
EUA (1999) – 15 estados, 207 casos, Salmonella Muenchen, suco não
pasteurizado
Rio de Janeiro (2006): suco in natura
74% coliformes 35ºC
57% coliformes 45ºC
Porto Alegre (2005): suco in natura
3 amostras coliformes 45ºC
1 amostra Salmonella
Isolamento e identificação
Método tradicional ISO6579, FDA, FSIS
Pré-enriquecimento
BPW, Caldo lactosado, TSB: 35-37ºC/18-24h
Enriquecimento
Caldo tetrationato: 35-37ºC/24h
Caldo Rappaport-Vassiliadis: 41-42ºC/24h
Plaqueamento: 35-37ºC/24h
Ágar Xilose Lisina Desoxicolato (XLD)
Ágar Hectoen (HE)
Ágar Bismuto sulfito (BS)
Ágar Verde brilhante (BG)
Confirmação bioquímica
Ágar tríplice açúcar ferro (TSI)
35-37ºC/24h
Ágar Lisina ferro (LIA)
Caldo descarboxilase lisina
35-37ºC/24h
Confirmação bioquímica
Ágar Uréia de Christenson
Teste Indol
Voges-Proskauer
Teste b-galactosidase
Confirmação sorológica
Poli O: soroaglutinação
Poli H: soroaglutinação
Testes
bioquímicos
Típicos
Testes sorológicos Resultado
Positivos
Confirmado
Típicos
Negativos
Pode ser
Atípicos
Positivos
Pode ser
Atípicos
Negativos
Não confirmado
Bactérias lácticas
Lactobacillus
Leuconostoc
Oenococcus
Gram-positivos
Cocos, cocobacilos ou bastonetes
Mesófilos D65ºC = 0,5 a 1min
Catalase negativa
Acidúricos (pH 3 a 7)
Não esporogênicos
Bactérias lácticas
Homo ou heterofermentativos
Redução do pH
Alteração de sabor e aroma
Acetoína e diacetil
Produção de gás
Contagem em placa
OSA (ágar soro de laranja), MRS 30-35ºC/48-72h
Microaerofilia ou sobrecamada
Presença/Ausência
TAB (caldo Thermoacidurans) ou CA (caldo ácido) 30-35ºC
Caldo APT ou MRS
Bactérias acéticas
Acetobacter
Gluconobacter
Gram negativas
Bastonetes ou cocbacilos
Aeróbias
Mesófilas
Catalase positiva
Oxidase negativa
Bactérias acéticas
Produção de ácido acético
Alteração de sabor e aroma
PDA acidificado 30ºC/5dias
Confirmação
Ágar etanol
Ágar GYC
Coloração de Gram
Bactérias acéticas
Principais características
Acetobacter
Aceto. aceti
Acidomonas
Frateuria
Gluconobacter
Gram
-/v
-/v
-/v
-/v
-/v
Bastonetes ou cocobacilos
+
+
+
+
+
Oxidação de etanol a ácido
acético
+
+
+
+
+
Oxidase
-
-
+
-
-
Catalase
+
+
Pigmento marron nas colônias
em Ágar GYC
-
-
Colônias de cor amarela
-
-
Fermentação de d-arabinose
-
-
Filamentos
+/-
-
+/-
Cadeias
+/-
-
+/-
+
+/-
+/-
-
+
-
+/-
+
Grupo Bacillus (Flat Sour)
Bacillus coagulans
Gram-positivos
Termófilo facultativo 30 a 61ºC
Catalase positiva
Acidúricos (pH 3,8)
Esporogênicos
Anaeróbio facultativo
Redução do pH (ac láctico) sem produção de gás
TAB (CA) 30-35ºC e 55ºC
DTA (agar Dextrose Triptona) ou TAA (agar Thermoacidurans) 35ºC e 55ºC
Alicyclobacillus
Wisotzkey (1992)
Bacilos termófilos acidófilos – “flat sour”
Ácidos graxos alicíclicos na membrana celular
Karavaiko (2005): nova classificação
Gram-positivos
Aeróbios ou anaeróbios facultativos
Acidófilos estritos (pH 0,5 a 6,0)
Termófilos estritos ou facultativos (mesófilos????)
Catalase positiva ou negativa
Alicyclobacillus
A. acidoterrestris
20ºC a 62ºC
D95ºC = 2,5 a 8,7min
Solo, suco de frutas, concentrados
Esporos viáveis: Brix 30º
Produtor de guaiacol (104 UFC/g)
Sabor estranho, odor fenólico, medicinal
A. acidocaldarius (termófilo estrito) - suco concentrado UHT
A. acidiphilus – refrescos ácidos
A. pomorum – suco misto
Alicyclobacillus
Metodologia APHA ou IFU (International Federation of Juice Producers)
ALI x YSG (agar extrato de levedura amido glicose) ou BAT (agar Bacillus
acidoterrestris)
Teste de contagem em placa + P/A
Células vegetativas : sem choque térmico
Esporos: choque de 80ºC/10min
Preparo da amostra
Suco pronto para consumo: incubação direta 45ºC/7dias
Amostras solidas e concentradas: 10g : 90ml YSG caldo
Sucos concentrados: 10g : 90ml água
Contagem em placa
Agar K e Agar BAT ou YSG 45ºC/5dias
Alicyclobacillus
Presença/Ausência
Confirmação
Incubação do restante da amostra a 45ºC/5dias
Coloração de Gram
Crescimento em PCA, TSA ou BHI
Crescimento a 30ºC e 65ºC em YSG
Teste de produção de guaiacol
Princípio do teste de guaiacol
peroxidase
H2O2 + guaiacol
O2 + H2O +composto oxidado
(vermelho tijolo/castanho)
Alicyclobacillus
Tabela. Interpretação de resultados
Perfil 1
Alicyclobacillus
spp não
deteriorantes
Perfil 2
Alicyclobacillus spp deteriorantes
potenciais
(principalmente A. acidoterrestris)
Crescimento em Ágar YSG ou BAT a
45ºC
+
+
Crescimento em pH neutro
(PCA/TSA/BHI) a 45ºC
-
-
Formação de esporos
+
+
Crescimento em YSG ou BAT a 65ºC
+
-
Crescimento em YSG ou BAT a 30ºC
-
+
Crescimento em Ágar K
-
+
Característica
Clostrídios
Cl. pasteurianum
Cl. butiricum
Anaeróbios estritos
Esporogênicos
Calatase negativa
Gram positivos
Mesófilos
pH 4,2-4,4
Emb. estufada (CO2 + H2), odor butírico
TAB (CA) com ágar selo 30-35ºC
TAA 35ºC anaerobiose
OBRIGADA!
[email protected]