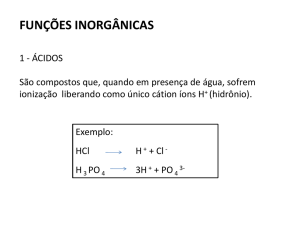
Ácidos Ionização Ácido é toda substância que em solução aquosa libera íon H+ Equação de Ionização de ácidos: HCl H+ + Cl-­‐ H2SO4 2H+ + SO4-­‐2 H3PO4 3H+ + PO4-­‐3 Classificação a)Quanto ao número de H+ Monoácido: HBrO2 Diácido: H2SO3 Triácido: H3BO3 Tetrácido: H4P2O7 b)Quanto à força: Forte:α > 50% Moderado: 5% < α < 50% Fraco: α < 5% Hidrácidos: Fortes: HCl, HBr e HI Moderados: HF Fracos: restante (H2S...) Oxiácidos: Hx X Oy Forte: y -­‐ x = 3 ou 2 HClO4 e H2SO4 Médio: y – x = 1 H3PO4 Fraco: y – x = 0 Nomenclatura dos ácidos: 1)Hidrácidos (ácidos sem oxigênio na fórmula): HX X = 7A nox -­‐1 6A nox -­‐2 CN-­‐ nox -­‐1 íon ciano NC-­‐ nox -­‐1 íon isociano Nome: ácido ______ ídrico Exemplos: HCl ácido clorídrico H2S ácido sulfídrico HI ácido iodídrico HCN ácido cianídrico 2)Oxiácidos (ácidos com oxigênio na fórmula) Hz X Oy X = ametal, Cr+6 e Mn+6/+7 Nox dos ametais em ácidos: 3A +3 4A +4 5A +3 +5 6A +4 +6 7A +1 +3 +5 +7 hipo…oso oso ico per…ico nox variável: Fe, Co, Ni+2 ou +3 Cu, Hg+1 ou +2 Pt, Sn, Pb+2, ou +4 Au+1 ou +3 Exemplo: HClO ácido hipocloroso HPO3 ácido fosforoso HMnO4 ácido permangânico H2CO3 ácido carbônico Formulação de ácidos: Ácido Clórico HClO3 Ácido Selênico H2SeO4 Ácido Nitroso HNO2 Exceções: utilizar H3 com os seguintes ametais: P, As, Sb e B Ácido fosfórico H3PO4 Ácido Antimonioso H3SbO3 Meta H___ Piro H4___ (Orto)H3____ Bases ou Hidróxidos Base é toda substância que dissolvida em água, libera íons OH-­‐ Dissociação das bases: NaOH Na+ + OH-­‐ Ca(OH)2 Ca+2 + 2OH-­‐ Al(OH)3 Al+3 + 2OH-­‐ As bases são formadas por: (metal)OH Exemplo: Pb(OH)2 AgOH Zn(OH)2 Obs: NH4+1 = amônio NH3 = amônia Nomenclatura: a)para metais de nox fixo (Al+3, Zn+2, Ag+1, família 1A, 2A e 3A): Hidróxido de _________ (metal) Exemplo: NaOH Hidróxido de Sódio AgOH Hidróxido de Prata Ba(OH)2 Hidróxido de Bário Mg(OH)2 Hidróxido de Magnésio NH4(OH) Hidróxido de Amônio b)para metais de nox variável: Fe, Co, Ni +2 ou +3 Cu, Hg +1 ou +2 Pt, Sn, Pb +2, ou +4 Au +1 ou +3 Hidróxido de _____________ + (nox em algarismo Romano) Hidróxido de _____________ + OSO (menor nox) + ICO (maior nox) Exemplo: Fe(OH)2 Hidróxido de ferro II Fe(OH)3 Hidróxido de ferro III Ou Fe(OH)2 Hidróxido ferroso Fe(OH)3 Hidróxido férrico Cu(OH) Hidróxido de cobre I ou Hidróxido cuproso Pb(OH)4 Hidróxido de Chumbo IV ou Hidróxido plúmbico Au(OH)3 Hidróxido de ouro III ou Hidróxido áurico Classificação das bases: a)Quanto ao número de hidroxilas OH-­‐ Monobase Li(OH) Dibase Mg(OH)2 Tribase Al(OH)3 Tetrabase Pb(OH)4 b)Força das Bases: Fortes: 1A e 2A Fracas: outras c)Solubilidade: Solúvel: 1A e NH4OH Pouco Solúvel: 2A Insolúvel: outras Sal São provenientes da reação entre ácido e base. HCl + NaOH NaCl + H2O Ácido + Base Sal + água Nomenclatura: A nomenclatura dos sais é obtida a partir da nomenclatura do ácido: Tabela ácido: 3A
4A
5A
6A
+1
hipo…oso
+3
+4
+3
oso
+5
+6
+5
ico
+7
per…ico
Ácido
ico
oso
ídrico
Sal
ato
ito
eto
+3
+4
Nome: 2o elemento + (ato, eto ou ito) de 1o elemento Formação so Sal a partir do Nome: 7A
Óxido São compostos binários de oxigênio __O Exemplos: Na2O CO2 NO Fe2O3 Classificação e nomenclatura dos óxidos: a)Óxidos Básicos São feitos por metais de nox +1 ou +2 Nome: NOX fixo: Óxido de ______ NOX variável: Óxido de _______ oso (< nox) Óxido de _______ ico (> nox) Exemplos: Na2O óxido de sódio CaO óxido de cálcio Ag2O óxido de prata FeO óxido de ferro II ou óxido ferroso OBS: os óxidos básicos reagem com a água formando bases: CaO + H2O Ca(OH)2 b)Óxidos Anfóteros: São formados por metais de nox +3 ou +4 Nome: NOX fixo: Óxido de ______ NOX variável: Óxido de _______ oso (< nox) Óxido de _______ ico (> nox) Al2O3 óxido de alumínio Fe2O3 óxido férrico ou óxido de ferro III PbO2 óxido plúmbico ou óxido de chumbo IV OBS: os óxidos anfóteros não reagem com água. c)Óxidos ácidos ou anidridos: São formados por ametais e por Cr+6 e Mn+6/+7 Nome: Anidrido ______ oso (< nox) Anidrido ______ ico (> nox) CO2 anidrido carbônico SO3 anidrido sulfúrico I2O3 anidrido iodoso N2O5 anidrido nítrico Mn2O7 anidrido permangânico P2O3 anidrido fosforoso Os óxidos ácidos reagem com água formano ácidos. Exemplo: SO3 + H2O H2SO4 d)Óxidos neutros: São os óxidos que não reagem com ácidos, nem com bases nem com água. NO monóxido de nitrogênio N2O monóxido de dinitrogênio CO monóxido de carbono e)Óxido salino ou misto: Nome: Óxido misto (ou salino) de ________ (metal) Fórmula: X3O4 X = metal Fe3O4 óxido salino (ou misto) de ferro Co3O4 óxido salino de cobalto f)Peróxidos: Nox do oxigênio nos peróxidos = -­‐1 XO2-­‐1 Nome: peróxido de ____ H2O2 peróxido de hidrogênio CaO2 peróxido de cálcio Na2O2 peróxido de cálcio g)Superóxido Nox do oxigênio = -­‐1/2 1A = X2O4-­‐1/2 2A = XO4-­‐1/2 Nome: superóxido de ____ Li2O4 superóxido de Lítio