PAGQuímica 2011/1
Exercícios de Equilíbrio Ácido-Base – Parte III
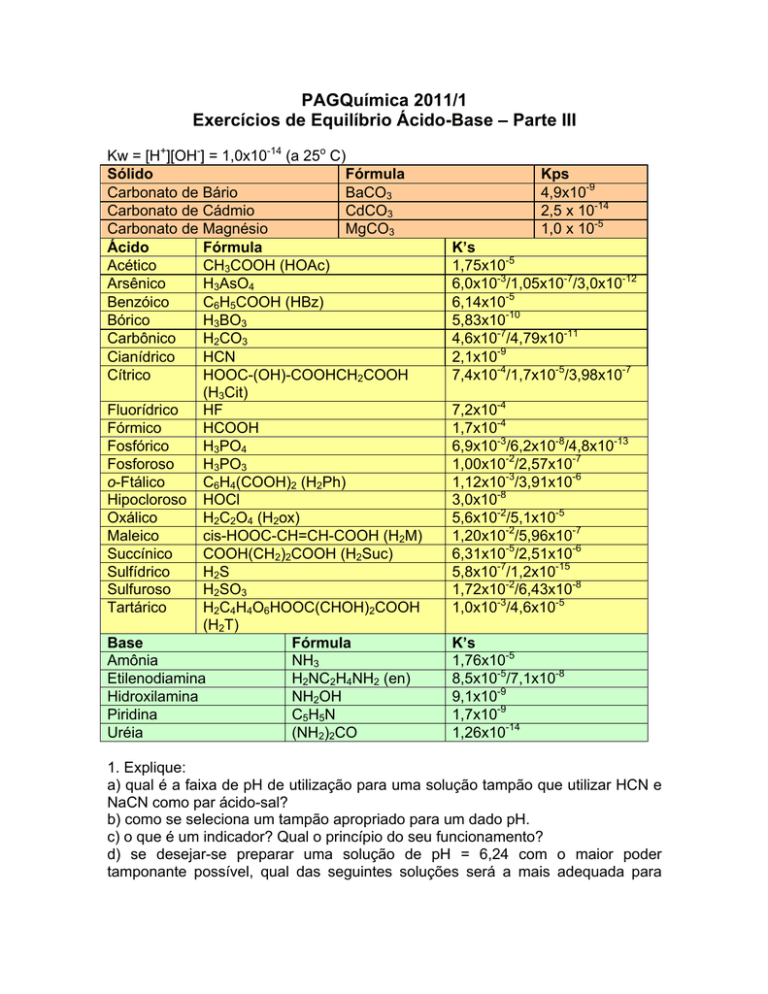
Kw = [H+][OH-] = 1,0x10-14 (a 25o C)
Sólido
Fórmula
Carbonato de Bário
BaCO3
Carbonato de Cádmio
CdCO3
Carbonato de Magnésio
MgCO3
Ácido
Fórmula
Acético
CH3COOH (HOAc)
Arsênico
H3AsO4
Benzóico
C6H5COOH (HBz)
Bórico
H3BO3
Carbônico
H2CO3
Cianídrico
HCN
Cítrico
HOOC-(OH)-COOHCH2COOH
(H3Cit)
Fluorídrico
HF
Fórmico
HCOOH
Fosfórico
H3PO4
Fosforoso
H3PO3
o-Ftálico
C6H4(COOH)2 (H2Ph)
Hipocloroso HOCl
Oxálico
H2C2O4 (H2ox)
Maleico
cis-HOOC-CH=CH-COOH (H2M)
Succínico
COOH(CH2)2COOH (H2Suc)
Sulfídrico
H2 S
Sulfuroso
H2SO3
Tartárico
H2C4H4O6HOOC(CHOH)2COOH
(H2T)
Base
Fórmula
Amônia
NH3
Etilenodiamina
H2NC2H4NH2 (en)
Hidroxilamina
NH2OH
Piridina
C5 H5 N
Uréia
(NH2)2CO
Kps
4,9x10-9
2,5 x 10-14
1,0 x 10-5
K’s
1,75x10-5
6,0x10-3/1,05x10-7/3,0x10-12
6,14x10-5
5,83x10-10
4,6x10-7/4,79x10-11
2,1x10-9
7,4x10-4/1,7x10-5/3,98x10-7
7,2x10-4
1,7x10-4
6,9x10-3/6,2x10-8/4,8x10-13
1,00x10-2/2,57x10-7
1,12x10-3/3,91x10-6
3,0x10-8
5,6x10-2/5,1x10-5
1,20x10-2/5,96x10-7
6,31x10-5/2,51x10-6
5,8x10-7/1,2x10-15
1,72x10-2/6,43x10-8
1,0x10-3/4,6x10-5
K’s
1,76x10-5
8,5x10-5/7,1x10-8
9,1x10-9
1,7x10-9
1,26x10-14
1. Explique:
a) qual é a faixa de pH de utilização para uma solução tampão que utilizar HCN e
NaCN como par ácido-sal?
b) como se seleciona um tampão apropriado para um dado pH.
c) o que é um indicador? Qual o princípio do seu funcionamento?
d) se desejar-se preparar uma solução de pH = 6,24 com o maior poder
tamponante possível, qual das seguintes soluções será a mais adequada para
este fim: i) NH4OH e NH4Cl 0,2 mol/L; ii) ácido acético e acetato de sódio 0,1
mol/L; iii) H2S e NaHS 0,02 mol/L; iv) H2S e KHS 0,08 mol/L?
e) como proceder para preparar uma solução tampão de pH = 10 tendo em
estoque no laboratório apenas NaHCO3, além de alguns reagentes mais comuns.
2. Preparou-se uma solução 0,25 mol/L de carbonato de sódio (Na2CO3) em água.
a) qual o pH da solução? Ignore uma eventual segunda hidrólise do ânion.
b) qual ou quais dos respectivos carbonatos podem ser precipitados pela adição
de 5 x 10-6 mol dos cátions correspondentes a 1 L dessa solução: Ba2+, Cd2+ e
Mg2+?
c) se o pH for ajustado para 5, qual ou quais dos carbonatos anteriores devem
precipitar?
d) voltando à solução de partida, descreva duas maneiras de se preparar soluções
tampão a partir dela e de quaisquer outros reagentes à sua escolha.
e*) sabendo a expressão de α2 para um ácido diprótico, proponha uma expressão
para α4 para um ácido tetraprótico como por exemplo o EDTA.
3. Sabendo as constantes de dissociação dos ácidos oxálico (H2C2O4), fosfórico
(H3PO4) e fórmico (HCOOH), determine:
a) qual o melhor par conjugado para se obter um tampão de pH = 2,88?
b) como se preparam 50 mL deste tampão, dispondo-se de soluções 0,10 mol/L
de cada membro do par conjugado?
4. Qual o pH resultante das seguintes soluções aquosas (apresente os equilíbrios
envolvidos e indique os cálculos realizados):
a) HOCl 0,5 mol/L+ NaOCl 0,2 mol/L
b) KHCO3 + K2CO3 (1 mol/L cada)
c) NaH2Cit 0,5 mol/L+Na2HCit 0,2 mol/L (onde H2Cit- e HCit2- são ânions
derivados do ácido cítrico)
d) biftalato de potásio + ftalato de potássio (0,11 mol/L cada)
e) ácido cítrico 0,12 mol/L + seu sal monossódico 0,21 mol/L
5. A seguir são apresentadas duas afirmações. Classifique-as como verdadeiras
ou falsas. No caso de afirmações falsas, reescreva-as, corrigindo o que for
necessário.
a) para se preparar um tampão bissulfeto/sulfeto não é necessário que se tenha
no laboratório ambos os sais.
b) um ácido fraco e seu sal sempre constituirão uma solução tampão de pH ácido.
6. O hidróxido de zinco (Zn(OH)2) é um composto pouco solúvel. A adição de
NaOH a uma solução de Zn2+ leva a formação de um precipitado, mas a adição de
excesso de NaOH redissolve o precipitado, levando à formação de Zn(OH)42-. Este
íon complexo tem uma constante de formação tão elevada (2,8 x 1015), que
qualquer pH ligeiramente superior a 7 leva à dissolução do precipitado. Explique a
melhor maneira de preparar uma solução de pH = 7, na qual virtualmente todo o
Zn2+ vá precipitar na forma de hidróxido, utilizando os dados constantes no
formulário (HCN, HF, H2S, H2SO3, H2CO3, uréia) e explicitando qual deve ser a
relação entre as concentrações das espécies presentes.
7. Deseja-se tamponar um determinado meio no pH = 6,5
a) consultando a tabela de constantes de ionização (H3AsO4, H2CO3, ácido
maleico, H2S), sugira um par tamponante para este meio, justificando sua resposta.
b) calcule a massa do sal sódico que deve ser adicionada a 200 mL de solução de
ácido 0,500 mol/L para produzir o tampão sugerido em a.
c) quais são o pH e a variação de pH resultante da adição de 80 mg de NaOH à
solução tampão inicial? Compare com a variação de pH resultante da adição do
NaOH em 1 L de água pura.
8. Deseja-se tamponar um determinado meio no pH = 6,4
a) consultando a tabela de constantes de ionização, sugira um par tamponante
para este meio a partir do H3PO3 e seus sais, justificando sua resposta.
b) calcule a massa do sal sódico que deve ser adicionada a 1000 mL de solução
de ácido 0,500 mol/L para produzir o tampão sugerido em a).
c) quais são o pH e a variação de pH resultante da adição de 80 mg de NaOH à
solução tampão inicial? Compare com a variação de pH resultante da adição do
NaOH em 1000 mL de água pura.
9. Foram preparados 100 mL de solução tampão hidrogenocitrato de sódio
(Na2HCit, genericamente) 0,20 mol/L e citrato de sódio (Na3Cit, genericamente)
0,15 mol/L.
a) qual é o pH dessa solução tampão?
b) quais são o pH e a variação de pH resultante da adição de 10 mL de HCl 0,1
mol/L à solução tampão inicial? Compare com a variação de pH resultante da
adição do HCl em 100mL de água pura.
c) quais são o pH e a variação de pH resultante da adição de 10 mL de KOH 0,1
mol/L à solução tampão inicial? Compare com a variação de pH resultante da
adição do KOH em 100 mL de água pura.
10. Deseja-se preparar uma solução tampão de pH = 7, a partir de ácido
hipocloroso (HClO) e seu sal sódico.
a) qual a massa de sal que deve ser misturada a 400 mL de ácido 1 mol/L para
produzir este tampão?
b) qual a variação de pH decorrente da adição de 100 mL de solução 0,5 mol/L de
HCl a 400 mL do tampão? Compare com a variação de pH resultante da adição do
HCl em 400 mL de água pura.
c) qual a variação de pH decorrente da adição de 100 mL de solução 0,2 mol/L de
NaOH a 400 mL do tampão? Compare com a variação de pH resultante da adição
do NaOH em 400 mL de água pura.
11. Precisa-se tamponar um meio reacional a um pH = 4,75.
a) dentre os seguintes pares (ácido ou base + seu(s) sal(is)), escolha o mais
adequado para preparar tal tampão: ácido arsênico, piridina, ácido cianídrico,
ácido fosfórico, amônia, ácido fluorídrico e ácido fórmico.
b) qual a relação entre as espécies que compõem este tampão, para se obter o pH
desejado?
c) se for necessário que esse tampão resista à adição de 10 mL de solução de
HNO3 0,10 mol/L sem que o pH caia a menos de 4,70, qual deve ser a
concentração mínima de cada espécie?
d) se for necessário que esse tampão resista à adição de 10 mL de solução de
KOH 0,10 mol/L sem que o pH se eleve a mais de 4,80, qual deve ser a
concentração mínima de cada espécie?
12. Uma reação deve ocorrer em um meio tamponado de pH 5,50. Para obter a
solução tampão desejada, você tem a sua disposição as seguintes soluções: ácido
succínico 1,0 mol/L, HCl 3,0 mol/L e NaOH 3,0 mol/L.
a) quais soluções você utilizaria?
b) qual a relação entre as concentrações das espécies que compõem esse
tampão para que seja obtido o pH desejado?
c) que volume de solução de HCl ou NaOH (a que você escolheu no item a) deve
ser adicionado a 1,0 L de ácido succínico para obter o pH 5,50?
d) calcule o valor do pH final da solução tampão se a ela forem adicionados 10
milimols de KOH sólido.
13. Precisa-se tamponar um meio reacional a um pH = 4,20.
a) dentre os seguintes pares (ácido + seu sal ou base + seu sal), escolha o mais
adequado para preparar tal tampão: ácido bórico, hidroxilamina, ácido benzóico,
ácido fosfórico, amônia e ácido fluorídrico.
b) qual a relação entre as concentrações das espécies que compõem esse
tampão, para se obter o pH desejado?
c) se for necessário que 1 litro desse tampão resista à adição de 10 milimols de
HNO3 sem que o pH caia a menos de 4,10, qual deve ser a concentração mínima
de cada espécie?
14. Precisa-se tamponar um meio reacional a um pH = 4,00.
a) consultando a tabela de constantes de ionização de ácidos e bases fracos,
selecione o par conjugado (ácido fraco + seu sal ou base fraca + seu sal) mais
adequado para preparar o melhor tampão com este pH, dentre as seguintes
espécies: ácido acético, ácido bórico, ácido fluorídrico, ácido tartárico e
etilenodiamina.
b) qual deve ser a relação necessária entre as concentrações das espécies que
compõem esse tampão para se obter o pH desejado?
c) qual deve ser a concentração mínima de cada espécie, se for necessário que 1
litro desse tampão resista à adição de 10 milimols de KOH sem que o pH se eleve
a mais de 4,10?
15. Precisa-se tamponar um meio reacional a um pH = 9,00.
a) consultando a tabela de constantes de ionização de ácidos e bases fracos,
selecione o par conjugado (ácido fraco + seu sal ou base fraca + seu sal) mais
adequado para preparar o melhor tampão com este pH que resista a variações de
temperatura, dentre as seguintes espécies: ácido bórico, ácido cianídrico, amônia.
b) qual deve ser a relação necessária entre as concentrações das espécies que
compõem esse tampão para se obter o pH desejado?
c) qual deve ser a concentração mínima de cada espécie, se for necessário que 1
litro desse tampão resista à adição de 10 milimols de HNO3 sem que o pH caia a
menos de 8,90?
*: alfa-valores: assunto não abordado na QUI01004 em 2011/1 devido a restrições
de cronograma.












