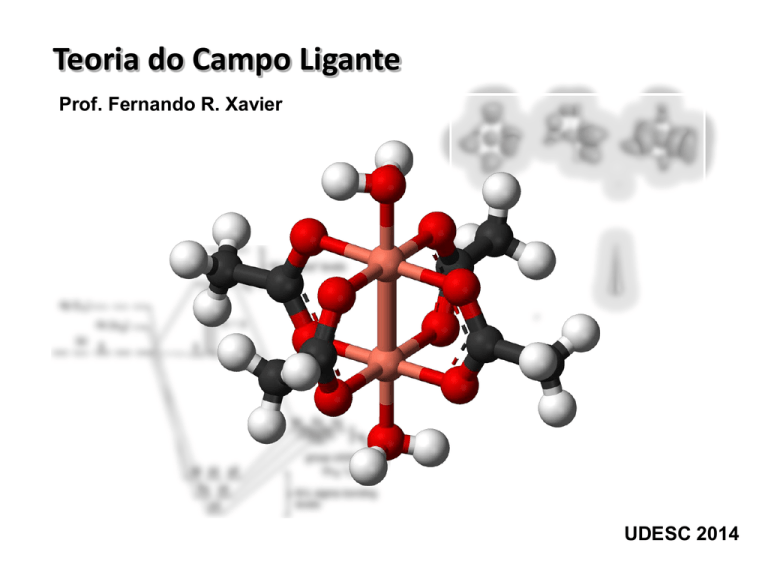
Teoria do Campo Ligante
Prof. Fernando R. Xavier
UDESC 2014
Até então...
A TCC apresenta um modelo conceitual simples para o fenômeno de formação
de compostos de coordenação que pode ser empregrada ainda para interpretar
propriedades magnéticas, spectroscópicas e termoquímicas através dos
valores encontrados para ΔO.
Problemas e Limitações:
•
Trata os ligantes como pontos de carga ou dipolos, não levando em
consideração o enlace de seus orbitais com os do centro metálico.
•
Não fornece uma explicação sobre qual a razão da ordem em que os
ligantes estão dispostos na série espectroquímica.
Teoria do Campo Ligante - TCL
A TCL consiste então na aplicação da teoria dos orbitais moleculares (já comum
para moléculas mais simples e não metálicas como o O2, por exemplo) à
compostos de coordenação.
Foi proposta por J. S. Griffith e L. E. Orgel em 1957 pela combinação das idéais
da Teoria do Campo Cristalino e da Teoria dos Orbitais Moleculares aplicados
em complexos.
Pricipal evidência: O Efeito Nefelauxético
Indica, indiretamente, que existem elétrons sendo compartilhados entre os orbitais
metálicos e dos ligantes, pois experimentalmente verifica-se que a repulsão elétroneletron em um complexo é menor quando comparada ao respectivo íon livre.
Explicação: As repulsões elétron-elétron caem devido a expansão da nuvem
eletrônica, pois orbitais atômicos (menores) dão lugar a formação de orbitais
moleculares (maiores).
Efeito Nefelauxético = “Expansão da Nuvem Eletrônica”
Evidência experimental: O espectro de RPE do complexo K2[IrCl6]
O desdobramento hiperfino observado no espectro ao lado
resulta do acoplamento dos momentos magnéticos de spin
dos ligantes com os momentos magnéticos dos spins
eletrônicos do metal.
Para que tal acoplamento ocorra, o espaço ocupado por estes elétrons deve ser
comum tanto para o ligante quanto para o complexo, por isso um orbital molecular.
Revisão: Orbitais moleculares
Para a formação de uma molécula diatômica simples (H2, por exemplo) a
combinação linear de funções de onda Ψ± = χA ± χB fornece duas soluções
possíveis:
Ψ + = χA + χ B
- interferência construtiva dos orbitais
Ψ- = χA - χ B
- interferência destrutiva dos orbitais
Ψ - = χA - χ B
χA
χB
Ψ + = χA + χ B
Probabilidade: Orbitais moleculares do H2
YA
YB
YA + Y B
YA
YB
YA - YB
|YA + YB|2
OM ligantes
|YA - YB|2
OM anti-ligantes
O diagrama de orbitais moleculares
ΨE
energia
χA
χB
Onde χA e χB são os orbitais atômicos e Ψ+ e Ψsão
os
orbitais
ligante
e
anti-ligante,
respectivamente.
Ψ+
O diagrama de orbital molecular do H2
E
Obs.: Em alguns casos é possível a
energia
geração de orbitais moleculares com
Ha
Hb
a mesma energia de um orbital
atômico. Este orbital é dito nãoligante.
Diagrama de OM da molécula de flúor (F2).
9F:
1s2 2s2 2p5
4σu
E
energia
4σu*
2p
2πg*
2πg
2p
1πu
1πu
3σg
3σg
2σu*
2s
2s
1σg
2σu
1σg
Um modelo simples (TLV): A formação do BeH2
1s2
2+ - 1s2
4Be
2s0
2p0
Estado fundamental
1
H1-
-
1s2
orbitais híbridos do tipo sp
Em termos de orbitais moleculares temos:
σ*
E
σ*
2p
sp
não ligante
Be2+
σ
σ
H-
Orbitais Moleculares de Compostos Octaédricos
Para aplicarmos a TOM em complexos podemos utilizar o método das
combinações lineares de simetria adaptada (em inglês SALCs).
Parte I – Interação Metal-Ligante do tipo σ (sigma)
Considere a formação de um complexo octaédrico nos quais cada ligante (L)
possui uma ligação simples com o centro metálico em questão. Neste caso os
orbitais do átomo central se dividem em 04 (quatro) grupos distintos:
Com a formação de um complexo, 06 (seis) combinações lineares de simetria
adaptada compatíveis (mesma paridade) são detectadas:
s
a1g: σx + σ-x + σy + σ-y + σz + σ-z
px
t1u: σx - σ-x
py
t1u: σy - σ-y
pz
t1u: σz - σ-z
dx2-y2
eg: σx + σ-x - σy - σ-y
dz2
eg: 2σz + 2σ-z - σx - σ-x - σy - σ-y
Note
que
os
orbitais
triplamente
degenerados t2g do centro metálico (dxy, dxz,
dyz) estão entre os eixos cartesianos e, por
isso, não interagem construtivamente para a
formação de combinações lineares.
Energia
A Construção do Diagrama de Orbitais Moleculares – Complexos Oh
t1u*
eg*
O mesmo da
TCC!!!
a1g*
Δo
t2g
4p (t1u)
eg*
4s (a1g)
3d (eg + t2g)
t2g
Orbitais dos
ligantes
(a1g + t1u + eg)
t1u
eg
a1g
Energia
Exemplo 1: O complexo [Co(NH3)6]3+
t1u*
eg*
a1g*
Δo
t2g
4p (t1u)
eg*
4s (a1g)
3d (eg + t2g)
t2g
Orbitais dos
ligantes
(a1g + t1u + eg)
t1u
Co3+
eg
(d6)
a1g
Energia
Exemplo 2: O complexo [CoF6]3-
t1u*
eg*
a1g*
Δo
t2g
4p (t1u)
eg*
4s (a1g)
3d (eg + t2g)
t2g
Orbitais dos
ligantes
(a1g + t1u + eg)
t1u
Co3+
eg
(d6)
a1g
Parte II – Interação Metal-Ligante do tipo π (pi)
Três tipos de orbitais presentes em ligantes são aptos (simetria e energias
compatíveis) para efetuarem ligações π com os orbitais d do centro metálico:
Como a ligação π ocorre entre eixos cartesianos, neste caso os orbitais metálicos
t2g (dxy, dxz, dyz) terão condições de interagir com orbitais de simetria adequada
presentes nos ligantes.
Ligantes do tipo π-doadores (ou π-básicos)
São aqueles que possuem orbitais de simetria π entorno do eixo de ligação M–L já
preenchidos por elétrons. Os íons Cl-, Br-, OH-, O2- e H2O são exemplos típicos.
Energia
Os elétrons π dos ligantes são depositados
eg*
Δo
eg*
Δo
nos OM t2g ligantes, enquanto os elétrons d
do centro metálico irão ocupar o nível
energético dos OM t2g anti-ligantes, fazendo
com que o valor de ΔO seja reduzido.
π
t2g*
t2g
t2g
t2g
Metal
Ligante
Energia
Exemplo 3: A ligação π-básica no complexo [CoF6]3eg*
Δo
eg*
Δo
t2g*
t2g
t2g
t2g
Ligantes do tipo π-aceptores (ou π-ácidos)
São aqueles que possuem orbitais de simetria π entorno do eixo de ligação M–L
vazios e, desta forma, podem receber elétrons provenientes do metal. Compostos
Energia
tais como CO, CN-, N2, R2S e PR3 são exemplos típicos destes ligantes.
t2g*
t2g
eg*
Δo
eg*
π
Como o OMs t2g* possui energia elevada
Δo
(maior caráter de ligante) são os OMs t2g
t2g
que irão acomodar os elétrons oriundos
do metal (maior caráter metálico). Neste
t2g
Metal
Ligante
caso o valor de ΔO será então acrescido.
Energia
Exemplo 4: A ligação π-ácida no complexo [Mn(CO)6]+
t2g*
t2g
eg*
Δo
eg*
Δo
t2g
t2g
A Série Espectroquímica e a Teoria do Campo Ligante
Ligantes de
“campo fraco”
I- < Br- < S2- < SCN- < Cl- < NO3- , F- < HO- <
ox2- < OH2 < NCS- < CH3CN < NH3 < en <
Ligantes de
“campo forte”
bpy < phen < NO2- < PR3 < CN- < CO
Agora é possível notar que ligantes π-básicos são tipicamente fracos, pois
reduzem a magnitude de ΔO, enquanto ligantes π-ácidos são tipicamente de campo
forte, pois o valor de ΔO é acrescido após o enlace entre os orbitais metálicos e os
orbitais do ligante.
Aumento do ΔO
π-básicos < π-básicos fracos < σ típicos < π-ácidos
I-, Cl-, Br-, F-
OH2
NH3
PR3, CO
Resumo: Ligações σ e π em complexos
Evidências Experimentais da ligação π em complexos
Uma técnica analítica bastante útil para detectarmos a presença de ligações π em
complexos é a espectroscopia na região do infravermelho (IV).
O infravermelho no espectro eletromagnético...
Infravermelho e a localização de funções orgânicas...
Ligações π em carbonil-complexos
A absorção de radiação infravermelha pela tripla ligação do ligante CO isolado é
em 2143 cm-1, entretanto é detectado significativas variações deste valor em
diferentes carbonil-complexos.
Considere as duas séries de compostos isoeletrônicos descritos abaixo:
Composto
Frequência (cm-1)
[Mn(CO)6]+
2090
[Cr(CO)6]
2000
[V(CO)6]-
1860
[Ni(CO)4]
2060
[Co(CO)4]-
1860
[Fe(CO)4]2-
1790
Nox do metal
Elétrons d
Os resultados indicam que quanto mais elevado o nox do metal (maior deficiência
eletrônica) menor é sua capacidade de efetuar a chamada retrodoação
eletrônica. A situação inversa também é observada.
Desta forma é possível, através da
técnica de IV, inferir sobre a ordem
de ligação do sistema M–C–O de
maneira indireta.
π
Sem retrodoação;
CO com maior caráter de tripla;
> νC-O no IV
Com retrodoação
CO com maior caráter de dupla
< νC-O no IV
Competição de ligantes por elétrons π
Considere dois complexos octaédricos com o seguinte arranjo espacial de ligantes:
No caso (a) a retrodoação irá ocorrer em ambos os sentidos ao longo de um eixo
OC–M–CO, pois temos o mesmo ligante com mesmas características π-aceptoras.
π
π
No caso (b) a retrodoação irá ocorrer de maneira desigual ao longo de um eixo
OC–M–L se o ligante L não for um forte π-aceptor.
π
π
O processo todo pode ser explicado pela análise das seguintes formas canônicas:
Se o ligante L for CO, ambas as formas canônicas (a) e (b) irão contribuir
para o híbrido de ressonância (50% de retrodoação para cada ligante). Caso
L não seja um forte pi-aceptor, a forma canônica (b) será a preponderante.
Exemplo 1: Análise de uma série de compostos de carbonil-molibdênio no IV.
Frequência (cm-1)
Composto
ν1 C–O
ν2 C–O
Diferença
[Mo(PCl3)3(CO)3]
1989
2041
52
[Mo(PϕCl2)3(CO)3]
1943
2016
73
[Mo(Pϕ2Cl)3(CO)3]
1885
1977
92
[Mo(Pϕ3)3(CO)3]
1835
1949
114
[Mo(py)3(CO)3]
1746
1888
142
[Mo(dien)(CO)3]
1723
1883
160
Através destes números, é possível verificar o grande poder π-aceptor das fosfinas,
pois estas competem fortemente pelos elétrons π do metal, logo a ordem de ligação
CO não é demasiadamente reduzida.
Como o ligante dien (típico σ-doador) não compete pelos elétrons π do metal, a
ordem de ligação CO é significativamente reduzida via retro-doação.
Juntamente com outros exemplos, foi possível montar uma série de ligantes de
acordo suas capacidades π-aceptoras:
Fortes
π-aceptores
NO > CO ≈ RNC ≈ PCl3 > PCl2OR > PCl2R
> PBr2R > PCl(OR)2 > PClR2 > P(OR)3 >
PR3 ≈ SR2 > RCN > o-phen > alquil-aminas,
éteres, álcoois
Fracos
π-aceptores
Nota-se claramente o efeito de vários fatores na composição da lista acima, dentre
estes, a eletronegatividade se destaca, juntamente com o efeitos eletrônicos
doadores e retiradores.
Exemplo 2: Análise estrutral de uma série de compostos de carbonil-cromo.
A ligação Cr–P é menor para o complexo
fosfito indicando maior retrodoação para
o cromo, uma vez que o ligante fosfito é
possui um maior poder π-aceptor que os
ligantes fosfino.
Ligação (pm)
[Cr(Pϕ3)(CO)5]
[Cr(POϕ3)(CO)5]
trans-[Cr(POϕ3)2(CO)4]
Cr–P
242,2
230,9
225,2
Cr–C (trans ao P)
184,4
186,1
-
Cr–C (trans ao CO)
188,0
189,6
187,8
C–O (trans ao P)
115,4
113,6
-
C–O (trans ao CO)
114,7
113,1
114,0
Resumo: Diagrama OM para Complexos Octaédricos com ligações σ e π.
Orbitais Moleculares de Compostos Tetraédricos
A TOM também pode ser aplicada em complexos tetraédricos via método das
combinações lineares de simetria adaptada (em inglês SALCs).
Parte I – Interação Metal-Ligante do tipo σ (sigma)
Considere a formação de um complexo tetraédrico nos quais cada ligante (L)
possui uma ligação simples com o centro metálico em questão. Neste caso os
orbitais do átomo central se dividem em 04 (quatro) grupos distintos:
Orbitais metálicos
Simetria
Degenerescência
s
a1
1
dx2-y2, dz2
e
2
dxy, dxz, dyz
t2
3
Com a formação de um complexo, 04 (quatro) combinações lineares de simetria
adaptada compatíveis (mesma paridade) são detectadas:
Energia
A Construção do Diagrama de Orbitais Moleculares – Complexos Td
t2*
4p (t2)
a1*
t2*
O mesmo da
TCC!!!
4s (a1)
e
t2*
3d (e + t2)
e
Orbitais dos
ligantes
t2
a1
(a1 + t2)
Energia
Exemplo 1: O complexo [Cu(NH3)4]2+ - (apenas ligações σ)
t2*
4p (t2)
a1*
O mesmo da
TCC!!!
t2*
Δo
4s (a1)
e
t2*
3d (e + t2)
e
Orbitais dos
ligantes
Cu2+
(d9)
t2
a1
(a1 + t2)
Exemplo 2: O complexo [Ni(CO)4] - (ligações σ e π)
A Construção do Diagrama de Orbitais Moleculares – Complexos QP
Exemplo 1: O complexo K2[PdCl4] - (apenas ligações σ)
Energia
1eu
px, py
eu
1b1g
3a1g
pz
2a1g
a2u
a2u
1b1g
s (a1g)
Δ
b2g
eg
2a1g
(a1g)
(b1g)
dz2 dx2-y2
(b2g)
dxy
(eg)
b2g
eg
(a1g + eu + b1g)
dxz, dyz
1b1g
Pd2+
(d8)
Orbitais dos
ligantes
1eu
1a1g
A Construção do Diagrama
de Orbitais Moleculares para
Complexos Quadrado-Planos
(ligações σ e π)