Complexos: estrutura – 1
Complexos: Estrutura
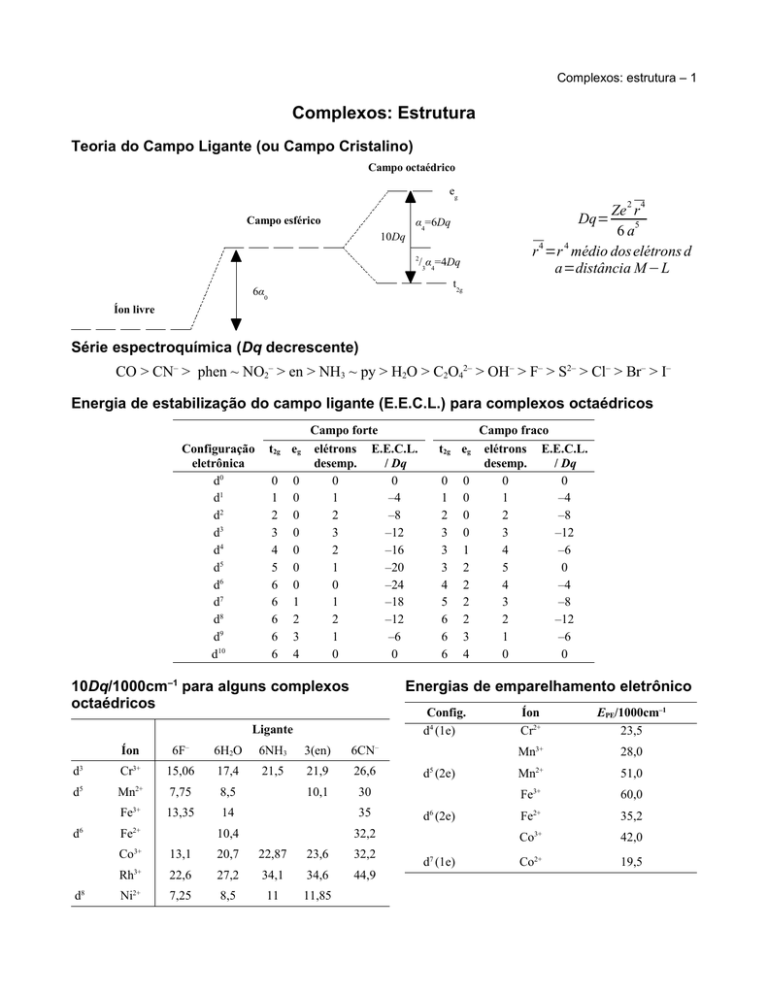
Teoria do Campo Ligante (ou Campo Cristalino)
Campo octaédrico
eg
Campo esférico
10Dq
Ze 2 r 4
6 a5
r 4 =r 4 médio dos elétrons d
a=distância M−L
Dq=
α4=6Dq
2
/3α4=4Dq
t2g
6α0
Íon livre
Série espectroquímica (Dq decrescente)
CO > CN– > phen ~ NO2– > en > NH3 ~ py > H2O > C2O42– > OH– > F– > S2– > Cl– > Br– > I–
Energia de estabilização do campo ligante (E.E.C.L.) para complexos octaédricos
Campo forte
Configuração
eletrônica
d0
d1
d2
d3
d4
d5
d6
d7
d8
d9
d10
t2g eg
0
1
2
3
4
5
6
6
6
6
6
0
0
0
0
0
0
0
1
2
3
4
elétrons
desemp.
0
1
2
3
2
1
0
1
2
1
0
E.E.C.L.
/ Dq
0
–4
–8
–12
–16
–20
–24
–18
–12
–6
0
10Dq/1000cm–1 para alguns complexos
octaédricos
Íon
6F
d
3
Cr
d
5
6NH3
3(en)
6CN–
15,06
17,4
21,5
21,9
26,6
Mn
7,75
8,5
10,1
30
Fe
13,35
14
35
10,4
32,2
2+
3+
d6
Fe2+
Co
d8
0
1
2
3
3
3
4
5
6
6
6
0
0
0
0
1
2
2
2
2
3
4
Config.
d4 (1e)
6H2O
3+
t2g eg
elétrons
desemp.
0
1
2
3
4
5
4
3
2
1
0
E.E.C.L.
/ Dq
0
–4
–8
–12
–6
0
–4
–8
–12
–6
0
Energias de emparelhamento eletrônico
Ligante
–
Campo fraco
3+
13,1
20,7
22,87
23,6
32,2
3+
Rh
22,6
27,2
34,1
34,6
44,9
Ni2+
7,25
8,5
11
11,85
d5 (2e)
d (2e)
6
Íon
Cr2+
EPE/1000cm–1
23,5
Mn3+
28,0
Mn2+
51,0
Fe3+
60,0
Fe
35,2
2+
Co
d7 (1e)
3+
42,0
Co2+
19,5
Complexos: estrutura – 2
Raios cristalinos de Shannon de metais de transição 3d, para N.C.=6
120
M2+
110
100
r/pm
M3+
90
80
70
Z
60
20
21
22
23
24
25
26
27
28
29
30
Energia reticular de MCl2 (M=metais de transição 3d)
-3600
-3700
-3900
U0/kJ mol
-1
-3800
-4000
-4100
-4200
Z
-4300
20
M
Z
Ca
Ti
Cr
Mn
Fe
Co
Ni
Cu
Zn
20
22
24
25
26
27
28
29
30
U0
/ kJ mol–1
–3630,0
–3872,2
–3944,8
–3882,4
–3968,6
–4056,7
–4125,0
–4181,1
–4117,4
21
ΔfH(MCl2)
/ kJ mol–1
–795,4
–513,8
–395,4
–481,3
–341,8
–312,5
–305,3
–220,1
–415,1
22
23
24
ΔsubH(M)
/ kJ mol–1
159,28
449,8
364,08
234,1
365,9
397,6
389,4
317
121,97
25
26
27
28
29
30
EI1(M)
EI2(M)
ΔdissH(Cl2)
–1
–1
/ kJ mol / kJ mol
/ kJ mol–1
589,7
1145
242,6
658
1310
"
652,7
1592
"
717,4
1509
"
759,3
1561
"
760,0
1646
"
736,7
1753
"
745,4
1958
"
906,4
1733
"
EAE(Cl)
/ kJ mol–1
–349
"
"
"
"
"
"
"
"
Complexos: estrutura – 3
Desdobramento de níveis dos orbitais d em campos de diferentes geometrias
dx²-y²
b1g
4
Obs : Dq tet = Dq oct
9
dx²-y²
eg
t2
dz²
10Dqoct
10Dqtet
t2g
e
dxy
dxz
Td
Kh ou Rh(3)
(campo esférico)
Oh
b2g
dxy
a1g
dz²
dyz
dxz
D4h
(eixo z along.)
dyz
eg
D4h
(planar)
Teoria dos Orbitais Moleculares – aplicação da Teoria de Grupo
O
E
6C4
3C2 8C3
(C42)
1
1
6C2
A1
1
1
A2
1
–1
1
1
–1
E
2
0
2
–1
0
(z², x²–y²)
T1
3
1
–1
0
–1
(x, y, z)
T2
–1
2
–1
2
0
0
1
0
(xy, xz, yz)
Гσ
3
6
Гπ
12
0
–4
0
0
1
Orbitais (n–1)d, ns e np do metal:
ГM=A1g + Eg + T2g + T1u
CLOA–AS dos orbitais σ dos ligantes:
Гσ(O)=A1 + E + T1 ⇒ Гσ(Oh)=A1g + Eg + T1u
CLOA–AS dos orbitais π dos ligantes:
Гπ(O)=2T1 + 2T2 ⇒ Гπ(Oh)=T1g + T2g + T1u + T2u
CLOA–AS dos orbitais σ dos ligantes:
Orientação dos
vetores que
representam os
orbitais σ:
z
1
2
5
Eg:
3
4
6
e 1=
1
2 L 2 L 6 −L 2 −L 3 −L 4 −L 5
12 1
e 2 =
1
L −L L 4−L 5
2 2 3
y
T1u:
A1g:
t11 =
t12 =
a1=
1
6
t13 =
L 1 L 2 L 3L 4 L 5L 6
1
2
1
2
L1 − L6
L2 − L4
1
L −L
2 3 5
Complexos: estrutura – 4
Diagrama qualitativo de energia dos OM de complexo octaédrico (ligante doador σ)
ML6 (OM)
M (OA)
t1u
6L
t1u*
(CLOA-AS)
a1g*
px
a1g
py
pz
eg*
s
10Dq
dn (ne)
dn (ne)
dx²-y²
dz²
dxy
dxz
t2g
dyz
t2g
eg
eg
t1u
a1g
12e
eg
t1u
12e
a1g
Efeito da ligação π nos níveis de energia
t2g*
Somente
ligações σ
Ligante
doador π
eg*
Ligante
aceptor π
t2g
eg*
Orbitais π
vazios do
ligante
eg*
10Dq
10Dq
t2g*
10Dq
t2g
↑↓
↑↓
↑↓
t2g
t2g
Orbitais π
preenchidos do
ligante
↑↓
↑↓ ↑↓
t2g
Teoria da Ligação da Valência – Número Atômico Efetivo
Complexo
Elétrons
do íon
Pt(NH3)64+
Co(NH3)63+
Fe(CN)64–
Fe(CO)5
Cr(CO)6
78 – 4 =74
27 – 3 =24
26 – 2 =24
26 – 0 =26
24 – 0 =24
Elétrons
dos
ligantes
6 × 2 = 12
6 × 2 = 12
6 × 2 = 12
5 × 2 = 10
6 × 2 = 12
N.A.E.
86(Rn)
36(Kr)
36
36
36
Elétrons
de
valência
18
18
18
18
18
Complexo
Elétrons
do íon
Ni(CO)4
Ni(NH3)62+
Ni(CN)42–
Cr(NH3)63+
28 – 0 =28
28 – 2 =26
28 – 2 =26
24 – 3 =21
Elétrons N.A.E. Elétrons
dos
de
ligantes
valência
4×2=8
36
18
6 × 2 = 12
38
20
4×2=8
34
16
6 × 2 = 12
33
15
Complexos: estrutura – 5
Orbitais híbridos para complexos metálicos
N. C. O. híbridos
Configuração
Lig. π
Exemplos
2
sp
Linear
p,d
Ag(NH3)2+
3
sp2
Planar trigonal
p, d2
BF3, NO3–, Ag(PR3)3+
4
sp3
Tetraédrica
4
dsp2
Planar quadrada
d3, p
Ni(CN)42–, Pt(NH3)42+
5
dz²sp3 ou d3sp
Bipiramidal trigonal
d2
TaF5, CuCl53–, [Ni(PEt3)2Br3]
5
dx²–y²sp3, d2sp2, d4s ou d4sp Piramidal tetragonal
d
IF5, [VO(acac)2]
6
d sp
d
Co(NH3)63+, PtCl62–
7
d5sp, ou d3sp3
Bipiramidal pentagonal
ZrF73–
7
d4sp2 ou d5p2
Prismática trigonal com um átomo extra em cada
face tetragonal
TaF72–, NbF72–
8
d4sp3
Dodecaédrica
8
d5p3
Antiprismática quadrada
TaF83–, Zr(acac)4
8
d3fsp3, ou d3f4s
Cúbica
U(NCS)84–
2
2
Ni(CO)4, MnO4–, Zn(NH3)42+
Octaédrica
3
2
3
d
Mo(CN)84–, Zr(C2O4)44–,
Configuração eletrônica de alguns complexos segundo T. L. V.
Íon ou complexo
Configuração eletrônica
3d
Cr3+
[Cr(NH3)6]
3+
Co3+, Fe2+
[Co(NH3)6] , [Fe(CN)6]
3+
[Fe(H2O)6]2+
[Fe(CN)6]
3–
Ni2+
[Ni(NH3)6]
2+
Zn2+
[ZnCl4]
4–
4s
↑
↑
↑
↑
↑
↑
↑↓ ↑↓
↑↓
↑
↑
↑
4p
↑↓
↑↓ ↑↓ ↑↓ diamagnético
↑↓
↑↓ ↑↓ ↑↓ diamagnético
↑
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
Obs.
↑
↑
↑
↑
↑↓ ↑↓
↑
↑↓ ↑↓
↑↓ ↑↓ ↑↓
↑
↑
↑↓ ↑↓ ↑↓
↑
↑
“iônico”
↑↓
paramagnético
↑↓ ↑↓ ↑↓ oxid. de [Fe(CN)6]4–
“iônico”
paramagnético
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
2–
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑↓ tetraédrico
[Zn(NH3)6]2+
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
[Ni(CO)4]
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑↓ tetraédrico
[Ni(CN)4]2–
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓
[Fe(CO)5]
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑↓ bipiramidal trigonal
[Cr(CO)6]
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑↓ octaédrico
“iônico”
planar quadrado
Complexos: estrutura – 6
Propriedades magnéticas
Suscetibilidade magnética
B=H 4 I ⇒
B = fluxo magnético (dentro da substância)
H = intensidade do campo magnético aplicado
I = intensidade de magnetização
B/H = permeabilidade magnética do material
κ = suscetibilidade magnética por volume
B
I
=14 =14
H
H
Suscetibilidade magnética por massa: χ = κ /ρ (ρ = densidade).
Suscetibilidade magnética molar: χm = Mχ (M = massa molar).
Tipos de comportamento magnético
Tipo
Diamagnetismo
Paramagnetismo
Ferromagnetismo
Antiferromagnetismo
Sinal de Grandeza de χm Dependência de
Origem
χm
χm com H
χm < 0
1–500 × 10–6 Independente
Carga do elétron
Movimento angular orbital e de spin dos elétrons
–2
χm > 0
0–10
Independente
em átomos individuais
Interação
cooperativa
entre
momentos
–2
6
χm > 0
10 –10
Dependente
magnéti–cos de átomos individuais
χm> 0
0–10–2
Pode depender
Idem ferromagnetismo
Lei de Curie
corrigido
m
N A 2 /3k
=
⇒ efetivo =2,84 corrigido
T
m
T
Momento magnético de um elétron:
s =g e e s ⇒ s =∣s∣=g s s1 B=2,00023 1/ 21/ 21 B=1,73 B
Momento magnético de complexos:
devido somente a spin (spin–only): S =2 S S 1 B
devido aos momentos angulares de spin e orbital: S L = 4SS 1 L L1 B
Momentos magnéticos teóricos e experimentais para alguns íons de metais de transição:
Íon
V4+
Cu2+
V3+
Ni2+
Cr3+
Co2+ *
Fe2+ *
Co3+ *
Mn2+ *
Fe3+ *
S
/2
1
/2
1
1
3
/2
3
/2
2
2
5
/2
5
/2
1
L
2
2
3
3
3
3
2
2
0
0
* configuração spin alto
Termo
2
D
2
D
3
F
3
F
4
F
4
F
5
D
5
D
6
S
6
S
μS/μB
1,73
1,73
2,83
2,83
3,87
3,87
4,90
4,90
5,92
5,92
μS+L/μB
3,00
3,00
4,47
4,47
5,20
5,20
5,48
5,48
5,92
5,92
μexper./μB
1,7-1,8
1,7-2,2
2,6-2,8
2,8-4,0
~3,8
4,1-5,2
5,1-5,5
~5,4
~5,9
~5,9