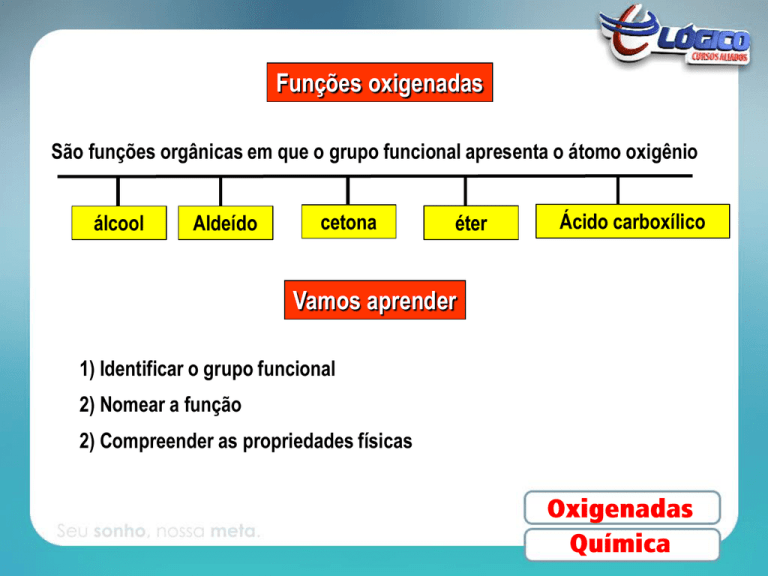
Funções oxigenadas
São funções orgânicas em que o grupo funcional apresenta o átomo oxigênio
álcool
Aldeído
cetona
éter
Vamos aprender
1) Identificar o grupo funcional
2) Nomear a função
2) Compreender as propriedades físicas
Ácido carboxílico
Álcoois
Os compostos orgânicos que apresentam um ou mais radicais oxidrilas (OH)
ligados a átomos de carbono saturados
Carbono saturado
H3C C C OH
H2 H2
Álcool
Carbono insaturado
H3C C C OH
H H
Enol
Classificando os álcoois
Posição do grupo funcional
Carbono primário
H3C C C OH
H2 H2
Álcool primário
Carbono secundário CH3
H3C C C OH
H2 H
Álcool secundário
Carbono terciário
CH3
H3C C C OH
H2
CH3
Álcool terciário
Quantidade de grupos funcionais
H2C
H
C
H
C
H
3C
3
CH CH2
OH OH OH
O
H
Monol
triol
H3C
CH CH2
OH OH
diol
Nomenclatura
Infixo
Prefixo
Sufixo
Número de
carbonos
Tipo de ligação
metanol
etanol
1
2
3
Função
orgânica
ol
4
Butan-2-ol
A numeração ocorre na extremidade mais próxima do grupo funcional
CH3
1
H3C
2
4
CH
CH3
CH2
OH
3
CH2
6
CH
5
C
CH2
7
CH2
8
CH3
4-etil-6,6-dimetiloctan-2-ol
CH3
Nomenclatura IUPAC para monoálcooois Insaturados
3
4
H2C
1
2
CH CH CH2 OH
CH3
2-Metilbut-3-en-1-ol
Nomenclatura IUPAC para poliálcooois
H3C
1
OH
OH
CH
CH
2
3
Butano-2,3-diol
CH3
4
Propriedades físicas
H3C C C OH
H2 H2
Parte apolar
Parte polar
• Dipolo induzido
• ligações de hidrogênio
Comparando propriedades físicas
Vamos colocar os compostos em ordem crescente de temperatura de ebulição
H3C C C OH
H
O
C
C
H
H
3
2
H2 H2
Etanol
Propan-1-ol
H
C
CC
H
3
2
H3C C CH3
H2
O
H
O
H
Propano-1,2-diol
H3C C CH3
H2
H3C CH2 OH
Propano
H3C C C OH
H2 H2
Aumento da temperatura de ebulição
H3C
C
CH2
OH OH
Análise da solubilidade
Análise da solubilidade
OH
Mais solúvel em água
cadeia
Solubilidade solventes polares
OH
OH
OH
Menos solúvel em água
Solubilidade solventes apolares
Parte apolar
OH
OH
Substância muito solúvel em água, devido
ao grande número de ligações de
hidrogênio que esse álcool pode realizar
com a água.
Fenóis
Os compostos orgânicos que apresentam uma ou mais oxidrilas (OH) ligadas
diretamente a um átomo de carbono do anel aromático
Não é aromático
OH
C
HC
CH
HC
C
H
OH
CH
Não é um fenol
Nomenclatura para fenóis
OH
O H
H 3C
1
6
2 CH 3
5
4
3
CH 3
Benzenol (IUPAC)
Fenol (IUPAC)
2,4,6 -trimetilbenzenol
2,4,6 -trimetilfenol
Propriedades físicas
OH
Parte polar
• Dipolo induzido
• ligações de hidrogênio
Parte apolar
Análise da temperatura de ebulição
OH
menor
maior
Análise da solubilidade
OH
OH
OH
OH
menor
maior
Podem realizar ligações de hidrogênio com a água
Acidez
Os fenóis são ácidos de Brönsted-Lowry e se ionizam em solução
aquosa, originando soluções ligeiramente ácidas, já que são
ácidos fracos.
Aldeídos
São compostos orgânicos que apresentam o
grupo funcional carbonila ligado a átomo de
hidrogênio.
O
C H
O
H3C C C H
H2
H3C
CH2 CHO
Nomenclatura
Infixo
Prefixo
Número de
carbonos
Sufixo
O
O
H C H
H3C C H
Metanal
5
CH C
4
3
CH2
2
al
Etanal
O
H3C
Função
orgânica
Tipo de ligação
O
C H
H
1
CH3
3-Metilpent-3-enal
CH2 C H
Propanodial
O
C H
Benzaldeído
C
O
Cetonas
As cetonas são compostos que
apresentam o seguinte grupo
funcional :
O
R1
C
R1
O
H3C C C CH3
H2
H3C
CO CH3
Nomenclatura
Infixo
Prefixo
Número de
carbonos
Tipo de ligação
5
Propanona
4-metilpentan-2-ona
Sufixo
4
3
2 1
Função
orgânica
ona
pentan-2-ona
3- metil-hexano-2,4-diona
Propriedades físicas
O
Parte polar
H3C C C C H
H2 H2
Parte apolar
Podem realizar ligações de
hidrogênio com a água
• Dipolo induzido
• dipolo-dipolo
Parte polar
O
Parte apolar
H3C C C CH3
H2
Parte apolar
Fixando
Coloque os compostos em ordem crescente do ponto de ebulição
O
H3C
C
H3C
CH3
propano
propanona
H3C
C CH3
H2
C C OH
H2 H2
Propan-1-ol
propano < propanona < propan-1-ol
Éteres
São compostos caracterizados pela
presença de um átomo de oxigênio (O),
ligado a dois radicais orgânicos
R — O —R '
H3C C O C CH3
H2
H2
Nomenclatura oficial dos éteres
Radical menor
Radical
OXI
Radical
Ilíco
metoxietano
Éter etilmetílico
radical maior +ano
Ordem
alfabética
etoxietano
Éter dietílico
metoxibenzeno
Éter fenilmetilíco
parte polar
H3C C O CH3
H2
Parte
apolar
parte apolar
• Dipolo induzido
• Dipolo-dipolo
pouco solúveis em água
Podem realizar ligações de hidrogênio com a água
Revisando
O
O
cetona
éter
O
OH
H
álcool
aldeído
Ácidos carboxílicos
São compostos caracterizados pela presença
do grupo carboxila, formado pela união dos
grupos carbonila e hidroxila.
O
C OH
carboxila
O
H3C
CH2 C
OH
H3C
CH2 COOH
Nomenclatura
Prefixo
Número de
carbonos
Infixo
Tipo de ligação
Sufixo
Função
orgânica
oico
Ácido metanoico
ácido 2-metilpentanóico
Ácido etanoico
ácido propanodioico
ácido benzóico
Obs:
O
HO C
(CH2)16
CH3
Ácidos carboxílicos de cadeia
longa com número par de
carbonos
àcido esteárico
Ácidos graxos
Propriedades físicas
O
H3C C C OH
H2
Parte apolar
Parte polar
• Dipolo induzido
• ligações de hidrogênio
Podem realizar ligações de hidrogênio com a água
Por apresentarem o grupo carboxila, esses compostos são
muito polares e podem fazer o dobro de ligações de
hidrogênio que as moléculas de álcoois, dando origem a um
dímero, como esquematizamos abaixo.
Comparando propriedades físicas
Vamos colocar os compostos em ordem crescente de temperatura de ebulição
O
H3C C C H
H
O
C
C
H
H
3
2
H2
etanol
propanal
Ácido etanóico
O
H3C C C H
H
O
C
C
H
H
3
2
H2
Acidez do ácido carboxílicos
Ionização
O caráter ácido dos ácidos carboxílicos é, no entanto, fraco
Mas será que todos os ácidos
orgânicos tem a mesma
acidez?
Não!
C
H
C
O
O
H H3C
3
CH2 COOH Cl
CH2 COOH
Menos
ácido
Mais
ácido
-I
Ácido mais forte
Ácido mais fraco
+I
Derivados de ácidos carboxílicos
Sais orgânicos
Neutralização
O
CH3
C OH
O
+
NaOH
Ácido etanóico Hidróxido de sódio
C
H3 C O N
a+ + H2O
Etanoato de sódio
Esterificação
O
O
CH3 C OH +H
C
H
3O
Ácido etanóico
Ésteres
Metanol
C
H3 C O C
H3 + H2O
Etanoato de metila
O
O
OK
Butanoato de potássio
H3C C O CH
CH3
Etanoato de isopropila
O
H3CCH2COOCH2CH3
Propanoato de etila
CH3
O
Propriedades físicas
Os
sais
orgânicos
são
compostos iônicos. Portanto,
apresentam
todas
as
características de compostos
iônicos.
Pontos de fusão e ebulição
Muito elevados devido à ligação iônica.
Solubilidade
Os sais orgânicos de metais alcalinos e de amônio são
solúveis em água; os de metais pesados são praticamente
insolúveis.
O
Parte polar
H3C C C O CH3
H2
• Dipolo induzido
Parte apolar
• dipolo-dipolo
muito pouco solúveis em água
Podem realizar ligações de hidrogênio com a água
Revisando
O
O
H
O
cetona
aldeído
éter
O
O
OH
OH
Ácido carboxílico
álcool
O
éster
éter
alqueno
álcool
éster
CH3
H3C
CH2 CH2 C
O
CH C OH
álcool
éster












