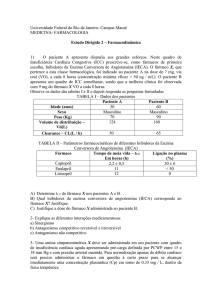
À descoberta de uma nova molécula seguem-se
os testes em laboratório e em animais e, por fim,
os ensaios clínicos com seres humanos.
Os ensaios clínicos servem para testar a segurança
e a eficácia dos novos fármacos. Decorrem por etapas
e duram vários anos. Os participantes são voluntários.
O medicamento experimental é testado primeiro por
pessoas saudáveis, depois por doentes.
Mesmo depois de comercializados e usados em larga
escala os medicamentos continuam sob investigação.
FASE I
O medicamento experimental é administrado pela
primeira vez em seres humanos. Geralmente pessoas
saudáveis.
Os ensaios centram-se na segurança e tolerância ao
medicamento.
Usam-se inicialmente pequenas doses do novo fármaco
num pequeno grupo de pessoas, entre 20 e 80. As doses
vão aumentando gradualmente. Estudam-se as reacções
do corpo ao medicamento, por exemplo, quanto tempo
permanece no sangue, ou qual a dose tolerada pelo
organismo.
FASE II
Aqui, o ensaio clínico testa a eficácia do medicamento
experimental.
Também é recolhida informação sobre a segurança,
toxicidade e potenciais riscos.
Nesta fase, os investigadores tentam determinar as
doses mais eficazes para o medicamento e a melhor forma
de o administrar: comprimidos, cápsulas, injecções, etc.
Estes ensaios clínicos já envolvem um maior número de
participantes, normalmente mais de 100.
Os participantes são doentes com a doença que o
medicamento experimental pretende tratar.
FASE III
Os estudos envolvem um maior número de pessoas.
Podem ser centenas ou milhares de doentes de vários
países.
Cada ensaio envolve, em regra, dois grupos: um grupo
toma o novo medicamento, outro mantém a medicação
habitual ou toma uma substância aparentemente igual
ao novo medicamento, mas sem qualquer efeito terapêutico
(placebo).
Esta fase permite averiguar quais as vantagens do novo
medicamento face aos tratamentos já disponíveis.
Os resultados permitem fazer a avaliação do risco/benefício
do novo medicamento e fornecem boa parte da informação
que virá a ser incluída na bula (o folheto de informação que
vem nas embalagens). É com base nos resultados do ensaios
clínicos de fase I,II e III que as autoridades decidem autorizar,
ou não, o novo medicamento.
FASE IV
O medicamento já foi autorizado. Já está no mercado
e é usado, em geral, por milhares de pessoas. É o teste
em grande escala. Pode demorar anos.
Os ensaios clínicos da fase IV avaliam a interacção entre
o novo fármaco e outros medicamentos.
Os investigadores recolhem informação adicional sobre
os riscos a longo prazo, efeitos secundários, benefícios
e sobre como optimizar o medicamento.
Nalguns casos, apesar de ter passado todos os passos
prévios à autorização, o medicamento pode ser retirado
do mercado. Acontece quando após a utilização maciça
provoca efeitos graves nunca antes detectados.