UNIDADE 3 - PROPRIEDADES FÍSICO-QUÍMICAS DAS
ÁGUAS OCEÂNICAS
Natureza da água e composição da água do mar
PROPRIEDADES DA ÁGUA
• A água é o composto mais abundante na natureza, existe 6 vezes
mais água que feldspato.
• A molécula da água (composta por um átomo de oxigênio e dois de
hidrogênio), apesar de ser eletricamente neutra, apresenta uma
polarização: um de seus extremos é mais positivo e o outro é mais
negativo pela distribuição desigual da densidade de elétrons.
• O átomo de oxigênio compartilha um elétron com cada um dos
átomos de hidrogênio. A ligação entre os dois átomos de hidrogênio
forma um ângulo de 104° e esse ângulo aumenta para 109º quando
a água congela.
• Os átomos de hidrogênio têm carga positiva e unitária, enquanto que
o átomo de oxigênio têm duas cargas negativas. Todavia, o arranjo
final das moléculas é de tal maneira que as cargas elétricas não se
neutralizam (as cargas poderiam estar neutralizadas se o ângulo
fosse 180° ao invés de 105°).
• Assim água tem uma carga negativa parcial ( ) junto ao átomo de
oxigênio, por causa dos pares de elétrons não-compartilhados, e tem
cargas positivas parciais ( ) junto aos átomos de hidrogênio.
• Uma atração eletrostática entre as cargas positivas parciais dos
átomos de hidrogênio e a carga negativa parcial do átomo de
oxigênio resulta na formação de uma ligação chamada ponte de
hidrogênio, que conferem forte coesão entre as moléculas, e
determinam as características anômalas da água se comparada a
outras substâncias semelhantes.
• Assim, as pontes de hidrogênio são as ligações de um átomo de
oxigênio de uma molécula com um átomo de hidrogênio de outra.
• As pontes de hidrogênio explicam a capacidade de ser solvente da
água e também o fato da água entrar em ebulição e se congelar em
temperaturas maiores que outras moléculas semelhantes.
• De toda água existente na Terra, apenas 0,001% está em forma
gasosa na atmosfera.
1- Altos pontos de fusão e ebulição
• A água comporta-se como se fosse uma substância com peso
molecular 5 vezes maior (PM cerca de 100) devido a coesão de suas
moléculas.
•
•
•
•
Se não fosse sua estrutura molecular (pontes de hidrogênio)
possuiria ligação bem mais fracas que ocorrem em substâncias
semelhantes (força de Van der Waals).
Se não fossem as pontes de hidrogênio a ebulição da água (que
ocorre em 100ºC) seria a -90ºC e o congelamento da água (que
ocorre em 0ºC na água doce) seria a -110ºC, não sendo possível a
existência de água na terra.
A água possui o maior calor latente de vaporização e fusão, isso
significa que é necessário adquirir ou perder grande quantidade de
energia para mudar do estado líquido para o gasoso (vaporização) e
do estado gasoso para o líquido (fusão).
É a única substância que pode ser encontrada nos 3 estados físicos
da matéria.
2- Alta capacidade térmica
• A água possui o maior calor específico dentre os sólidos e líquidos
comuns. Calor específico é a propriedade que define a quantidade de
calor necessária para elevar em 1°C a temperatura de uma grama de
substância.
• Essa propriedade faz com que a água resista muito à mudanças de
temperatura, concentrando e conduzir calor antes de mudar de
estado. Nesse sentido a água é determinante no equilíbrio térmico do
planeta devido ao transporte de calor pelas correntes marinhas, de
regiões equatoriais para altas latitudes.
3- Anomalia térmica
• O gelo possui densidade menor que a água líquida, é por isso que o
gelo flutua (geralmente, as substância no estado sólido tem suas
moléculas mais próximas tornando a substância mais densa e
pesada).
• As ligações hidrogênio mantêm as moléculas de água mais afastadas
no sólido do que no líquido.
• Caso o gelo afundasse dificilmente se descongelaria, e os fundos dos
mares ficariam eternamente congelados.
• A maior densidade da água doce é em 4ºC.
• Na água salgada, com salinidade de 35, o ponto de congelamento é
-1,9°C.
4- Alto poder de solução
• A habilidade dos íons e de certas moléculas de se dissolver na água é
devida à polaridade.
• A água possui a capacidade de dissolver mais substâncias e em maior
quantidade do que qualquer outro líquido. Através da reação de
hidratação a água é capaz de quebrar ligações iônicas (ligações
fortes). Ex.: 350g do sal NaCl dissolve-se completamente em 1 litro
de água.
Figura 1- Cloreto de sódio dissolvido na água
RESERVATÓRIOS NATURAIS DE ÁGUA
• Toda a água existente na natureza exibe relações mútuas de
intercâmbio (ou transferência) através do chamado ciclo hidrológico.
As relações entre as várias formas de transferência da água, na
superfície
terrestre,
podem
ser
representadas
por:
precipitação=escoamento + infiltração + evapotranspiração.
• Devido sua capacidade de dissolução, ela é um importante agente de
transporte de elementos e devido a alta capacidade térmica, ela
muda os seus estados, de líquido (água oceânica) para gás (vapor
d´água) e sólido (gelo) transferindo calor, saindo e voltando do
oceano através do ciclo hidrológico (figura 2).
2
•
•
•
Uma das fontes dos elementos que compõem quimicamente as águas
fluviais são os elementos naturalmente dissolvidos das rochas e dos
solos. A abundância relativa dos sólidos dissolvidos que compõe essa
água é diferente da água marinha (que será abordada
posteriormente). De maneira geral, na água fluvial predomina o
bicarbonato, seguidos pelos elementos cálcio, sílica, sulfato, cloro,
sódio, magnésio e potássio.
A precipitação compreende todos os tipos de água condensada, que
cai sobre a superfície terrestre nas formas de chuva, neve, granizo e
orvalho. O escoamento corresponde a parcela da água de
precipitação, que ocorre pela superfície do terreno. A infiltração
representa a parcela de água de precipitação absorvida pelo solo,
que pode premanecer armazenada no subsolo como água
subterrânea ou, após percolar certas distâncias, emergir como
fontes. Finalmente a evapotranspiração inclui a evaporação
superficial e a transpiração vegetal.
Da quantidade total de água precipitada, 77% caem sobre os
oceanos e 23% sobre as áreas emersas. Por outro lado, 84% da
evaporação total da terra provêm dos oceanos e as terras emersas
contribuem com apenas 16%. Desse modo, a evaporação dos
oceanos é 7% superior a respectiva precipitação. O excesso de água
doce sobre os continentes, que não sofre evaporação, é submetido ao
escoamento e/ou infiltração para finalmente atingir os oceanos e
fechar o ciclo hidrológico.
•
•
De toda a água atualmente encontrada na terra, 97% formam os
oceanos e apenas 3% são encontrados nos continentes ou na
atmosfera. Desse total, aproximadamente 75% formam as geleiras e
24,5% ocorrem como água subterrânea. As águas dos rios, dos
lagos, lagoas e da atmosfera perfazem apenas 0,5 a 3%.
A água permanece com diferentes tempos de residência nos
diferentes reservatórios naturais da hidrosfera terrestre. O tempo de
residência significa o tempo em que a água é renovada no
reservatório (tabela abaixo).
COMPOSIÇÃO DA ÁGUA DO MAR
• O oceano corresponde a 71% da superfície da terra.
• A água do mar é uma solução contendo 70 elementos químicos,
constituída por solvente (água) e por soluto (sais).
• Na química, um sal é um composto neutro (Ex.: NaCl, KCl, CaSO4)
de um cátion (Na+, K+, Ca++) ligado a um ânion (Cl--, SO4--). Eles são
tipicamente o produto de uma reação química entre:
• * Uma base e um ácido, formam um sal + água, ex.: 2NaOH +
H2SO4 --> Na2SO4 + 2H2O sulfato de sódio
• * Um metal e um ácido, formam um sal + hidrogênio, ex.: Mg +
H2SO4 --> MgSO4 + H2 sulfato de magnésio
•
•
•
* Um óxido ácido e um óxido básico, formando um sal, ex.: CO2 +
CaO --> CaCO3 carbonato de cálcio
A água dos oceanos é salgada porque contém sais dissolvidos (com
concentrações entre cerca de 33 e 37 g por cada quilograma de água
do mar) que têm várias origens: 1. As rochas da crosta vão-se
desgastando por erosão e há uma parte dissolvida desse material que
é transportada para o oceano pelos rios. 2. As erupções vulcânicas
libertam substâncias voláteis (tais como dióxido de carbono, cloro e
sulfato) para a atmosfera, uma parte das quais é transportada por
precipitação diretamente para o oceano ou indiretamente por meio
dos rios. As erupções vulcânicas submarinas contribuem fortemente
para os íons no oceano. Em contrapartida a essas fontes de sais, há
sumidouros que consomem parte dos sais dissolvidos: plantas e
animais marinhos que usam sais (por exemplo, sílica, cálcio e
fósforo) para construir os seus esqueletos ou conchas, sedimentos
depositados no fundo do mar e que incorporam alguns sais (por
exemplo, potássio e sódio), e ainda outros processos como a saída do
sal transportada pela evaporação (maresia). O equilíbrio entre as
fontes e os sumidouros fazem com que a composição da água do mar
seja essencialmente constante.
Os depósitos hidrotermais são formados pela penetração e pela
percolação das águas oceânicas em fendas e fissuras existentes nas
rochas. Nesse percurso as águas se enriquecem de metais que são
posteriormente precipitados no seu retorno ao oceano. Esses metais
precipitam-se
nas
proximidades
do
eixo
das
cordilheiras
mesoceânicas, onde ocorrem edifícios vulcânicos submarinos e
fraturas, associados aos limites de placas litosféricas. Nessas regiões,
que possuem alto fluxo de calor, formam-se as fumarolas (figura 3),
que são como fontes submarinas de água enriquecida em metais
dissolvidos das rochas vulcânicas do fundo submarino pela percolação
de água aquecida em fissuras e fraturas da rocha.
Figura 3 - Erupções vulcânicas submarinas que contribuem para os íons
no oceano.
• Para todos os oceanos, embora a quantidade total de sais
dissolvidos seja variável, as proporções relativas dos
principais elementos (Sódio - Na+, Cloro - Cl--, Magnésio Mg++, Cálcio - Ca++, Potássio - K+, Sulfato - SO4--) são
constantes. Esses elementos correspondem a 99% do total de
elementos na água do mar.
• Somente o sal NaCl (Cloreto de Sódio) é responsável por 86% da
composição da água marinha.
• Em uma salinidade de 35, 1kg de água do mar contém em média 35
gramas de sais inorgânicos dissolvidos. A água do mar é constituída
de 96,5% de água pura e 3,5% de sais. Apresenta também uma
pequena quantidade de organismos vivos e material inorgânico
particulado e orgânico dissolvido.
• Obs.:
• Material dissolvido é o que passa por uma membrana de 45µm
e o particulado é o que fica retido.
• O material dissolvido pode ser orgânico, com composição
biológica como proteínas, lipídeos, aminoácidos, uréia, ácidos
húmicos ou inorgânico como os sais e nutrientes.
• O material particulado orgânico constitui, por exemplo,
tecidos animais ou vegetais e o inorgânico fragmentos de minerais
em suspensão.
• A determinação da salinidade auxilia na identificação de massas de
água, da sua movimentação e mistura.
• A água dos oceanos é um bem mineral e uma fonte sustentável de
elementos economicamente importantes, como por exemplo: Cl, Na,
Mg, K, Br, Sr e B. Em muitos países, a água do mar constitui a
principal fonte de sal para consumo humano, como é o caso do
Brasil, que extrai todo seu sal de cozinha (NaCl) a partir da
evaporação da água marinha proveniente das salinas do Nordeste e
do Rio de Janeiro.
NUTRIENTES E GASES NO MAR
Na água do mar estão dissolvidos diversos tipos de sólidos e gases.
• Estes elementos podem ser divididos em: a) conservativos, que não
são alteradas suas proporção biologicamente como os sais e b) não
conservativos que são metabolizados pelos organismos, como os
elementos nutrientes e gases dissolvidos na água como oxigênio e
gás carbônico.
• Além dos nutrientes essenciais para o crescimento dos vegetais
marinhos e dos gases dissolvidos existem também os elementostraço, ocorrem em concentrações muito pequenas e também são
necessários em reações metabólicas.
• Os nutrientes são importantes para a vida marinha, porque sem eles
o fitoplâncton não cresce e não se reproduz, afetando toda a cadeia
alimentar.
• Os nutrientes se dividem em blocos químicos que são: construtores de matéria viva: C, O, N, H; - macronutrientes que
são elementos necessários em quantidades moderadas: Na, Mg, P,
S, Cl, K, Ca,
- microelementos ou elementos traços, os
organismos precisam de quantidades muito pequenas para
desempenhar funções vitais: F, Si,Vn, Mn, Cr, Fe, Co, Cu, Zn, Se,
Mo, Sn,I.
• Em ilhas oceânicas, como na Ilha de Páscoa no Pacífico, depósitos
de fosfatos de cálcio, conhecidos por guano, são formados pela
reação das rochas carbonáticas com o excremento de pássaros,
ricos em fósforo, um importante nutriente.
• Na água do mar também encontra-se gases da atmosfera como o
nitrogênio, o oxigênio, o argônio, o gás carbônico, o neônio, entre
outros. A principal troca de gases com água ocorre através da
interface ar-água.
• O ciclo biogeoquímico existe em função da entrada e saída de
elementos da água do mar. Cada elemento possui um tempo
médio de permanência nos oceanos, que varia de milhões de anos
a até pouco menos de 100 anos.
• Abaixo o ciclo do Dióxido de carbono (figura 4)
Figura 4 – Ciclo do Carbono na água
•
•
•
•
•
•
•
Outro exemplo é o ciclo do nitrogênio as formas inorgânicas são
transformadas em orgânicas e estas em inorgânica fechando o
ciclo. As reações químicas que ocorrem nesse ciclo são (figura 5):
Assimilação NH4+ por algas
Assimilação do NO3- por algas (redução do nitrato): NO3- a N(NH3)-orgânico
Amonificação – produção de amônio pela decomposição da matéria orgânica
NH4OH
Nitrificação – conversão do NH4+ a NO3- (oxidação; ganho de energia para
bactéria). Precisa de oxigênio para ocorrer.
Denitrificação – desassimilação do NO3- a N2 (redução). Ocorrem geralmente
em ambientes mais carentes de oxigênio.
Fixação do Nitrogênio - N2 gasoso atmosférico a N(NH3)-orgânico por
cianobactéria
Figura 5 – Ciclo do Nitrogênio na água
Interferência da atividade humana nos ciclos biogeoquímicos
•
Elementos químicos originados de atividades humanas entram nos
ciclos biogeoquímicos influenciando em suas quantidades e
processos (figura 6).
Figura 6 – Interferência
biogeoquímicos
das
atividades
humanas
nos
ciclos
Fatores que influenciam no transporte de nutrientes na Zona Costeira
•
Densidade populacional
indústrias de portos;
–esgotos
domésticos,
resíduos
de
•
Agricultura e Aqüicultura (fertilizantes e rações);
•
Deposição Atmosférica;
•
Características naturais do solo como composição das rochas e
vegetação do entorno dos corpos hídricos;
•
Entre outros.
Conseqüências do aumento de nutrientes na Zona Costeira
•
A elevação dos níveis de produção primária que até certo ponto
é benéfico, freqüentemente observados em estuários, são
associados diretamente ao grande suprimento de nutrientes
inorgânicos dissolvidos, tanto de origem natural quanto antrópica.
Todavia, quando ocorre um desequilíbrio no balanço nutritivo das
águas costeiras, estas se tornam suscetíveis à ocorrência de
fenômenos ecologicamente indesejáveis, como a eutrofização
(figura 7).
•
Em síntese, o processo de eutrofização representa uma resposta
biogeoquímica ao excesso de nutrientes causando alterações na
comunidade fitoplantônica e zooplanctônica, além da proliferação
de macroalgas bênticas, da perda da biodiversidade e do aumento
na incidência de algas tóxicas, causando alteração da coloração
das águas costeiras. O aumento da matéria orgânica por espécies
oportunistas do fitoplâncon pode exaurir as concentrações de
oxigênio dissolvido na água devido a decomposição dessa matéria
orgânica pelas bactérias.
Mortalidade de peixes
Maré vermelha
“Bloom” de algas
Figura 7 – Conseqüências da eutrofização
Distribuição horizontal e vertical da salinidade
Salinidade
• Definição de salinidade: “É o total de material sólido (g) dissolvido
em 1Kg de água do mar quando o carbonato tiver se convertido em
óxido, todo o Br em Cl e toda a matéria orgânica completamente
oxidada”.
• No oceano pode variar de 33 a 38, sendo sua média global de 34,7.
Essa variação é decorrente de:
• 1- processos que aumentam a salinidade: evaporação e
formação do gelo
• 2 - processos que diminuem a salinidade: precipitação,
descarga fluvial e derretimento do gelo.
• Maior salinidade média: Atlântico=35,37
• Menor salinidade média: <34
• Horizontalmente os valores máximos de salinidade são a 20ºN e S,
mínimos nos pólos e baixos no equador (maiores que nos pólos).
• Trópicos: valores máximos de salinidade devido ventos alísios
intensos e constantes causando muita evaporação nessa região
anticiclônica (alta pressão atmosférica, onde o ar desce).
• Pólos: Mínimas salinidades em decorrencia ao degelo
•
Equador: Salinidades baixas por ser uma região ciclônica, de baixa
pressão atmosférica, onde o ar quente se eleva, formando nuvens e
consequentemente com precipitação superior a evaporação.
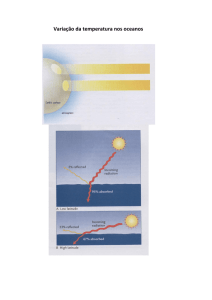
• A radiação do sol e a condução de calor da atmosfera aquecem a
superfície dos oceanos. Os oceanos resfriam-se pela radiação de
retorno da superfície para a atmosfera, pela condução do calor de
volta à atmosfera ou por evaporação.
Temperatura
• A temperatura da água varia tanto verticalmente como
horizontalmente na coluna d’água. A temperatura da água do mar
exerce influencia tanto nos seres marinhos como nas massas de
água.
• Medidas de salinidade e temperatura juntas são usadas para
identificar massas de água e sistemas de correntes.
• A temperatura superficial dos oceanos é influenciada pela latitude. O
ângulo de incidência da radiação solar é maior nas pequenas
latitudes, portanto o equador recebe cerca de 1,5 a 2 vezes mais
calor que os pólos.
• A circulação atmosférica e oceânica transfere o excesso de calor
recebido nas regiões equatoriais para regiões polares, gerando dessa
forma um equilíbrio térmico.
• Cerca de 77% do volume total dos oceanos apresenta temperaturas
inferiores a 4°C.
• Na superfície, a distribuição da temperatura forma isotermas, ou
seja, linhas de mesma temperatura segundo a latitude.
• A grosso modo, a cada linha de latitude percorrida a temperatura
altera-se em 0,5°C.
• A temperatura nos continentes varia mais do que nos oceanos, os
continentes resfriam maior quantidade de volume de ar, que extrai
mais calor dos oceanos pela ação dos ventos.
• A temperatura na coluna d’água decresce em função da profundidade
nas regiões equatoriais e tropicais.
• A camada onde a temperatura muda drasticamente com a
profundidade é conhecida como termoclina permanente. Essa fica
localizada entre 150-400 metros nos trópicos e entre 400-1000
metros nas regiões subtropicais. Abaixo dos
1000 metros de
profundidade ocorrem uniformidade das propriedades temperatura e
salinidade.
• Nas várias regiões oceânicas tanto a temperatura como a salinidade
decrescem com a profundidade. Um decréscimo na temperatura
resulta num aumento da densidade, e assim, a estratificação da
temperatura produz uma estratificação de densidade estável. Um
decréscimo em salinidade por outro lado, resulta em uma densidade
menor. Sozinha, a estratificação pela salinidade produziria uma
estratificação de densidade instável. Nos oceanos, o efeito da
diminuição da temperatura é muito mais forte do que o da diminuição
da salinidade, e assim no final o oceano permanece estratificado de
maneira estável.
Densidade
•
•
•
•
•
A densidade é um dos parâmetros mais importantes no estudo da
dinâmica dos oceanos. Pequenas mudanças de densidade na
horizontal (causadas por exemplo por diferenças de aquecimento da
superfície) podem produzir correntes bastante fortes. A determinação
da densidade tem sido portanto uma das atividades mais importantes
em oceanografia. O símbolo para a densidade é a letra grega ρ (rho).
A densidade da água do mar depende da temperatura T, da
salinidade S e da pressão p.
A densidade aumenta com um aumento da salinidade e com
decréscimo em temperatura, exceto para temperaturas abaixo
daquela de densidade máxima. A densidade dos oceanos é
usualmente próxima a 1025 kg m-3 (Em água doce é próxima a
1000 kg m-3).
Os oceanógrafos comumente usam o símbolo σt (a letra grega sigma
com um subscrito t) para densidade, para o qual eles pronunciam
"sigma-t". Essa quantidade é definida como σt = ρ - 1000 e não
possui unidades geralmente (ele deveria ter as mesmas unidades que
ρ). Uma densidade típica da água do mar é portanto σt = 25.
Note que a densidade máxima é acima do ponto de congelamento
para salinidades abaixo de 24,7 mas abaixo do ponto de
congelamento para salinidades acima de 24,7. Isso influencia na
convecção térmica:
•
S < 24,7: A água resfria até chegar a sua densidade máxima; então, quando a
água de superfície se torna mais leve (i.e., depois de ter passado de sua
densidade máxima) o resfriamento fica restrito a camada de mistura pelo
vento, que eventualmente congela. As bacias profundas se tornam repletas de
água com densidade máxima.
•
S > 24,7: A convecção sempre alcança todo o corpo de água. O processo de
resfriamento é retardado devido a grande quantidade de calor que está
armazenada no corpo de água. Isso acontece porque a água chega a seu ponto
de congelamento antes de alcançar seu valor de densidade máxima.
Propriedades físico-químicas da água
Salinidade e temperatura
Já discutidas anteriormente.
pH
•
O pH da água é determinado pela quantidade de hidretos (H+) ou
hidroxilas (OH-). Quanto mais hidretos mais a solução é ácida e
quanto mais hidroxilas mais a solução é básica.
• Número de gramas de íons H+ por litro de solução:
1
Log10
[H +]
1
1
Log10 −5 = Log10
= Log1010000 = 5
[0,00001]
10
1
1
Log10 −7 = Log10
= Log101000000 = 7
[0,0000001]
10
[ ]
[ ]
•
•
A escala de acidez e de alcalinidade varia de 1 a 14, sendo que
quanto mais ácida uma solução menor o valor do seu pH. Quando
ocorrem números iguais de íons, o pH é neutro e possui valor 7.
A água do mar é alcalina devido a presença de íons alcalinos em
maior quantidade que os ácidos. O pH da água do mar varia de
7,4 a 8,5.
TURBIDEZ E TRANSPARÊNCIA
OXIGÊNIO
Ver transparências de aula
LUZ
• A luz e o som são as duas formas principais para transmitir
informações usadas em comunicação animal e humana. Na terra,
o som é atenuado em distâncias bem mais curtas que a luz, e
essa se torna a maneira preferida de comunicação em longa
distância. A situação oposta ocorre nos oceanos: enquanto a luz
não consegue penetrar mais que poucas centenas de metros em
água, o som na água pode percorrer distâncias bem grandes, e
assim é usado em várias aplicações como medidas de fundo,
comunicação, e medidas sob a água tanto por animais e humanos.
Informações detalhadas sobre a velocidade do som (isso é a
velocidade de fase das ondas sonoras) é essencial para essas
aplicações.
• Importância: fotossíntese.
• Propagação: espectro eletromagnético. A luz visível ocorre entre
400 (violeta) e 800 (vermelho).
• Os processos de interação da energia eletromagnética com a água
marinha ocorrem através de absorção, reflexão e transmissão.
•
Cor dos oceanos: Na superfície é determinada por sua
composição. Na coluna é função da absorção diferenciada de cada
comprimento de onda. Vermelho 10m, laranja 50m, azul 150m.
SOM
•
A velocidade do som c é uma função da temperatura T, salinidade
S e pressão p e varia ente 1400 m s-1 e 1600 m s-1. No oceano
aberto, ela é influenciada pela distribuição de T e de p, mas nem
tanto pela de S. Ela diminui com o decréscimo de T, p e S. A
combinação da variação nesses três parâmetros com a
profundidade produzirá um perfil de velocidade do som com um
mínimo bem marcado em profundidades intermediárias: a
temperatura decresce rapidamente nos primeiros 1000 metros e
assim domina o perfil da velocidade do som, i.e., c diminui com a
profundidade. Em regiões com águas mais profundas que 1000
metros, as mudanças de temperatura abaixo dessa faixa se
tornam bem reduzidas e assim c começa a ser determinada pelo
aumento de pressão com a profundidade, i.e., a pressão aumenta
com a profundidade, i.e., c aumenta com a profundidade.
Mudanças verticais de salinidade são muito pequenas para ter
uma influência, mas a salinidade média vai determinar se c é
baixa (se a salinidade média for baixa) ou alta (se a salinidade
média for alta) em média
Propagação do Som
O som se propaga em raios assim com a luz faz. Assim, as leis de
geometria óptica são também aplicáveis ao som:
1. O som viaja através de um caminho reto aonde a velocidade do
som c é constante; ou ele se volta em direção a região de baixa c
2. Os raios de propagação são independentes.
3. Os caminhos do som são reversíveis
4. A lei de reflexão (ângulo de incidência = ângulo de refexão) é
válida para o fundo do oceano, para a superfície e para objetos na
superfície e interfaces.
5. A lei da refração é válida em interfaces:
•
Como a estratificação no oceano é aproximadamente horizontal, a
propagação do som na vertical ocorre praticamente ao longo de
um caminho reto. Isso é base para as medidas de fundo através
de eco: A profundidade é conhecida se a velocidade de
propagação média do som é conhecida. Uma primeira estimativa é
1500 m s-1; mas existem tabelas de correções disponíveis para
várias áreas do oceano global.
•
A propagação da velocidade mínima do som (geralmente em torno
de 1000 m). Os raios de som se curvam em direção da velocidade
mínima do som e viajam naquela profundidade por distâncias
grandes (elas podem atravessar oceanos inteiros). Esse canal de
som é conhecido como canal de SOFAR (SOund Fixing And
Ranging). Antes da introdução do Global Positioning System
(GPS), o canal de SOFAR era usado para localizar navios e
aeronaves com problemas, e também para posicionar bóias (com
dois ou mais sensores de recepção) para o estudo das correntes
oceânicas.
•
Na camada de mistura com temperatura uniforme (tipicamente
em torno de 100 m de espessura), a velocidade do som aumenta
abaixo da superfície devido ao aumento da pressão antes do
decréscimo normal devido a temperatura se torne mais
importante. O máximo em velocidade de som resultante numa
profundidade aproximadamente de 100 m cria uma zona de
sombra, já que todos os raios de som se voltam contrário àquela
profundidade.
Leituras Complementares
O Conceito de Salinidade
(http://www.es.flinders.edu.au/~mattom/IntroOc/por/notes/lecture03.html)
Como mencionado anteriormente, a água do mar contem em seu peso
3,5 % sais, mas também gases, substâncias orgânicas e material
particulado. A presença adicional dos sais influencia na maioria das
propriedades físicas da água do mar (densidade, compressibilidade,
ponto de congelamento, temperatura da densidade máxima) em algum
grau, mas não são os fatores que os condicionam. Algumas
propriedades (viscosidade, absorção de luz) não são significativamente
afetada pela salinidade (detalhe: o material dissolvido e particulado
afeta a absorção de luz, e de fato, essa influência é usada na maioria
das aplicações ópticas). Duas propriedades que são determinadas pela
quantidade de sais na água são a condutividade e a pressão osmótica.
Numa maneira ideal, a salinidade deveria se a soma de todos os sais
dissolvidos em gramas por cada quilograma de água. Na prática, isso é
uma coisa difícil de medir. A constatação que - não importando quanto
sal existe em uma parcela de água do mar - os vários componentes
contribuem em uma razão ou proporção fixa, ajuda a solucionar as
dificuldades. Essa fato permite a determinação do conteúdo em sal pela
medida de uma quantidade substituta e o cálculo de material total a
partir dessa medida.
A determinação da salinidade pode ser assim feita através da medida de
seu componente mais importante, que é o cloreto. O conteúdo em
cloreto foi definido em 1902 como a quantia total em íons cloreto em
gramas presente em um quilograma de água do mar se todos os
halogênios fossem substituídos por cloretos. A definição reflete no
processo de titulação para a determinação de conteúdo em cloreto e é
ainda tem importância quando lidamos com dados históricos.
A salinidade foi definida em 1902 como a quantia total em gramas de
todas as substâncias dissolvidas se todos os carbonatos fossem
convertidos em óxidos, todos os brometos e iodetos fossem convertidos
a cloretos e todas as substâncias orgânicas fossem oxidadas. A relação
entre a salinidade e o conteúdo em cloretos foi estabelecida com uma
série de medidas feitas em laboratório em amostras de água do mar
coletadas em todas as regiões do oceano mundial e foi dada como:
S (o/oo) = 0.03 +1.805 Cl (o/oo) (1902)
O símboloo/oo significa "partes por mil" ou"ppt"; um conteúdo em sal
content de 3.5% é equivalente a 35 o/oo, or 35 gramas de sais por
quilograma de água do mar.
O fato de que a equação de 1902 dá um valor de salinidade igual a
0.03 o/oo quando a cloridade é zero é um motivo de preocupação. Isso
indica um problema nas amostras de água do mar usadas nas medidas
de laboratório. A United Nations Scientific, Education and Cultural
Organization (UNESCO) decidiu repetir as análises usadas como base
para essa relação inicial entre salinidade e clorinidade e introduziu uma
definição nova, conhecida como salinidade absoluta ,
S (o/oo) = 1.80655 Cl (o/oo) (1969)
A definição de 1902 e 1969 dão resultados idênticos a uma salinidade de
35 o/oo e não muda significativamente na maioria das aplicações.
A definição da salinidade foi mais uma vez revisada quando as técnicas
para medir salinidade usando a condutividade, a temperatura e a
pressão foram desenvolvidas. Desde 1978, a chamada "Practical Salinity
Scale" (Escala de Salinidade Prática) define salinidade na forma de uma
razão entre medidas de condutividade:
" A practical salinity, símolo S, de uma amostra de água do mar, é
definida em termos da razão K, que é na verdade a medida de
condutividade elétrica de uma amostra a 15°C e pressão igual a 1
atmosfera dividida pela condutividade elétrica de uma solução de cloreto
de potássio (KCl) contendo a proporção em peso de 0,0324356, na
mesma temperatura e pressão. O valor de K igual a 1,000 corresponde
por definição, a uma salinidade prática de 35." A fórmula
correspondente aqui é:
S = 0.0080 - 0.1692 K1/2 + 25.3853 K + 14.0941 K3/2 - 7.0261 K2 +
2.7081 K5/2
Repare que nessa definição, a salinidade é uma razão e assim (o/oo) não
é mais usada, mas um valor antigo de 35o/oo corresponde a um valor de
35 em salinidade prática. Alguns oceanógrafos não se acostumam a usar
números de salinidade sem unidades e escrevem "35 psu", onde psu
está lá para significar "practical salinity unit".Como a salinidade prática é
uma razão (divisão de dois termos com mesma unidade) não tem
portanto nenhuma unidade (que se cancelam na divisão), a unidade
"psu" não tem muito sentido e seu uso é fortemente desencorajado.
Mesmo assim, pequenas diferenças ocorrem entre as definições antigas
e a nova escala de salinidade prática, mas de maneira geral são
bastante pequenas e usualmente ignoráveis.
GEOGRAFIA : ENSINO FUNDAMENTAL E MÉDIO : O MAR NO
ESPAÇO GEOGRÁFICO BRASILEIRO Brasília: MEC, SEF, 2005.
304 p. : il. (Coleção Explorando o ensino ; v. 8).BBE.
http://www.aoceano.org.br/ono/downloads.htm