Nióbio
O que é o Nióbio?
• É um elemento químico, de símbolo Nb , número atômico 41 .
• Possui massa atômica igual a 92,9 g/ mol.
• É um elemento de transição pertencente ao grupo 5 ou 5B da
classificação periódica dos elementos.
• Possui distribuição eletrônica [Kr]4d4 5s1 .
Propriedades do Nióbio
Raio médio
145 pm
Raio atômico calculado
198 pm
Raio covalente
137 pm
Estrutura Cristalina
Cúbica de Corpo Centrado
Estado da matéria
Sólido
Ponto de fusão
2750 K
Ponto de ebulição
5017 K
Entalpia de vaporização
696,6 kJ/mol
Entalpia de fusão
26,4 kJ/mol
Pressão de vapor
0,0755 Pa a 2741 K
Eletronegatividade
1,6 (Pauling)
Calor específico
265 J/(kg·K)
Condutividade elétrica
6,93 106 m-1·Ω-1
Condutividade térmica
53,7 W/(m·K)
Fonte: Wikipédia
Características principais
• É um metal dúctil.
• É um metal que tem boa resistência mecânica e tenacidade.
• É um metal cinza brilhante em condições naturais.
• Pode adquirir uma coloração azulada quando em contado
com o ar em temperatura ambiente após um longo período.
• Suas propriedades químicas são muito semelhantes às do
tântalo (elemento químico), que está situado no mesmo grupo.
• O metal começa a oxidar-se com o ar a 200 ºC e seus
estados de oxidação mais comuns são +2, +3 e +5.
Ocorrência
•É encontrado em minerais como:
• Niobita (columbita) [( Fe, Mn )( Nb, Ta )2O6].
• Niobita-tantalita [( Fe, Mn )( Ta, Nb )2O6].
• Pirocloro [( NaCaNb2O5F)] .
• Euxenita [( Y, Ca, Ce, U, Th ) (Nb, Ta, Ti)2O6] .
Característica principal
• Minerais que contém nióbio geralmente contém também o tântalo.
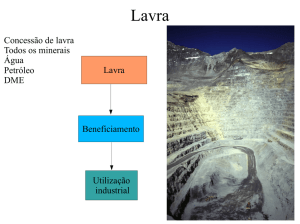
O nióbio é nosso
• O Brasil lidera a produção mundial de nióbio, utilizado na
fabricação de supercondutores.
• Toda a tecnologia de purificação do nióbio foi desenvolvida na
Faenquil, projeto iniciado por um grupo de engenheiros vindos da
Unicamp no final da década de 70.
• Em 12 anos o Brasil conquistou a auto-suficiência tecnológica no
beneficiamento do produto.
Jazidas de Nióbio
Brasil
Empresas do setor (exploradoras)
• Mineração Catalão de Goiás – Controle acionário (Grupo Anglo
American e Bozzano Simonsen).
• Cia. Brasileira de Metalurgia e Mineração (CBMM), com capital
distribuído entre o Grupo Moreira Sales e a Molycorp.
• A CBMM a única empresa do setor que opera, desde a mina até a
produção de produtos de nióbio de alto valor agregado.
• O Centro de Desenvolvimento Ambiental da CBMM, já obteve os
certificados ISO 9002 e ISO 14000.
Reservas Brasileiras
Reservas Brasileiras
96,30%
Minas Gerais
Amazonas
Góias
1,00%
2,70%
Fonte: DNPM – DEM, Mineral Commodity Summaries
Produção interna
Produção interna
78,30%
Minas Gerais
Góias
21,60%
Fonte: DNPM – DEM, Mineral Commodity Summaries
Mundo
• O Brasil é o líder mundial em reservas conhecidas de pirocloro
(Nb2O5), com uma participação de 88,0%, seguido do Canadá com
9,0%.
Líderes Mundiais
0%
20%
40%
Outros
80%
100%
Brasil 88%
Brasil
Canadá
60%
Canadá 9%
Outros 3%
Fonte: DNPM – DEM, Mineral Commodity Summaries
Principais Consumidores Internacionais
• Os Países Baixos (28,0%), Estados Unidos (24,0%), Japão (22,0%),
Alemanha (8,0%) e Canadá (7,0%), os principais consumidores do produto.
Consumidores Mundiais
30%
25%
20%
15%
10%
5%
0%
Países Eua Japão
Canadá
Alemanha
Baixos
Fonte:
DNPM – DEM, Mineral Commodity Summaries
O Comércio do Nióbio
¾ A liga FeNb destina-se ao mercado externo na aplicação da
fabricação de aços especiais (grades, estruturas e oleodutos), nas
industrias automobilísticas, espaciais, navais, aeronáuticas
e de ferramentas de alta precisão.
¾ A Cia Brasiliera de Metalurgia e Mineração exportou 87,8% de
sua produção de FeNb (2006).
¾ A empresa exportou seus produtos para cerca de 330 clientes
em 45 países e a partir desta base, a empresa atenderá com maior
agilidade os clientes asiáticos, onde em Tóquio foi criado uma joint
venture com a empresa nipônica Nissho Corporation.
Fonte: CBMM
Obtenção do Nb
-
Procedimentos para a obtenção do nióbio de alta pureza por
redução do Nb2O5:
Redução carbotérmica
Redução silicotérmica
Redução por hidrogênio
Redução metalotérmica (alumínio e magnésio)
Redução aluminotérmica do Nb2O5
-
Forno para redução aluminotérmica do Nb2O5:
Câmara de reação;
Molde;
Leito de escória.
Principais reações envolvidas:
2/5 Nb2O5 + 4/3 Al -> 4/5 Nb + 2/3 Al2O3
NaClO3 + 2 Al -> Al2O3 + NaCl
Refino em forno por feixe eletrônico
Forno composto de dois canhões, câmara de fusão mantidos sob
alto-vácuo.
Os eletrodos fazem o lingotamento do metal. O lingote obtido na
primeira fusão é resfriado. Em geral, três fusões são necessárias
para se obter o nióbio altamente puro.
Forno de feixe eletrônico
Aplicações
• Como elemento de liga para conferir melhoria de propriedades em produtos
de aço;
• Em superligas que operam a altas temperaturas em turbinas das aeronaves
a jato;
• Adicionado ao aço inoxidável utilizado em sistema de escapamento dos
automóveis para evitar corrosão intergranular;
• Produção de ligas supercondutoras de nióbio-titânio usadas na fabricação de
magnetos para tomógrafos de ressonância magnética;
• Encontra aplicação também em cerâmicas eletrônicas e em lentes para
câmeras.
Usos para os aços microligados ao nióbio
• Na indústria naval e nas plataformas marítimas;
• Nos tubos de grande diâmetro para transporte de gás ou petróleo;
• Na produção dos aços Interstitial Free, livres de átomos intersticiais,
com teor de carbono extra baixo (menos de 0,005%) e excelente
conformabilidade;
• Na construção civil, onde é típica a utilização de chapas grossas de aços
de alta resistência microligados ao nióbio (pontes, viadutos e edifícios);
• Amplo o emprego da tira laminada a quente na indústria automotiva
(chassis de caminhões, nas rodas e em algumas partes estruturais);
• Seu uso pode ser observado ainda em guindastes, vagões ferroviários,
contêineres e veículos fora de estrada.
Nióbio puro e suas ligas
• Superliga – usada a temperaturas acima de 650 °C em atmosferas altamente
oxidantes e corrosivas;
• Supercondutividade, com desaparecimento total da resistividade elétrica, abaixo
de temperaturas críticas próximas ao zero absoluto;
• Em estado puro, encontra aplicação em aceleradores de partículas subatômicas;
• Lâminas de nióbio puro usadas na produção de diamantes sintéticos;
• Componentes de nióbio-titânio resistentes à ignição, usados por mineradoras,
especialmente na mineração de ouro;
• Nióbio para os alvos de evaporação usados na indústria de vidro arquitetural,
nas lâminas de barbear e na indústria eletrônica;
• Ligas de nióbio-titânio para uso em implantes cirúrgicos, de desenvolvimento
recente.
Lâmina de Nióbio Puro
Ligas à base de Nióbio
Lingotes de Nb-Ti para cabos (1988);
Liga C-103: propulsores e bocais de foguetes;
Cabos anódicos de Nb nas plataformas marítimas;
Lâminas de Nb puro: diamantes sintéticos;
Ligas Nb- Ti para implantes cirúrgicos;
Cerâmicas finas
Chamados materiais funcionais e estruturais de engenharia.
Capacitores cerâmicos e lentes ópticas, ferramentas e peças de
motor.
500 toneladas por ano de Nb2O5 para cerâmicas, 2/3 para Japão.
Tântalo
Ocorrência
Ocupa a 54ª posição na escala de abundância relativa
Columbita-Tantalita: fórmula geral, (Fe,Mn) (Ta,Nb)2O6
Minerais mais raros: Wodginita, Euxenita, Pirocloro
Países da África ( Zimbábue, Congo, Nigéria e Moçambique), Brasil e
Austrália
columbite
euxenite
niobite
Informações adicionais
As reservas minerais conhecidas no mundo em 2001, segundo o
Departamento Nacional de Produção Mineral – DNPM atingem
180.724 t de tantalita. O Brasil concentra 49,4% das reservas
mundiais, seguido da Austrália com 32%.
Propriedades
É um metal de alto valor devido às suas propriedades intrínsecas
que englobam: excelente ductilidade, resistência à corrosão, alto
ponto de fusão e ebulição e boa condutividade térmica e elétrica.
Pode ser trefilado em arames finos, que são usados como
filamentos para evaporar metais como o alumínio.
É atacado somente pelo ácido fluorídrico, por soluções ácidas
contendo o íon fluoreto e por trióxido de enxofre. Álcalis o atacam
de forma bastante lenta.
Torna-se mais reativo em altas temperaturas.
É supercondutor a -268,7°C. Filmes de óxido de tântalo são estáveis
e possuem boas propriedades dielétricas.
Rede Cristalina : cúbica de corpo centrado
Grandeza
Valor
Unidade
Massa específica do sólido
16650
kg/m3
Ponto de fusão
3017
°C
Calor de fusão
36
kJ/mol
Ponto de ebulição
5458
°C
Calor de vaporização
735
kJ/mol
Temperatura crítica
s/ dado
°C
Eletronegatividade
1,5
Pauling
Estados de oxidação
+5
-
Resistividade elétrica
13
10-8 Ω m
Condutividade térmica
57,5
W/(m°C)
Calor específico
140
J/(kg°C)
Coeficiente de expansão térmica
0,63
10-5 (1/°C)
Coeficiente de Poisson
0,34
-
Módulo de elasticidade
186
GPa
Velocidade do som
3400
m/s
Estrutura cristalina
cúbica de corpo centrado
-
Produção
Comercialmente a produção do tântalo pode seguir um
dos diversos métodos:
eletrólise do fluortantalato de potássio fundido;
Redução do fluortantalato de potássio com sódio;
Reagindo o carboneto de tântalo com óxido de tântalo;
Como subproduto da extração do estanho;
O processo “KROLL”(Titanio) também é aplicado para o
tântalo
Aplicações
Atualmente a maior aplicação do tântalo, correspondendo a cerca
de 60% do uso total, é como pó metálico na produção de
capacitores, os quais regulam o fluxo de eletricidade nos circuitos
integrados da indústria eletrônica. Seus capacitores têm maior
capacitância por unidade de volume, propriedade responsável por
sua extensiva utilização em circuitos elétricos miniaturizados como
em telefones celulares,computadores pessoais, bens de
consumo digitais (vídeos e câmeras, por exemplo),
eletrônica de automóveis e equipamentos médicos.
A foto mostra capacitores de tântalo.
Aplicações
Usado em superligas para fabricação de produtos laminados (como
carbeto - TaC) e fios assim como em lâminas de turbinas para
indústria aeronáutica.
Vale lembrar que já foi muito usado como fio em filamentos de
lâmpadas tendo sido substituído pelo tungstênio, que apresenta
menor custo.
Aplicações
A demanda por concentrado de tantalita teve um aumento nos
últimos anos devido principalmente à sua maior utilização em
aparelhos eletrônicos portáteis como telefones celulares, laptops e
vídeos. Estima-se que, com o desenvolvimento da indústria de
telecomunicações, esta demanda aumente mais ainda.
Zircônio
Distribuição Eletrônica:
[Kr]4d25s2
Estrutura Cristalina:
Hexagonal Compacta
- símbolo Zr
- número atômico 40
- massa atômica 91
- sólido a temperatura ambiente
- grupo 4 (4B) – metal de transição
Distribuição de reservas e produção mundiais de zircônio
A principal fonte de zircônio é a zirconita, ( ZrSiO4) cuja apresentação pode variar nas
seguintes cores: marrom, verde, azul, vermelho, amarelo e incolor. Em termos teóricos,
a composição da zirconita é formada de 67,2% de ZrO2 e 32,8% de SiO2.
Outros minerais de zircônio conhecidos são a baddeleyta e o caldasito (ou
zirkita). A baddeleyta (ou zircônia, ZrO2) é o segundo minério mais importante de
zircônio. Contém teores de óxido de zircônio contido que variam entre 96,5% a 98,5%.
Como esse minério apresenta teores tão significativos, é conhecido como uma fonte
de extrema pureza na obtenção de zircônio metálico e compostos químicos. O
caldasito, também conhecido como zirkita, cuja ocorrência só tem registro no Brasil, é
um minério de zircônio que se apresenta como uma mistura de zirconita e
baddeleyta, idêntica a uma massa compacta homogênea acizentada, podendo
variar, quando oxidado, para as cores marrom ou vermelho.
O metal é obtido principalmente de uma cloração redutiva
através do processo denominado Kroll:
primeiro se prepara o cloreto para depois reduzi-lo com magnésio.
num processo semi-industrial, pode-se realizar a eletrólise de sais
fundidos, obtendo-se o zircônio em pó que pode ser utilizado,
posteriormente, em pulvimetalurgia.
Propriedades
- Massa específica: 6,51 g/cm3 a 300 K;
- Coeficiente de Poisson: 0,34;
- Ponto de fusão: 2125 K;
- Coeficiente linear de
expansão térmica: 5,78.10-6/K;
- Ponto de ebulição: 4650 K;
- Raio atômico: 2,16 Å
- Calor de fusão: 16,9 kJ/mol;
- Calor de vaporização: 58,2 kJ/mol;
- Calor específico: 0,27 J/gK;
- Condutividade térmica: 0,227 W/cmK;
- Condutividade elétrica: 0,0236.106/cmΩ;
- Módulo de Young: 98 Gpa;
- Volume molar: 14,06 cm3/mol;
Sistemas Cristalinos
A fase monoclínica é estável até 1170 ºC de onde se
transforma à fase tetragonal. A 2370 ºC, a fase tetragonal se transforma à fase
cúbica que existe até 2680 ºC, o ponto de fusão da zircônia.
Características
- Metal branco acinzentado brilhante e muito resistente a corrosão;
- Mais leve que o aço com uma dureza similar ao cobre;
- Quando pulverizado entra em ignição no ar, de forma espontânea a altas temperaturas.
Risco de explosão. Na forma de bloco, a ignição é difícil;
- É resistente à corrosão de ácidos (melhor que o aço), e álcalis (supera o tântalo, o
titânio e o aço inox), da água do mar e de outros agentes, mas pode se dissolver com
HF, formando complexos com os fluoretos;
- A menos que não esteja corretamente ligado, é pouco resistente
à ação corrosiva da água e do vapor d’água;
- Os estados de oxidação mais comuns são +2, +3 e +4;
Características
- À temperatura ambiente não reage com nenhum dos gases comuns e permanece
brilhante por tempo indefinido. A altas temperaturas reage praticamente com todos os
gases, formando compostos como óxidos e nitretos, ou simplesmente dissolve o gás,
sem modificar a própria estrutura cristalina;
- O háfnio está associado aos minerais de zircônio e a separação é difícil. O zircônio
comercial pode ter até 3% de háfnio;
- Ligado com zinco, torna-se magnético em temperaturas abaixo de 35 K;
- Os compostos são de baixa toxidade;
- Não se conhece nenhuma função biológica deste elemento.
Aplicações
- Devido à sua seção de capturas de nêutrons ser muito baixa, é utilizado principalmente
(em torno de 90% do consumo) como revestimento de reatores nucleares, em forma de
ligas zircaloy, que contém estanho, ferro e cromo em porcentagens reduzidas;
- Aditivo em aços obtendo-se materiais muito resistentes;
- Empregado em ligas com o níquel na indústria química devido a sua resistência diante
de substâncias corrosivas e remoção de oxigênio de válvulas eletrônicas e ligas de aço;
- Óxido de zircônio impuro é empregado na fabricação de utensílios de laboratório que
suportam mudanças bruscas de temperaturas, revestimentos de fornos e como material
refratário em indústrias cerâmicas e de vidro;
- É bastante tolerado pelos tecidos humanos, por isso pode ser
usado para a fabricação de articulações artificiais;
- Também é empregado em trocadores de calor, tubos de vácuo
e filamentos de lâmpadas.
Aplicações
- Alguns de seus sais são empregados para a a fabricação de
antitranspirantes;
- Pode ser usado como agente incendiário para fins militares;
- Óxido de zircônio é usado em joalheria. É uma gema artificial
denominada zirconita, que imita o diamante;
- O carboneto e o nitreto são materiais de elevada dureza que se utilizam no fabrico de
abrasivos e instrumentos cortantes. O nitreto de zircônio (ZrN) tem sido usado em
substituição ao nitreto de titânio no revestimento de brocas;
- O carboneto duplo de amônio e zirconilo é utilizado na preparação de fluidos hidrófobos e
de revestimentos à prova de água;
- Utilizado como constituinte de isolantes, esmaltes e outros materiais resistentes à
temperatura;
- Outras aplicações menores incluem a fabricação de lâmpadas de flash para fotografia,
explosivos, fogos de artifício, balas traçadoras, foguetes de sinalização, etc;
Aplicações
- Pigmento na indústria de cerâmica;
- Sensores para avaliação de oxigênio
(para motores e indústria siderúrgica);
- Tecidos High-tech;
- Vidro metálico.
O óxido de zircônio (ZrO2) ocorre na natureza na forma de um mineral raro,
chamado baddeleyíta, que cristaliza no sistema monoclínico. Existe, porém, a
zircônia artificial, que tem a mesma composição química, mas cristaliza no sistema
cúbico, sendo, por isso, chamada de zircônia cúbica.
Tanto a baddeleyíta quanto a zircônia cúbica são usadas como gema,
sendo a zircônia cúbica muito mais conhecida por ser a mais perfeita imitação de
diamante já obtida. Ela serve, além disso, para, variando a cor, imitar outras gemas,
como a ametista.
Materiais cerâmicos são frágeis e uma das maneiras conhecidas para se contornar
esta deficiência é a introdução de partículas de zircônia na matriz, o que tenacifica o
material, intensificando suas propriedades mecânicas.
Assim, esta característica se faz muito importante quando estamos interessados
em fabricar, por exemplo, cerâmicas dentárias.
Inovações Tecnológicas
Cientistas criam um vidro perfeito a partir de um metal
Submetendo-o à mesma pressão capaz de criar
os diamantes, cientistas da Universidade da Califórnia, Estados
Unidos, criaram um vidro tão puro que poderá vir a ser chamado
de o "vidro-diamante".
O vidro metálico puríssimo poderá ser utilizado em
materiais mais resistentes e estáveis para aplicações
médicas, esportivas e em aplicações de opto-eletrônica.
Os cientistas Yusheng Zhao e Jianzhong Zhang descobriram que o vidro de zircônio
se forma a cerca de um terço da temperatura de fusão do elemento, quando o material é
submetido a um pressão de cinco bilhões de Pascal, algo como 50.000 vezes a pressão
atmosférica da Terra.
Os vidros metálicos têm encontrado uma grande variedade de usos nos últimos 15
anos, substituindo materiais convencionais como metais cristalinos, ligas metálicas e
cerâmicas de alta tecnologia. Entre as suas aplicações atuais estão materiais estruturais
para engenharia, componentes eletrônicos, joalheria, esquis, raquetes de tênis e tacos de
golfe.
Os vidros metálicos se comportam elasticamente como os polímeros, mas são
mais fortes do que as ligas metálicas. Isto os torna quase inquebráveis, mantendo o formato
e sendo difíceis de serem riscados.
Mas até agora os vidros metálicos continham três ou mais elementos, o que
diminui sua estabilidade termal. O novo vidro de zircônio puro resolve este problema. O
material permanece estável a temperaturas acima de 800º C e pressões de mais de 2,8
bilhões de Pascal.