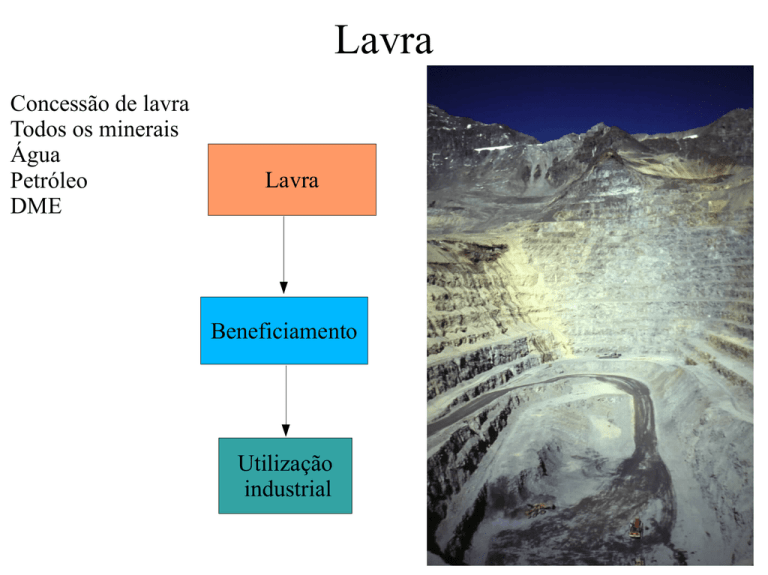
Lavra
Concessão de lavra
Todos os minerais
Água
Petróleo
DME
Lavra
Beneficiamento
Utilização
industrial
Moagem
Separação por flotação
Separação magnética,
Fe, Co, Ni
Mesas vibratórias e sep. por
densidade
Métodos de beneficiamento
hidrodinâmicos
Água
espiral
Vórtice
Filtragem, secagem, tamisagem
Descarte de sub-produtos
“Landfilling”, diques e depósitos
Altíssimo impacto ambiental
Degradação do ambiente original
Muitas vezes irremediáveis
Tratar destes problemas é uma grande
fonte de lucro!
Redução a alta temperatura
Processo Goldschmidt ou termite
Fe2O3 + 2Al
2Fe+ Al2O3
Processo Kroll
MnO2 + 2Mg
Ln2O3 + 3Ca
Mn+ 2MgO
2Ln + 3CaO
Ferro e Aço
Redução eletrolítica
Eletrólise ígnea
Processo
Halt-Héroult
Misturas eutéticas
950 oC
Manganês
Psilomelana (óxido)
●Criptomelano (óxido)
●Pirolusita (óxido)
●Rodocrosita (carbonato)
●
Elemento metálico de transição, de cor cinza, frágil. Z = 25, configuração
eletrônica: [Ar] 4s2 3d5, MA = 54,94, d = 7,4 g.cm-3, PF = 1244ºC, PE =
2040ºC. As principais fontes são pirolusita ou manganês mole,(MnO2),
psilomelana ou manganês duro (MnO2) e rodocrosita (MnCO3). O metal pode
ser extraído por redução do óxido usando magnésio (processo Kroll) ou
alumínio (processo Goldschmidt). Freqüentemente o minério é misturado com
minério de ferro e reduzido em forno elétrico para produzir ferro-manganês
para uso em ligas de aços. O elemento é bastante eletropositivo e reage com
água e ácidos diluídos dando hidrogênio. Quando aquecido combina com
oxigênio, nitrogênio e com outros metais. Sais de manganês contêm o
elemento nos estados de oxidação +2 e +3. Os sais de manganês (II) são mais
estáveis. Também forma compostos em estados de oxidação mais altos como
óxido de manganês (V) e sais de manganato (VI) e permanganato (VII). O
elemento foi descoberto em 1774 por Scheele.
Nióbio e tântalo
Columbita e Tantalita
(Fe,Mn)(Nb,Ta)2O6
Abertura com HF
Elemento metálico de transição azul acinzentado. Z = 73; configuração
eletrônica: [Xe]4f145d36s2; MA = 180,948; d = 16,63 g.cm-3; PF = 2996°C; PE
= 5427°C. É encontrado juntamente com o nióbio nos minérios columbita –
tantalita: (Fe, Mn) (Ta, Nb)2O6. É extraído por dissolução em ácido fluorídrico,
que separa os fluoretos de nióbio e tântalo para dar K2TaF7 que é reduzido com
sódio. O elemento apresenta os isótopos 181Ta que é estável e 180Ta que tem
ocorrência de 0,12% e é radioativo com meia-vida maior do que 107 anos. Há
vários outros isótopos de meia-vida curtas. O elemento é usado em algumas ligas
especiais e em componentes eletrônicos. Por ser não reativo, peças metálicas de
tântalo são usadas em cirurgias como por exemplo pinos para juntar ossos.
Quimicamente o metal forma camada passiva de óxido no ar. Forma complexos
nos estados de oxidação +2, +3, +4 e +5. O tântalo foi identificado em 1802 por
Ekeberg e isolado em 1820 por Berzelius.
Estanho
Cassiterita
(Óxido)
Redução por Carbono
SnO2 + C
Sn+CO2
Elemento metálico pertencente ao grupo do carbono na Tabela Periódica. É maleável e prateado. Z =
50; configuração eletrônica: [Kr]4d105s25p2; MA = 118,69; d = 7,29g.cm-3; PF = 231,97ºC; PE =
2270ºC. É encontrado como óxido de estanho (IV) nos minérios como a cassiterita (SnO 2) e é extraído
por redução com carbono. O metal (chamado estanho branco) passa para outra forma alotrópica a
18ºC, o estanho cinza. A formação deste alótropo é um problema e pode ser revertida por aquecimento
a 100ºC. O elemento natural tem 21 isótopos (o maior número encontrado para um só elemento). São
conhecidos cinco isótopos radioativos. O metal é usado em camadas de proteção em chapas de aço e
constitui importante elemento de ligas (por exemplo: bronze fosforado (liga à base de cobre e estanho
contendo até 1% de fósforo), liga metálica para armas de fogo, solda, metal de Babbitt e latas que são
ligas geralmente com 63% de estanho, para embalagens de alimentos. Quimicamente é reativo.
Combina diretamente com cloro e oxigênio e desloca o hidrogênio de ácidos diluídos. Também se
dissolve em álcalis para formar estanatos. Há duas séries de compostos de estanho, respectivamente
nos estados de oxidação +2 e +4.
Alumínio
Bauxita (oxo-hidróxido)
AlOOH
Redução eletrolítica ígnea.
Elemento metálico, prateado claro, brilhante, pertencente ao Grupo III da Tabela Periódica. Z = 13,
configuração eletrônica: [Ne] 3s2 3p1, MA = 26,98, d = 2,702 g.cm-3, PF = 660° C, PE = 2467° C. O
metal é muito reativo, mas é protegido por uma fina camada transparente de óxido que se forma
rapidamente no ar. O alumínio e seus óxidos são anfóteros. O metal é extraído da bauxita purificada
(Al2O3.2H2O) por eletrólise. O principal processo usa cela de Hall-Heroult, mas estão sendo
desenvolvidos outros métodos eletrolíticos, incluindo a conversão de bauxita com cloro e eletrólise do
cloreto fundido. O alumínio puro é mole e dúctil, mas sua resistência pode ser aumentada por
tratamento adequado. São produzidas muitas ligas de alumínio contendo vários elementos inclusive
cobre, manganês, silício, zinco e magnésio. Sua leveza, resistência mecânica (em ligas), resistência à
corrosão e condutividade elétrica (62% da condutividade do cobre), o tornam adequado para muitas
finalidades inclusive na construção de veículos, aeronaves, construção civil (estruturas, portas, janelas
e esquadrias) e cabos condutores. Embora seja o terceiro elemento mais abundante na crosta terrestre
(8,1% em peso) só foi isolado em 1825 por H.C. Oersted (1777-1851).
1 ton Al=15000 kW/h de energia
Ouro
Aluvião (pepitas)
Intrusivo (veios)
Subproduto (Cobre etc...)
Cianetação
2 Au + 4 CN- + 0.5 O2 + H2O => 2 [Au(CN)2]- + 2 OH-
Extração com Mercúrio
Silício
Monocristais de Si
SiO2 + C
Si + CO2
Purificação do Si
Preparação de “wafers”
Por litografia obtém-se
circuitos integrados
Dos isolantes aos semi-condutores
Terras raras
Lantânio; La
Lantanídeos
Cério; Ce
Praseodímio; Pr
Neodímio; Nd
Promécio; Pm
Samário; Sm
Európio; Eu
Gadolínio; Gd
Térbio ; Tb
Disprósio ; Dy
Hôlmio; Ho
Érbio; Er
Túlio ; Tm
Ytérbio ; Yb
Lutécio ; Lu
Ocorrem todos juntos
Monazitas (fosfatos), xenotímio (YPO4) e alguns outros
E.S. > Areias negras, monazíticas
Props parecidas dos elementos> contração lantanídica
Conf. Eletrônica estável 3+ em todos os elementos
Separação por via úmida
Abertura ácida
Monazita
H2SO4;200oC
Res. Insol.
C/ Ra
Ppt Óxido
Th
Ln leves
sulfatos
duplos/ppt
H2O
Sulfatos
La/Ln/Th
Aumento pH
NH4OH
Sol. de (Ln/La)2
(SO4)3
Na2SO4
Ln pesados
sulfatos(sol)
Abertura alcalina
Monazita
NaOH 80%
140oC
H2O
Borra de
oxo/hidróxidos
HCl
pH=3,5
ThO2
Ln/LaCl3
+ Ra
BaCl3
Ln2(SO4)3
Ln/LaCl3
BaSO4
RaSO4ppts.
Resinas de troca iônica
Variando aos poucos o pH do eluente, pode-se alterar a afinidade
dos cátions com a resina de T.I.












