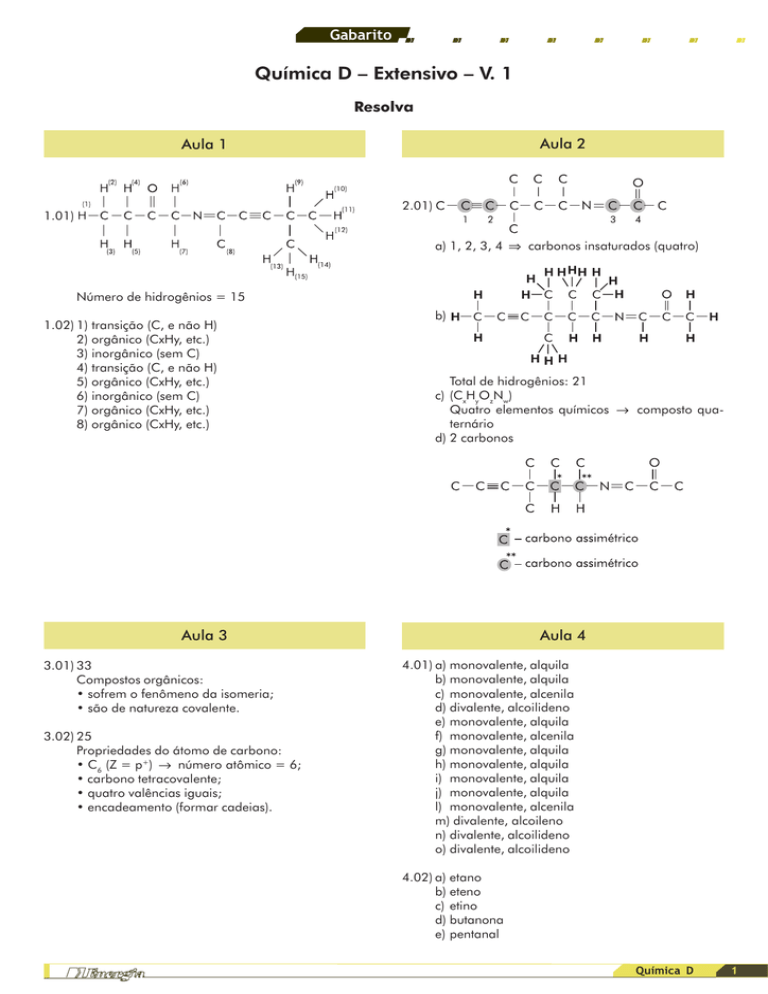
Gabarito
Química D – Extensivo – V. 1
Resolva
Aula 2
Aula 1
2.01)
1.01)
a) 1, 2, 3, 4 Á carbonos insaturados (quatro)
Número de hidrogênios = 15
1.02) 1) transição (C, e não H)
2) orgânico (CxHy, etc.)
3) inorgânico (sem C)
4) transição (C, e não H)
5) orgânico (CxHy, etc.)
6) inorgânico (sem C)
7) orgânico (CxHy, etc.)
8) orgânico (CxHy, etc.)
b)
Total de hidrogênios: 21
c) (CxHyOzNw)
Quatro elementos químicos composto quaternário
d) 2 carbonos
Aula 4
Aula 3
3.01) 33
Compostos orgânicos:
• sofrem o fenômeno da isomeria;
• são de natureza covalente.
3.02) 25
Propriedades do átomo de carbono:
• C6 (Z = p+) número atômico = 6;
• carbono tetracovalente;
• quatro valências iguais;
• encadeamento (formar cadeias).
4.01) a) monovalente, alquila
b) monovalente, alquila
c) monovalente, alcenila
d) divalente, alcoilideno
e) monovalente, alquila
f) monovalente, alcenila
g) monovalente, alquila
h) monovalente, alquila
i) monovalente, alquila
j) monovalente, alquila
l) monovalente, alcenila
m) divalente, alcoileno
n) divalente, alcoilideno
o) divalente, alcoilideno
4.02) a) etano
b) eteno
c) etino
d) butanona
e) pentanal
Química D
1
Gabarito
Testes
Aula 1
1.01) A
A síntese da úreia [CO(NH2)2] a partir do cianato de
amônia provou a possibilidade de se sintetizar compostos orgânicos a partir de inorgânicos.
1.11) E
Atualmente, a química orgânica é definida como a
química que estuda os compostos do elemento carbono.
1.02) D
A teoria da força vital foi formulada por Berzelius.
1.12) 24
Todo composto de transição tem carbono e geralmente não possui hidrogênio.
Todo composto orgânico apresenta carbono.
1.03) D
O elemento que deve ser encontrado em toda substância orgânica é o carbono.
1.04) E
O elemento químico existente em maior número na
constituição do corpo humano é o hidrogênio.
1.05) B
• Teoria da força vital Berzelius.
• CHC 3 é um composto orgânico.
• O carbono é tetravalente.
• Todo composto orgânico (CxHy, etc.) possui carbono.
1.06) D
1.13) 37
Compostos tipicamente orgânicos: CxHy, etc.
01. CH4
04. CHC 3
32. CH3 – CH3
1.14) síntese da uréia
NH4 | CNO ¡¡
CO(NH2 )2
'
cianato de amônio
uréia
1.15) Berzelius
A síntese da uréia destruiu a teoria da força vital,
defendida por Berzelius.
1.16) 03
1.07) B
C6 1s2 2 s2 2p2
K
2
L
4
1.08) D
organógenos C, H, O, N, P, S, etc.
Logo, Ca não é organógeno.
1.09) C
Propriedades do carbono:
• tetravalente;
• igualdade entre as quatro valências;
• caráter anfótero.
1.10) 47
64. Incorreta
Incorreta. Organógenos: C, H, O, N, P, S, etc.
2
Química D
Das seis estruturas apresentadas, apenas três são
diferentes (1, 2 e 3).
1.17) Wöhler, cianato de amônio, uréia, Berzelius
Gabarito
Aula 2
2.01) Carbono 3.
2.05) C
2.02) D
Kekulé (plano)
Le Bel e Van't Hoff (espacial)
2.03) 02
C10H17O4N3
2.06) D
C (primário)
a) saturados: 10
b) insaturados: 3
c) assimétrico: 2
2.07) B
Quaternário (4 elementos químicos)
2.08) D
Quaternário (4 elementos químicos)
d) primários: 8
secundários: 3
terciários: 1
quaternários: 1
2.09)
2.04) C8H12O3N2
5 carbonos secundários
Química D
3
Gabarito
2.10) A
2.14) 04
2.11) B
2.15)
2.12) C
H HH
2.16) H
H HH
H
C
H
H
H
H
C
C
C* C
C
C
H
C
C
H
H
H
H HHH HH
a) 1C terciário (
2.13) 15
).
b) 1 carbono assimétrico.
c) 2 carbonos insaturados.
d) 7 carbonos primários (
).
e) 5 carbonos secundários ( ).
4
Química D
ins
ins
C
C
C
H
C
C
C
H
H HH
H
Gabarito
Aula 3
3.01) D
Principais organógenos: C, H, O, N.
3.02) Coluna I
2
4
32
(38)
Coluna II
1
8
16
(25)
Diferença (–) Á 38 – 25 = 13
3.07) 06
Propriedades dos compostos orgânicos:
• PF e PE baixos;
• pequena estabilidade térmica.
3.08) 69
• Apresentam carbono na sua constituição.
• Podem ser obtidos em laboratório a partir de compostos inorgânicos.
• Possuem reações lentas, pois geralmente são moleculares.
3.03) B
NaC :
• composto iônico;
• PE e PF altos.
Observação:
PE: ponto de ebulição
PF: ponto de fusão
3.04) 07
Compostos orgânicos:
• ligação covalente;
• C, H, O, N (organógenos);
• PE e PF baixos;
• isomeria: fenômeno em que dois ou mais compostos apresentam a mesma fórmula molecular e
fórmulas estruturais diferentes.
3.09) 59
04. Incorreta
Incorreta. Os compostos orgânicos, em sua
maioria, não conduzem corrente elétrica.
3.10) D
Isomeria é o fenômeno em que duas ous mais substâncias têm mesma fórmula molecular e fórmulas
estruturais diferentes.
3.11) C
São isômeros (fórmulas estruturais )
3.05) 97
• C6 Á Z = p+; número atômico = 6
• Nox do carbono: de – 4a + 4.
• Tetracovalente
• Encadeamento
• Quatro valências iguais
3.06) E
Compostos orgânicos:
• PF e PE baixos;
• isomeria.
3.12) a) orgânicos
b) orgânicos
c) inorgânicos
d) orgânicos
e) inorgânicos
f) orgânicos
g) orgânicos
h) inorgânicos
Química D
5
Gabarito
Aula 4
4.01) Octano
Oito carbonos Á oct
Cadeia saturada, normal Á an
Hidrocarboneto Á o
f) propadieno: C3H4
g) propeno: C3H6 Á
h) pentino: C5H8 Á
i) heptino: C7H12 Á
j) propino: C3H4 Á
m) buteno C4H8
Á
n) metano CH4
Á
Á 4H
6H
8H
12H
4H
8H
4H
4.07) Alquila
Alcoíla é sinônimo de alquila.
4.02) Propino
•Hidrocarboneto (somente carbonos e hidrogênios)
•CxHy
•Cadeia insaturada (etínica): tripla ligação (in)
•Três átomos de carbono: prop
4.08) C
prop|in|o
4.03) B
4.09) B
C4H10
4.04) Metano
• Menor hidrocarboneto
• Fórmula molecular: CH4
• Fórmula estrutural:
4.05) B, I, E, F, J, G, A, D, H, C
4.06) a) etano: C2H6
b) butano: C4H10
c) eteno: C2H4
d) butino: C4H6
e) hexano: C6H14
6
Química D
Á
Á
Á
Á
Á
6H
10H
4H
6H
14H
4.10) 25
Radicais orgânicos: • monovalentes
• hidrocarbonetos (CxHy)
01. H3C – (metil)
08.
16.
Gabarito
4.18) E
Radicais: grupo de átomos com elétrons desemparelhados
4.11) 06
02.
4.19) D
04.
4.12) D
Valência livre no carbono saturado e monovalente:
os radicais orgânicos são chamados de alcoílas ou
alquilas.
4.13) A
Terminação para radicais segundo a Iupac:
• il ou ila (monovalente);
• ileno (bivalente);
• ilideno (bivalente).
4.14) Iupac
União Internacional de Química Pura e Aplicada
4.20) A
4.15) 21
01.
(exceção nome: metileno)
04.
16.
4.16) E
Radical:
• monovalente;
• valência no anel aromático (arilas).
4.21) C
Não é radical.
4.17) D
Grupo de átomos com elétrons desemparelhados
Química D
7