Conj.
2o
Código
Q21
Período
M
Turma
B
Data
07/05/2004
Questão 1 (2.0 pontos)
Um risco a lápis consome, em média, 0,1 mg de grafite (Carbono) / cm2 . Calcule o número
de átomos de carbono contidos em 10 riscos, e supor que cada risco ocupe uma área de 10
cm2 ?
Dados: 1 g = 1000 mg; massa molar (Carbono) = 12 g / mol; número de
Avogadro = 6 x 10 23 partículas / mol
Questão 2 (2.0 pontos)
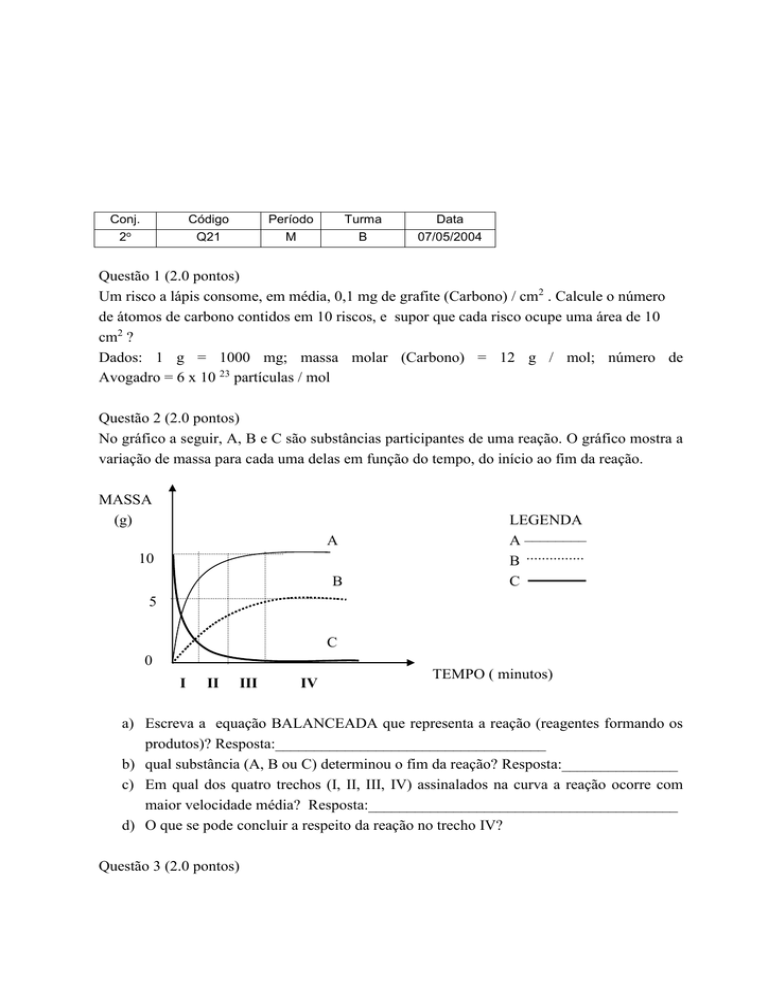
No gráfico a seguir, A, B e C são substâncias participantes de uma reação. O gráfico mostra a
variação de massa para cada uma delas em função do tempo, do início ao fim da reação.
MASSA
(g)
A
10
B
LEGENDA
A ––––––––
B
C
5
C
0
I
II
III
IV
TEMPO ( minutos)
a) Escreva a equação BALANCEADA que representa a reação (reagentes formando os
produtos)? Resposta:___________________________________
b) qual substância (A, B ou C) determinou o fim da reação? Resposta:_______________
c) Em qual dos quatro trechos (I, II, III, IV) assinalados na curva a reação ocorre com
maior velocidade média? Resposta:________________________________________
d) O que se pode concluir a respeito da reação no trecho IV?
Questão 3 (2.0 pontos)
A tabela a seguir indica valores das velocidades de reação e as correspondentes molaridades
dos reagentes em idênticas condições, ou seja, dados experimentais sobre a reação do brometo
de t-butila com o íon hidroxila, a 55°C:
(CH3)3CBr + OH - (CH3)3COH + Br Experimento
V (mols L-1 min-1)
I
II
III
IV
V
0,0010
0,0020
0,0040
0,0010
0,0010
Concentração de
(CH3)3CBr
0,10
0,20
0,40
0,10
0,10
Concentração OH 0,10
0,10
0,10
0,20
0,30
Perguntas sobre a Questão 3
a) Qual é a equação de velocidade em termos de concentração desse processo?
b) Qual é a ordem de reação em relação a (CH3)3CBr e em relação a OH - ?
c) Calcule o valor da Constante da velocidade?
d) A reação é elementar ou não?
Resposta da questão 3!
Questão 4 (2.0 pontos)
O carvão é um combustível constituído de uma mistura de compostos ricos em carbono. Na
tabela abaixo temos algumas situações em que as formas de apresentação do combustível,
comburente e a temperatura variam:
Reação
I
II
III
IV
V
Combustível
Carvão em pedaços
Carvão em em pó
Carvão em pedaços
Carvão em pó
Carvão em pedaços
Comburente
Ar atmosférico
Ar atmosférico
Oxigênio puro
Oxigênio puro
Oxigênio Liquefeito
Temperatura
0
0
20
50
50
Dados: Ar atmosférico é formado cerca de 78 % de Nitrogênio, 20 % de Oxigênio entre
outros gases.
a) Qual é a reação (I, II, III, IV, V) de maior e menor velocidade?
b) Indique quatro fatores que alteram a velocidade de uma reação química?
Questão 5 (2.0 pontos)
O diagrama energético dos caminhos A e B da reação REAGENTES PRODUTOS é:
Entalpia
(KJ/mol) 30
LEGENDA
A –––––––
B
A
25
20
reagente
B
10
produtos
caminho da reação
Determine o que se pede abaixo:
a) a energia de ativação do caminho A e do caminho B?
b) em qual caminho (A ou B) há presença do catalisador?
c) em qual caminho (A ou B) a velocidade da reação é maior?
d) quanto de energia foi liberada (ou absorvida) com a reação?
e) se a reação é endotérmica ou exotérmica?
f) Localize no gráfico o complexo ativado para os dois caminhos.












