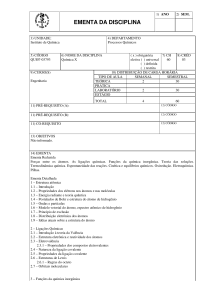
Química 12º ano
Netprof
Novo programa
Unidade I – Metais e Ligas metálicas
1º Banco de Questões
As questões que se seguem foram retiradas ou adaptadas de exames de acesso a universidades brasileiras.
1. (CESGRANRIO-99) O elemento manganês ou manganésio não ocorre livre na Natureza e
encontrando-se combinado, na forma de uma variedade de minerais, tais como: pirolusita (MnO2),
manganita (MnO3.H2O), ausmanita (Mn3O4) entre outros. Extraído dos seus minerais, pode ser
empregado em ligas de aço (britadores, agulhas e cruzamentos ferroviários), ligas de baixo
coeficiente térmico (bobinas de resistência), etc. A respeito desse elemento químico, é correto
afirmar que:
A é líquido em condições ambientais.
B se trata de um não-metal.
C se trata de um metal alcalino terroso.
D os seus átomos possuem dois electrões no
subnível de maior energia.
E os seus átomos possuem dois electrões na
camada de valência.
2. (PUCMG-99) Numere a segunda coluna de acordo com a primeira, considerando os tipos de ligações
para as espécies químicas.
Substância
Ligação
1. Ne
(
) iónica
2. Fe
(
) covalente polar
3. NH3
(
) covalente apolar
4. KF
(
) metálica
5. O2
(
) van der Waals
3.(U.E. LONDRINA-96) Há correlação entre substância química e natureza da ligação entre
átomos em
A Substância: fluoreto de hidrogénio
B Substância: dióxido de carbono
Ligação: covalente apolar
C Substância: cloreto de potássio
Ligação: iónica
D Substância: monóxido de carbono
Ligação: covalente polar
E Substância: oxigénio
Ligação: iónica
Ligação: covalente apolar
4. (Fuvest 2000) Considere as propriedades das seguintes substâncias:
Substância: CCl4
Ponto de fusão (°C): -23,0
Solubilidade (g/100 cm3) a 25° C em água: praticamente zero
-1-
NetProf
Química 12º ano
Netprof
Densidade (g/ cm3) a 25° C: 1,59
Substância: iodo
Ponto de fusão (°C): 113,5
Solubilidade (g/100 cm3) a 25° C em água: 0,03
Solubilidade (g/100 cm3) a 25° C em CCl4: 2,90
Densidade (g/ cm3) a 25° C: 4,93
Substância: água
Ponto de fusão (°C): 0,0
Solubilidade (g/100 cm3) a 25° C em CCl4: praticamente zero
Densidade (g/ cm3) a 25° C: 1
A 25° C, 3,00 g de iodo, 70cm3 de água e 50cm3 de CCl4 são colocados num funil de separação.
Após agitação e repouso, qual dos esquemas seguintes representa a situação final?
5. (PUCMG-99) "O SiO2 é um sólido de ponto de fusão muito elevado (ponto de fusão = 1 700° C)
e o CO2 é um gás nas condições ambiente. Ambos são polares, mas a grande diferença de pontos
de ebulição não se justifica pela diferença de massa molar. Justifica-se, portanto, que a estrutura
rede cristalina de SiO2 é _________ e o do CO2 é ____________."
As lacunas ficam correctamente preenchidas, respectivamente com:
A iónico - molecular
B molecular - iónico
C molecular - covalente
D iónico - covalente
E covalente - molecular
6.(CESGRANRIO-98) Considere a Tabela Periódica dos elementos e as seguintes afirmações:
I - os átomos de cloro são os mais eletronegativos do terceiro período da tabela periódica;
II - os átomos do titânio são maiores que os átomos do cobalto;
III - os átomos do frâncio são mais eletropositivos que os do lítio;
IV - a configuração eletrónica, por subníveis, em ordem crescente de energia, para os átomos do
ferro é 1s22s22p63s23p64s23d6.
São afirmatições correctas:
A I e II apenas.
B III e IV apenas.
C I, II e III apenas.
D II, III e IV apenas.
E I, II, III e IV.
-2-
NetProf
Química 12º ano
Netprof
7. (UFMG - 2000) Um dos fatores que favorecem a solubilidade de um metal em outro é a
semelhança das redes cristalinas. No entanto, é preciso também que os seus átomos não sejam
muito diferentes quanto a
- raio atómico;
- electronegatividade; e
- valência.
Os metais alcalinos e o ferro, que apresentam redes cristalinas semelhantes, não formam ligas por
causa das grandes diferenças quanto a essas propriedades.
Considerando as propriedades periódicas do ferro e dos metais alcalinos, assinale a alternativa
falsa.
A a electronegatividade do átomo de ferro é mai B
a do átomo de sódio.
C
o número de oxidação mais comum dos
metais alcalinos é +1.
o raio atómico do ferro é maior que o do
potássio.
D
o raio atómico do ferro é menor que o do
rubídio.
8. (ITA - 2001) Considere as seguintes afirmações:
I. O nível de energia de um átomo, cujo número quântico principal é igual a 4, pode ter, no
máximo, 32 electrões.
2
2
2
2
II. A configuração electrónica 1s 2s 2px 2py representa um estado excitado do átomo de oxigénio.
III. O estado fundamental do átomo de fósforo contém três electrões desemparelhados.
IV. O átomo de azoto apresenta o primeiro potencial de ionização menor que o átomo de flúor.
V.A energia necessária para excitar um electrão do estado fundamental do átomo de hidrogénio
para a orbital 3s é igual à necessária para excitar este mesmo electrão para a orbital 3d.
Indique as afirmações CORRECTAS:
A apenas I, II e III.
B apenas I, II e V.
C apenas III e IV.
D apenas III, IV e V.
E todas.
9. (ITA – 2003) Considere o elemento galvânico mostrado na
figura ao lado. O semielemento A contém uma solução aquosa,
isenta de oxigénio, 0,3 mol L–1 em Fe2+ e 0,2 mol L–1 em Fe3+.
O semielemento B contém uma solução aquosa, também
isenta de oxigénio, 0,2 mol L–1 em Fe2+ e 0,3 mol L–1 em Fe3+.
M é um condutor metálico (platina). A temperatura do elemento
galvânico é mantida constante num valor igual a 25º C. A partir
do instante em que o circuito “S” é fechada, considere as
seguintes afirmações:
I. O sentido convencional de corrente eléctrica ocorre do
semielemento B para o semi-elemento A.
II. Quando a corrente eléctrica for igual a zero, a relação de concentrações [Fe3+(aq)]/[Fe2+(aq)]
tem o mesmo valor tanto no semi-elemento A como no semi-elemento B.
III. Quando a corrente eléctrica for igual a zero, a concentração de Fe2+(aq) no semielemento A
será menor do que 0,3 mol L–1.
-3-
NetProf
Química 12º ano
Netprof
IV. Enquanto o valor da corrente eléctrica for diferente de zero, a diferença de potencial entre os
dois semielementos será maior do que 0,118 log (3/2).
V. Enquanto a corrente eléctrica fluir pelo circuito, a relação entre as concentrações
[Fe3+(aq)]/[Fe2+(aq)] permanece constante nos dois semielementos.
Indique as afirmações correctas.
A apenas, I, II e III
B apenas I, II e IV
C apenas III e V
D apenas IV e V
E todas.
10. (ITA – 2003) Um elemento galvânico, chamado de I, é constituído pelos dois eléctrodos
seguintes, separados por uma membrana porosa:
IA. Chapa de prata metálica, praticamente pura, mergulhada numa solução 1 mol L–1 de nitrato de
prata
IB. Chapa de zinco metálico, praticamente puro, mergulhada numa solução 1 mol L–1 de sulfato de
zinco.
Um outro elemento galvânico, chamado de II, é constituído pelos dois seguintes eléctrodos,
também separados por uma membrana porosa:
IIA. Chapa de cobre metálico, praticamente puro, mergulhada numa solução 1 mol L–1 de sulfato
de cobre.
IIB. Chapa de zinco metálico, praticamente puro, mergulhada em uma solução 1 mol L–1 de sulfato
de zinco.
Os elementos galvânicos I e II são ligados em série de tal forma que o eléctrodo IA está ligado ao
IIA, enquanto que o eléctrodo IB está ligado ao IIB. As conexões são feitas através de fios de
cobre. A respeito desta montagem:
1) Faça um desenho esquemático dos elementos galvânicos I e II ligados em série. Neste
desenho indique:
1.1) qual é o elemento activo (aquele que fornece energia eléctrica) e quem é o elemento
passivo (aquele que recebe energia eléctrica);
1.2) o sentido do fluxo de electrões;
1.3) a polaridade de cada um dos eléctrodos IA, IB, IIA e IIB;
1.4) as semi-reações electroquímicas devidamente acertadas para cada um dos
eléctrodos.
-4-
NetProf