01) (FMTM-MG) Sobre tabela periódica, um estudante
formulou as proposições abaixo.
I.
II.
III.
IV.
( 1 ) Alguns elementos que constam da tabela
periódica recebem o nome de gases nobres
porque não reagem com nenhuma substância.
( 2 ) O silício e o fósforo são usados na fabricação
dos chips porque pertencem à mesma família na
tabela periódica.
( 3 ) A utilização do germânio, em vez do silício, para
a confecção de chips, pode ser atendida a partir
de uma análise da tabela periódica.
03) (PUC-SP) Resolva a questão com base na análise
das afirmativas abaixo.
Átomos de um mesmo período possuem o
mesmo número de camadas ocupadas.
Átomos de um mesmo período possuem o
mesmo número de elétrons na camada de
valência.
Um átomo, cujo número atômico é 18, está
classificado na tabela periódica como gás
nobre.
Na tabela periódica atual, os elementos estão
ordenados em ordem crescente de massa
atômica.
I.
A tabela periódica moderna atual está disposta
em ordem crescente de massa atômica.
II. Todos os elementos que possuem 1 elétron e 2
elétrons na camada de valência são,
respectivamente, metais alcalinos e metais
alcalino-terrosos, desde que o número quântico
principal desta camada (n ≠ 1).
III. Em um mesmo período, os elementos
apresentam o mesmo número de níveis
(camadas).
IV. Em um mesmo grupo (família), os elementos
apresentam o mesmo número de níveis
(camadas).
São corretas apenas as afirmações:
a)
b)
c)
d)
e)
I e II
II e III
I e III
II e IV
III e IV
02) (UNB-DF) Para produzir a grande quantidade de
materiais que necessita, o homem tem ao seu dispor
cerca de 90 diferentes tipos de átomos, sem contar
com os elementos artificiais que são utilizados pela
indústria. Para melhor organizar as informações
sobre os elementos químicos, o cientista russo
Mendeleyev propôs a utilização de uma tabela
periódica similar à que se utiliza hoje.
Na indústria de computadores, dois elementos
importantíssimos são o silício (elemento que constitui
aproximadamente 27,2% da massa da crosta
terrestre) e o germânio, que são utilizados para a
confecção dos chips. Estes, cada vez menores, mais
complexos e eficientes, já são feitos também a partir
de diamantes (sintéticos), que são uma forma
alotrópica do carbono. No caso da memória de um
computador, os chips possuem a seguinte estrutura:
Conclui-se que, com relação à tabela periódica atual
dos elementos químicos, estão corretas:
a)
b)
c)
d)
e)
I e IV (apenas).
I e II (apenas).
II e III (apenas).
II e IV (apenas).
II e V (apenas).
04) (CESGRANRIO-RJ) Fazendo a associação entre as
colunas abaixo, que correspondem às famílias de
elementos segundo a tabela periódica, a sequência
numérica será:
1.
2.
3.
4.
5.
Como o auxílio das informações contidas no
enunciado e consultando a tabela periódica, julgue
os itens que se seguem.
(
(
(
(
(
( 0 ) Os símbolos químicos do silício e do fósforo são,
respectivamente, S e F.
Gases Nobres
Metais Alcalinos
Metais Alcalinos Terrosos
Calcogênios
Halogênios
) Grupo 1 A
) Grupo 2 A
) Grupo 6 A
) Grupo 7 A
) Grupo O
Lucas – Material Complementar de Química
1
a)
b)
c)
d)
e)
08) (UFSC-SC) Recentemente foi divulgada pela imprensa
a seguinte notícia: "Uma equipe de cientistas
americanos e europeus acaba de acrescentar dois
novos componentes da matéria à tabela periódica de
elementos químicos, anunciou o laboratório nacional
Lawrence Berkeley (Califórnia). Estes dois recémchegados, batizados elementos 118 e 116, foram
criados em abril num acelerador de partículas, através
do bombardeamento de objetivos de chumbo com
projéteis de criptônio, precisou o comunicado do
laboratório, do Departamento Americano de Energia.
A equipe que 'criou' os dois novos elementos é
composta de cientistas europeus e americanos".
1, 2, 3, 4, 5.
2, 3, 4, 5, 1.
3, 2, 5, 4, 1.
3, 2, 4, 5, 1.
5, 2, 4, 3, 1.
05) (UNITAU-SP) Um átomo X tem um próton a mais que
um átomo Y. Com base nesta informação, assinale a
alternativa correta.
a) Se Y for um gás nobre, X será um metal alcalino.
b) Se Y for um alcalino-terroso, X será um metal
alcalino.
c) Se Y for um gás nobre, X será um halogênio.
d) Se Y for um metal, X será um gás nobre.
e) Se Y for um gás nobre, X será um alcalino-terroso.
DIÁRIO CATARINENSE - 13/06/99.
Com base neste texto, assinale a(s) proposição(ões)
VERDADEIRA(S) de acordo com a classificação
periódica atual.
01) O elemento de número 116 será classificado
como pertencente à família dos halogênios.
02) O elemento de número 118 será classificado
como um gás nobre.
04) Os dois novos elementos pertencerão ao período
número 7.
08) O elemento chumbo utilizado na experiência é
representado pelo símbolo Pb.
16) O novo elemento de número 118 tem 8 elétrons
no último nível, quando na sua configuração
fundamental.
32) Esses dois novos elementos são caracterizados
como elementos artificiais, uma vez que não
existem na natureza.
06) (UFPR-PR) A respeito da classificação dos elementos
químicos na tabela periódica, é correto afirmar que:
01) o fato de os elementos de um mesmo grupo
apresentarem o mesmo número de elétrons na
camada de valência não faz com que suas
propriedades físico-químicas sejam semelhantes.
02) os elementos pertencentes a um mesmo período
estão dispostos, na tabela periódica atual, em
ordem crescente de número atômico. Cada
período se encerra quando o elemento apresenta
configuração eletrônica estável de gás nobre.
04) elementos de uma mesma família que
apresentam o mesmo número quântico principal
da camada de valência são chamados de
isóbaros.
08) todos os elementos que possuem configuração
eletrônica igual a ns1 na camada de valência são
chamados de metais alcalinos.
16) todos os elementos que possuem configuração
eletrônica igual a ns2 na camada de valência são
chamados de metais alcalino-terrosos.
32) no final de cada período, observam-se os
elementos que possuem pequena tendência à
reatividade química. Este comportamento reflete
a configuração da camada de valência com
octeto completo, ou 2 elétrons na primeira
camada.
09) (PUCCAMP-SP) A afirmação: “número de prótons –
número de elétrons = 2” é válida para os íons dos
elementos da tabela periódica que estão no grupo:
a) 1A
b) 2A
c) 3A
10) (UEL-PR) Os elétrons de um átomo são atraídos pelo
núcleo, sendo necessário fornecer energia para retirálos. A quantidade de energia necessária depende de
alguns fatores, como o número de prótons do núcleo,
o orbital onde se “localiza” o elétron, a presença de
outro elétron no mesmo orbital, etc. Quando o átomo
é neutro e o elétron a ser retirado é o de menor atração
nuclear, a energia necessária para retirá-lo é
denominada 1ª energia (ou 1º potencial) de ionização
(1ª EI ou 1º PI) ou simplesmente energia de ionização.
Os valores das energias de ionização, obtidos
experimentalmente, são algumas das informações
que os físicos e químicos utilizam para desenvolver
teorias a respeito da estrutura do átomo, sendo, por
isto, possível estabelecer uma relação entre os
potenciais de ionização e as configurações
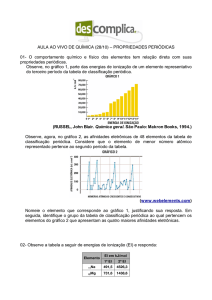
eletrônicas. O gráfico abaixo representa a variação da
energia de ionização para os elementos químicos de
números atômicos de 1 a 12.
07) (UEL-PR) Considere o texto a seguir.
"Os átomos de cloro, bromo e iodo têm o mesmo
número de ...X... na camada de valência e por isso
possuem propriedades ...Y... . Todavia não
apresentam mesma aparência. À temperatura
ambiente e sob pressão de 1atm, cloro é um gás
verde-amarelado, bromo é um ...Z... vermelho escuro
e iodo um sólido violeta."
Completa-se corretamente o texto, substituindo-se X,
Y e Z, respectivamente, por
a)
b)
c)
d)
e)
d) 6A
e) 7A
prótons, diferentes e gás.
elétrons, diferentes e líquido.
elétrons, semelhantes e líquido.
prótons, semelhantes e gás.
elétrons, semelhantes e gás.
Lucas – Material Complementar de Química
2
É errado afirmar que:
a) dentre os átomos anteriores, o átomo I tem o
maior potencial de ionização.
b) A perda de dois elétrons pelo átomo II leva à
formação do cátion Mg2+.
c) Dentre os átomos anteriores, o átomo III tem a
maior afinidade eletrônica.
d) O ganho de um elétron pelo átomo IV ocorre com
a liberação de energia.
e) O átomo IV é o mais eletronegativo.
14) (FCC-SP) Esta questão apresenta um texto com duas
lacunas, x e y. Escolha a alternativa que as completa
corretamente. Dentre os íons Na+ e Aℓ3+, o que possui
menor raio iônico é o íon [x]. A escolha, neste caso,
baseou-se na maior [y] do correspondente íon, pois
ambos possuem a mesma configuração eletrônica
1s2, 2s2, 2p6.
Relacionando o gráfico com a estrutura da tabela
periódica, é incorreto afirmar:
a) No gráfico estão representadas as energias de
ionização de alguns elementos de transição.
b) Os átomos de menor energia de ionização
pertencem ao grupo dos metais alcalinos.
c) Os átomos de maior energia de ionização
pertencem ao grupo dos gases nobres.
d) Os átomos de número atômico 1 e 2 pertencem ao
mesmo período da tabela periódica.
e) O 2º e o 3º períodos da tabela periódica começam
com elementos de baixa energia de ionização.
11) (EFOA-MG) Considere as afirmativas abaixo:
I.
II.
III.
IV.
a)
b)
c)
d)
e)
A primeira energia de ionização é a energia
necessária para remover um elétron de um
átomo neutro no estado gasoso.
A primeira energia de ionização do sódio é maior
do que a do magnésio.
Nos períodos da tabela periódica, o raio
atômico, sempre cresce com o número atômico.
A segunda energia de ionização de qualquer
átomo é sempre maior que a primeira.
a) A massa total do átomo está, praticamente,
concentrada no núcleo.
b) A perda de elétron pelo átomo neutro ocorre com
liberação de energia.
c) O ganho de dois elétrons leva à formação de um
íon negativo de raio maior que o do átomo neutro.
d) Os átomos de número de massa 18 têm 10
nêutrons.
e) Os núcleos dos átomos neutros são envolvidos
por oito elétrons.
II e III.
II e IV.
I, II, III e IV.
I e IV.
I e II.
16) (FESP-SP) Na equação:
12) (UFF-RJ) Analisando a classificação periódica dos
elementos químicos, pode-se afirmar que:
Na(g) + Energia → Na+(g) + elétron
a energia necessária é 5,13 eV (elétrons-volts). A
energia 5,13 eV é:
a) o raio atômico do nitrogênio é maior que o do
fósforo.
b) a afinidade eletrônica do cloro é menor que a do
fósforo.
c) o raio atômico do sódio é menor que o do
magnésio.
d) a energia de ionização do alumínio é maior que a
do enxofre.
e) a energia de ionização do sódio é maior que a do
potássio.
a)
b)
c)
d)
e)
energia livre.
energia de ativação.
1ª energia de ionização.
energia de ligação.
eletroafinidade.
17) (FEI-SP) As configurações eletrônicas no estado
fundamental dos átomos dos elementos E1, E2 e E3
são:
13) (ITA-SP) Dadas as configurações eletrônicas dos
seguintes átomos no seu estado fundamental:
I.
II.
III.
IV.
[y]
carga iônica
eletronegatividade
eletronegatividade
carga nuclear
carga nuclear
15) (UFMG-MG) Com relação a átomos de oxigênio,
todas as afirmativas estão corretas, exceto:
Dado: Z (O) = 8
São afirmativas corretas:
a)
b)
c)
d)
e)
[x]
Na+
Aℓ3+
Na+
Aℓ3+
Na+
E1. 1s2 2s2 2p6 3s1
E2. 1s2 2s2 2p6 3s2 3p5
E3. 1s2 2s2 2p6 3s2 3p6 4s1
1s2 2s2 2p6 3s2 3p6
1s2 2s2 2p6 3s2
1s2 2s2 2p6 3s2 3p6 4s1
1s2 2s2 2p6 3s2 3p5
A alternativa correta é:
Lucas – Material Complementar de Química
3
a) O elemento E2 tem maior raio atômico que o
elemento E1.
b) O elemento E1 tem maior potencial de ionização
que o elemento E3.
c) O elemento E3 tem maior afinidade eletrônica que
o elemento E2.
d) Os elementos E1 e E2 são metais e o elemento E3
é não-metal.
e) O elemento E3 e os íons E12 e E11 são
isoeletrônicos.
c)
d)
18) (FGV-SP) Indique, entre as equações abaixo, aquela
cuja energia envolvida mede, exclusivamente, a
afinidade eletrônica.
a)
b)
c)
d)
e)
Br−(aq) → ½ Br2(aq) + e−
½ Br2(ℓ) + e− → Br− (g)
Br(g) + e- → Br− (g)
½ Br2(g) + e- → Br− (g)
Br− (cristal) → ½ Br2 + e−
e)
19) (ITA-SP) Em relação ao tamanho de átomos e íons,
são feitas as afirmações seguintes:
I.
II.
III.
IV.
O Cℓ− (g) é menor do que o Cℓ(g)
O Na+(g) é menor do que o Na(g)
O Ca2+(g) é maior do que o Mg2+(g)
O Cℓ(g) é maior do que o Br(g)
21) (UEL-PR) Os gráficos I e II estão representando
aleatoriamente
os
7
elementos
químicos
representativos do 3º período e do 5º período da
tabela periódica respectivamente, sem os gases
nobres. O gráfico I mostra o tamanho dos átomos e
o gráfico II mostra a energia de ionização dos
átomos.
Das afirmações anteriores, estão corretas apenas:
a)
b)
c)
d)
e)
II.
I e II.
II e III.
I, III e IV.
II, III e IV.
20) (UFMG-MG) O gráfico energia (E) versus ordem de
ionização (OI), que representa corretamente a
ionização de um átomo isolado de carbono
(arrancados, sucessivamente, todos os seus
elétrons), é:
a)
b)
Lucas – Material Complementar de Química
4
Consultando a tabela periódica e comparando os
gráficos I e II, é CORRETO afirmar que estão na
mesma família ou grupo somente:
a)
b)
c)
d)
e)
08) C apresenta alta densidade.
16) F estabelece quatro ligações químicas.
25) (UEPG-PR) Os elementos químicos aqui designados
A, B, C e D apresentam os seguintes números e
massas atômicas.
Com base na tabela, que apresenta as temperaturas
de fusão e de ebulição dos compostos A‚, B‚, C‚ e D‚
assinale o que for correto.
Os átomos da posição Y nos gráficos I e II.
Os átomos da posição T nos gráficos I e II.
Os átomos da posição Z nos gráficos I e II.
Os átomos das posições M e D nos gráficos I e II.
Os átomos das posições G e H nos gráficos I e II.
22) (FEI-SP) Baseando-se nas configurações eletrônicas
em ordem crescente de energia dos elementos a
seguir, identifique a alternativa correta.
A.
B.
C.
D.
1s2 2s2 2p6 3s2 3p6 4s2
1s2 2s2 2p6 3s2 3p6 4s2 3d2
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f2
a) C e D estão no mesmo período da Tabela
Periódica.
b) A e C pertencem ao mesmo grupo, mas estão em
períodos diferentes.
c) A, B, C, D são todos metais alcalino-terrosos.
d) C é mais eletropositivo que A.
e) B e D são elementos de transição.
01) Os quatro elementos pertencem ao mesmo
grupo ou família da tabela periódica.
02) O número de massa representado por algarismo
decimal indica que nem todos os átomos deste
elemento químico apresentam o mesmo número
de nêutrons.
04) Os elementos citados são ametais.
08) O composto C‚ é um sólido de baixo ponto de
fusão.
16) O composto A‚ encontra-se no estado gasoso.
23) (UFSC-SC) Se examinarmos as propriedades físicas
e químicas dos elementos, à medida que seus
números atômicos vão crescendo, concluiremos
que:
01) O átomo de lítio é menor que seu íon Li+.
02) O átomo de telúrio (Te) possui um total de 6
(seis) níveis eletrônicos fundamentais.
04) O átomo de nitrogênio é menos eletropositivo
que o átomo de flúor.
08) Os átomos de todos os elementos com números
atômicos entre 19 e 30 possuem subníveis d
incompletos.
16) Os átomos de fósforo e nitrogênio possuem, na
última camada, a configuração: ns2 np3.
32) Os átomos dos elementos com números
atômicos 8, 10 e 18 têm 8 elétrons na última
camada.
26) (UFPR-PR) As bases da atual classificação periódica
foram estabelecidas em 1869 por Mendeleev, um
químico russo. Na época, nem todos os elementos
eram conhecidos; o mérito de Mendeleev foi deixar
espaços em branco, como o ocupado pelo elemento
X, na figura ao lado, prevendo a existência e, ainda
mais importante, as propriedades químicas
(posteriormente confirmadas) de alguns elementos
ainda desconhecidos naquela época. Atualmente o
elemento X é muito utilizado na tecnologia eletrônica.
24) (UEPG-PR) Com base na tabela periódica a seguir,
em que as letras representam elementos químicos,
assinale o que for correto.
Embora a classificação de Mendeleev tenha sofrido
algumas
modificações,
é
possível
prever
propriedades dos elementos químicos a partir da sua
posição na tabela periódica atual.
Por exemplo, com base na posição do elemento X na
tabela periódica representada parcialmente na figura,
é correto afirmar sobre esse elemento:
01) A, B, C, D e E são metais.
02) G e H apresentam elevada eletronegatividade.
04) O elétron mais energético de E está no subnível
5p1.
01) A configuração eletrônica da sua camada de
valência é 2s2 2p2.
Lucas – Material Complementar de Química
5
02) Seu caráter metálico é mais acentuado que o do
silício.
04) Seu núcleo contém um próton a mais que o
núcleo do gálio.
08) Sua eletronegatividade é menor que a do gálio e
maior que a do arsênio.
16) Sua energia de ionização é maior que a do
criptônio.
d) o elemento Z apresenta o maior potencial de
ionização entre eles.
e) os três elementos apresentam a mesma
eletroafinidade.
30) (PUCRS) Na coluna da esquerda estão relacionados
elementos químicos que podem ou não estar
relacionados às características apresentadas na
coluna da direita.
27) (UEPG-PR) Mediante consulta à tabela periódica,
assinale o que for correto sobre o elemento químico
que possui a configuração eletrônica:
1s2 2s2 2p6 3s2 3p6 4s2 3d4
1. bário
2. alumínio
3. enxofre
4. platina
01) É um elemento de transição cujos números
quânticos principal e secundário são,
respectivamente, 3 e 2.
02) Dentre todos os elementos situados em
períodos anteriores, é o que apresenta maior
densidade.
04) É um halogênio e situa-se no terceiro período da
tabela.
08) Trata-se de um elemento muito eletronegativo.
16) O número quântico magnético para o elétron
diferencial deste elemento é +1.
28) (UEL-PR) Considere as afirmações a seguir, acerca
da tabela periódica.
I.
Existem associações corretas somente em
a)
b)
c)
d)
e)
Na família 6A, a eletronegatividade aumenta de
cima para baixo.
Os números atômicos dos elementos químicos
aumentam da esquerda para a direita, nos
períodos.
Na família 1A, a energia de ionização aumenta
de baixo para cima.
A eletronegatividade aumenta da esquerda para
a direita, nos períodos.
Na família 7A, a temperatura de ebulição
aumenta de cima para baixo.
II.
III.
IV.
V.
1 - a; 2 - b; 3 - c; 4 - d.
1 - c; 2 - b; 3 - e; 4 - d.
1 - e; 2 - c; 3 - d; 4 - a.
1 - d; 2 - a; 3 - b; 4 - c.
1 - e; 2 - c; 3 - b; 4 - a.
GABARITO:
As afirmações corretas são em número de
a)
b)
c)
d)
e)
a. tem elevada densidade.
b. tem elevada energia de ionização.
c. pertence ao mesmo grupo do boro.
d. é elemento de transição.
e. é elemento alcalino-terroso
01)
02)
03)
04)
05)
06)
07)
08)
09)
10)
11)
12)
13)
14)
15)
16)
17)
18)
19)
20)
21)
22)
23)
24)
25)
26)
27)
28)
29)
30)
5
4
3
2
1
29) (UFRGS-RS) Considere três elementos químicos,
designados como X, Y e Z, que apresentam a
distribuição de seus elétrons descrita abaixo.
X-2881
Y - 2 8 18 4
Z - 2 8 18 8
Com base nessa distribuição e nas propriedades
periódicas, é incorreto afirmar que:
a) os três elementos se localizam no mesmo
período.
b) o elemento Y é o mais eletronegativo entre eles.
c) o elemento X apresenta seus elétrons distribuídos
em quatro níveis de energia.
Lucas – Material Complementar de Química
6
C
F, F, F, V.
C
B
A
34
C
62
B
A
D
E
C
D
B
C
B
C
C
A
A
E
16
31
23
06
19
B
E
E