COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
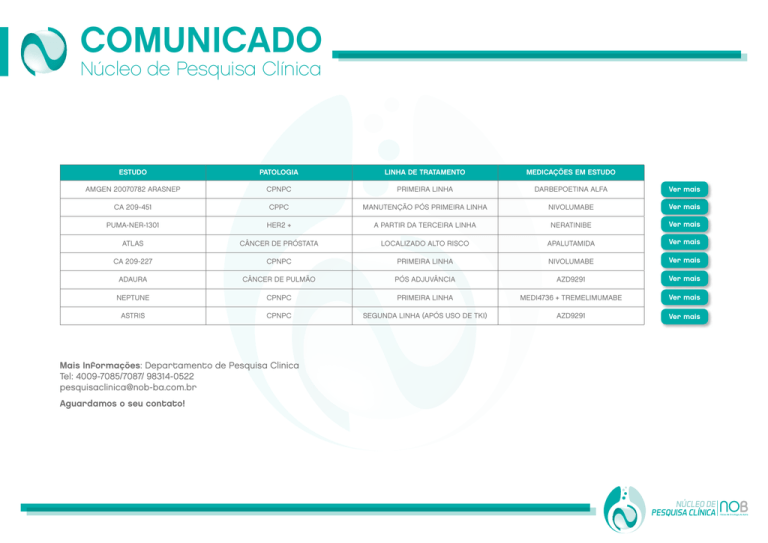
ESTUDO
PATOLOGIA
LINHA DE TRATAMENTO
MEDICAÇÕES EM ESTUDO
AMGEN 20070782 ARASNEP
CPNPC
PRIMEIRA LINHA
DARBEPOETINA ALFA
Ver mais
CA 209-451
CPPC
MANUTENÇÃO PÓS PRIMEIRA LINHA
NIVOLUMABE
Ver mais
PUMA-NER-1301
HER2 +
A PARTIR DA TERCEIRA LINHA
NERATINIBE
Ver mais
ATLAS
CÂNCER DE PRÓSTATA
LOCALIZADO ALTO RISCO
APALUTAMIDA
Ver mais
CA 209-227
CPNPC
PRIMEIRA LINHA
NIVOLUMABE
Ver mais
ADAURA
CÂNCER DE PULMÃO
PÓS ADJUVÂNCIA
AZD9291
Ver mais
NEPTUNE
CPNPC
PRIMEIRA LINHA
MEDI4736 + TREMELIMUMABE
Ver mais
ASTRIS
CPNPC
SEGUNDA LINHA (APÓS USO DE TKI)
AZD9291
Ver mais
Mais Informações: Departamento de Pesquisa Clinica
Tel: 4009-7085/7087/ 98314-0522
[email protected] Aguardamos o seu contato!
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 1: AMGEN 20070782: ARASNEP - PULMÃO
“Estudo randomizado, duplo cego e controlado por placebo para avaliação da segurança e eficácia à longo prazo de 500 µ de darbepoetina alfa administrados
a cada 3 semanas em sujeitos anêmicos com câncer de pulmão de células não pequenas em estágio avançado recebendo quimioterapia multicíclica”.
Investigadora Principal: Dra. Clarissa Mathias
Critérios de Inclusão
• Sujeitos com NSCLC estágio IV (não recidivante ou recidivamente ou restadiamento);
• Expectativa de receber pelo menos 2 adicionais (pelo menos um total de 6 semanas) de quimioterapia clínica mielossupressora de primeira linha após a
randomização. Não deve-se esperar que os sujeitos recebam apenas quimioterapia de manutenção;
• Valor de hemoglobina menor ou igual 11,0 g/dL conforme avaliado pelo laboratório local.
Critérios de Exclusão
• Qualquer terapia adjuvante ou neo-adjuvante anterior recebida para NSCLC;
• Sujeitos com histórico de metástase cerebral;
• Infecção sistêmica clinicamente significativa ou doença inflamatório crônica não controlada;
• Saturação de transferrina < 20% e ferrina < 50 ng/Ml.
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 2: CA 209-451 - PULMÃO
Randomizado, Multicêntrico, duplo cego, de nivolumabe, nivolumabe combinado com ipilimumabe, ou placebo como terapia de manutenção em indivíduos com
câncer de pulmão pequenas células em estádio extenso (ED-SCLC) após conclusão de qumioterapia de primeira linha a base de platina.
Investigadora Principal: Dra. Clarissa Mathias
Critérios de Inclusão
• Indivíduos com câncer de pulmão pequenas células em estádio extenso documentado por histologia ou citologia;
• Resposta contínua de doença estável ou melhora após 4 CICLOS de quimioterapia de primeira linha à base de platina;
• Capacidade Funcional (OS) pelo Eastern Cooperative Oncology Group (ECOG) 0 ou 1.
Critérios de Exclusão
• Indivíduos com Metástases no Sistema Nervosos Central não tratados são excluidos;
• Indivíduos com doença auto-imune ativa, conhecida ou suspeita são excluídos;
• Todos os eventos adversos relacionados a terapia anticarcinogênica prévia devem estar resolvidos para Grau 1 ou nível basal.
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 3: PUMA-NER-1301 - MAMA
NALA um estudo de Neratinibe mais capecitabina Versus Lapatinibe e Capecitabina em doentes com câncer da mama HER2+ metastático , que receberam
dois ou mais regimes de HER2 no contexto metastático (NALA).
Investigadora Principal: Dra. Luciana Landeiro
Critérios de Inclusão
• Histologicamente confirmada MBC, atual estágio IV;
• Superexpressão de HER2 documentada ou tumor de gene amplificado (imuno-histoquímica IHC 3+ ou IHC 2+ com fluorescência de confirmatória de
hibridação in situ (FISH +);
• Ter recebido tratamento prévio com pelo menos dois ( 2 ) regimes direcionados para o HER2 para o câncer de mama metastático.
Critérios de Exclusão
• Receberem terapia anterior com capecitabina, Neratinibe, lapatinibe ou qualquer outro inibidor da tirosina quinase direcionada ao HER2. Metástases
ativas sintomática no Sistema Nervosos Central;
• Metástases cerebrais sintomáticas ou instáveis;
• Te recebido radioterapia ≤ 14 dias antes do início dos produtos em investigação.
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 4: ATLAS - PRÓSTATA
“Estudo de Fase 3, Randomizado, duplo cego, controlado por placebo de JNJ-56021927 em participantes da pesquisa com câncer de próstata localizado ou
localmente avançado de alto risco recebendo tratamento com radioterapia primária”.
Investigadora Principal: Dr. André Bacellar
Critérios de Inclusão
• Adenocarcinoma de uma próstata intacta com confirmação histológica e 1 dos seguintes no diagnóstico:
Pontuação de Gleason ≥ 8 e ≥ cT2c, Pontuação de Gleason ≥ 7, PSA ≥ 20 ng/mL e ≥ cT2c;
• Indicação e planejamento para receber RT primária para câncer de próstata;
• Índice de Comorbidade de Charlson (CCI) ≤ 3;
• ECOG - Grupo Cooperativo de Oncologia do Leste (Eastern Cooperative Oncology Group) grau 0 ou 1.
Critérios de Exclusão
• Presença de metástase distante, incluindo doença nodal pélvica abaixo da bifurcação ilíaca > 2 cm no eixo curto;
• Tratamento prévio com um análogo do GnRH ou um antiandrógeno ou ambos por > 3 meses antes da randomização;
• Orquiectomia bilateral;
• Histórico de radiação pélvica;
• Tratamento prévio sistêmico (ex.: quimioterapia) ou de procedimento (ex.: prostatectomia, crioterapia) para câncer de próstata;
• Tratamento prévio com agentes radiofarmacêuticos (ex.: estrôncio-89) ou imunoterapia(ex.: sipuleucel-T);
• Tratamento prévio com glicocorticoides sistêmicos ≤ 4 semanas antes da randomização ou previsão de necessidade do uso prolongado de corticosteroides
durante o estudo;
• Uso de inibidores da 5-α redutase (ex.: dutasterida, finasterida) ≤ 4 semanas antes da randomização;
• Tratamento prévio ou atual com medicamentos antiepilépticos para o tratamento de convulsões;
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 5: CA 209-227 - PULMÃO
CA209-227 estudo aberto, Randomizado, Fase 3 de Nivolumabe, ou Nivolumabe mais Ipilimumabe, versus quimioterapia combinada à base de platina em
indivíduos virgens de quimioterapia com câncer de pulmão não pequenas células (NSCLC) estádio IV ou recorrente.
Investigadora Principal: Dr. Clarissa Mathias
Critérios de Inclusão
• Pacientes com NSCLC estádio IV ou recorrente, histologicamente confirmado de histologia escamosa ou não escamosa, sem nenhuma terapia oncológica
sistêmica anterior administrada como terapia primária para doença avançada ou metastática;
• Os pacientes devem ter teste de PD-L1 por imuno-histoquímica (IHC), com resultados, realizado pelo laboratório central durante o período de triagem;
• Capacidade Funcional ECOG ≤ 1;
• Doença mensurável por TC ou RM segundo os critérios RECIST1.1;
• Doença mensurável de acordo com os critérios RECIST 1.1.
Critérios de Exclusão
• Pacientes com Metástases no Sistema Nervosos Central não tratados são excluidos;
• Indivíduos com doença auto-imune ativa, conhecida ou suspeita são excluídos;
• Qualquer teste positivo para vírus da hepatite B ou vírus da hepatite C ou vírus da imunodeficiência humana (HIV) indicando infecção aguda ou crônica.
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 6: ADAURA - PULMÃO
Estudo de Fase 3, duplo cego, randomizado, controlado por Placebo, Multicêntrico para avaliar a eficácia e a segurança de AZD9291 versus Placebo em pacientes com Carcinoma
Pulmonar de Células não pequenas em estádio IB-IIIA com mutação positiva do receptor do fator de crescimento Epidérmico, após ressecção completa do Tumor com ou sem
Quimioterapia Adjuvante.
Investigadora Principal: Dr. Clarissa Mathias
Critérios de Inclusão
• Diagnóstico histologicamente confirmado de câncer de pulmão de células não pequenas (NSCLC) primário com histologia predominantemente não escamosa;
• A confirmação pelo laboratório central de que o tumor contém uma das 2 mutações de EGFR comuns, conhecidas por estarem associadas à sensibilidade do TKI do EGFR
(Ex19del, L858R), isolada ou em combinação com outras mutações de EGFR, incluindo T790M;
• A ressecção cirúrgica completa do NSCLC primário é obrigatória. Toda doença macroscópica deve ter sido removida ao final da cirurgia. Todas as margens cirúrgicas da
ressecção devem ser negativas em relação ao tumor. A ressecção pode ser realizada por técnicas de cirurgia aberta ou Cirurgia Torácica Vídeo-Assistida (CTVA);
• Recuperação completa da cirurgia e terapia pós-operatória padrão (se aplicável) no momento da randomização. O tratamento não pode ter início dentro de 4 semanas
após a cirurgia. No máximo 10 semanas podem ter transcorrido entre a cirurgia e a randomização para pacientes que não receberam quimioterapia adjuvante; no máximo
26 semanas podem ter transcorrido entre a cirurgia e a randomização para pacientes que receberam quimioterapia adjuvante;
• Recuperação completa da cirurgia e terapia pós-operatória padrão (se aplicável) no momento da randomização. O tratamento não pode ter início dentro de 4 semanas
após a cirurgia. No máximo 10 semanas podem ter transcorrido entre a cirurgia e a randomização para pacientes que não receberam quimioterapia adjuvante; no máximo
26 semanas podem ter transcorrido entre a cirurgia e a randomização para pacientes que receberam quimioterapia adjuvante;
• Classificação como estágio IB, II ou IIIA como base do critério patológico. Classificação será realizada em acordo com o sistema TNM (7ª edição);
• Homens e Mulheres, acima de 18 anos de idade.
Critérios de Exclusão
• Radioterapia pré-operatória, pós-operatória ou planejada para o câncer de pulmão atual;
• Quimioterapia a base de platina pré-operatória (neoadjuvante) ou outra quimioterapia;
• Qualquer terapia anticâncer prévia, incluindo terapia em investigação, para o tratamento de NSCLC, exceto quimioterapia dupla adjuvante a base de platina padrão pósoperatória;
• Tratamento anterior com TKI do EGFR neoadjuvante ou adjuvante;
• Pacientes que foram submetidos apenas a segmentectomias ou ressecções em cunha.
• Cirurgia de grande porte (inclusive cirurgia primária do tumor, exceto inserção de acesso vascular) dentro de 4 semanas da primeira dose da droga em estudo;
• Histórico de outras malignidades, exceto câncer de pele não melanoma tratado adequadamente, câncer in-situ tratado curativamente ou outros tumores sólidos
tratados curativamente sem nenhuma evidência da doença por > 5 anos após o fim do tratamento e que, na opinião do médico responsável pelo tratamento, não
apresentam um risco substancial de recidiva da malignidade prévia.
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 7: NEPTUNE - PULMÃO
Um Estudo Fase III, Global, Multicêntrico, Aberto, Randomizado de Medicação a Ser Usada em Combinação com Terapia de Outra Medicação a Ser Usada
Versus Tratamento Padrão de Quimioterapia à Base de Platina em Tratamento de Primeira Linha em Participantes da Pesquisa com Câncer de Pulmão de
Células Não Pequenas Metastático ou Avançado (NSCLC) (NEPTUNE).
Investigadora Principal: Dr. Clarissa Mathias
Critérios de Inclusão
• Pelo menos 18 anos de idade;
• Evidência documentada de câncer de pulmão de células não pequenas estágio IV;
• Os participantes da pesquisa precisam ter tumores sem ativação de mutação de EGFR ou de rearranjo de ALK;
• Sem quimioterapia anterior ou qualquer outra terapia sistêmica para o Câncer de Pulmão de Células Não Pequenas avançado ou metastático;
• Condição de desempenho da Organização Mundial da Saúde (OMS)/Eastern Cooperative Oncology Group (ECOG) de 0 ou 1.
Critérios de Exclusão
• Histologia mista de câncer pulmonar de células pequenas e de células não pequenas;
• Metástase cerebral ou compressão da medula espinhal; salvo se assintomático, tratado e estável sem esteroides;
• Exposição prévia à terapia mediada por sistema imunológico incluindo, mas não limitada a, outros anticorpos antiCTLA-4, antiPD-1, antiPD-L1 ou antiPD-L2,
excluindo vacinas anticâncer terapêuticas;
• Doença inflamatória intestinal ativa ou anteriormente documentada (por ex: doença de Crohn, colite ulcerativa).
COMUNICADO
Núcleo de Pesquisa Clínica
Núcleo de Oncologia da Bahia
Voltar para primeira página
ESTUDO 8: ASTRIS - PULMÃO
Estudo clínico, Multinacional, Multicentro, Estudo de tratamento em mundo real de agente único AZD9291 para pacientes com receptor de fator de
crescimento epidérmico avançado/metastático T790, mutação positiva de células de câncer de pulmão não pequenas (NSCLC) que receberam terapia prévia
com inibidor tirosina quinase do EGFR ( EGFR-TKI)
Investigadora Principal: Dr. Clarissa Mathias
Critérios de Inclusão
• NSCLC com EGFRm localmente avançado ( estádio IIIB) ou metastático ( estádio IV), não suscetível à radioterapia ou cirurgia curativa, com confirmação
da presença da mutação T 790M;
• Terapia anterior com um EGFR _ TKI. Os pacientes também podem ter recebido linhas de tratamento adicionais.
Critérios de Exclusão
• Tratamento ( dentro de 6 meses) ou atual com AZD9291;
• Pacientes que atualmente recebem (ou que são incapazes de interromper o uso ao menos 1 semana antes de receberem a primeira dose de AZD9291)
qualquer tratamento conhecido como um potente inibidor ou indutor do citocromo P450 ( CYP) 3ª4;
• Paciente com metástases e sintomáticos no sistema nervoso central ( SNC) que é neurologicamente instável ou que exigiu doses crescentes de
esteroides para controlar os sintomas no SNC nas 2 semanas anteriores ao início da administração de AZD9291.
Mais Informações: Departamento de Pesquisa Clinica
Tel: 4009-7085/7087/ 98314-0522
[email protected]