Bacteriologia Alimentar – Parte 2
Resumo dos procedimentos a adoptar para Pesquisa de Patogénicos
Pesquisa de patogénicos dos alimentos (1ª parte):
- Cocos Gram +: Staphylococcus aureus
- Bacilo Gram +: Listeria monocytogenes
- Bacilos gram negativos: Salmonella/Yersinia
•
Os agentes patogénicos existem em reduzido nº. nos alimentos ao contrário das amostras biológicas
usadas na clínica; estão em menos proporção face ao resto da flora normal do alimento ,logo,
requer passos de enriquecimento;
• Staphylococcus aureus
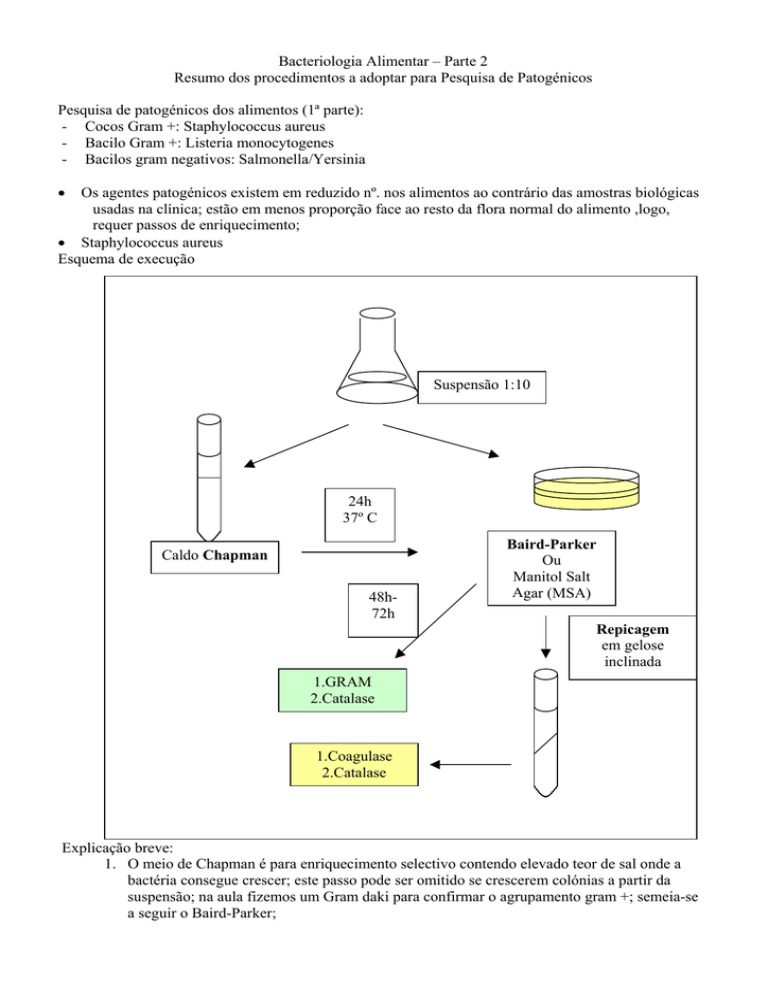
Esquema de execução
Suspensão 1:10
24h
37º C
Caldo Chapman
48h72h
Baird-Parker
Ou
Manitol Salt
Agar (MSA)
Repicagem
em gelose
inclinada
1.GRAM
2.Catalase
1.Coagulase
2.Catalase
Explicação breve:
1. O meio de Chapman é para enriquecimento selectivo contendo elevado teor de sal onde a
bactéria consegue crescer; este passo pode ser omitido se crescerem colónias a partir da
suspensão; na aula fizemos um Gram daki para confirmar o agrupamento gram +; semeia-se
a seguir o Baird-Parker;
2. O meio de Baird-Parker é selectivo (isolamento) e serve para identificação pois contem
emulsão de gema de ovo(ver fotocópias da
constituição do meio); a presença de telurito faz
com que a bactéria tome coloração escura e por ter
capacidade proteolítica cria um halo; das colónias
características procede-se ao Gram (cocos G+) e à
catalase (+); este meio, inoculado directamente a
partir da suspensão, permite fazer a contagem das
colónias caracteristicas (ler norma 4196/1992);A
partir destas colónias suspeitas faz-se a
confirmação;
3. A confirmação é feita semeando uma gelose inclinada (sem selectividade) com as colónias
características; a execução da coagulase e o seu resultado positivo confirma a bactéria; as
contagens são de placas entre 15 e 150 colónias características ou não (ler bem as normas de
pesquisa e contagem de S. aureus).
•
Listeria
Esquema de execução
Suspensão 1:10
Pré-enriquecimento
Tampão Fosfato
21 dias
4º C
Caldo Fraser
48h35ºC(?)
PALCAM
OXFORD
1.GRAM
2.Catalase
3.Colónia com depressão
Teoricamente, isolava-se em meio não selectivo e partia para provas bioquímicas /API
Explicação breve
1. Os produtos suspeitos de terem listeria podem ser sujeitos a um pré-enriquecimento a 4ºC
, visto a bactéria crescer a esta temperatura; na aula usou-se o tampão Fosfato a 4ºC
(teoricamente podia usar-se o caldo de fraser a meia potência, ou seja, com metade dos
constituintes selectivos); este pré-enriquecimento aumenta a carga bacteriana, ou seja, o
nº. de base do agente sem aplicar selectividade significativa;
2. Após isto faz-se sementeira em caldo de fraser (de coloração dourada); este caldo vai ser
usado para enriquecimento
selectivo do agente patogénico(
contém uma elevada quantidade
de sal na sua composição, que
limita o crescimento de outras
bactérias; é diferencial por
conter esculina + citrato férrico
e que a listéria é capaz de
degradar e gerar coloração
tipicamente negra; o meio
contém cloreto de lítio que
inibe enterococos, que também
hidrolisam esculina; assim
evitamos falsos positivos ); a
partir do caldo de fraser
fizemos na aula o gram para
vermos a morfologia tipica em
bastonete da listeria e a sua
positividade ao Gram!
3. Semeia-se agora o meio de
Palcam(avermelhado) e o meio
de Oxford, meios para se fazer
o isolamento da bactéria, ambos
os meios evidenciam a hidrólise
da esculina; ao apreciarmos bem as colónias vemos que elas têm tipicamente uma
depressão central; a partir de uma dessas colónias suspeitas vamos fazer uma
confirmação com um gram (+) e uma catalase (+); era possível em gelose-sangue ver-se
uma B-hemólise mas não vimos na aula; a partir daki faríamos um API para
identificação.
• Yersinia
Esquema de execução
Suspensão 1:10
Pré-enriquecimento
Tampão Fosfato
vários dias
4º C
vários dias
4º C
MacConkey
(passo
alternativo?usamos o
outro!)
Yersinia agar
1.Kligler
2.ONPG
3.API
Explicação breve
1. A bactéria cresce a 4ºC e daí de fazer um pré enriquecimento em tampão fosfato a 4ºC; como
se sabe não á aplicada selectividade a não ser a relacionada com a temperatura;
2. Vamos depois cultivar num meio diferencial : MacConkey ou Yersinia agar; nós usamos o
segundo, mas podíamos esperar
colónias no MacConkey amarelas,
não
fermentadoras
da
lactose(imagem); no nosso caso,
como usamos o meio diferencial e
selectivo Yersinia agar vamos ter
outro
tipo
de
resultados
e
completamos
de
outra
maneira com testes de
açucares; o meio em questão
tem manitol
na sua
constituição e o indicador
vermelho neutro; como a
bactéria fermenta o manitol,
vão originar-se colónias
típicas
vermelhas
fermentadoras do manitol.
3. A partir destas colónias para se proceder à sua identificação vai proceder-se ao
kligler para confirmar se são realmente LAC (-), ou seja o kligler fica amarelo no
fundo e com a rampa vermelha; posteriormente faz-se o teste de ONPG que deve
dar positivo, uma vez que a bactéria não é um fermentador fenotípico da lactose
mas produz B-galactosidase, tendo portanto uma mutação a nível das permeases. Findos estes
testes partimos para o API que será inoculado a partir do kligler.
• Salmonella
Esquema de execução
Suspensão 1:10
Água peptona Tamponada
18h
37ºC (?)
Ressuscitação
Água peptona Tamponada
0,1 ml
Enriquecimento
selectivo
Caldo
RappaportVassiliadis
43ºC
24h
Caldo
Selenito
37ºC
24h
SS agar
XLD agar
1.TSI
2.APP
3.SIM
4.Ureia
Explicação breve
1 ml
1. A slmonella geralmente está presente em reduzido nº. nos alimentos e quando sujeitas ao
processamento do alimento diminuem a sua viabilidade; faz-se o processo de ressuscitação para
aumentar essa viabilidade pois em água peptona tamponada cresce tudo e bem;
2. parte-se para o enriquecimento selectivo em dois meios líquidos: o RV e o selenito; no 1º, vamos
inocular 100 ul e este meio tem na sua constituição verde de malaquite
(meio azulado-fica creme após incubação) que impede o crescimento de
outras bactérias (enterobacteriaceae); tem sal que a bactéria suporta bem
e é um meio com pH relativamente baixo; estes factores favorecem o
crescimento desta bactéria; por sua vez o caldo de selenito (incolor(1) –
fica tijolo(2)-imagem), inoculado com 1 ml, contém cisteína que é
utilizada apenas por bactérias cuja capacidade redóx o permite e contém
selenito que inibe outras bactérias de crescer.
3. Passamos abgora para cada caldo a fazer o isolamento em meio sólido
em dois meios simultaneamente: meios SS e XLD. Em ambos os meios
vamos ter colónias típoicas com um centro escuro(por causa do H2S) e
uma pequena borda branca. O meio de SS contém verde brilhante e sais
biliares que inibe o crescimento de outas bactérias; tem tiossulfato e
citrato férrico que põe em evidência a formação de H2S pela bactéria; o
meio de XLD tem xilose e lisina, substratos específicos que só algumas
SS Medium
bactérias usam e também permitem a
visualização de uma coloração negra com a
produção de H2S.
4. Após estarmos em presença das colónias suspeitas vamos fazer 4 provas bioquímicas para
confirmar a presença da salmonella (a partir da placa)e despistar de outras bactérias semelhantes:
Prova
TSI
APP
SIM
UREASE-caldo
•
O TSI – é semelhante ao Kligler ams também contém sacarose; a nossa bactéria é Lac(-) e Sac(-)
(ao contrario do proteus que é Sac+)e poratnto no TSI vai deixar o meo vermelho na rampa; é
GLU (+) mas não se vê pois é também H2S (+) como evidenciado anteriormente nos meios
sólidos;
•
O APP – pesquisa a fenilalanina desaminase e não deve dar verde após adicionar cloreto férrico,
pois a nossa bactéria é negativa a este teste; se desse positivo estaríamos perante um Proteus;
O SIM – evidencia a produção de H2S, deve dar negativo ao indol (Erlich) e deve apresentar
mobilidade (embora desse reduzida na aula, não sei se era ausente); este é apenas um teste de
complemento, não diz nada por si só;
Urease - teste feito em caldo num eppendorf e que era amarelinho e daria cor de cereja no caso
de dar positivo; deu negativo pois a salmonella é urease (-)
•
•
5. Após todos estes testes concordantes (ou a maioria) dever-se-ia fazer a classificação serológica
usando antisoros específicos (não confundir com reacção de Widal, que é uma pesquisa de Ac no
plasma)
Nesta segunda parte pesquisamos o B.cereus (bacilo Gram + aeróbio e pode esporular) e C.
Perfringens (anaeróbio esporulado de gram variável).
Enquanto que as outras bactérias exigiam enriquecimento e eram poucos mas relevantes
petogenicamente, aqui, só um nº. elevado é patogenicamente significativo – logo faz-se pesquisa
directa sem enriquecimento!
•
Clostridium perfringens: é um anaeróbio estrito e portanto há que criar condiçoes adequadas; a
metodologia é simples e por isso não tenho em esquema de execução.
1. A partir da nossa amostra (suspensão 1:10) faz-se cultura por incorporação em meio
TSC (triptose, sulfite, cicloserin) colocando
1ml de amostra e 10 ml de meio; faz-se a
seguir um Overlay com mais 10 ml de meio;
incuba-se em anaerobiose – Gás pack ou saco
gerador de anaerobiose (saquinho para
pequenas quantidades).
2. Da incubação neste meio resultam colónias
típicas negras (sulfito redutoras); se se fizesse
contagem seria feita aqui;
3. Provas bioquímicas: meio semisólito – nitratos
e mobilidade – averigua-se mobilidade e
produção de nitritos (com uso de reagentes) –
o resultado deve ser imóvel e nitritos (+); O outro meio contém lactose e gelatina – se
virar para amarelado dará Lac(+) devido ao vermelho de fenol; se o meio que era semisólido ficar líquido, significa que há gelatinase presente; a nossa bactéria é gelatinase
(+) e Lac(+);
4. Realização da coloração dos esporos: esfregaço seco – fixar pelo calor – fuchsina
concentrada e aquecer por 15 minutos – lava e seca – aplica película de nigrosina – seca
e observa fundo escuro, célula transparente e esporo corado de rosa!
•
Bacillus cereus
1. vamos semear por dispersão 100 ul em meio de B. Cereus(verde alface) e incubação a
30ºC, para os outros bacillus seria a 37ºC;
2. após incubação temos colónias esbranquiçadas com bordos franjados e o meio aparece
azul porque não há fermentação do manitol e além disso precipita e hidrolisa a lecitina
– coloração azul. A contagem é feita neste meio segundo a norma vigente;
3. Execução de Gram, execução da coloração das granulações lipídicas – faz-se esfregaço
– negro do sudão 15’ – seca e depois descora com xilol (hotte); lava e aplica Fuchsina
diluída e deixa actuar – lava e seca – As granulações aparecem negras e o bacilo rosa!