Sociedade Brasileira de Química (SBQ)
Efeito sinérgico do sulfito e do nitrito na inibição da corrosão do aço
carbono 1020 em meio de NaCl 3,5%.
Archimedes Fortes(PG), Amanda Da Silva Cardoso(PG), Adriana N. Correia (PQ), Pedro De Lima
1*
Neto (PQ)
1 Universidade Federal Do Ceará, Departamento de Química Analítica e Físico-Química
*[email protected]
Palavras Chave: Aço carbono 1020, Inibidores de corrosão, Sulfito de sódio, Nitrito de sódio.
Uma solução muito utilizada industria para
combater a corrosão metálica é a do uso de
inibidores de corrosão. Entre os inúmeros inibidores
utilizados, o nitrito (NaNO2) aparece como sendo
um promissor inibidor inorgânico para aço carbono,
produzindo uma barreira de óxido na superfície do
1
material , com baixa toxicidade e boa aceitação
2
ambiental . Uma alternativa como inibição da
atividade corrosiva seria a remoção do oxigênio
dissolvido no material, proporcionado pelo sulfito
3
(Na2SO3), o qual reduz o processo catódico . Assim,
este trabalho objetiva estudar a inibição da corrosão
do aço carbono 1020 em meio de NaCl 3,5% por
misturas de concentrações variadas nitrito e sulfito.
0,59 a 0,08V e uma corrente de passivação de
-5
-2
7,83x10 A cm . Curvas de polarização, obtidas em
meio desaerado contendo nitrito, apresentaram um
intervalo de passivação é menor que aquelas
obtidas com nitrito e sulfito adicionado ao meio.
1E-3
1E-4
I(A)/cm2
Introdução
NaCl 0,6M + Na2SO3 1,5M
NaCl 0,6M + Na2SO3 1M
NaCl 0,6M + Na2SO3 0,1M
1E-5
NaCl 0,6M + Na2SO3 0,01M
NaCl 0,6M + Na2SO3 0,001M
NaCl 0,6M + Na2SO3 0,0001M
Resultados e Discussão
Foi utilizada uma célula eletroquímica composta por
um eletrodo de trabalho de aço carbono 1020, com
2
área circular exposta de 0,882cm , eletrodo auxiliar
de platina e eletrodo de referência de Ag/AgCl.
Foram preparadas concentrações de Na2SO3 de 10
4
a 1,5 M em meio de NaCl 3,5%. Os gráficos de
potencial de circuito aberto revelaram que o
aumento da concentração de Na2SO3 desloca os
potenciais para valores mais negativos em relação
ao branco. Isso se deve a remoção do oxigênio
pelos íons sulfito. Esta suposição foi confirmada
deslocamento do potencial de corrosão obtidas da
curva de polarização do aço carbono em NaCl
3,5%, na ausência dos inibidores e desaerado. A
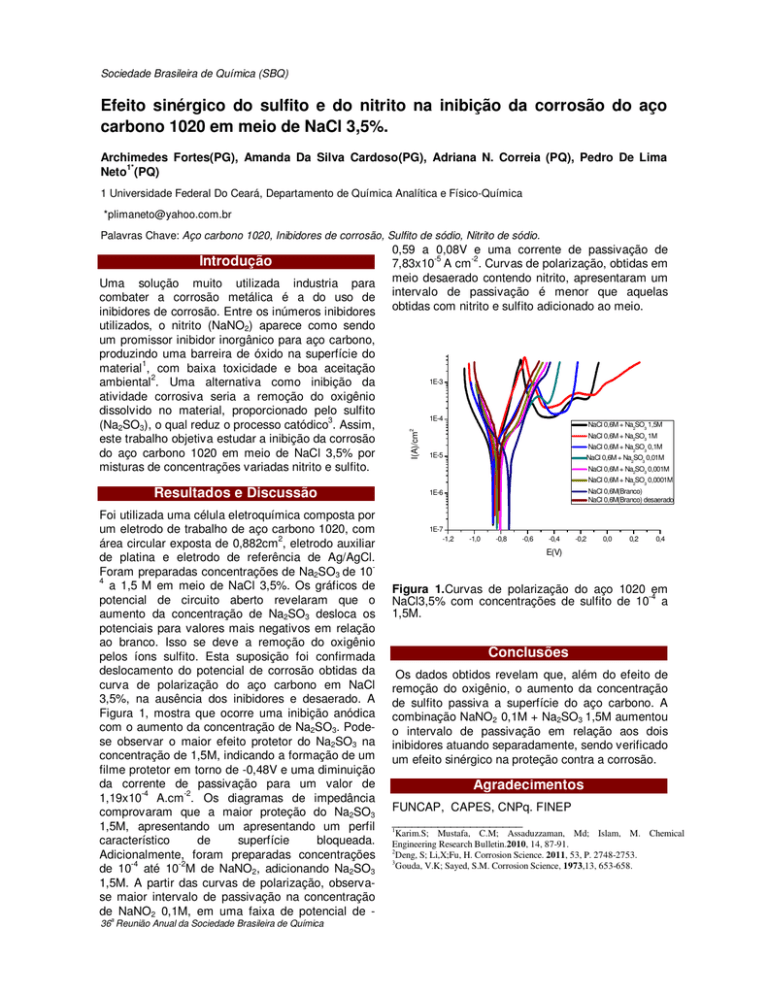
Figura 1, mostra que ocorre uma inibição anódica
com o aumento da concentração de Na2SO3. Podese observar o maior efeito protetor do Na2SO3 na
concentração de 1,5M, indicando a formação de um
filme protetor em torno de -0,48V e uma diminuição
da corrente de passivação para um valor de
-4
-2
1,19x10 A.cm . Os diagramas de impedância
comprovaram que a maior proteção do Na2SO3
1,5M, apresentando um apresentando um perfil
característico
de
superfície
bloqueada.
Adicionalmente, foram preparadas concentrações
-4
-2
de 10 até 10 M de NaNO2, adicionando Na2SO3
1,5M. A partir das curvas de polarização, observase maior intervalo de passivação na concentração
de NaNO2 0,1M, em uma faixa de potencial de a
36 Reunião Anual da Sociedade Brasileira de Química
NaCl 0,6M(Branco)
NaCl 0,6M(Branco) desaerado
1E-6
1E-7
-1,2
-1,0
-0,8
-0,6
-0,4
-0,2
0,0
0,2
0,4
E(V)
Figura 1.Curvas de polarização do aço 1020 em
-4
NaCl3,5% com concentrações de sulfito de 10 a
1,5M.
Conclusões
Os dados obtidos revelam que, além do efeito de
remoção do oxigênio, o aumento da concentração
de sulfito passiva a superfície do aço carbono. A
combinação NaNO2 0,1M + Na2SO3 1,5M aumentou
o intervalo de passivação em relação aos dois
inibidores atuando separadamente, sendo verificado
um efeito sinérgico na proteção contra a corrosão.
Agradecimentos
FUNCAP, CAPES, CNPq. FINEP
____________________
1
Karim.S; Mustafa, C.M; Assaduzzaman, Md; Islam, M. Chemical
Engineering Research Bulletin.2010, 14, 87-91.
2
Deng, S; Li,X;Fu, H. Corrosion Science. 2011, 53, P. 2748-2753.
3
Gouda, V.K; Sayed, S.M. Corrosion Science, 1973,13, 653-658.