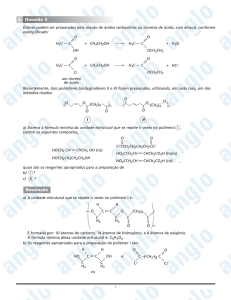
Heterocíclicos e
Coenzimas_________________________________________________________________1
11.. Introdução
Compostos heterocíclicos podem ser definidos como aqueles que contém
um anel no qual pelo menos um dos átomos não seja o carbono.
A diversidade estrutural possível desses compostos, aliadas a sua
abundância e a importância dos processos químicos e bioquímicos dos quais
participam faz com que recebam um olhar e interesse especial dos químicos
sintéticos.
Os compostos heterocíclicos são componentes essenciais dos ácidos
nucleicos, de enzimas e coenzimas, e respondem por parte significativa dos
fármacos atualmente comercializados, agroquímicos, corantes, produtos naturais,
dentre outros.
Consideraremos neste trabalho algumas coenzimas que funcionam como
transportadores transitórios de elétrons e grupos funcionais específicos como
grupos acil (tab.1.1). As coenzimas são ativadores de várias enzimas, por isso são
indispensáveis no metabolismo dos seres vivos.
Algumas enzimas, para serem ativadas, não requerem algum grupo
químico além do seu resíduo de aminoácido, porém outras requerem
componentes químicos chamados de cofatores. Um cofator pode ser um ou mais
íons inorgânicos (como Fe2+, Mg2+, Mn2+ e Zn2+) ou uma molécula orgânica
complexa( metalorgânica) denominada coenzima.
Muitas vitaminas, nutrientes orgânicos necessários em pequenas
quantidades na alimentação diária dos animais superiores, são precursores das
coenzimas, pois apresentam em sua estrutura adenina nucleotídeo ou parte da
estrutura das coenzimas. As vitaminas servem para quase as mesmas funções em
todas as formas de vida, mas os animais superiores perderam a capacidade de
sintetizá-las. Podem ser classificadas segundo sua solubilidade em água
Heterocíclicos e
Coenzimas_________________________________________________________________2
(vitaminas hidrossolúveis) ou em solventes apolares (vitaminas lipossolúveis).
As vitaminas hidrossolúveis são a vitamina C e uma série conhecida como o
complexo das vitaminas B (fig.1.1).
O
O
-
C CH2
CH2
O
C
H
H
CH3
N
C
C C CH2OH
O
OH CH3
+
N
H
Nicotinato
(niacina)
Pantotenato
CH2OH
HO
H3C
CH2OH
H
O
+
N
H
Pirodoxina
(Uma das formas da vitamina B6)
N
H3C
H3C
N
H
Fig.1.1-Estrutura de algumas vitaminas hidrossolúveis
N H
N
CH2
H
C OH
H
C OH
H
C OH
O
Riboflavina
(vitamina B2)
CH2OH
A série de vitaminas B é de componentes de coenzimas (tab.1.1). Por
exemplo, a riboflavina (vitaminaB2) é um precursor do FAD, e o
pantotenato(vitamina B3) é um componente da coenzima A.
As vitaminas lipossolúveis não são coenzimas, assim como a vitamina C
que é hidrossolúvel não é, porém a ação destas moléculas é bem conhecida. Estas
moléculas lipossolúveis são designadas pelas letras A, D, E e K e também são
muito importantes para os animais.
O-
Heterocíclicos e
Coenzimas_________________________________________________________________3
Trataremos neste trabalho das coenzimas abaixo mostrando suas
estruturas, sua importância para os animais superiores e algumas aplicações na
química.
Flavina adenina dinucleotídeo (FAD) e flavina mononucleotídeo
(FMN).
Nicotinamida-adenina dinucleotídeo (NAD+) e nicotinamidaadenina dinucleotídeo fosfato (NADP+).
Coenzima A (CoA).
Exemplos de alguns grupos
Coenzima
químicos funcionais
Precursor dietético em
transferidos
mamíferos
Tiamina pirofosfato
Aldeídos
Tiamina (vitamina B1)
Flavina adenina
Elétrons
Riboflavina (vitamina B2)
Íon hidreto (:H-1)
Ácido nicotínico (niacina)
Grupos acila
Ácido pantotênico mais
dinucleotídeo
Nicotinamida adenina
dinucleotídeo
Coenzima A
outras moléculas
Pirtodoxal fosfato
Grupos amino
Piridoxima (vitamina B6)
5’-desoxiadenosil-
Átomos de hidrogênio e
Vitamina B12
cobalamina(coenzimaB12)
grupos alquila
Biocitina
CO2
Biotina
Tetrahidrofolato
Unidades monocarbônicas
Folato
Tabela 1.1- Algumas coenzimas que funcionam como transportadoras de grupos funcionais,
elétrons ou de átomos específicos.
Heterocíclicos e
Coenzimas_________________________________________________________________4
22.. Transportadores universais de elétrons.
A maioria das células possui enzimas que catalisam a oxidação de
centenas de compostos diferentes, catalisam a transferência de elétrons retirados
dos seus substratos em uns poucos tipos de transportadores universais de
elétrons. Os nucleotídeos NAD+, NADP+, FMN e FAD são cofatores
hidrossolúveis que sofrem oxidações e reduções reversíveis em muitas das
reações de transferência de elétrons do metabolismo. Sua redução em processos
catabólicos resulta na conservação da energia livre liberada pela oxidação do
substrato. NAD+ e NADP+ movem-se facilmente de uma enzima para outra,
porém FMN e FAD são fortemente ligados às enzimas, chamadas de
flavoproteínas, para as quais eles servem como grupos prostéticos. Serão
descritas algumas características químicas dos cofatores nucleotídeos e de certas
enzimas (desidrogenases e flavoproteínas) que os empregam.
ii.. O NADH e o NADPH
A nicotinamida adenina dinucleotídeo (NAD+ na forma oxidada) e seu
análogo nicotinamida adenina dinucleotídeo fosfato (NADP+ na forma oxidada)
são compostos de dois nucleotídeos unidos através de grupos fosfato, por uma
ligação de anidrido de ácido fosfórico (fig.1.2). Como seus anéis de nicotinamida
lembram a piridina esses compostos são chamados de nucleotídeos de piridina. A
porção nicotinamida é fornecida para
H
a síntese dos nucleotídeos de piridina
O
NH2
pela vitamina niacina.
+
N
Ambas as coenzimas sofrem
O
-
redução
reversível
nicotinamida(fig.1.3).
do
NAD+
O
anel
e
NADP+ recebe um íon hidreto(:H-, o
equivalente de um próton e dois
P
O
-
O P
O
CH2
NH2
O H
H
OH
OH
O
O
N
N
O
CH2
H H
OH
N
N
Adenina
H
H Fig.2.1 R=HNADH
OR
R=fosfatoNADPH
Heterocíclicos e
Coenzimas_________________________________________________________________5
elétrons) com a oxidação do substrato(desidrogenação) e, é transformada na sua
forma reduzida(NADH e NADPH). O segundo H+ removido do substrato é
liberado para o solvente aquoso. A meia reação para cada nucleotídeo é :
NAD+ + 2e- NADH + H+
NADP+ + 2e- NADPH + H+
Mais de 200 enzimas são conhecidas por catalisar reações nas quais NAD+
ou NADP+ aceita um íon hidreto do mesmo substrato reduzido ou doam um íon
hidreto para o substrato oxidado. O nome geral para enzimas deste tipo é
H
H O
C NH2
H
O
NH2
íon hidreto
H:. .
+
N
O
-
O
P
O
-
O P
O
CH2
NH2
O H
OH
O
O
ou
H
OH
N
N
O
CH2
N
H O
C NH2
H
N
. .
H H
OH
H
H
A
N
Fig.2.2 R=HNADH
R=fosfatoNADPH
N
B
OR
oxidorredutase (veja alguns exemplos na tab.1.2), são também comumente
chamadas de desidrogenases.
NADPH difere de NADH por sua hidroxila 2’ da parte adenosina ser
esterificada com fosfato. NADPH transporta elétrons da mesma maneira que
NADH. Porém, é usado quase que exclusivamente para biossínteses redutivas,
enquanto NADH é usado primariamente para produção de ATP. O grupamento
fosfato extra no NADPH é o que distingue este agente redutor pelas enzimas de
biossíntese.
Quando NAD+ ou NADP+ é reduzido, o íon hidreto pode, em princípio,
ser transferido para qualquer lado do anel de nicotinamida: o lado frontal (A) ou
Heterocíclicos e
Coenzimas_________________________________________________________________6
o lado posterior (B) como representado na fig. 1.3. Os estudos com substratos
marcados isotopicamente demonstraram a estereoespecificidade destas reações e
que uma dada enzima catalisa um ou outro tipo de transferência, mas não os dois.
Por exemplo, a álcool desidrogenase de levedura e a lactato desidrogenase do
coração de vertebrados transferem o íon hidreto dos seus respectivos substratos
para o mesmo lado do anel da nicotinamida. Elas são classificadas como
desidrogenases do tipo A, para distingui-las do outro grupo de enzimas que
reduzem o NAD+ pela transferência do hidreto para o outro lado do anel (B)
(tab.1.2). A estereoespecificidade na transferência de hidreto em desidrogenase é
uma conseqüência da assimetria do sítio ativo(fig.1.4).
Especificidade
estereoquímica para o
Enzima
Cofator
anel da nicotinamida
(A ou B)
NAD+
A
NAD+
B
desidrogenase
NADP+
B
Malato desidrogenase
NAD+
A
NAD+ ou NADP+
B
desidrogenase
NAD+
B
Lactato desidrogenase
NAD+
A
Álcool desidrogenase
NAD+
A
Isocitrato desidrogenase
-cetoglutarato
desidrogenase
Glicose-6-fosfato
Glutamato desidrogenase
Gliceraldeído-3-fosfato
Tab 2.1- Desidrogenases que empregam NAD+ ou NADP+ como cofatores.
Heterocíclicos e
Coenzimas_________________________________________________________________7
Devido a excelente especificidade estereoquímica das reações que
Fig. 2.3
envolvem estes cofatores, os mesmos são usados na química em reduções e
oxidações em que se deseja obter centros quirais. Várias reações já são
conhecidas, como por exemplo a redução de cetonas a álcoois quirais1, usando
microorganismos como Saccharomyces cerevisiae em fermentações, que devido
as enzimas e os cofatores produzidos pela célula são capazes de promover
reduções mesmo em moléculas que não fazem parte do metabolismo das células.
A associação entre uma dada desidrogenase e o NAD ou NADP é
relativamente fraca; o cofator difunde facilmente da superfície de uma dessas
enzimas para outra, atuando como um transportador hidrossolúvel de um
substrato metabólico para outro.
Esses
cofatores
funcionam
cataliticamente,
sendo
repetidamente
reciclados sem que ocorra uma mudança líquida na concentração de NAD+ +
NADH. Por exemplo, na produção de álcool durante a fermentação da glicose
por células de levedura, um íon hidreto é removido do gliceraldeído-3-fosfato
para uma enzima (gliceraldeído-3-fosfato desidrogenase) e transferido para o
NAD+. O NADH assim produzido deixa então a superfície da enzima e difundese para outra enzima, a álcool desidrogenase, com transferência de um íon
1
aa)) J. B. Jones, Tetrahedron, 1986, 42(13), 3351
Heterocíclicos e
Coenzimas_________________________________________________________________8
hidreto do NADH para o acetaldeído, produzindo o etanol, como ilustrado a
baixo:
(1)
Gliceraldeído-3-fosfato + NAD+
3-fosfatoglicerato + NADH + H+
Acetaldeído + NADH + H+
(2)
Soma: Gliceraldeído-3-fosfato
etanol + NAD+
3-fosfoglicerato + etanol
iiii.. FADH2 e o FMNH2
As flavoproteínas (tab.2.2) são enzimas que catalisam reações de
oxidação-redução usando a flavina mononucleotídeo (FMN) ou flavina adenina
nucleotídeo (FAD) como cofatores (fig.2.4). São derivados da vitamina
riboflavina(B2) (fig.1.1). A estrutura fundida em anel de flavina nucleotídeo (o
anel da isoaloxazina) sofre redução reversível, recebendo de um substrato
reduzido um ou dois elétrons na forma de átomo de hidrogênio(elétron + próton);
as formas reduzidas são abreviadas por FADH2 e FMNH2. Quando flavina
nucleotídeo totalmente oxidado
NH2
N
N
e
O
-
O
OH
do
anel
da transferência tanto de um
como de dois elétrons, envolvem-
OH
se numa diversidade de reações
c
CH2
maior
HCOH
b
semiquinona
isoaloxazina (fig.2.5). Como as
N
H
O
d
forma
flavoproteínas podem participar
H
H H
O P O-
N
O
CH2
O P O
aceita um elétron, é produzida a
que
as
desidrogenases
ligadas ao NAD.
HCOH
HCOH
a
CH2
H3C
N
H3C
N
Fig. 2.4- a) riboflavina; b) FMN;
c) FAD;
d) D-ribitol; e) AMP- adenosina monofosfato
N
O
N
O
H
Heterocíclicos e
Coenzimas_________________________________________________________________9
Em muitas flavoproteínas, a flavina nucleotídeo está ligada de maneira
muito forte à parte protéica e, em algumas enzimas como a desidrogenase
succínica, esta ligação é covalente. Esses cofatores firmemente ligados são
chamados de grupos prostéticos. Eles não transportam elétrons por difundirem-se
de uma enzima para outra; antes, eles fornecem uma maneira pela qual a
flavoproteína pode reter temporariamente enquanto catalisa a transferência deles
de um substrato redutor para um receptor de elétrons. Uma característica
importante das flavoproteínas é variabilidade no potencial de redução padrão da
flavina nucleotídeo a elas ligado; a associação firme entre a enzima e o grupo
prostético confere ao anel da flavina um potencial redução típico de uma
flavoproteína específica, algumas vezes muito diferente da flavina nucleotídeo
livre. As flavoproteínas são, em geral, muito complexas; algumas têm, em adição
à flavina nucleotídeo, íons inorgânicos firmemente ligados(ferro ou molibdênio,
por exemplo) capazes de participar da transferência de elétrons.
Flavina
Enzima
nucleotídeo
Acil-CoA graxo desidrogenase
FAD
Diidrolipoil desidrogenase
FAD
Succinato desidrogenase
FAD
-glicerofosfato desidrogenase
FAD
NADH desidrogenase
FMN
Glicolato desidrogenase
FMN
Tab. 2.2- Algumas enzimas (flavoproteínas) que empregam coenzimas da flavina.
Heterocíclicos e
Coenzimas_________________________________________________________________10
R
H3C
N
H3C
N
N
O
N
H
O
Forma oxidada FADou FMN
+ +H , e
_ H+ , eR
R
H3C
H3C
N
N
N
O
N
.
H
pKa ~
= 8,4
H3C
N
H3C
¨_
N
N
.
O
N
H
O
Anion semiquinona
H
O
Forma semiquinona
+ +H ,e
R
H
H3C
N
N
H3C
N
O
N
H
H
O
Forma reduzida FADH2 ou FMNH2
Fig. 2.5- formação da forma semiquinona
do anel de isoaloxasina
iiiiii.. Coenzima A (CoA)
A coenzima A é outra molécula central no metabolismo. Em 1945, Fritz
Lipmann descobriu que um cofator termo estável era necessário a muitas
acetilações catalisadas por enzimas. Esse cofator foi denominado coenzima A
(CoA), com o A significando acetilação. Foi isolada, e sua estrutura foi definida
alguns anos após. A elucidação desta importante coenzima conferiu a Lipmann o
Heterocíclicos e
Coenzimas_________________________________________________________________11
Nobel em fisiologia ou medicina de 1953. Podemos dividir sua estrutura em 2
partes(fig.2.6), 4-fosfopantotênico(unidade de -mercapto-etilamina + unidade
de pantotenato(derivado da vitamina B3, ác. pantotênico(fig.1.1)) e 3’,5’ADP(adenosina difosfato).
A unidade de ADP é que confere a CoA a afinidade e especificidade a
algumas enzimas. Em transporte de acil proteínas, o 4-fosfopantotênico está
ligado covalentemente ao grupo hidroxil da serina.
As funções da CoA são duas:
(a)
ativação de grupo acila para transferência por ataque nucleofílico.
(b)
ativação do hidrogênio- do grupo acila para abstração de um
próton.
SH
A sulfidrila terminal na CoA é o
CH2
-mercaptoetilamina
CH2
local
C
denominado acil CoA.
CH2
A transferência de acila
NH
com acil-CoA para um nucleófilo
C
O
é
CHOH
C
para
P
um
formado
NH2
P
O
N
N
O
a
éster
de
oxigênio
pela
abstração
do
hidrogênio- é estabilizado por
ressonância(fig.2.8) A hidrólise
N
CH2
N
O
H
H
que
éster são ácidos e o carbânio
O
O
O
favorável
(fig2.7).Os hidrogênios- do tio
O
-
mais
transferência de um grupo acil
Pantotenato
CH3
CH2
O
acila
tio éster. O derivado resultante é
O
CH2
-
Radicais
ligam-se à CoA por uma ligação
NH
H3C
reativo.
H
O
-2
PO3
OH
um
tio
termodinamicamente
H
3
de
Fig.-2.6
éster
é
mais
favorável do que a de um éster
Heterocíclicos e
Coenzimas_________________________________________________________________12
com oxigênio porque o caráter de dupla ligação da ligação C
não se estende significativamente para a ligação C
O.
S. Consequentemente a acil-
CoA tem um alto potencial de transferência de acetila. A acetil CoA carreia um
radical acetila ativado da mesma maneira que o ATP carreia uma fosforila
ativada. As duas propriedades da acil-CoA são evidenciadas na reação cetotiolase (fig.2.9).
O
CoA S C CH3
_
RY:
R
H
O
_
CoA S
+
RY C CH3
Fig.- 2 .7 : transferência de acila com
acil-CoA para um nucleófilo.
R
O
CH C SC o A
+
B:H
+
O
R
_CH C SC o A
H
C C
_
O
C oA
Ânion enolato
B:
Fig.-2 .8: abstração do H-
O
H
C SC o A
CH2
B : H+
+
_CH2
O
R
C SC o A
H
C C
_
O
C oA
B:
H3C C SC o A
O
O
O
H3C C
O
C SC o A
CH2
+
_
C o AS
CH2
C SC o A
H3C C SC o A
_O
Fig.-2 .9: reação
-cetolase. Esta
reação evidencia
as propriedades
da acetil-CoA.
Heterocíclicos e
Coenzimas_________________________________________________________________13
33.. Bibliografia
“Princípios de Bioquímica”, Lehninger, A. L.; Nelson, D. L.; Cox, M. M; 2a
edição. Sarvier Editora de Livros Médicos Ltda. 1995.
“Bioquímica” ; Stryer, L.; 3a edição. Editora GUANABARA KOOGAN.
1988.
“Biocheistry”; Garret, R. H.; Grisham, C. M.; edição internacional. Saunders
College Publising. 1995
“Biotransformation in organic chemistry A textbook”; Faber, K. Berlin,
Springer. 1997.