Simulado Livre do dia 13/08. Gepê. Obs: A interdisciplinar é a 4
1. Para identificar quatro soluções aquosas, A, B, C e D, que podem ser soluções de hidróxido
de sódio, sulfato de potássio, ácido sulfúrico e cloreto de bário, não necessariamente nessa
ordem, foram efetuados três ensaios, descritos a seguir, com as respectivas observações.
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas
a amostra de B se tornasse rosada.
II. A solução rosada, obtida no ensaio I, tornou-se incolor pela adição de amostra de A.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com
amostras de D.
Com base nessas observações e sabendo que sulfatos de metais alcalino-terrosos são pouco
solúveis em água, pode-se concluir que A, B, C e D são, respectivamente, soluções aquosas
de
a) H2SO4, NaOH, BaCℓ2 e K2SO4.
b) BaCℓ2, NaOH, K2SO4 e H2SO4.
c) NaOH, H2SO4, K2SO4 e BaCℓ2.
d) K2SO4, H2SO4, BaCℓ2 e NaOH.
e) H2SO4, NaOH, K2SO4 e BaCℓ2.
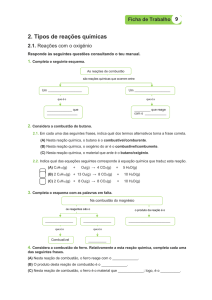
2. Nas condições ambientes, assinale a opção que contém apenas óxidos neutros.
a) NO2, CO e Aℓ2O3
b) N2O, NO e CO
c) N2O, NO e NO2
d) SiO2, CO2 e Aℓ2O3
e) SiO2, CO2 e CO
3. O composto representado pela fórmula SiO2, também conhecido como sílica, é matéria-
prima para a obtenção
I. do silício empregado em semicondutores;
II. dos diversos tipos de vidros;
III. das vitaminas solúveis em gorduras.
É correto o que se afirma em
a) I, apenas.
b) II, apenas.
c) III, apenas.
d) I e II, apenas.
e) I, II e III.
4. Nos últimos três anos, mais 120 mil veículos passaram a circular na cidade de Salvador,
que não tem monitoramento de poluentes emitidos para a atmosfera, exigido para municípios
com mais de 500mil habitantes. A medida é recomendada pela FIFA para a Copa de 2014.
Estudos apontam para queima de combustíveis fósseis como principal fonte poluidora, a
exemplo do diesel, o maior emissor de material particulado e de compostos poluentes.
Partículas com diâmetros menores que 2,5 micrômetros, 2,5 106 m , passam diretamente
dos pulmões para a corrente sanguínea, o que afeta a saúde da população. A partir dessas
informações, é correto concluir:
a) Os veículos automotores, a gasolina, não emitem NO2 g e NO(g) misturados aos gases
de escapamento.
b) O diesel é uma mistura de hidrocarbonetos de cadeias menores que as encontradas na
gasolina.
c) Os gases de escapamento dos veículos automotores movidos a diesel estão isentos de
SO2 g e de NO2 g .
d) As partículas de fuligem emitidas para a atmosfera, durante a combustão incompleta de
diesel, formam um aerossol sólido.
e) A fumaça preta emitida pelos escapamentos de caminhões e de ônibus não é nociva ao
organismo porque, além de conter CO(g), possui partículas maiores que 0,0025mm de
diâmetro.
5. O hidrogênio vem sendo considerado um possível substituto dos combustíveis altamente
poluentes de origem fóssil, como o dodecano, utilizado na aviação.
Sabe-se que, sob condições-padrão, as entalpias de combustão do dodecano e do hidrogênio
molecular são respectivamente iguais a −7500 e −280 kJ.mol-1. Dados: C = 12; H = 1.
A massa de hidrogênio, em gramas, necessária para gerar a mesma quantidade de energia
que a gerada por 1 g de dodecano equivale a:
a) 0,157
b) 0,315
c) 0,471
d) 0,630
e) 0,527
6.
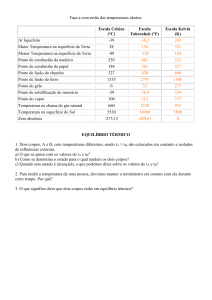
MM (g/mol)
Entalpia padrão de
combustão, ΔHº kJ
Metano CH4
16
- 889,5
Butano CH4H10
58
- 2 893,8
O gás metano, produzido a partir da fermentação anaeróbica do lixo orgânico, e o gás butano,
proveniente do gás natural liquefeito de petróleo, são utilizados na geração de energia a partir
da combustão.
De acordo com essas considerações, é correto afirmar:
a) O gás natural é uma fonte de energia renovável.
b) A energia liberada na combustão do butano é transformada diretamente em energia elétrica.
c) A combustão de 22,4L de gás metano produz menor quantidade de energia que a de igual
volume de gás butano, nas CNTP.
d) A energia produzida na combustão de 1,0g do gás butano é maior do que a produzida por
igual massa de gás metano nas mesmas condições.
e) O gás carbônico, CO2 (g) , produzido a partir da combustão do metano, proveniente dos
aterros sanitários, não apresenta toxidez e não contribui para o efeito estufa.
Gabarito:
Resposta da questão 1:
[E]
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas
a amostra de B (NaOH; base forte) se tornasse rosada.
II. A solução rosada (básica), obtida no ensaio I, tornou-se incolor pela adição de amostra de A
(H2SO4 - solução ácida); temos uma neutralização.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com
amostras de D.
H2SO4(aq) (A) + BaCℓ2 (D) BaSO4 + 2HCℓ(aq)
K2SO4(aq) (C) + BaCℓ2 (D) BaSO4 + 2KCℓ(aq)
Resposta da questão 2:
[B]
Óxidos neutros são formados por ametais e na temperatura ambiente são gasosos. Os mais
comuns são o monóxido de carbono (CO), óxido nítrico (NO) e o óxido nitroso (N2O).
Eles não reagem com água, nem com ácidos, nem com bases. Mas podem participar de outras
reações.
Resposta da questão 3:
[D]
O SiO2 é empregado na fabricação de vidros, semicondutores e na fabricação do cimento
Portland.
Resposta da questão 4:
[D]
Análise das alternativas:
a) Incorreta: os veículos automotores, a gasolina sem catalisador adequado, emitem NO2 g e
NO(g) misturados aos gases de escapamento, devido às possíveis reações entre o N2 e O2
presentes na atmosfera e no interior do motor.
b) Incorreta: o diesel é uma mistura de hidrocarbonetos de cadeias maiores que as
encontradas na gasolina.
c) Incorreta: os gases de escapamento dos veículos automotores movidos a diesel não estão
isentos de SO2 g e de NO2 g , devido ao enxofre (presente no diesel) que reage com o
gás oxigênio e às possíveis reações entre o N2 e O2 presentes na atmosfera e no interior
do motor.
d) Correta: as partículas de fuligem emitidas para a atmosfera, durante a combustão
incompleta de diesel, formam um aerossol sólido.
e) Incorreta: a fumaça preta emitida pelos escapamentos de caminhões e de ônibus é nociva
ao organismo porque, além de conter CO(g), possui partículas menores que 0,0025 mm (
2,5.106 m ) de diâmetro.
Resposta da questão 5:
[B]
Teremos:
1C12H26 + 18O2 12CO2 + 12H2O
H = −7500 kJ/mol
170 g ------------------------------------------------ 7500 kJ
1 g ------------------------------------------------ x kJ
x = 44,12 kJ
H2 + ½ O2 H2O
H = −280 kJ/mol
2 g --------------------------------------------- 280 kJ
m ---------------------------------------------- 44,12 kJ
m = 0,315 g
Resposta da questão 6:
[C]
Análise das alternativas:
a) Incorreta: o gás natural não é uma fonte de energia renovável.
b) Incorreta: a energia liberada na combustão do butano não é transformada diretamente em
energia elétrica, pois pode ser utilizada para vaporizar água. O vapor de água pode
movimentar turbinas.
c) Correta: a combustão de 22,4 L de gás metano produz menor quantidade de energia que a
de igual volume de gás butano, nas CNTP: