FARMACOCINÉTICA
A relação entre a administração de um fármaco, a evolução temporal de sua distribuição
e a magnitude da concentração obtida em diferentes regiões do corpo é denominada
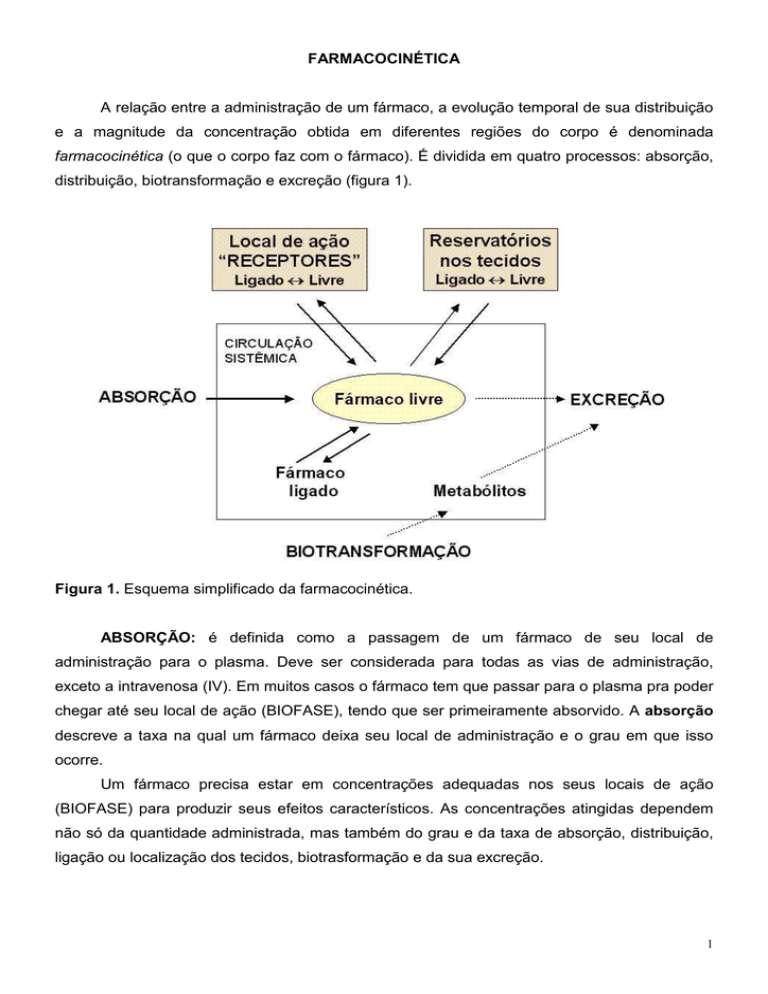
farmacocinética (o que o corpo faz com o fármaco). É dividida em quatro processos: absorção,
distribuição, biotransformação e excreção (figura 1).
Figura 1. Esquema simplificado da farmacocinética.
ABSORÇÃO: é definida como a passagem de um fármaco de seu local de
administração para o plasma. Deve ser considerada para todas as vias de administração,
exceto a intravenosa (IV). Em muitos casos o fármaco tem que passar para o plasma pra poder
chegar até seu local de ação (BIOFASE), tendo que ser primeiramente absorvido. A absorção
descreve a taxa na qual um fármaco deixa seu local de administração e o grau em que isso
ocorre.
Um fármaco precisa estar em concentrações adequadas nos seus locais de ação
(BIOFASE) para produzir seus efeitos característicos. As concentrações atingidas dependem
não só da quantidade administrada, mas também do grau e da taxa de absorção, distribuição,
ligação ou localização dos tecidos, biotrasformação e da sua excreção.
1
Os dois processos fundamentais que determinam a concentração de um fármaco em
dado momento e numa região qualquer do corpo são:
-
translocação de moléculas de fármacos
-
transformação química de moléculas de fármacos (BIOTRANSFORMAÇÃO)
Translocação das moléculas de drogas: as moléculas de fármacos movem-se pelo corpo
de duas maneiras:
-
por transferência através de fluxo de massa (pela corrente sangüínea)
-
por transferência difusional (molécula por molécula, por curtas distâncias)
Na transferência por fluxo de masssa, a natureza química do fármaco é desprezível.
O sistema cardiovascular constitui um sistema de distribuição por longas distâncias muito
rápido para todos os solutos, independente da sua natureza química.
Do ponto de vista farmacocinético, o que distingue um fármaco de outro são suas
características difusionais, especialmente sua capacidade de atravessar barreiras não-aquosas
à difusão, constituídas de membranas celulares que separam os diversos compartimentos
aquosos do corpo (plasma, líquido intersticial, líquido intracelular e líquido transcelular). A
difusão aquosa ocorre naturalmente como parte do mecanismo geral de transporte de
fármacos, pois é este processo que distribui moléculas de fármacos de e para as barreiras nãoaquosas. A taxa de difusão de uma substância depende principalmente de seu tamanho
molecular; assim, as grandes moléculas difundem-se mais lentamente que as pequenas. O que
determina onde e por quanto tempo um fármaco vai estar presente no corpo após ter sido
administrado é o movimento entre compartimentos, que envolve geralmente a penetração de
barreiras não-aquosas à difusão.
Fatores físico-químicos na transferência dos fármacos através das membranas:
Uma vez que a absorção, distribuição, biotransformação e excreção de um fármaco são
feitas através das membranas celulares, é essencial observar os mecanismos pelos quais os
fármacos atravessam as membranas e as propriedades físico-químicas das moléculas e das
membranas que influenciam essa transferência. São características importantes de um
fármaco:
-
tamanho e o formato da molécula
-
solubilidade no local de absorção
-
grau de ionização
-
lipossolubilidade relativa das formas ionizada e não-ionizada
2
As barreiras ente os compartimentos aquosos no corpo são constituídas de membranas
celulares e é óbvio que o fármaco precisa atravessar a membrana plasmática para penetrar em
uma célula. Uma camada única de membrana separa os compartimentos intra e extracelular.
Uma barreira epitelial, como a mucosa do trato gastrointestinal (TGI) ou um túbulo renal,
consiste em uma camada de células firmemente unidas uma às outras, de modo que as
moléculas têm que atravessar duas camadas de membrana para passar de um lado para outro.
O endotélio vascular é mais complicado; os capilares são fenestrados em muitos tecidos,
sendo as lacunas entre as células suficientemente grandes para possibilitar que moléculas
pequenas atravessem por difusão aquosa, mas demasiadamente pequenas para possibilitar a
passagem de moléculas com peso molecular superior a 30 KDa (a maioria das moléculas de
proteínas).
Em alguns órgãos, especialmente SNC e placenta o endotélio é contínuo e a penetração
de moléculas de fármacos envolve a passagem através da membrana celular endotelial, o que
torna esses leitos vasculares bem diferentes daqueles de outros órgãos e têm grandes
conseqüências farmacocinéticas.
Apesar dessas diferenças estruturais, a difusão e o transporte de fármacos através
dessas fronteiras têm características comuns, visto que, em geral, os fármacos passam através
das células e não entre elas. Assim, a membrana celular representa uma barreira comum.
Membrana celular:
A membrana celular consiste em uma camada dupla de lipídeos anfipáticos (moléculas
que apresentam em uma as extremidades afinidade pela água, definida como cabeça
hidrofílica, e na outra extremidade estruturas hidrofóbicas, denominadas cauda apolar), com
suas cadeias de hidrocarbonetos orientadas para dentro, formando uma fase hidrofóbica
contínua, e suas cabeças hidrófilas voltadas para fora. Cada molécula de lipídeo na camada
dupla pode movimentar-se no sentido lateral, conferindo à membrana fluidez, flexibilidade,
grande resistência elétrica e relativa impermeabilidade a moléculas altamente polares. As
proteínas da membrana embutidas na camada dupla servem como receptores que
proporcionam vias de sinalização elétricas ou químicas e alvos seletivos para as ações das
drogas.
3
Figura 2. A célula.
Figura 3. Modelos propostos de membrana celular (Gorter e Grendel (1925): biomembranas
com bicamadas lipídicas; Danielli e Davdson (1935): acrescentava a sobre a
bicamada lipídica de algumas membranas proteínas globulares; Robertson (1961):
microscopia eletrônica – conceito de unidade de membrana: bicamada lipídica
encontra-se entre camadas compactas de proteínas; Singer e Nicolson (1972):
modelo do mosaico fluído – proteínas encontram-se inseridas na bicamada
lipídica).
4
Em geral, são quatro as maneiras pelas quais moléculas pequenas atravessam
membranas celulares:
-
difusão através do lipídio
-
difusão através dos poros aquosos (filtração)
-
transporte mediado por carreadores (difusão facilitada ou transporte ativo)
-
pinocitose
Entre essas, a difusão através do lipídio e o transporte mediado por transportadores são
particularmente importantes.
Difusão através de lipídeos: as substâncias não-polares dissolvem-se livremente em
solventes não-polares, como os lipídeos, penetrando, portanto muito facilmente as membranas
celulares por difusão simples ou passiva (figura 4) seguindo um gradiente de concentração em
virtude de sua solubilidade na camada lipídica. Essa transferência é diretamente proporcional à
grandeza do gradiente de concentração através da membrana e ao coeficiente de partição
lipídeo: água do fármaco. Quanto maior o coeficiente, maior a concentração do fármaco na
membrana e mais rápida sua difusão. A concentração de um fármaco não-eletrolítico livre é
igual em ambos os lados da membrana depois que se atinge um estado de equilíbrio. Há uma
estreita relação entre a solubilidade em lipídios e a permeabilidade de membrana celular a
diferentes substâncias. Por essa razão, a lipossolubilidade é um dos mais importantes fatores
determinantes das características farmacocinéticas de um fármaco, podendo-se prever, com
base no conhecimento da lipossolubilidade de um fármaco, muitas de suas propriedades, como
a razão de absorção pelo TGI, a penetração no cérebro e outros tecidos e a duração de sua
ação. No caso dos compostos iônicos, as concentrações de equilíbrio dependem de diferenças
no pH através da membrana que podem influenciar o estado de ionização da molécula em
cada lado da membrana e do gradiente eletroquímico do íon.
5
Figura 4. Difusão através de lipídeos.
Difusão através de poros aquosos (filtração): esse tipo de transporte não é tão
importante, pois esses poros, cuja existência ainda é controversa, têm provavelmente diâmetro
pequeno demais (ao redor de 0,4 nm de diâmetro) para possibilitar a passagem das moléculas
da maioria dos fármacos (que geralmente tem diâmetro superior a 1 nm), embora sejam
considerados a principal via pela qual a água e outras pequenas moléculas polares (ex.: uréia)
atravessam membranas celulares. Muitas membranas biológicas são relativamente permeáveis
à água, seja por difusão ou por fluxo, o qual pode trazer consigo pequenas substâncias
hidrossolúveis. A maioria das membranas celulares só permite a passagem de água, uréia e
outras moléculas hidrossolúveis pequenas através desses mecanismos. Estas substâncias não
costumam atravessar as membranas celulares quando suas massas moleculares são
superiores a 100 ou 200 Da. O fluxo volumoso através dos poros intercelulares é o principal
mecanismo de passagem das drogas por muitas membranas endoteliais capilares, com a
importante exceção do SNC. As lacunas intercelulares são suficientemente grandes para que a
difusão através de muitos capilares seja limitada pelo fluxo sangüíneo e não pela
lipossolubilidade das drogas ou pelos gradientes de pH. As junções de oclusão são
características dos capilares do SNC e de vários epitélios. Como conseqüência, a difusão
intercelular é pequena.
6
Transporte na membrana mediado por um carreador (ou proteína carreadora):
Embora a difusão passiva através da camada dupla predomine na absorção e
distribuição de muitas drogas, mecanismos mais ativos e seletivos podem ter participações
importantes. Muitas membranas celulares possuem mecanismos de transporte especializados
que regulam a entrada e saída de moléculas fisiologicamente importantes, como carboidratos,
aminoácidos, neurotransmissores e íons metálicos. Em geral, esses sistemas de transporte
envolvem uma molécula transportadora que se liga à molécula ou íons a serem transportados e
os passam para o outro lado da membrana. Esses sistemas podem operar de modo passivo,
sem gasto de energia; neste caso eles só facilitam o processo de equilíbrio transmembrana da
substância transportada na direção de seu gradiente eletroquímico; o mecanismo chama-se
difusão facilitada. Podem ser altamente seletivos para fármacos com estruturas de
configuração específica e são necessários para o transporte de compostos endógenos cuja
velocidade de movimentação através das membranas biológicas por difusão simples seria
muito lenta.
Ocorre transporte ativo de alguns fármacos através das membranas neuronais, do
plexo coróide, das células tubulares renais e dos hepatócitos. As características do transporte
ativo são: seletividade, inibição competitiva por congêneres, necessidade de energia,
saturabilidade e movimento contra gradiente eletroquímico, podem ser importantes no
mecanismo de ação dos fármacos que estão sujeitos a transporte ativo ou que interferem no
transporte ativo de metabólitos ou neurotransmissores naturais.
Figura 5. Transporte mediado por carreadores ou proteínas carreadoras.
7
A pinocitose envolve a invaginação de uma parte da membrana celular e o
encerramento, no interior da célula, de uma pequena vesícula contendo componentes
extracelulares (líquidos). O conteúdo da vesícula pode então ser liberado na célula ou expulso
pelo outro lado desta. Este mecanismo parece ser importante no transporte de algumas
macromoléculas (ex.: insulina, que atravessa a barreira hematoencefálica por este processo)
mas não há nenhuma evidência de que contribua de modo apreciável para o movimento de
moléculas pequenas. A importância da pinocitose é provavelmente desprezível na
farmacocinética.
Figura 6. Pinocitose.
Eletrólitos fracos e influência do pH:
Muitas moléculas são ácidos ou bases fracas, podendo existir tanto na forma ionizada
como não- ionizada, variando a razão entre as duas formas com o pH. De maneira geral, as
moléculas não-ionizadas são lipossolúveis e podem difundir-se através da membrana celular.
Por outro lado, as moléculas ionizadas geralmente não conseguem penetrar na membrana
lipídica por causa de sua baixa lipossolubilidade. Portanto, a distribuição transmembrana de um
eletrólito fraco geralmente é determinada por seu pKa e pelo gradiente de pH através da
membrana.
Para ácidos fracos:
A razão entre o fármaco não-ionizado e o ionizado em cada pH é calculada pela
equação de Handerson-Hasselbach.
pKa = pH + log [AH]
[A-]
HA
A- + H+
Em pH ácido, onde a concentração de H+ é elevada, o equilíbrio
se desloca para esquerda, ou seja, predomina a forma molecular HA. Então, no suco gástrico,
a absorção de um fármaco ácido fraco é alta.
8
HA
A- + H+
Em pH básico, como plasma 7,4, onde a concentração de H+ é
baixa, o equilíbrio se desloca para direita, predominando a forma ionica do fármaco, portanto a
absorção fica prejudicada.
Para bases fracas:
A constante de dissociação pKa é dada pela equação de Handerson-Hasselbach:
pKa = pH + log [BH+]
[B]
BH+
B + H+ Em pH ácido, onde a concentração de H+ é elevada, o equilíbrio
se desloca para esquerda, ou seja, predomina a forma iônica BH+. Então, no suco gástrico, a
absorção de um fármaco base fraca é pequena.
BH+
B + H+ Em pH básico, como plasma 7,4, onde a concentração de H+ é
baixa, o equilíbrio se desloca para direita, predominando a forma molecular do fármaco,
portanto a absorção é alta.
Regra geral: base é bem absorvida em meio básico
ácido é bem absorvido em meio ácido
Em qualquer caso, a forma ionizada BH+ (no caso de bases) e A- (no casa de ácidos)
tem lipossolubilidade muito baixa e é praticamente incapaz de passar por uma membrana,
exceto nos raros casos onde exista um mecanismo de transporte específico. Para a maioria
dos fármacos, a forma não-carregada é suficientemente lipossolúvel para possibilitar a
passagem rápida pela membrana, embora haja exceções (antibióticos aminoglicosídeos) em
que mesmo a molécula não-carregada é suficientemente lipossolúvel para atravessar
membranas.
A formação de gradientes de concentração de eletrólitos fracos através de membranas
com um gradiente de pH é um processo puramente físico e não requer um sistema de
transporte ativo. Tudo que se precisa é uma membrana preferencialmente permeável a uma
forma do eletrólito fraco e um gradiente de pH através da membrana. A formação do gradiente
de pH é um processo ativo.
9
Fatores que modificam a absorção:
Além dos fatores físico-químicos que afetam o transporte através de membranas muitas
variáveis influenciam a absorção das drogas.
-
Sem levar em conta o local, a absorção depende da solubilidade do fármaco. Em
solução aquosa, os fármacos são absorvidos mais rapidamente do que aqueles
administrados em solução oleosa, suspensão ou forma sólida, porque se misturam
mais prontamente à fase aquosa no local da absorção. A velocidade de dissolução
pode ser o fator limitador da absorção dos fármacos administrados na forma sólida.
-
As condições no local de absorção alteram a solubilidade em especial no TGI. A
aspirina, relativamente insolúvel no meio gástrico ácido, é um exemplo comum de
fármaco desse tipo.
-
A concentração influencia sua velocidade de absorção. Os fármacos administrados
em soluções altamente concentradas são absorvidos mais rapidamente que aqueles
em soluções de baixa concentração.
-
A circulação no local de administração também afeta a absorção do fármaco. O
aumento do fluxo sangüíneo, determinado por massagem ou aplicação local de
calor, potencializa a velocidade de absorção do fármaco; a redução do fluxo
sangüíneo, provocada por vasoconstrição, choque ou outros fatores patológicos
pode retardar a absorção.
-
A área da superfície absortiva à qual o fármaco é exposto é um dos determinantes
importantes da velocidade de absorção. Os fármacos são absorvidos com maior
rapidez em superfícies com grandes áreas como o epitélio alveolar pulmonar, a
mucosa intestinal ou em alguns casos, depois da aplicação extensa na pele. A
superfície absortiva é determinada em grande parte pela via de administração. Cada
um desses fatores, separadamente ou em conjunto com os outros, podem ter efeitos
acentuados na eficácia clínica e na toxicidade de um fármaco.
Biodisponibilidade:
Quantidade de uma droga que atinge seu local de ação (BIOFASE) ou um líquido
biológico a partir do qual o fármaco tem acesso a seu local de ação. Por exemplo: um fármaco
absorvido pelo estômago e intestino precisa passar primeiro pelo fígado antes de atingir a
circulação sistêmica. Se o fármaco for metabolizado no fígado ou excretado na bile, parte dele
será inativada ou desviada antes que seja distribuída aos seus locais de ação. A
biodisponibilidade diminui consideravelmente se a capacidade metabólica ou excretora do
fígado para o agente em questão for grande (o chamado efeito de primeira passagem). Essa
redução depende do local anatômico a partir do qual ocorre absorção: outros fatores
10
anatômicos, fisiológicos e patológicos podem influenciar na biodisponibilidade e a escolha da
via de administração do fármaco deve basear-se no conhecimento dessas condições. Além do
mais, fatores que modificam a absorção de um fármaco podem alterar sua biodisponibilidade. A
aplicação dos conhecimentos de biodisponibilidade em estudos comparativos de duas ou mais
formulações diferentes, com os mesmos princípios ativos, nas mesmas concentrações,
administrados pelas mesmas vias, em uma mesma espécia é denominado de bioequivalênia.
DISTRIBUIÇÃO: saída do fármaco da corrente sangüínea para o tecido-alvo. Depois de
absorvido ou injetado na corrente sangüínea, o fármaco pode distribuir-se para os líquidos
intersticial e celular. Alguns órgãos como coração, rins, fígado, cérebro e outros bem
perfundidos recebem grande parte da droga nos primeiros minutos depois de sua absorção. A
oferta de droga ao músculo, à maioria das vísceras, à pele e à gordura é mais lenta, e esses
tecidos podem exigir vários minutos a várias horas para que seja atingido o estado de equilíbrio
estável.
Compartimentos de líquidos corporais:
O corpo é constituído de 50 a 70% de água. A água corporal distribui-se por quatro
compartimentos principais: o líquido extracelular compreende plasma sangüíneo (4,5% do peso
corporal); líquido intersticial (16%, espaços) e linfa (1-2%); líquido intracelular (30-40%) é a
soma do conteúdo líquido de todas as células do corpo e o líquido transcelular (2,5%) inclui o
líquido cefalorraquidiano, intra-ocular, peritoneal, pleural e sinovial e as secreções digestivas.
Para passar de um compartimento extracelular para os compartimentos transcelulares, um
fármaco tem de atravessar uma barreira epitelial, como a hematoencefálica, deve ser capaz de
penetrar em células.
Em cada um desses compartimentos aquosos, moléculas de fármacos existem
geralmente tanto em solução livre como em forma ligada; além disso, fármacos que são ácidos
fracos ou bases fracas existem como uma mistura em equilíbrio das formas carregada e nãocarregada, com a posição de equilíbrio dependente do pH.
O padrão de equilíbrio de distribuição entre os diversos compartimentos depende da:
permeabilidade através de barreiras teciduais; ligação no interior dos compartimentos; partição
do pH; partição lipídeo : água.
Reservatórios de drogas: Os fármacos podem-se acumular nos tecidos em
concentrações maiores do que as esperadas a partir dos equilíbrios estáveis de difusão, como
resultado dos gradientes de pH, da ligação a componentes intracelulares ou da distribuição nos
lipídios. Os compartimentos orgânicos nos quais um fármaco se acumula são reservatórios
11
potenciais. A concentração do fármaco no plasma e em seu local de ação é mantida e seus
efeitos farmacológicos prolongados quando a quantidade armazenada está em equilíbrio
estável com aquela no plasma e é liberada à medida que a concentração plasmática cai.
Contudo, quando contém grande capacidade e enche-se rapidamente, o reservatório altera a
distribuição do fármaco de modo que são necessárias quantidades iniciais maiores do fármaco
para proporcionar uma concentração terapeuticamente eficaz no órgão-alvo.
Proteínas plasmáticas:
A ligação de um fármaco às proteínas plasmáticas limita sua concentração nos tecidos e
no seu local de ação, visto que apenas o fármaco livre está em equilíbrio estável através da
membrana. A distribuição pode ser limitada pela ligação do fármaco às proteínas do plasma,
principalmente a albumina no caso dos fármacos ácidos e a glicoproteína α1- ácida no caso
das drogas básicas; a ligação costuma ser reversível. Um fármaco fortemente ligado tem pouco
acesso a locais de ação intracelulares e pode ser metabolizado e eliminado lentamente. Nas
concentrações terapêuticas, a fração do fármaco que fica livre em solução aquosa pode ser de
até 1%, estando o restante associado a proteínas plasmáticas.
A quantidade de um fármaco que se liga às proteínas vai depender de três fatores:
concentração de fármaco livre; sua afinidade pelos locais de ligação; concentração de
proteínas plasmáticas.
Como a ligação com as proteínas plasmáticas não é seletiva, muitos fármacos com
características físico-químicas semelhantes podem competir entre si e com substâncias
endógenas por esses locais de ligação. Por exemplo, sabe-se que o deslocamento da
bilirrubina livre do local de ligação com a albumina pelas sulfonamidas e outros ânios orgânicos
aumenta o risco de encefalopatia da bilirrubina no recém-nascido (Kernicterus). Como as
respostas aos fármacos, quer eficaz quer tóxica, dependem das concentrações livres, as
concentrações livres em equilíbrio estável só mudam se forem alteradas a entrada do fármaco
(taxa de administração) ou a depuração do fármaco não-conjugado. Assim, as concentrações
livres em equilíbrio estável independem do grau de ligação à proteína. Entretanto uma
alteração transitória nas concentrações livres imediatamente após uma dose de um fármaco
competidor poderia preocupar no caso de fármacos com índice terapêutico estreito.
Na albumina plasmática, a existência de um mesmo local de ligação para diferentes
fármacos, pode levar à competição entre eles, de modo que a administração de um fármaco A
poderá reduzir a ligação de um fármaco B às mesmas proteínas, levando um aumento de sua
concentração livre no plasma. Para fazer isso, o fármaco A necessita ocupar uma fração
considerável dos locais de ligação. Muitos fármacos não afetam a ligação de outros por
ocuparem (em concentrações plasmáticas terapêuticas) apenas uma fração pequena dos
12
locais disponíveis. Apenas alguns fármacos causam efeitos inesperados por deslocar outros
fármacos, como as sulfonamidas que ocupam cerca de 50% dos locais de ligação (em
concentrações terapêuticas). A competição entre fármacos pela ligação às proteínas, pode
levar a interações clinicamente importantes entre fármacos. Uma ligação mais extensa às
proteínas plasmáticas torna mais lenta a eliminação do fármaco. Fármacos que estão
fortemente ligados a proteínas permanecem principalmente no compartimento plasmático.
Reservatórios celulares: muitos fármacos acumulam-se no músculo e outras células
em concentrações maiores do que nos líquidos extracelulares. Alguns fármacos têm grande
afinidade pelo ácido nucléico (mepacrina) e são fortemente captados pelo núcleo dos
hepatócitos. A cloroquina tem afinidade pela melanina e é captada por tecidos como a retina,
ricos em melanina. O tecido adiposo constitui um grande compartimento não-polar (apolar).
Se a molécula de um fármaco apolar tem um coeficiente de partição lipídeo : água de 10, em
equilíbrio aproximadamente 75% do fármaco estariam dissolvidos no tecido adiposo corporal,
não exercendo nenhuma função farmacológica, mas formando um grande reservatório do
fármaco em comunicação com o compartimento plasmático. O segundo fator que limita o
acúmulo de fármacos no tecido adiposo corporal é seu escasso suprimento sangüíneo (menos
de 2% do débito cardíaco). Os fármacos são levados ao tecido adiposo e a água corporal é
atingida lentamente. Para fins práticos a distribuição ao tecido adiposo corporal após a
administração aguda só é importante para alguns fármacos altamente lipossolúveis
(anestésicos gerais) o mesmo ocorrendo com a administração crônica de fármacos
lipossolúveis (benzodiazepínicos). Fármacos lipossolúveis chegam a todos os compartimentos
e podem acumular-se no tecido adiposo. Osso: As tetraciclinas e os metais pesados
acumulam-se lentamente nos ossos e dentes, por terem grande afinidade pelo cálcio. Podem
ser acumulados no osso por adsorção à superfície osso-cristal e incorporação final no
arcabouço de cristal. O osso pode transformar-se num liberador lento de agentes tóxicos, como
chumbo e o rádio para o sangue; assim, os efeitos destes podem persistir muito depois do
término da exposição. Reservatórios transcelulares: as drogas também atravessam células
epiteliais e podem acumular-se nos líquidos transcelulares. O principal reservatório transcelular
é o TGI.
REDISTRIBUIÇÃO: Em geral o término do efeito do fármaco se dá por biotransformação
e excreção, mas também pode resultar da redistribuição do medicamento de seu local de ação
para outros locais ou tecidos. A redistribuição é um fator importante no término do efeito de um
fármaco, principalmente quando se administra rapidamente por injeção intravenosa ou inalação
um fármaco altamente lipossolúvel que atua no cérebro ou no sistema cardiovascular.
13
O fármaco que se acumula em determinado tecido pode atuar como um reservatório que
prolonga sua ação nesse mesmo tecido ou em um local distante atingido pela circulação. Um
exemplo é o uso do tiopental, uma droga altamente lipossolúvel. Como o fluxo sangüíneo para
o cérebro é muito grande, o fármaco atinge sua concentração máxima nesse órgão cerca de
um minuto após injeção intravenosa. A concentração plasmática cai à medida que o tiopental
difunde-se para outro tecidos, como o músculo. A concentração no cérebro acompanha a do
plasma, visto que há pouca ligação deste com componentes cerebrais. Dessa forma, o início e
o término da ação são rápidos. Uma terceira fase de distribuição deste fármaco deve-se à
captação lenta e dependente do fluxo sangüíneo que ocorre no tecido adiposo. A
administração de doses sucessivas determina acúmulo deste fármaco na gordura e outros
tecidos que podem armazenar grandes quantidades do composto. Esses podem tornar-se
reservatórios para manutenção da concentração plasmática e, portanto, da concentração
cerebral, no ou acima do limiar necessário para anestesia. Assim, um fármaco de curta ação
por causa da rápida redistribuição para locais nos quais o agente não tem efeito farmacológico
pode transformar-se em outro de longa ação quando esses locais de armazenamento ficam
“cheios” e o término da ação do fármaco fica dependente da biotransformação e da excreção.
Transferência placentária de fármacos: a transferência através da placenta é muito
importante uma vez que os fármacos podem causar anomalias congênitas. Os fármacos
administrados imediatamente antes do parto também podem ter efeitos adversos nos recémnascidos. As drogas atravessam a barreira hematoplacentária por difusão simples.
Os
fármacos não-ionizados lipossolúveis entram com facilidade no sangue fetal a partir da
circulação materna. A penetração é menor quando os fármacos possuem alto grau de
dissociação ou pequena lipossolubilidade. A idéia de que a placenta é uma barreira contra
drogas está incorreta, o feto fica, pelo menos até certo ponto, exposto a praticamente todos os
fármacos ingeridos pela mãe.
14
BIOTRANSFORMAÇÃO DE DROGAS
Conjunto de alterações químicas que as drogas sofrem no organismo, geralmente
promovidas por enzimas, com a finalidade de facilitar a sua eliminação, podendo modificar:
- as propriedades físico-químicas da droga como: a solubilidade, a polaridade, etc.
- atividade biológica (efeito farmacológico): alterações de intensidade da atividade
biológica (pró-drogas); alterações da natureza da atividade biológica (codeína; morfina);
alterações de toxicidade.
Importância:
•
fisiológica: determinar o término da atividade biológica da droga.
•
farmacológica: determinar a intensidade e a natureza do efeito farmacológico,
além do aparecimento ou não de toxicidade.
Local da biotransformação e sistemas enzimáticos:
Em geral, a conversão metabólica das drogas tem natureza enzimática. Os sistemas
enzimáticos participantes da biotransformação dos fármacos localizam-se no fígado, embora
possam estar distribuídos em diversas porções celulares de outros tecidos como: rins, TGI,
pele e os pulmões.
•
Principais frações celulares onde estão contidos os sistemas enzimáticos:
o Fração mitocôndrica: Ex.: MAO [monoamina oxidase - degradação
oxidativa das aminas biológicas como: NA, 5-HT (5-hidroxitriptamina) e
tiramina];
o Fração solúvel: Ex.: esterases (degradam ésteres como a procaína e Ach);
amidases (hidrolisam a procainamida); desidrogenases (oxidação de álcoois
e aldeídos); transferases (transferem radicais nas reações conjugativas);
o Fração Microssômica: Ex.: citocromo P450 (oxidação de barbitúricos e
anfetaminas, etc.).
Pró-drogas: são precursores inativos metabolizados em metabólitos ativos.
PRINCIPAIS TIPOS DE REAÇÕES DE BIOTRANSFORMAÇÃO
•
Reações de fase I e Reações de fase II
o Principais características:
Algumas vezes, apenas uma delas já é suficiente para preparar o fármaco
para ser eliminado;
15
Costumam ocorrer em seqüência, mas isso não é uma regra;
Podem ocorrer simultaneamente.
REAÇÕES DE FASE I:
- Também são chamadas de reações não sintéticas ou de funcionalização;
- Modificam as drogas por introdução ou exposição de radicais em suas estruturas;
- As mais importantes são: oxidação, redução e hidrólise.
Sistema de monooxigenase do citocromo P450:
A família de enzimas do citocromo P450 é o principal catalisador das reações
oxidantes de biotransformação de drogas. A superfamília de enzimas catalisa uma grande
variedade de reações oxidantes e redutoras e exerce atividade contra um grupo de substratos
quimicamente diferentes. As famílias 1, 2 e 3 de citocromo P450 (CYP1, CYP2 e CYP3)
codificam as enzimas que participam na maioria das biotransformações de drogas.
A) Oxidação:
- São as reações de biotransformação mais freqüentes;
- Na maioria das vezes, envolvem enzimas microssomais (especialmente citocromo
P450). Exemplos:
A1) Hidroxilação do núcleo aromático
A2) Desaminação
16
B) Redução
- São bem mais raras que as reações de oxidação;
- Também podem envolver enzimas microssômicas. Exemplos:
C) Hidrólise
- Não envolvem enzimas microssomais hepáticas;
- Ocorrem no plasma e na fração solúvel de muitos tecidos;
- São responsáveis pela degradação de muitas drogas que possuem ligação éster ou
amida em sua estrurura. Exemplos:
C1) Hidrólise da procaína
17
C2) Hidrólise do ácido acetil salicílico
REAÇÕES DE FASE II:
- Também são chamadas de reações sintéticas ou reações de conjugação;
- Modificam as drogas ou seus metabólitos por conjugarem seus grupos funcionais
(OH, COOH, NH2, etc.) com grupamentos de substâncias endógenas (metila, ác. acético, ác.
sulfúrico, ác glicurônico, etc.);
- Geralmente ocorrem em 2 fases: síntese do doador do radical (sintetases) e
transferência do radical (transferases);
- Muitas vezes acontecem no fígado e quase sempre geram metabólitos inativos e
menos lipossolúveis que seus precursores;
- As mais importantes são: conjugação com o ácido glicurônico e com o grupo metil.
D) Conjugação
D1) Glicuronidação
- Ocorre geralmente com fármacos ou metabólitos que apresentam grupamento fenol,
álcool ou carboxil.
18
D2) com grupo metil
- O doador do grupo metil é sintetizado no fígado e corresponde à S-adenosil
metionina.
- As enzimas que transferem o grupo metil são chamadas de N, O ou Smetiltransferases, conforme a posição da molécula da droga ou metabólito para o qual ele é
transferido.
- Ocorre, por exemplo, com as catecolaminas (NA; Adr), além de outras aminas como a
5-HT).
D3) outras
- Com a glicina e glutamina: ocorre com ácidos carboxílicos aromáticos, como o ácido
salicílico.
- Com o sulfato: ocorre com o cloranfenicol, aminas aromáticas, fenóis, esteróides
fenólicos ou alcoólicos, etc.
FATORES MODIFICADORES DA BIOTRANSFORMAÇÃO
•
Espécie animal: diferenças entre espécies, de vias metabólicas e de velocidade de
biotransformação;
•
Idade: recém-nascidos e idosos;
19
•
Fatores genéticos: Variações individuais determinadas geneticamente da capacidade
e/ou da velocidade das vias metabólicas. Por exemplo: metabolizadores “rápidos” ou
“excelentes”; metabolizadores “lentos” ou “ruins”; portadores de enzimas atípicas
(pseudocolinesterase); deficientes em determinadas enzimas;
•
Interações medicamentosas: indução enzimática e inibição enzimátia;
o Indutores enzimáticos: Aumentam a biotransformação de outros compostos ou
deles mesmos por: estímulo da atividade enzimática e indução da síntese
enzimática.Ex.: fenobarbital, fenilbutazona, rifampicina, fenitoína, griseofulvina,
carbamazepina, etanol (uso crônico), etc.
Principais conseqüências: aumento da velocidade de biotransformação
hepática; aumento da velocidade de produção de metabólitos; aumento da
depuração hepática da droga; diminuição da 1/2 vida sérica da droga;
diminuição das concentrações séricas da droga livre e total.
Possíveis
aplicações
clínicas:
hiperbilirrubinemia
em
neonatos;
intoxicação por inseticidas halogenados; cirrose hepática.
o Inibidores enzimáticos: Diminuem ou inibem a biotransformação de outros
compostos por: diminuição da síntese enzimática; depleção de co-fatores;
competição com a droga pelos seus sítios de ligação à enzima; por ligação à
enzima em sítios diferentes daqueles nos quais a droga se liga (não competitiva).
Principais
enzimas
envolvidas:
colinesterases,
MAO,
aldeído-
desidrogenase e citocromo P450.
Inibidores clinicamente importantes: cimetidina, cloranfenicol, álcool
(exposição aguda), pro-poxifeno e dissulfiram.
Principais conseqüências: aumento da 1/2 vida da droga no soro;
aumento das concentrações séricas da droga livre e total; diminuição da
velocidade de produção de metabólitos; diminuição da depuração total.
Possíveis aplicações clínicas: no alcoolismo (dissulfiram); na gota
(alopurinol);
fisostigmina,
como
colinomiméticos
prostigmina,
de
edrofônio,
ação
indireta
ecotiopato,
(neostigmina,
etc.);
como
antidepressivos (IMAO – inibidor da MAO).
•
Fatores ambientais: Exposição a determinados poluentes que causam indução
enzimática (ex.: benzopireno).
•
Fatores patológicos: Ex.: patologias que causam diminuição do fluxo sangüíneo
hepático ou da função hepática (hepatite).
20
DEPURAÇÃO
É a “taxa de eliminação” do fármaco do organismo. A depuração por vários órgãos de
eliminação é aditiva. A eliminação de um fármaco pode ser o resultado de processos que
ocorrem no rim, no fígado e em outros órgãos. Quando somadas, as depurações são iguais à
depuração sistêmica total (depuração hepáticva e depuração renal).
EXCREÇÃO DE DROGAS
Processo de eliminação de fármacos do organismo. Um medicamento pode ser
excretado após a biotransformação ou mesmo na sua forma inalterada.
Principais vias de excreção:
•
Pulmonar: substâncias gasosas ou voláteis;
•
Renal: substâncias polares e hidrossolúveis;
•
Biliar: substâncias com alto coeficiente de partição lipídeo : água;
•
Fecal: substâncias não absorvidas quando administradas pela via oral ou
absorvidas, porém, eliminadas pela bile.
Vias de excreção secundárias:
• leite materno; saliva; lágrima; suor; secreção nasal.
EXCREÇÃO RENAL
•
Filtração glomerular: difusão de moléculas com peso molecular inferior a 20 KDa. A
albumina plasmática (PM 68KDa) é quase totalmente retida, porém as drogas
atravessam livremente a barreira (exceção: heparina).
•
Secreção e reabsorção tubulares: até 20% do fluxo plasmático renal é filtrado no
glomérulo, de modo que pelo menos 80% do fármaco podem passar para os capilares
peritubulares no túbulo proximal. Mecanismo mais eficaz de eliminação de droga pelos
rins.
•
Difusão através do túbulo renal
21
Excreção de fármacos expressa como depuração: A depuração renal é definida como
volume de plasma que contém a quantidade da substância que é removida pelo rim por
unidade de tempo.
Fatores que interferem na excreção renal:
• Patologias: Nefrites e pielonefrites;
• pH da urina: Alcalinização; Acidificação; Bicarbonato de sódio (intoxicações por
fenobarbital).
Interações medicamentosas
• com fármacos que aumentam o volume urinário (diuréticos);
• com fármacos que competem pelo mesmo transportador (probenecida);
• com fármacos que alteram o pH urinário (antiácidos, alcalinizantes, acidificantes).
EXCREÇÃO BILIAR
(CICLO ENTERO-HEPÁTICO)
Drogas que possuem grande lipossolubilidade; Peso molecular acima de 200 Da;
Transporte ativo para a bile semelhante ao renal; Aumento do tempo de permanência de
drogas no organismo.
22
MEIA VIDA
Tempo necessário para que a concentração, em µg/mL de sangue, de um determinado
agente terapêutico se reduza à metade.
23












