Soluções, equilíbrios e solubilidade
Por Victor Costa
Índice
1. Soluções
Solução
Soluto
Solvente
Propriedades eletrolíticas
Solução insaturada
Solução saturada
Solução supersaturada
Unidades de concentração
Diluição
2. Equilíbrio
Reações reversíveis
Definição
Constante de equilíbrio
Deslocamento do equilíbrio
3. Termodinâmica
Entropia
Energia livre de Gibbs
Energia livre de Gibbs fora das condições padrão
Quociente de reação
Energia livre de Gibbs no equilíbrio
Entalpia de solução
4. Solubilidade
Dissolução
Solvatação
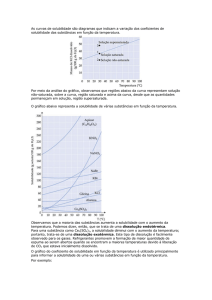
Relação com a temperatura
Relação com a pressão
Produto de solubilidade (Kps)
Solubilidade molar
Como prever se vai precipitar
Precipitação seletiva
5. Tipos de reações
Reação de precipitação
Reação ácido-base
Reação de oxirredução
Reação de complexação
Soluções
Solução É uma mistura homogênea de duas ou mais substâncias, ou
seja, uma mistura que apresenta somente uma fase. Pode ser em fase líquida,
como sal em água, em fase sólida, como carbono no ferro (para formar o aço)
e até mesmo em fase gasosa, como a mistura de dois gases.
Soluto É a substância presente em menor quantidade na solução.
Solvente É a substância presente em maior quantidade na solução.
Propriedades eletrolíticas Refere-se à capacidade da solução de
conduzir eletricidade. As soluções podem ser eletrólitos fortes (possuem muitos
íons), eletrólitos fracos (possuem poucos íons) ou não eletrolíticas (não
possuem íons).
Eletrólitos fortes são formados por substâncias que sofrem bastante
ionização/dissociação, como ácidos e bases fortes e sais. A grande taxa de
ionização/dissociação leva à formação de vários íons e consequente
capacidade de transportar corrente elétrica.
Eletrólitos fracos são formados por substâncias que sofrem pouca
ionização/dissociação como ácidos e bases fracos. A baixa taxa de
ionização/dissociação leva à formação de poucos íons e, consequentemente, à
uma baixa capacidade de transportar corrente elétrica. Uma informação
interessante sobre essas soluções é que há um equilíbrio entre a espécie
protonada e a desprotonada do soluto.
Soluções não eletrolíticas são formadas por substâncias que não sofrem
ionização/dissociação, como alguns compostos covalentes (como, por
exemplo, soluções de álcool).
Solução insaturada É a solução que não possui todo o soluto capaz
de ser dissolvido no solvente em uma determinada temperatura.
Solução saturada É a solução que possui a quantidade máxima de
soluto que pode ser dissolvida no solvente em determinada temperatura. A
partir desse ponto, se for adicionado mais soluto ele precipitará, formando o
corpo de fundo (nesse caso, a solução restante chama-se sobrenadante).
Solução supersaturada Em condições especiais é possível dissolver
mais soluto do que o existente em uma solução saturada, em determinada
temperatura. Essas soluções são muito instáveis: qualquer perturbação do
sistema precipitará soluto dissolvido a mais que o limite da solução saturada.
Unidades de concentração
Título (ou porcentagem em massa) É quantos % da massa
total da solução é proveniente de um soluto.
T = massa de soluto
massa de solução
Fração molar É a relação entre o número de mols de um soluto
e o número de mols total da solução (somando todos os
componentes).
FM = número de mols do soluto
número de mols total da solução
Molaridade É a quantidade de mols de um soluto por unidade
de volume.
M = número de mols do soluto =
volume total da solução
massa do soluto
massa molar do soluto X volume total
Molalidade É a quantidade de mols de um soluto por
quilograma de solvente. É uma unidade de concentração bastante
utilizada em estudos de propriedades coligativas.
M = número de mols do soluto
massa do solvente (em kg)
Concentração comum É a massa do soluto por unidade de
volume.
C = massa do soluto
volume de solução
PPM É a quantidade de miligramas do soluto por quilograma
de solução.
ppm = 1g de soluto
106g de solução
PPB É a quantidade de miligramas do soluto por mil
quilogramas de solução.
ppb = 1g de soluto
109g de solução
Diluição É o processo de diminuição da concentração de uma solução
pela adição de solvente. Ao aumentar o volume de solução, as moléculas de
soluto passam a ter um maior espaço para ocuparem, de modo que ficam mais
espalhadas: o pedaço onde antes tinha uma média de 2x moléculas passa a ter
uma média de x moléculas, por exemplo.
IMPORTANTE: na diluição, conserva-se o número de mols!
A partir dessa observação, obtemos a fórmula:
C1V1 = C2V2
Onde C = concentração molar
V = volume de solução
1 = condição inicial
2 = condição final
Outro caso de diluição é quando não se adiciona solvente, mas sim
outra substância que não reage com o soluto original. Nesse caso, também
utilizamos a conservação do número de mols para obtermos a formula:
C1V1 + C2V2 = C3V3
Onde C = concentração molar
V = volume de solução
1 = condição inicial de um soluto
2 = condição inicial de outro soluto
3 = condição final da solução
Equilíbrio
Reações reversíveis Muitas reações são reversíveis, ou seja, os
produtos podem reagir entre si para formar novamente os reagentes. Nesses
casos, temos a reação direta (reagente virando produto) e a reação inversa
(produto virando reagente).
Definição À medida que a reação direta começa a ocorrer, a
concentração dos produtos começa a aumentar. Portanto, a velocidade da
reação inversa também aumenta (de acordo com a Lei de Ação das Massas.
Mais explicações no resumo de cinética). O equilíbrio é o momento no qual a
velocidade da reação inversa iguala-se à velocidade da reação direta.
Quando a reação alcança o equilíbrio ela parece parar, pois não se
observa mais alterações no sistema. É importante compreender que na
verdade a reação não parou: a falta de alterações no sistema deve-se ao fato
de a velocidade da reação inversa ser igual à da direta, ou seja, logo que
formam-se novos produtos eles são consumidos para formar os reagentes, de
modo que as concentrações de produtos e reagentes permanecem constantes.
Em outras palavras, o equilíbrio químico é dinâmico: está constantemente
ocorrendo reações.
Constante de equilíbrio É uma grandeza que relaciona as
quantidades de produtos e reagentes no equilíbrio.
IMPORTANTE: Apenas a alteração de temperatura muda o valor da
constante de equilíbrio.
Considerando a reação reversível bB + cC dD +eE, a constante de equilíbrio
é dada por
K = (aD)d x (aE)e
(aB)b x (aC)c
Onde b, c, d, e = coeficientes estequiométricos das substâncias B, C, D, E
aB, aC, aD, aE = atividade das substâncias B, C, D, E
A atividade de uma substância é algo que será estudado em físicoquímica. Aqui, basta saber que:
- Para soluções atividade aproximadamente igual à concentração
molar.
- Para gases atividade aproximadamente igual à pressão parcial.
- Para sólidos e líquidos puros atividade aproximadamente igual a um.
Às vezes, separa-se a constante de equilíbrio em duas: o Kc, utilizado
para soluções, e o Kp, utilizado para gases.
Deslocamento do equilíbrio Segundo o Princípio de Le Chatelier,
quando ocorre alguma perturbação em um sistema em equilíbrio, o sistema
tende a formar produtos ou reagentes de modo a minimizar a perturbação. Há
cinco casos que merecem nossa atenção:
1 – Adição de produto/reagente A adição de produto desloca o
equilíbrio no sentido de formar reagentes, assim como a adição de reagentes
desloca o equilíbrio no sentido de formar produtos.
2 – Retirada de produto/reagente A retirada de produto desloca o
equilíbrio no sentido de formar produtos, assim como a retirada de produto
desloca o equilíbrio no sentido de formar reagentes.
3 – Mudança de pressão Um aumento de pressão leva a uma
diminuição de volume e, portanto, desloca o equilíbrio no sentido de formação
de menos mols gasosos. Se não houverem gases envolvidos, alteração da
pressão não afeta o equilíbrio.
4 – Mudança de temperatura Um aumento de temperatura desloca o
equilíbrio no sentido da reação endotérmica, assim como um abaixamento de
temperatura desloca o equilíbrio no sentido da reação exotérmica. Essa
análise, contudo, é um pouco mais complexa, uma vez que a temperatura
altera a constante de equilíbrio.
5 – Adição de gás inerte Não altera o equilíbrio.
Termodinâmica
Sim, termodinâmica. Para aprofundarmos os estudos de solução e
iniciarmos os estudos de solubilidade, precisamos ver alguns importantes
conceitos termodinâmicos.
Entropia É uma grandeza que quantifica o número de possibilidades
de distribuição energética do sistema. Achou confuso? Pode-se entender a
entropia como o nível de desordem do sistema: quanto mais desorganizado o
sistema, maior sua entropia.
Há várias informações importantes sobre a entropia no estudo da
termodinâmica, mas elas serão vistas nas aulas de físico-química. Agora, basta
compreender que entropia é um indicativo da desordem do sistema.
Energia Livre de Gibbs É uma grandeza que indica a espontaneidade
de uma reação e o trabalho máximo não expansivo (todo trabalho que não é
devido à expansão contra uma pressão, como o trabalho elétrico ou trabalhos
mecânicos do tipo alongar uma mola ou subir uma ladeira) que pode ser
realizado por um sistema. Agora, iremos analisar somente a indicação de
espontaneidade (a outra função da Energia Livre de Gibbs será analisada na
aula sobre Eletroquímica).
A Energia Livre de Gibbs é calculada pela fórmula:
ΔG = ΔH – TΔS
Onde ΔH = variação de entalpia
ΔS = variação de entropia
IMPORTANTE:
- Se ΔG > 0 Reação não é espontânea
- Se ΔG < 0 Reação é espontânea
- Se ΔG = 0 Reação em equilíbrio
Uma reação espontânea é aquela que tende a ocorrer sem necessidade
de influência externa. É importante saber que uma reação ser espontânea
significa que ela é termodinamicamente favorecida, o que não quer dizer que
ela ocorra rápido. A transformação do carvão em diamante, por exemplo, é
espontânea, mas é extremamente lenta. Em outras palavras,
termodinamicamente favorecido é diferente de cineticamente favorecido.
Energia Livre de Gibbs fora das condições padrão A fórmula fornecida
na sessão anterior é válida somente nas condições padrão, ou seja, a 25oC,
gases a 1 bar e soluções a 1 mol/L. Apesar dessa fórmula ser bastante útil para
várias análises, podemos precisar da Energia Livre de Gibbs fora das
condições padrão. Nesses casos, utilizamos a fórmula:
ΔG = ΔGo + RTlnQ
Onde ΔGo = Energia Livre de Gibbs nas condições padrão
R = constante universal dos gases
T = temperatura (em kelvin)
Q = quociente da reação
Quociente da reação É uma grandeza que indica a relação entre as
concentrações (ou pressões parciais, no caso de gases) dos produtos e
reagentes fora do equilíbrio. Calcula-se exatamente como a constante de
equilíbrio, mas utilizando dados de concentrações (ou pressões parciais) fora
do equilíbrio.
É importante perceber que o valor de Q não é único: enquanto a reação
não está em equilíbrio, as concentrações de produtos e reagentes vão se
alterando até o equilíbrio, mudando, também o valor de Q. Um fato interessante
de se perceber é que à medida que as concentrações tendem às
concentrações de equilíbrio, o valor de Q tende à K. Em outras palavras, no
equilíbrio Q = K.
- Energia Livre de Gibbs no equilíbrio Como dito anteriormente, no
equilíbrio temos que ΔG = 0 e Q = K. Unidos essas duas informações com a
equação da Energia Livre de Gibbs para condições fora da condição padrão,
temos que:
ΔGo = -RTlnK
Entalpia de solução Para um soluto dissolver em um solvente e
formar uma solução, é preciso que as ligações entre as moléculas de soluto e
as ligações entre as moléculas de solvente se rompam e formem ligações entre
as moléculas de solvente e de soluto. Esses três processos envolvem
variações de energia, de modo que o processo global de dissolução tenha uma
variação de entalpia, a entalpia de solução, que pode ser positiva (processo
endotérmico) ou negativa (processo exotérmico).
Pensar na dissolução como quebra das ligações soluto-soluto e
solvente-solvente para formação de ligações solvente-soluto dá uma ideia do
porque da veracidade da famosa lei “Semelhante dissolve semelhante”: se
tanto soluto quanto solvente tiverem polaridades semelhantes, as ligações
soluto-soluto e solvente-solvente serão de tipos parecidos (ver resumo de
ligações químicas), de modo que ao formarem as ligações soluto-solvente a
perturbação no sistema não será muito grande.
Essa análise, contudo, foi bastante simplista. Para se compreender
adequadamente o processo de dissolução é necessária uma análise mais
detalhada, avaliando os fatores de entalpia e de entropia para três casos de
dissolução.
Para calcularmos a entalpia de solução, consideramos que primeiro se
obtém os íons no estado gasoso e, então, esses íons são hidratados:
ΔHsolução = U + ΔHhidratação
Onde U = entalpia reticular (ver resumo de ligações químicas) (positiva).
ΔHhidratação = entalpia envolvida na solvatação dos íons (negativa).
Solubilidade
Dissolução Dispersão das partículas do soluto em um solvente.
Solvatação Na solubilização de compostos que formam íons ocorre a
solvatação, que consiste na interação da parte negativa do solvente com os
cátions e interação da parte positiva do solvente com os ânions, de modo que
várias moléculas do solvente envolvem os íons.
É importante saber que a solvatação não é permanente: quando ocorre
a formação do corpo de fundo, passa a ter um equilíbrio entre a fase sólida e a
fase aquosa, ou seja, o sólido dissolve formando os íons e os íons se ligam
formando o sólido. Nesse caso, o ΔG do sistema é 0, pois ele está em
equilíbrio.
Relação com a temperatura Para que ocorra solubilização, o ΔG para
esse processo deve ser negativo (processo deve ser espontâneo). Portanto,
como a temperatura interfere no valor de ΔG, ela também influencia na
solubilidade. Para analisarmos essa influência, precisamos avaliar dois casos
distintos:
1 – Solubilização de sólidos Na solubilização de sólidos, um aumento
da temperatura aumenta a solubilidade. Isso porque na mudança de um sólido
(com fortes interações intermoleculares que mantem as moléculas firmemente
unidas) para uma solução (com moléculas dispersas pelo solvente) ocorre um
aumento de entropia (ΔS>0), de modo que o termo –TΔS seja negativo. Assim,
um aumento de temperatura aumenta o módulo de um termo negativo no
cálculo da Energia Livre de Gibbs, tornando-a cada vez menor, ou seja, cada
vez mais negativa (ou mais próxima do zero, se antes fosse positiva).
2 – Solubilização de gases Na solubilização de gases, um aumento
da temperatura diminui a solubilidade. Isso porque na mudança de um gás
(com moléculas bastante espalhadas e com fracas interações entre si) para um
solução (na qual o espaço em que as moléculas estão confinadas é menor, de
modo que elas tenham uma maior interação entre si e consequente maior
organização do sistema) ocorre uma diminuição de entropia (ΔS<0), de modo
que o termo –TΔS seja positivo. Assim, um aumento de temperatura aumenta o
módulo de um termo positivo no cálculo da Energia Livre de Gibbs, tornando-a
cada vez maior, ou seja, cada vez mais positiva (ou mais próxima do zero, se
antes fosse negativa).
Relação com a pressão Para gases, a solubilidade depende da
pressão parcial do gás, segundo a lei de Henry:
S=hxp
Onde S = solubilidade
h = constante de Henry (depende do soluto, do solvente e da
temperatura).
p = pressão parcial do gás
Produto de solubilidade (Kps) É a constante de equilíbrio entre a fase
sólida e a fase dissolvida (ou seja, é calculado em soluções saturadas, para
que haja o equilíbrio em questão). Em outras palavras, é o produto entre as
concentrações dos íons para o qual a solução está saturada (com ou sem
corpo de fundo).
A(s) bB(aq)+ + cC(aq)-
b
Kps B C
c
IMPORTANTE: Começará a ocorrer precipitação quando o produto
das concentrações dos íons for igual ao Kps, ou seja, quando Q = Kps,
sendo Q o produto da concentração dos íons em qualquer instante fora
do equilíbrio.
Solubilidade molar É a quantidade máxima de mols de soluto que
podem ser dissolvidos no solvente em uma dada temperatura (é dada em
mol/L). É esse valor que deve ser posto do sólido para que se atinja o Kps, ou
seja, se a solubilidade molar é 10 mol/L, em um litro de solução é preciso que
se adicione 10 mol do sólido para que o produto da concentração dos íons seja
igual ao Kps, ou seja, para que Q = K.
Exemplo 1
A solubilidade molar do Ag2CrO4 é 6,5x10-5 M, determine o valor do
Kps.
A reação envolvida é:
Ag2CrO4(s) 2Ag(aq)+ + CrO4(aq)2+
Chamando a solubilidade molar de S, se forem adicionados S mols do
dicromato de prata serão formados 2S mols de Ag+ e S mols de CrO42+.
Como S é a quantidade que precisamos adicionar para que Q = K, temos
que:
2
-12
Kps = (2S)
xS =o1,1x10
Pode-se
utilizar
mesmo raciocínio para calcular a solubilidade molar,
caso seja fornecido o Kps.
É importante constatar que para a resolução desse tipo de exercício,
devemos considerar que há dissolução total do sal.
Como prever se vai precipitar? Basta calcular o Q e compará-lo com o
Kps: se o Q for igual ao Kps, qualquer adição extra formará precipitado.
Exemplo 2
Haverá formação de precipitado quando 200 mL de AgNO 3 1,0x10-4 M e 900
mL de KCl 1,0x10-6 M forem misturados?
Dado: Kps AgCl = 1,6x10-10
10-4 = (nAgNO3)/0,2 nAgNO3 = 0,2x10-4 mols de Ag+MAg+ = 0,18x10-4 mol/L
10-6 = (nKCl)/0,9 nKCl = 0,9x10-6 mols de Cl- MCl- = 0,81x10-6
Calculando o Q:
Q = 0,18x10-4x0,81x10-6 = 1,49x10-11
Como Q < Kps, não haverá formação de precipitado.
Precipitação seletiva Quando temos mais de um cátion em uma
solução, por exemplo, podemos querer saber qual deles precipitará primeiro
diante da adição de um ânion. Nessas situações, devemos lembrar que
ocorrerá precipitação quando Q = Kps, ou seja, precisamos descobrir qual dos
dois cátions precisam da adição de menos ânion para atingir o Kps.
Exemplo 3
A água do mar contém Mg2+ 0,050 M e Ca2+ 0,010 M. Quando NaOH
sólido for adicionado, qual cátion precipitará primeiro (sob a forma de
hidróxido)?
As reações de interesse são:
Mg(OH)2 Mg2+ + 2OHCa(OH)2 Ca2+ + 2OHCalculando o Q para os dois casos:
QMg = 0,05x(MOH-)2
QCa = 0,01x(MOH-)2
Ocorrerá precipitação quando Q = Kps, ou seja:
0,05x(MOH-)2 = KpsMg(OH)2 MOH- = (KpsMg(OH)2/0,05)1/2
0,01x(MOH-)2 = KpsCa(OH)2 MOH- = (KpsCa(OH)2/0,01)1/2
Como não foram fornecidos os valores de Kps não é possível finalizar o
problema. A resposta será aquele precisar de menos OH, ou seja, o que tiver
o menor valor de MOH-
Tipos de reações
Reação de precipitação Reação entre duas soluções na qual ocorre a
formação de um sólido, chamado de precipitado.
Na representação das reações de precipitação, pode-se usar três tipos
de equações:
1 – Equação global Mostra todas as espécies.
2 – Equação iônica completa Mostra os íons presentes na solução e
os sólidos formados pela reação entre os íons. Mostra todos os íons, mesmo
os íons espectadores (aqueles que não reagem).
3 – Equação iônica incompleta Mostra os íons presentes na solução e
os sólidos formados pela reação entre os íons. Mostra somente os íons que
participam de reações, omitindo os íons espectadores.
Reação de ácido-base Reação de neutralização, com formação de
sais.
Reação de óxido-redução Reação na qual ocorre transferência de
elétrons.
Reação de complexação Reação para formar complexos.
Esses três últimos tipos de
detalhadamente em aulas específicas.
reações
serão
abordados
mais