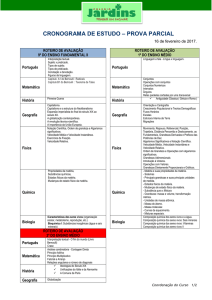
C. E. OLGA BENARIO PRESTES
Correção da Lista de exercícios – 3ª BIMESTRE – 2ª ANO
QUESTÃO 01:
QUESTÃO 04:
1. Falso, só é considerado solução se forma mistura
homogênea.
2. Verdadeiro.
3. Verdadeiro.
4. Falso. Para ser considerado função de estado, a
variação da propriedade deve ser função apenas do
estado final e do estado inicial. No caso da entalpia H,
sua variação (∆𝐻) só depende do estado final e do
estado inicial, sendo portanto uma função de estado.
5. Falso. Isso só é verdade se a temperatura e a
pressão forem constantes. Por este motivo, usamos a
entalpia-padrão, onde temos uma temperatura fixa
de 298K e pressão fixa de 1 bar.
6. Verdadeiro.
7. Falso. Se ∆𝐻 é negativo, isto implica que a entalpia
dos produtos é menor que a dos reagentes, logo
libera energia.
QUESTÃO 02: Em qual dos
precisaríamos da concentração?
casos
𝑚1
𝑚1
40
40
=
=
=
= 0,4
𝑚
𝑚1 + 𝑚2 40 + 60 100
O título percentual em massa é:
%𝜏𝑚 = 𝜏𝑚 × 100 = 0,4 × 100 = 40%
𝜏𝑚 =
QUESTÃO 05:
𝑀=
𝑛1
𝑛1
→ 40 =
→ 𝑛1 = 40 × 200 = 8000 𝑚𝑜𝑙𝑠
𝑉
200
QUESTÃO 06: Pela lei de Hess, se eu conseguir somar
reações químicas de modo a obter uma reação química
global como resultado, a soma de suas entalpias será a
entalpia da reação global. A reação global que o problema
pede é: 2 N2(g) + 5 O2(g) 2N2O5(g). Se reorganizarmos as
reações fornecidas pela questão da seguinte forma, a
soma será a reação global pedida pelo problema:
2 H2O(ℓ) → 2 H2(g) + O2(g) ∆H = +571,5 kJ (invertemos)
4 HNO3(ℓ) →2N2O5(g) + 2H2O(ℓ) ∆H = +153,2 kJ (invertemos
e dobramos)
2 N2(g) + 6 O2(g) + 2 H2(g) → 4HNO3(ℓ) ∆H = -696,4 kJ (
abaixo multiplicamos por 4)
Soma: 2 N2(g) + 5 O2(g) 2N2O5(g) ∆H = 571,5 + 153,2 -696,4
1. Precisamos da concentração, pois não sabemos a
= 28,3 kJ (positivo, absorve). Resposta (B).
quantidade de reagentes que estão misturados.
2. Não é necessário.
QUESTÃO 07: Para determinação da entalpia padrão de
formação, precisamos formar um mol da substância
QUESTÃO 03:
composta a partir de substâncias simples em seu estado
a) Densidade é uma propriedade da substância, de referência (mais estável). A resposta seria a letra (C),
ou seja, depende da massa e do volume da pois a forma de referência do carbono é o carbono grafite
substância. Concentração comum é uma
e do oxigênio é o O2, formando um mol do composto.
propriedade da solução e correlaciona a
massa do soluto pelo volume da solução.
b) Concentração comum relaciona uma massa QUESTÃO 08: A entalpia de uma reação pode ser
de soluto pelo volume da solução. determinada desde que saibamos as entalpias de
Concentração molar relaciona o número de formação de todas as substâncias. Para a reação
mols do soluto pelo volume da solução.
especificada, teremos que:
c) Titulo em massa correlaciona a massa do
soluto pela massa da solução. Titulo em ∆𝐻 = ∆𝐻
𝑓𝑜𝑟𝑚𝑎çã𝑜 𝐻2𝑂 + ∆𝐻𝑓𝑜𝑟𝑚𝑎çã𝑜 𝐶𝑎𝐶𝑂3
volume correlaciona o volume do soluto pelo
− ∆𝐻𝑓𝑜𝑟𝑚𝑎çã𝑜 𝐶𝑎(𝑂𝐻)2 − ∆𝐻𝑓𝑜𝑟𝑚𝑎çã𝑜 𝐶𝑂2
volume da solução.
d) Título é o valor numérico da equação do
titulo. O titulo percentual é o valor Pela tabela, podemos calcular:
percentual.
Obtemos
este
valor
multiplicando o valor numérico do título por ∆𝐻 = −241,8 − 1206,9 + 393,5 + 986,1 =
𝑘𝐽
100.
−69,1 𝑚𝑜𝑙. A reação é exotérmica.