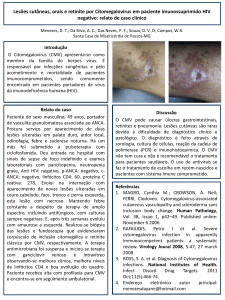
INSTRUÇÕES DE USO
HEMAGEN®VIRGO®
CMV- IgM - Imunofluorescência
Cat. No. 902112 - 96 testes (12x8)
USO DO PRODUTO
O teste de Citomegalovirus (CMV) – IgM Hemagen® Virgo® por
imunofluorescência indireta é usado para a detecção e titulação dos
anticorpos IgM do citomegalovirus no soro humano.
RESUMO, EXPLICAÇÃO E PRINCÍPIO DO TESTE
Por toda parte do mundo, a infecção por citomegalovírus (CMV) é
assintomaticamente adquirida durante a infância. Porém, em uma
comunidade afluente, a infecção primária pode ser retardada resultando
em:
- infecção durante a gravidez conduzindo ao princípio evidente
ou retardado de anomalias congênitas em recém-nascidos.
- Infecção seguida de transfusões de sangue que pode conduzir
a mononucleose induzidas por CMV.
- Infecção seguida de imunossupressão por transplante de órgão
que pode conduzir a complicações durante a recuperação e/ou
perda de órgão.
A infecção por CMV não pode ser clinicamente diagnosticada sem
confirmação pelo teste de laboratório, tais como, o isolamento do vírus
ou a demonstração de um aumento sorológico no título do anticorpo
específico.
Em 1904, Rippert descreveu células contendo grandes inclusões que é
o efeito anátomo-patológico primário causado pelo CMV1. Este herpes
vírus foi primariamente isolado cinqüenta anos mais tarde por Smith,
CMV IgM IFA
1
mas o termo descritivo citomegalovirus foi denominado por Weller 2,3 .
O CMV tem a capacidade de persistir em seu hospedeiro humano
indefinidamente como uma infecção latente nas várias glândulas e nos
rins. Ao contrário de outras viroses por herpes, o CMV cresce
lentamente, produzindo um efeito citopático retardado nas culturas de
células. A citomegalia é característica de uma infecção de CMV,
resultando em células dilatadas contendo inclusões nucleares grandes.
Os estudos de prevalência baseado na freqüência de soro positivo
individuais na população geral (40-100 %), mostra uma correlação
inversa entre a aquisição da infecção do CMV e a condição sócio
econômica da população. Estudos da incidência relacionada à idade
sugere risco aumentado durante os períodos perinatal e reprodutivo do
ciclo de vida humano5. A infecção perinatal pode ser adquirida através
de secreções cervicais e leite materno, ao passo que o súbito aumento
na soroconversão da maturidade sexual é sugestivo de uma possível
transmissão venérea. Apesar de ser menos freqüente, a infecção de
CMV prenatal pode resultar de transmissão transplacentária da mãe
para o feto e é a maior causa de infecção do retardamento mental e
outros defeitos congênitos em recém nascidos. Somente 1 em 2000
crianças nascem expressando doença de inclusão citomegálica severa
(CID), enquanto que dez vezes esta relação adquirem infecção
assintomática no útero. Clinicamente, a doença congênita
assintomática ou “silenciosa” é importante devido ao possível efeito de
desenvolvimento a longo prazo e a perda dos sinais clínicos evidentes
para guiar o diagnóstico médico6 . Adicionalmente podem ocorrer os
dois tipos de infecção iatrogênica. Primeiro, a infecção recorrente ou
reativada freqëntemente segue a terapia imunossupressiva que
tipicamente acompanha o transplante de órgão 7 ou tratamento de
câncer8 . Segundo, receptores de transfusões múltiplas normalmente
adquirem a infecção primária ou a reativada9 . Estas infecções
oportunistas são freqëntemente subclínicas, mas a severidade do estado
de doença depende da dose recebida, do estado imune e da
competência do sistema imune do indivíduo. Uma vez que a presença
do anticorpo IgG circulante do CMV é indicativo de infecção prévia, a
pesquisa da soropositividade em mulheres grávidas, receptores de
órgãos transplantados e outros pacientes imunossuprimidos é uma
CMV IgM IFA
2
ferramenta valiosa para determinar se eles foram ou não previamente
infectados.
PRINCÍPIO DO TESTE
Os ensaios de anticorpos fluorescentes Hemagen® Virgo® utiliza o
método indireto de impregnação de anticorpo fluorescente, descrito
pela primeira vez por Weller e Coons em 1954 10 . O procedimento é
realizado em dois passos de reações básicas. No passo um, o soro
humano a ser testado entra em contato com o substrato antigênico. O
anticorpo, se presente no soro teste, irá se ligar ao antígeno, formando
um complexo antígeno-anticorpo. Se o soro a ser testado não contém
anticorpo a este antígeno particular, não é formado nenhum complexo
e todos os componentes do soro são lavados no passo de lavagem. O
segundo passo envolve a adição de um anticorpo anti-humano marcado
com fluoresceína aos poços de teste. Se o complexo antígeno-anticorpo
específico é formado no passo um, o anticorpo marcado com
fluoresceína irá ligar à metade do anticorpo do complexo no passo
dois. Uma reação positiva,verde-maçã fluorescente brilhante pode ser
vista com a ajuda de um microscópio de fluorescência.
Princípio do Teste Indireto de Anticorpo Fluorescente
Passo 1
Antígeno (substrato) na lâmina + Anticorpo específico = Complexo
Antígeno-Anticorpo
Passo 2
Antígeno-Anticorpo + Anticorpo anti-humano marcado com
fluoresceína = Fluorescência
MATERIAIS FORNECIDOS
Quantidade de testes: 96 testes
CMV IgM IFA
3
12 (8 poços)
01 frasco
01 frasco
01 frasco
03 pacotes
01 frasco
02 pacotes
Lâminas contendo células infectadas com CMV (cepas
AD- 169) e células não infectadas, fixadas.
Frasco de Controle Positivo contendo soro humano
liofilizado.
Frasco de Controle Negativo contendo soro humano
liofilizado.
Conjugado FITC contendo IgM anti-humano inativado
de cabra (cadeia μ específica) liofilizado com contracorante.
*Tampão fosfato (PBS) em pó, com pH 7,4 +/- 0,2.
*Contendo 2 ml de glicerol tamponado.
*Contendo 5 mata-borrões.
*Estes componentes podem ser trocados entre diferentes lotes.
MATERIAIS REQUERIDOS MAS NÃO FORNECIDOS
Tubos de testes e estantes para fazer as diluições.
Pipetas para a preparação das diluições.
Lamínulas de 22 x 50 mm, Nº 1 de espessura.
Câmara úmida.
Agitador magnético de placa (opcional)
Travessa de coloração e estante com suporte de lâmina.
Microscópio de fluorescência. Referir ao manual de
instruções do fabricante para que o sistema de filtro dê ótimos
resultados para o FITC (comprimento de excitação máxima =
490 nm. Comprimento de emissão média = 520 nm).
Estes materiais podem ser obtidos nas lojas e/ou empresas que vendem
produto e acessórios para laboratório.
ARMAZENAMENTO E ESTABILIDADE
1.
Armazenar o kit de 2º a 8º C. O pó de PBS e o glicerol
tamponado podem ser armazenados de 2º a 30º C se desejado.
CMV IgM IFA
4
2.
O kit de teste pode ser usado até a data de expiração indicada
no lado externo da caixa.
Após a hidratação: o controle positivo, controle negativo e o
conjugado FITC deverão ser armazenados de 2º a 8º C, ou
divididos em alíquotas e armazenados a – 20 ºC ou menos,
caso não seja usado dentro de uma semana.
NOTA: Foram tomadas precauções na fabricação deste produto
para proteger os reagentes de contaminação. Após a
reconstituição, deverão ser tomados cuidados para proteger os
reagentes deste kit de contaminação. Se for mantida uma
temperatura constante de armazenamento, os reagentes e
substratos deverão ser estáveis até o período de vencimento do kit.
CUIDADOS E PRECAUÇÕES
1.
2.
3.
4.
5.
Este kit é somente para uso diagnóstico in vitro.
Manusear todas as amostras do ensaio, lâminas, controles
positivo e negativo como se fossem capazes de transmitir
agentes infecciosos. Todos os componentes de sangue
humano do kit foram testados por métodos aprovados pelo
FDA e apresentou-se negativo para antígeno de superfície da
hepatite B (HbsAg) e para anticorpos ao vírus tipo 1da
imunodeficiência humana HIV-1. Como nenhum método
pode oferecer completa segurança de que o vírus do HIV,
hepatite B e outros agentes infecciosos estão ausentes, as
amostras e os reagentes do kit deverão ser manuseados no
Nível 2 de Biossegurança, como recomendado para qualquer
soro humano ou amostra de sangue potencialmente
infeccioso 11,12 .
Os substratos antigênicos são fixados em acetona. Tentativas
de re-isolar o vírus se apresentaram negativos.
Não pipetar com a boca.
Não fumar, comer ou beber em áreas onde as amostras ou
reagentes do kit são manuseados.
CMV IgM IFA
5
6.
7.
8.
9.
Todos os materiais usados neste ensaio, incluindo reagentes,
amostras e materiais de limpeza deverão ser descartados de
uma maneira que irá inativar os agentes infecciosos.
Não usar o kit ou os reagentes individuais além das suas datas
de expiração marcadas.
Os componentes do kit foram testados como uma unidade.
Não trocar os componentes de outras fontes ou de diferentes
lotes, exceto quando anotado.
Proteger o conjugado de exposição prolongada à luz.
COLETA, ARMAZENAMENTO E MANUSEIO DA AMOSTRA
1.
As amostras de soro podem ser armazenadas à temperatura
ambiente até 24 horas. Por um período mais longo, podem
ser armazenados de 2º a 8ºC (por até 3 dias), ou congeladas a
–20ºC ou menos. Colocar a 37ºC até que a amostra seja
descongelada. Remover e misturar bem antes do uso. Não é
recomendado o auto degelo. Evitar ciclos múltiplos de
congelamentos e descongelamentos13 .
2.
A ótima execução do kit de CMV IgM Hemagen® Virgo®
IF depende do uso de amostras de soro frescas. As amostras
deverão ser colhidas assepticamente. A separação rápida do
coágulo previne a hemólise do soro14 .
3.
Para melhores resultados, deverá ser colhida uma nova
amostra se houver a presença de contaminação bacteriana ou
lípides. Se não for obtida uma nova amostra, é requerida uma
filtração (0,45 μ) ou centrifugação (aproximadamente
3000xG por 10 minutos).
4.
O excesso de lípides no soro teste pode produzir uma reação
de “filmagem”. Os lípides “fixam”não especificamente no
vidro e são extremamente difíceis de remover. A experiência
CMV IgM IFA
6
irá habilitar o técnico a diferenciar esta reação de “filme”da
reação específica.
5.
Ocasionalmente as amostras podem conter certas enzimas
proteolíticas que atacam e digerem o substrato. Isto é devido
especialmente a amostras contaminadas com
microorganismos. Tais amostras podem ser aquecidas a 56ºC
por 30 minutos. Caso não ocorra a redução da atividade
enzimática, deverá ser colhida nova amostra do paciente.
PROCEDIMENTO DO TESTE
A- PREPARAÇÃO DOS REAGENTES
Deixar todos os reagentes e lâminas atingirem a
temperatura ambiente por 15 a 30 minutos antes do uso.
CMV IgM IFA
1.
Lâminas e glicerol: prontos para uso.
2.
PBS: dissolver o conteúdo de um pacote
em 1 litro de água destilada ou
deionizada. Fechar o recipiente para
prevenir contaminação ou evaporação.
3.
Controles: reidratar com 1,0 ml de PBS.
Os controles estão agora a uma diluição
apropriada de trabalho. Aliquotar e
armazenar a –20ºC caso não seja usado
em uma semana.
4.
Conjugado: reidratar com 2,0 ml de PBS.
Armazenar de 2º a 8ºC ou aliquotar e
armazenar a –20ºC.
7
B- PROCEDIMENTO
As amostras podem conter agentes infecciosos portanto
deverão ser manuseadas com cuidado. Para obter ótimos
resultados NÃO deixar os poços do substrato secarem
durante a execução do teste.
1. Remover do refrigerador as lâminas e os
reagentes requeridos e deixe-os atingir a
temperatura ambiente (15 a 30 minutos).
2. Remova as lâminas da embalagem apenas antes
do uso e identifique.
3. Reidrate os controles para preparar a diluição
apropriada a 1:8. Estes são agora
representativos de padrões de fluorescência
positivo e negativo típico.
4. Dilua as amostras com PBS a diluições
apropriadas ou prepare diluições seriadas para a
determinação quantitativa.
5. É necessário testar 1 Controle Positivo, 1
Controle Negativo e 1 Controle de Tampão
PBS para cada bateria de lâminas testadas.
6. Cobrir cada poço com uma amostra diluída ou
controles (aproximadamente 10-20 μl por
poço).
7. Incubar em uma câmara úmida de 20º - 25ºC
por 60 minutos.
8. Enxaguar as lâminas rapidamente com um leve
jato de PBS. Não jogar direto nos poços.
9. Enxaguar as lâminas completamente por 7
minutos em uma travessa de coloração do PBS.
Trocar o tampão e lavar uma vez mais por 8
minutos. Manusear as lâminas levemente. É
necessária uma leve agitação do tampão para a
lavagem eficiente da lâmina.
CMV IgM IFA
8
10. Secar o lado pintado da lâmina com o mataborrão fornecido. Não deixar os poços secarem
antes da adição do conjugado.
11. Cobrir cada poço com uma gota (~10 μl) do
Conjugado FITC.
12. Incubar em uma câmara úmida de 20º - 25ºC
por 30 minutos. Proteger da luz intensa.
13. Repetir os passos 8 e 9. Secar o lado pintado da
lâmina com o mata-borrão, não deixar os poços
secarem antes da adição do glicerol.
14. Colocar uma pequena gota do Glicerol
Tamponado em cada poço e cobrir com uma
lamínula.
15. Para melhores resultados, as lâminas deverão
ser lidas imediatamente em aumento de 200 –
500 X. Alternativamente, as lâminas podem ser
lidas dentro de 24 horas. Porém elas deverão ser
armazenadas de 2º a 8ºC no escuro e seladas
para prevenir a secagem do fluido de
montagem.
C- CRITÉRIO PARA A GRADUAÇÃO DA
INTENSIDADE DE FLUORESCÊNCIA
4+
Fluorescência verde-maçã brilhante nos corpos de
inclusão nuclear difuso.
3+
Fluorescência verde-maçã luminoso nos corpos de
inclusão nuclear difuso.
2+
Fluorescência verde-maçã claro distinguível nos
corpos de inclusão nuclear difuso.
1+
Fluorescência verde-maçã escuro, mudando a forma
mas legível nos corpos de inclusão nuclear difuso.
0
Nenhuma fluorescência ou fluorescência
discretamente visível (qualquer fluorescência visível
é normalmente de cor amarelada).
CMV IgM IFA
9
D- GUIA PARA CARACTERIZAR A
FLUORESCÊNCIA
FLUORESCÊNCIA ASSOCIADA AO CMV
Uma reação de anticorpo de CMV positiva é caracterizada pela
presença de corpos de inclusão nuclear difuso que exibe fluorescência
verde-maçã. Como controle adicional, as células não infectadas são
misturadas com células infectadas. Cada campo de fonte alta deve
conter células que não exibem fluorescência específica. Estas células
não infectadas “negativas” deverão exibir coloração do citoplasma
vermelha ou laranja com núcleo preto-esverdeado a preto.
FLUORESCÊNCIA NÃO ESPECÍFICA
Toda a célula exibe fluorescência verde-maçã positiva no núcleo,
citoplasma ou em ambos. Um estado de doença não relacionado ou em
conjunto com infecção por CMV, tais como anticorpo antinuclear ou
anticorpo antimitocondrial deverão ser considerados como
responsáveis por esta reação 15,16 .
NENHUMA FLUORESCÊNCIA
Ausência de fluorescência ou menos que 1+ nas inclusões dentro do
núcleo. Áreas amareladas a amarelo-esverdeadas no citoplasma
somente.
Notas:
1.
Nas determinações quantitativas o título de ponto final é a
diluição mais alta que apresenta fluorescência 1+ nas
inclusões.
CMV IgM IFA
10
2.
Os corpos de inclusão são formados no núcleo do fibroblasto
humano infectado com CMV. Tem sido reportado que o
CMV também induz receptores para a porção Fc das
moléculas de IgG. A reação somente na região perinuclear
(Golgi) das células infectadas deverão ser consideradas não
relacionadas com anticorpos anti-CMV17,18 . O contra corante
empregado com o conjugado tende a fazer a fluorescência
citoplasmática mais amarela do que verde. As inclusões
difusas fluorescentes verde-maçã definidas devem estar
presentes.
ORIENTAÇÕES SOBRE OS PROCEDIMENTOS DE LEITURA
ESPECIFICAÇÕES DO MICROSCÓPIO
Os sistemas de comparação de filtro são mostrados abaixo:
Fluorescência da luz transmitida:
Fonte de Luz
Vapor de Mercúrio
200W
50W
Tungstenio Halogenio
50W
100W
Fluorescência da luz incidente:
Filtro de Excitação
KP490 + BG 38
(4 mm) ou BG 12 (4 mm) +
BG 38 (4 mm)
KP 490 + BG 38
(4 mm)
KP510, K515, K530
Raio dicroico
Filtro de Excitação
de espelho dividido
KP500 + BG 38 (4 mm) ou
TK510
BG 23 (4 mm) para a
supressão vermelha mais
forte. Filtro de canto de 450
nm, 480 nm para banda de
excitação estreita, supressão
da série de auto-fluorescência.
Fonte de Luz
Vapor de mercúrio
200W
100W
50W
CMV IgM IFA
Filtro de Barreira
KP510, K530
11
Tungstenio Halogenio
50W
100W
KP500 + BG 38 (4 mm)
TK510
INTERPRETAÇÃO DOS RESULTADOS
Resultados
IgM
Nenhuma fluorescência ou intensidade de
fluorescência < 1+ à diluição 1 : 8
Fluorescência > ou = 1+ à 1 : 8 ou mais em uma única
amostra de soro.
Significado
Nenhum anticorpo IgM de C
Suscetível de infecção por C
Positivo pela IF para os anti
CMV. Normalmente indicat
corrente ou recente.
LIMITAÇÕES DO PROCEDIMENTO
1.
2.
3.
4.
Os procedimentos do teste CMV IgM Hemagen® Virgo® e a
interpretação dos resultados devem ser seguidos à risca para
obtenção de resultados confiáveis.
Os resultados de uma determinação simples do anticorpo não
deverão ser usados para o diagnóstico de infecção recente.
Amostras pareadas (agudas e convalescentes) deverão ser
colhidas e testadas ao mesmo tempo para verificar a
soroconversão ou aumento significativo dos níveis de
anticorpos.
O aumento significativo nos níveis de anticorpos indica
estímulo antigênico recente mas não indica necessariamente
excreção viral ativa. Uma vez que foram observadas
flutuações de quatro diluições nos níveis de anticorpos de
CMV IgG em alguns indivíduos aparentemente saudáveis, a
forma mais definitiva de diagnóstico de infecção por CMV
ativa é a cultura viral. Porém têm sido descritos casos de
viremia assintomática19,20,21.
A falta de aumento significativo no título de anticorpos não
exclui a possibilidade de infecção por citomegalovírus.
CMV IgM IFA
12
5.
A presença de anticorpo CMV IgG não assegura a proteção à
doença.
6. Ao medir os níveis de anticorpos IgG, os resultados positivos
em neonatos deverão ser interpretados com cautela uma vez
que o anticorpo materno é transferido passivamente da mãe
para o feto antes do nascimento. Os ensaios de IgM são
geralmente os indicadores mais úteis da infecção em crianças
abaixo de 6 meses.
7. As amostras colhidas muito precocemente no curso de uma
infecção pode não apresentar níveis detectáveis de IgM. Em
tais casos é recomendado que seja feito um ensaio de IgG ou
então que seja colhida uma segunda amostra de soro de 10 a
14 dias mais tarde para ser testada em paralelo com a amostra
original para verificar a soro conversão, que é indicativa de
infecção primária.
8. Quando ambos os testes de CMV IgG e CMV IgM são
positivos, existe a possibilidade de um falso positivo devido à
presença de fator reumatóide22,23. Esta reação também pode
ser observada no soro de alguns recém-nascidos, normais ou
congenitamente infectados, e é devido à produção de
anticorpo IgM contra o IgG materno passivamente adquirido
24
. A execução de um ensaio para o fator reumatóide pode
esclarecer este fenômeno.
9. Quando reações falso positivas devido ao fator reumatóide ou
reações falso negativas devido à ligação competitiva de
anticorpo IgG são suspeitas, recomenda-se um pré-tratamento
do soro para a separação das frações IgG e IgM.
10. Há casos onde uma reação negativa de CMV é observada nas
diluições mais baixas enquanto que as reações se tornam
positivas nas diluições mais altas. Isto é o resultado de uma
reação causada por saturação. É freqüentemente observada em
soros com títulos altos de anticorpos IgM para CMV 25,26,27.
11. Os resultados deste teste deverão ser interpretados juntamente
com outros achados clínicos e procedimentos diagnósticos.
CMV IgM IFA
13
CONTROLE DE QUALIDADE
1.
2.
3.
4.
Os soros controles são representativos de reações positivas e
negativas. Na diluição de pesquisa, o controle positivo
representa uma forte reação (3+ - 4+). Se a intensidade de
fluorescência do controle positivo for menor que a faixa
aceitável, o teste é inválido e deverá ser repetido.
Cada lote do controle positivo deve ser titulado em uma
diluição ponto final. O título ponto final deverá estar dentro
de +/- duas diluições seriais de duplo passo do título de
controle positivo reportado na nota de diluição do kit de CMV
IgG por IF Hemagen® Virgo®. Se os resultados obtidos
estiverem fora da faixa, o teste é inválido e deverá ser
repetido.
Na diluição de pesquisa, o controle negativo não deverá
apresentar uma fluorescência nuclear difusa característica do
CMV. Se for observada fluorescência, o teste é inválido e
deverá ser repetido.
Os resultados do Controle de Qualidade foram obtidos em um
microscópio equipado Nikon® por epiiluminação com uma
lâmpada ARC de mercúrio de 50W HBO, sistema de filtro B
para FITC e uma objetiva seca de 40x (NA0,65). Diferenças
na reatividade de ponto final e intensidade de fluorescência
pode ser afetado pelo tipo e condição de fluorescência do
equipamento usado (ver especificações do microscópio).
CARACTERÍSTICAS DO DESEMPENHO
O teste de CMV de IF foi avaliado pela comparação com o teste de FC,
correntemente usado para a detecção dos anticorpos do
citomegalovírus. As amostras colhidas foram testadas no procedimento
de IF. Os resultados obtidos foram subseqüentemente comparados com
os resultados obtidos nas alíquotas das amostras testadas pelo método
de FC. Os resultados obtidos estão na Tabela 1.
CMV IgM IFA
14
Tabela 1: Resultados dos ensaios de IF e FC para o anticorpo do
citomegalovírus IgM.
Nº da
IF
FC
1
32
16
2
64
32
3
32
16
4
32
64
5
128 64
6
128 64
7
64
32
8
32
16
9
32
32
10
64
64
11
128 16
12
32
16
13
32
32
amostra
CMV IgM IFA
15
CMV IgM IFA
14
64
64
15
64
32
16
64
64
17
32
32
18
128 128
19
128 64
20
64
32
21
64
32
22
32
16
23
32
32
24
64
32
25
32
32
26
32
16
27
32
16
28
64
32
29
64
32
30
128 64
16
REFERÊNCIAS BIBLIOGRÁFICAS
1.
Rippert, H , 1904. Ober protozoenartige Zellen in der Niere
eines syphilitischen Neugeborenen und in der Parotis von
Kindem. Centralb. L. Allg. Pathol., 15:945-948.
2.
Smith, MG.1954. Propagation of Salivary Gland Virus of the
Mouse in Issue Cultures. Proc. Sm.Exp. Blot. Med., 86:435440.
3.
Weller, TH, JB Hanshaw and DE Scott.1960. Serologic
Differentiation of Viruses Responsible for Cytomegalic
Inclusion Disease. Virology, 12:130-132.
4.
Booth, JC, G Hannington, TMF Baktir et al. 1982.
Comparison of Enzyme-Linked Immunosorbent Assay,
Radioimmunoassay, Complement Fixation, Anticomplement
Immunofluorescence and Passive Hemagglutination
Techniques for Detecting Cytomegalovirus IgG Antibody. J.
Clin. Pat.
5.
Carlston, G and B Jalling. 1970. Cytomegalovirus Infections
in Different Groups of Paediatric Patients. Acta Paediatr
Scand., 59:303-309.
6.
Melish, ME and JB Hanshaw.1973. Congenital
Cytomegalovirus Infection: Development Progress of Infants
Detected by Routine Screening. Am. J. Dis. Child.,126:190194.
7.
Ho, M.1982. Cytomegalovirus: Biology and Infection, NY,
Plenum Medical Book, Co.
8.
Bodey, GP, PT Wertlake, G Douglas et al. 1965. Cytomegalic
Inclusion Disease in Patients with Acute Leukemia. Ann.
Intern. Med., 62:899-906.
CMV IgM IFA
17
9.
Prince, AM, W Szumuness, SJ Millian et al. 1971. A
Serologic Study of Cytomegalovirus Infections Associated
with Blood Transfusions. N. Engl. J. Med., 284:1125-1131.
10. Weller, TH and AH Coons. 1954. Fluorescent antibody
studies with agents of varicella and herpes zoster propagated
in vitro. Proc. Soc. Exp. Blot. Med., 86:789-794.
11. NCCLS Doc M29-P.1988. Protection of laboratory workers
from infectious disease transmitted by blood and tissue,
Proposed guideline. National Committee for Clinical
Laboratory Standards. Villanova, PA.
12. CDC/NIH Manual.1988. Biosafety in Microbiological and
Biomedical Laboratories, 2nd. Ed., pp 12-16.
13. NCCLS Doc H18-T.1984. Procedures for the Handling and
Processing of Blood Specimens. National Committee for
Clinical Laboratory Standards. Villanova, PA.
14. NCCLS Doc H3-A2.1984. Procedures for the Collection of
Diagnostic Blood Specimens by Venipuncture, 2nd. Ed. :
Approved Standard National Committee for Clinical
Laboratory Standards. Villanova, PA.
15. Holborow, EJ, DM Weir and GD Johnson. 1957. A Serum
factor in lupus erythematosus with affinity for tissue nuclei.
Br. Med. J. , 11: 732-734.
16. Berg, PA, I Roitt, D Doniach and HM Cooper. 1969.
Mithocondrial antibodies in primary biliary cirrhosis. IV.
Significance of membrane structure for the complement fixing
antigen. Immunol., 17:281-293.
CMV IgM IFA
18
17. Keller, R, R Peitchel, JN Goldman and M Goldman.1976. An
IgG-Fc receptor induced in cytomegalovirus-infected human
fibroblasts. J. Immunol., 116:772-777.
18. Rahman, AA, M Teschner, KK Sethi and H Brandis. 1976.
Appearance of IgG (Fc) receptor(s) on cultured human
fibroblasts infected with human cytomegalovirus. J.
Immunol., 117:253-258.
19. Starr, SE and HM Friedman. 1985. “Human
Cytomegalovirus”. Manual of Clinical Microbiology, 4 th ed.
EH Lennette, A Balows, WJ Hausler, Jr and MJ Shadomy.
Amer. Soc. Microbiol., pp 711-719.
20. Wentworth, B and ER Alexander. 1971. Seroepidemiology of
Infections due to members of the Herpes Virus Group. Am. J.
Epidemiol., 94:496-507.
21. Cox, F and WT Hughes, 1975.J. Pediatrics, 87:190-194.
22. Shirrodaria, PV, KB Fraser and F Stanford. 1973. Ann.
Rheumat. Dis., 32:53-57.
23. Fraser, KB et al. 1971. Brit. Med. J., 3:707-714.
24. Reimer, CB, CM Black, DJ Phillips et al. 1975. Ann. N.Y.
Acad. Sci., 254:77-84.
25. Reynolds, DW, S Stagno and CA Alford.1979.Laboratory
Diagnosis of Cytomegalovirus Infections. In Diagnostic
Procedures for Viral, Rickettsial and Chlamydial Infections.
Lennette, EH and NJ Schmidt (eds). American Public Health
Awn., Washington, DC pp. 399-439.
CMV IgM IFA
19
26. Holborow, EJ and GD Johnson. 1967. Immunofluorescence in
Handbook of Experimental Immunology. Weir, DM (ed). FA
Dads and Company. Philadelphia. Pp 571-596.
27. Eisen, HN. 1974. Immunology. Harper and Row. New York,
pp 359-404.
RESUMO DO KIT DE CMV IgM DA Hemagen VIRGO
IMPORTANTE: É recomendado que se esteja familiarizado com o
procedimento detalhado nas instruções de uso antes de usar este
resumo.
Cobrir os poços com as diluições apropriadas das amostras e
controles. Para a determinação quantitativa, preparar diluições
seriadas de duas etapas.
Incube as lâminas em câmara úmida de 20º a 25ºC por 60 minutos.
Enxaguar as lâminas rapidamente com PBS. Lavar por 15 minutos,
trocando o tampão 1 vez. Enxugar as lâminas.
Cobrir cada poço com o conjugado FITC.
Incubar as lâminas em uma câmara úmida de 20º a 25ºC por 30
minutos.
Repetir o passo de lavagem descrito acima.
CMV IgM IFA
20
Colocar uma pequena gota do Glicerol Tamponado em cada poço e
cobrir com uma lamínula.
Ler as lâminas imediatamente de 200-500X de aumento em um
microscópio de fluorescência.
TERMO DE GARANTIA
Este kit como um todo tem garantia de troca, desde que esteja dentro
do prazo de validade e seja comprovado pela Assessoria Científica da
HEMAGEN DIAGNÓSTICOS de que não houve falhas técnicas na
execução, manuseio do teste e na conservação do produto.
IMPORTADO E DISTRIBUÍDO POR:
HEMAGEN DIAGNÓSTICOS COM. IMP. EXP. LTDA.
Rua Doutor Diogo de Faria, 109 – Vila Clementino
São Paulo - SP - CEP 04037-000
Fone: (011) 3819-5222 Fax: (011)3816-7623
CGC: 64.002.686/0001-32
Resp. Técnico: Dhália Gutemberg CRF 07.183 - SP
FABRICADO POR:
HEMAGEN DIAGNOSTICS, INC.
VIRGO® PRODUCTS DIVISION
Columbia, Maryland 21045 - USA
Fone: (800) 436-2436 ou 617-890-3748.
SERVIÇO DE ATENDIMENTO AO CLIENTE
CMV IgM IFA
21
Quaisquer dúvidas técnicas, no manuseio deste kit ou no seu
procedimento entrar em contato com a ASSESSORIA CIENTÍFICA
DA HEMAGEN DIAGNÓSTICOS, que estará sempre à disposição
para auxiliar quando ocorrerem dificuldades na utilização de seus
produtos. Contate a HEMAGEN através do seguinte endereço:
HEMAGEN DIAGNÓSTICOS COM. IMP. EXP. LTDA.
Rua Doutor Diogo de Faria, 109 – Vila Clementino
São Paulo - SP - CEP 04037-000
Fone: (011) 3819-5222. Fax: (011) 3816-7623
DATA DA REVISÃO DAS INSTRUÇÕES DE USO
Documento Revisado em: - Março de 2014.
CMV IgM IFA
22