Estrutura da Matéria - UFABC
02/2016
LISTA DE EXERCÍCIOS 1
Escalas e unidades de medidas. Estimativas e notação científica. Unidades do Sistema
Internacional:
1) A torre Eiffel tem 300m de altura. Expresse a altura em : (a) km; (b) cm; (c) mm. (R: 0,300 km;
3X104cm; 3X105m).
2) O olho nu pode-se perceber objetos que tem um diâmetro igual a 3.94x10 -3 polegadas. Qual é o
diâmetro em mm? (R : 0,1 mm).
3) Um milímetro cúbico de óleo é espalhado sobre a superfície da água de tal forma que o filme de óleo
formado tem uma área de 1 metro quadrado. Qual é a espessura desse filme de óleo em Angstrom?
(R : 10 Å).
4) Qual área, em metros quadrados, será coberta por um litro de tinta espalhada de forma a produzir uma
espessura uniforme igual a 100 microns. (R : 10 m).
5) Qual é o volume, em centímetros cúbicos, de um cubo cujo lado mede 150 mm? (R : 3375 cm3).
Determinação de massas atômicas. Conceito de mol. Equação química. Cálculos estequiométricos:
6) Se o ponto ao abaixo possui massa de 1X10-6 g, e se assumirmos que ele foi produzido por uma
lapiseira que usa grafite 0,9 mm, quantos átomos foram requeridos para fazer este ponto?
= Ponto.
(R : 5x1016 átomos).
7) Qual é a diferença entre o número de átomos de carbono em 1,00 g de isótopos de C-12 (massa molar
= 12 g/mol) e 1,00 g de átomos do isótopo de C-13 (massa molar = 13,003 g/mol)? (R : 3.61x10 21
átomos).
8) Durante o pouso na Lua, um dos experimentos realizados foi a medida da intensidade do vento solar.
Uma tira de alumínio de aproximadamente 3000 cm2 foi utilizada como coletor. Em 100 minutos, havia
sido coletada uma massa de 3,0x10-10 g de átomos de Hidrogênio (H). Qual foi a intensidade do vento
solar (em número de átomos por cm2 por segundo)? (R : 1 x 107 átomos cm-2 s-1).
9) Determine a abundância relativa de cada isótopo do Gálio (ocorrência natural) sabendo que a massa
tabelada do Gálio (Ga) é 69,72 u e que os isótopos naturalmente encontrados são: 69Ga = 68,926 e 72Ga =
70,925. (R : 60% de 69Ga e 40% de 72Ga)
10) Qual a quantidade de matéria em um átomo? (R: 1,66 x 10 -24 mol).
11) Um metal tem massa atômica igual a 24 u. Quando reage com um não metal de massa atômica 80 u,
faz isso numa razão de 1 átomo para 2 átomos, respectivamente. Com esta informação, quantos gramas do
não metal irão combinar com 33.3 g do metal? Se 1 grama do metal reagir com 5 g do não metal, qual a
quantidade de produto formado? (R: 220 g; 5,75 g).
02/2016
Estrutura da Matéria - UFABC
Leis dos Gases. Teoria Cinética dos Gases. Desvios do Comportamento Ideal:
12) Considere o manômetro, ilustrado abaixo, primeiro construído por Robert Boyle. Quando h= 40 mm,
qual é a pressão, em mmHg (milímetros de mercúrio), do gás aprisionado no volume indicado por V gás. A
Temperatura é constante e a pressão atmosférica é P atm = 1 atm. (Dado: 1 atm = 760 mmHg).
(R = 800 mmHg = 800 torr)
13) Um frasco contento H2 a temperatura de 0 0C foi selado em uma pressão de 1 atm, a massa de gás
encontrada foi de 0,4512 g. Calcule a quantidade de matéria e o número de moléculas de H2 presentes
neste frasco. (R: 0,2238 mol de H2; 1,348 x 1023 moléculas de H2).
14) Três pesquisadores estudaram 1 mol de um gás ideal a 273 K de modo a determinar o valor da
constante R dos gases. O primeiro pesquisador encontrou que, para a pressão de 1 atm, o gás ocupa 22,4
L. O segundo pesquisador encontrou que, a pressão de 760 torr, o gás ocupa 22,4 L. Finalmente, o
terceiro pesquisador relatou que para o produto da pressão pelo volume o valor encontrado foi 542 cal.
Determine qual o valor de R encontrado por cada pesquisador.
(R: Rprimeiro pesquisador = 0,0821 L atm/K mol; Rsegundo pesquisador = 0,0821 L atm/K mol; Rterceiro pesquisador = 1,99
cal/mol K).
15) Descreva a curva que obteríamos ao representar graficamente Pressão versus Volume para um gás
ideal em que a temperatura e o número de mols deste gás são mantidos constante.
(R: Gráfico a ser desenhado).
16) Um recipiente de 0,100 L mantido a temperatura constante contém 5x10 10 moléculas de um gás ideal.
Quantas moléculas restarão se o volume é mudado para 0,005L? Que volume é ocupado por 10.000
moléculas na temperatura e pressão inicial? (R: 2 x 10-8 L).
17) Um motor de automóvel mal-regulado, em marcha lenta, pode liberar até 1,00 mol de CO por minuto
na atmosfera. Que volume de CO, ajustado para 1,00 atm, é emitido por minuto na temperatura de 27°C?
(R: 24,6 L/min)
18) Foi estimado que cada metro quadrado da superfície da terra suporta 1x10 7g de ar acima dela. Se o ar
é composto de, aproximadamente, 20%, em massa, de oxigênio, qual a quantidade de matéria de O2 há
sobre cada metro quadrado da terra? (R: 6x104 mols).
02/2016
Estrutura da Matéria - UFABC
19) Qual a pressão parcial de cada gás em uma mistura que contém 40 g de He, 56 g de N 2, e 16 g de O2,
se a pressão total da mistura é de 5 atmosferas?
(R: Pparcial He = 4 atm; Pparcial N2 = 0,8 atm; Pparcial O2 = 0,2 atm).
20) Utilizando a tabela das constantes empíricas a e b da Equação de Van der Waals, enumere os gases,
do mais ideal para o menos ideal. Explique.
27) A equação de Van der Waals é uma equação matemática que se aplica aos gases reais e pode ser
apresentada como:
Onde:
Os termos an2/V2 corrige a pressão por levar em consideração a atração intermolecular, e o termo “nb”
corrige o volume por considerar o volume molecular. Usando esta equação, determine se o gás torna-se
mais ou menos ideal quando:
a) O gás é comprimido à temperatura constante;
b) Mais gás é adicionado ao sistema à temperatura e volume constante;
c) A temperatura do gás é elevada a volume constante.
ATENÇÃO: cada resposta deve ser suportada pela aplicação da equação de van der Waals!!!
(R: a. Menos ideal; b. Menos ideal; c. O gás tem comportamento próximo ao ideal)
21) Use:
a) A lei do gás ideal e
b) A equação de van der Waals para calcular a pressão em atmosfera exercida por 10,0g de metano, CH 4
colocando em um recipiente de 1,00L a 25°C. (R: (a) 15,3 atm e (b) 14,8 atm
22) O que significa dizer que um gás se comporta como um gás ideal? Em que situações o
comportamento de um gás tende a se desviar mais do comportamento ideal? Proponha uma justificativa
em nível molecular para isso.
36) Quais as hipóteses para a teoria cinética dos gases? De acordo com essa teoria, qual o significado em
nível molecular da temperatura de um gás?
Construção dos modelos atômicos clássicos (Modelos de Thomson e Rutherford)
23) Descreva a principal contribuição para a ciência de cada um dos seguintes cientistas: Dalton;
Thomson; Millikan; Rutherford.
02/2016
Estrutura da Matéria - UFABC
24) Explique o experimento de espalhamento de partículas , que levou em 1911 à proposição do modelo
atômico de Rutherford. Em sua resposta, aborde necessariamente os seguintes aspectos: a) o que são
partículas ; b) descrição do experimento; c) resultados obtidos; d) de que maneira os resultados revelam
a estrutura do átomo (do que ele é formado, como ele está organizado, como a massa está distribuída, o
volume do átomo, etc.).
25) Numa reconstrução do experimento de Millikan, as gotas formadas atravessam um capacitor cuja
distância entre as placas é de 1cm e que está submetido a uma tensão V. Suponha que a densidade do óleo
seja de 0,8g/cm3, que o diâmetro de uma gota seja de 1 m e que esta gota esteja carregada com dois
elétrons excedentes. Esboce o aparato indicando a direção do campo elétrico e das forças que agem na
gota. Qual deve ser a tensão para que a gota carregada permaneça suspensa em repouso? (R: 128 V).
26) Se, em um de seus experimentos, J.J. Thomson acelerasse os elétrons num tubo de raios catódicos
aplicando uma diferença de potencial de 10.000 V entre o catodo e o anodo, com que velocidade um
elétron estaria ao atingir o anodo? Faça um esboço do que ocorreria indicando o catodo e o anodo, a
direção do campo e a direção da força aplicada sobre os elétrons. (R: 5,93x107 m/s)
Construção do modelo quântico do átomo (Modelo de Bohr) – Parte 1: espectroscopia, radiação do
corpo negro, efeito fotoelétrico:
27) Quando a nave espacial Sojourner pousou em Marte em 1997, o planeta estava a aproximadamente
7,8 × 107 km da Terra. Quanto tempo levou para que o sinal de televisão de Marte chegasse à Terra? (R: 4
m e 20 s)
28) Um telefone celular emite sinais em aproximadamente 850 MHz. Qual o comprimento de onda dessa
radiação? Qual é a energia transportada por cada fóton que compõe a radiação eletromagnética emitida
pelo celular? (R: = 0,35 m; E = 5,6 x 10-25J)
29) Coloque os seguintes tipos de radiação em ordem crescente de energia por fóton: a) luz visível de
uma lâmpada de sódio; b) raios X de um instrumento no consultório de um dentista; c) Micro-ondas em
um forno de micro-ondas; d) ondas emitidas por uma estação de rádio FM em 91,7MHz.
30) Um experimento é montado para demonstrar o efeito fotoelétrico para os metais sódio (Na) e ouro
(Au). Para isso, uma radiação incidente com comprimento de onda de 300 nm é utilizada. Assumindo que
a função trabalho do sódio tem o valor de 4 10-19 J e a do ouro 8 10-19 J por átomo, responda as
questões a seguir.
a) Mostre qualitativamente, num único gráfico, como varia a energia cinética dos elétrons ejetados em
função da frequência da radiação incidente para os dois metais.
b) Determine se a radiação com comprimento de onda de 300 nm será capaz de retirar elétrons dos metais
em questão. (R: será capaz de retirar os elétrons do Na).
c) Se a intensidade da radiação luminosa fosse aumentada, qual seria o efeito sobre o resultado obtido no
ítem “b”? Justifique sua resposta em termos do modelo proposto por Einstein para o efeito fotoelétrico.
02/2016
Estrutura da Matéria - UFABC
31) A velocidade de um elétron emitido pela superfície de um metal iluminada por um fóton é 3,6 x 10 3
km.s-1. (a) Qual é o comprimento de onda do elétron emitido? (b) A superfície do metal não emite
elétrons até que a radiação alcance 2,50 x 1016 Hz. Quanta energia é necessária para remover o elétron da
superfície do metal? (c) Qual é o comprimento de onda da radiação que causa a foto emissão do elétron?
(d) Que tipo de radiação eletromagnética foi usada? (R: (a) 2,02x10-10 m; (b) 1,66x10-17 J (c) = 8,6 nm
(d) Raios-X.
32) A função trabalho do metal crômio é 4,37 eV. Que comprimento de radiação deve ser utilizado para
provocar a emissão de elétrons com a velocidade de 1,5 x 10 3 km.s-1? Como o efeito fotoelétrico,
exemplificado pela ejeção de um elétron pelo crômio, contribui para a elaboração do Modelo Atômico
atual? Como é o modelo atômico aceito atualmente? (R: E = 1,72 x 10-18 J e = 115 nm)
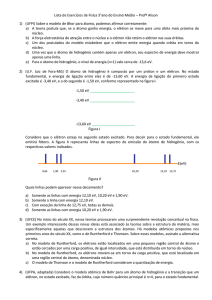
33) Responda as questões que se seguem utilizando o diagrama ao lado, que mostra os
níveis de energia de um elétron num átomo de hidrogênio.
a) Considerando apenas as transições entre os níveis 1, 2, 3 e 4, qual delas está associada à
emissão do fóton com maior comprimento de onda?
b) Considerando apenas as transições entre os níveis 1, 2, 3 e 4, qual delas está associada à
absorção do fóton com maior frequência?
c) Suponha que um átomo de hidrogênio seja excitado de modo que o elétron passe para o
nível n = 3. Calcule o comprimento de onda da luz emitida quando este átomo retorna ao estado
fundamental. Em que faixa do espectro eletromagnético esta radiação se encontra?
d) Calcule a energia de ionização do elemento hidrogênio em unidades de kJ/mol.
(R: (a) 4 3; (b) 1 4; (c) 102,6 nm (radiação UV); (d) 1310 kJ/mol)
34) O gráfico ao lado traz os espectros de emissão atômica dos elementos sódio e mercúrio na faixa de
comprimentos de onda entre 450 e 750 nm, bem como o espectro da
luz branca nesta mesma faixa. Responda as questões abaixo:
emissão atômica? De que maneira cada um destes espectros pode ser
obtido experimentalmente?
b) Lâmpadas de sódio são amplamente utilizadas para iluminação
pública. Qual a coloração destas lâmpadas? De que maneira esta
coloração pode ser inferida a partir do espectro de emissão?
c) Suponha que a luz branca da figura ao lado seja irradiada sobre um
Hg
intensidade (unidade arbitraria)
a) Qual a diferença entre um espectro de absorção e um espectro de
Na
luz branca
bulbo contendo sódio vaporizado a baixa pressão. Esboce num
gráfico qual será o espectro da radiação após ela ter atravessado a
amostra de sódio.
450
500
550
600
/ nm
650
700
02/2016
Estrutura da Matéria - UFABC
d) Repita o raciocínio do ítem “c” para dois casos diferentes: no primeiro, imagine que a luz incidente
sobre a amostra de sódio vem de uma lâmpada de sódio; no segundo, imagine que ela vem de uma
lâmpada de mercúrio.
35) A chamada “espectroscopia de absorção atômica” é uma técnica analítica amplamente utilizada. Em
ciências forenses, por exemplo, ela pode ser aplicada na determinação da presença de resíduos de pólvora
ou de metais pesados em casos de envenenamento. A figura abaixo mostra esquematicamente as partes
que constituem um espectrômetro, com ênfase para a fonte de radiação, o atomizador (responsável por
vaporizar e atomizar a amostra), o selecionador de comprimentos de onda (filtra e seleciona os
comprimentos de onda que chegarão ao detector) e o detector. Com base nas suas respostas anteriores,
explique que tipo de lâmpada deveria ser utilizada para determinar a presença de traços de mercúrio numa
amostra de sódio. Que cuidados deveríamos tomar ao selecionar os comprimentos de onda que chegam ao
detector?
36) De acordo com o modelo de Bohr, um elétron no estado fundamental de um átomo de hidrogênio
move-se em órbita ao redor do núcleo com um raio específico de 0,53 Å. Na descrição do átomo de
hidrogênio pela mecânica quântica, a distância mais provável do elétron ao núcleo é 0,53 Å. Por que essas
duas afirmativas são diferentes?
37) Descobriu-se, em 1965, que o universo é atravessado por radiação eletromagnética com o máximo em
1.05 mm (na região das microondas). Qual é a temperatura do universo no “vácuo”? (R: 2,76 K)
38) Qual é a energia de um quantum de luz que tem um comprimento de onda de 11,592 Å? (R:
1,714x10-16 J)
39) Se o ponto de fusão do ferro é 1540 °C, qual será o comprimento de onda (em nanômetros) que
corresponde à intensidade máxima da radiação quando uma peça de ferro funde? (R: 1600 nm)
40) (a) Qual é o fóton de mais alta energia que pode ser absorvido por um átomo de hidrogênio no estado
fundamental sem causar ionização? (b) Qual é o comprimento de onda dessa radiação? (c) Em que região
do espectro eletrônico observa-se esse fóton? (R: (a) 2,18x10-18 J; (b) 91,1 nm ; (c) UV)
41) (a) Use a fórmula de Rydberg para o hidrogênio atômico e calcule o comprimento de onda da
transição entre n = 5 e n = 2. (b) Qual é o nome dado à série espectroscópica a que esta linha pertence? (c)
Estrutura da Matéria - UFABC
02/2016
Indique a região do espectro que a transição é observada e, caso a transição ocorra na região do visível,
indique qual a cor emitida. (R: (a) 94,9 nm; (b) série de Lyman; (c) região do UV.
42) No espectro do hidrogênio atômico, observa-se uma linha violeta em 434 nm. Determine os níveis de
energia inicial e final da emissão de energia que corresponde a essa linha espectral. (R: transição de n = 5
n = 2)
43) Explique os postulados de Bohr e o modelo atômico proposto por ele. Não esqueça de apontar os
problemas que o modelo não resolveu.
Construção dos modelos quânticos do átomo – Parte 2: o início da nova Mecânica Quântica:
44) O que significa “dualidade partícula-onda”? Quais são suas implicações para nossa visão moderna de
estrutura atômica?
45) O comprimento de onda de De Broglie de um elétron é de 28nm. Determine:
a) o módulo de seu momento linear; (R: 2,4x10-26 kg.m.s-1)
b) sua energia cinética em Joule e em elétron-Volt. (R: 1,97x10-4 J e 1,97x10-3 eV)
46) Os raios dos núcleos dos átomos são da ordem de 5,0 × 10−15 m. Estime a incerteza mínima no
momento linear de um próton quando ele está confinado no núcleo. (R: 1,05x10-20 kg.m. s2-)
47) De acordo com a mecânica quântica, a natureza ondulatória das partículas faz com que partículas
confinadas em uma caixa possuam apenas comprimentos de onda que resultam de ondas estacionárias na
caixa, e as paredes da caixa são necessariamente nós dessas ondas.
a) Mostre que um elétron confinado em uma caixa de comprimento L em uma dimensão possui níveis de
energia dados por
.
b) Se um átomo de hidrogênio for imaginado como uma caixa em uma dimensão cujo comprimento seja
igual ao raio de Bohr, qual será a energia (em elétron-volt) do nível mais baixo de energia do elétron?