Faculdade de Medicina da Universidade do Porto
Serviço de fisiologia
Transportadores de Sais Biliares
Texto de Apoio
Aluna Carla M. C. Sousa
Dra. Cristina Gavina
Professor Doutor J. M. Fortunato
Sais biliares e sua síntese
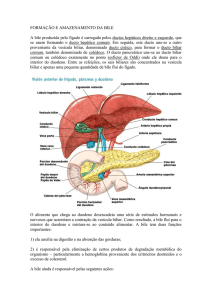
A bile é uma secreção vital, fundamental para a digestão e absorção intestinais de
lípidos e para a excreção de xenobióticos e endobióticos. 75% da bile é secretada pelos
hepatócitos para os canalículos biliares (bile canalicular), os restantes 25% são secretados pelos
dúctulos e ductos biliares (bile ductular/ductal) [1].
Os sais biliares são um dos solutos principais da bile (ilustração 1). Sal biliar é
diferente de ácido biliar. Os ácidos biliares são compostos esteróides anfipáticos derivados do
catabolismo enzimático do colesterol pelo fígado por acção da 7-α-hidroxilase [2]. Os ácidos
biliares primários (essencialmente os ácidos cólico e quenodesoxicólico) são sintetizados nos
hepatócitos e conjugados no terminal carboxilo com taurina ou com glicina. Esta amidação
aumenta o carácter anfipático e diminui as constantes de ionização dos ácidos biliares, tornando-os mais hidrofílicos e mais facilmente excretáveis para a bile. Os glicuronoconjugados, que
predominam em humanos, e os tauroconjugados, predominantes em roedores, têm valores de Ka
de aproximadamente 4 e 2, respectivamente e existem predominantemente na forma de sais
aniónicos, a pH fisiológico [3]. Assim, são chamados de sais biliares.
Ilustração 1: estrutura de um sal biliar
Embora a bile seja isoosmótica com o plasma, os
sais biliares estão 1000 vezes mais concentrados na bile,
necessitando de ser transportados activamente pelos
hepatócitos [4]. Já na bile, uma minoria de sais e ácidos
biliares “protonados” não conjugados viajam como
monómeros e estão sujeitos a “shunt” colehepático (são
reabsorvidos pelas células ductais biliares, voltam aos hepatócitos via plexo capilar periductular
e, são reexcretados pelos hepatócitos para a bile) [3]. Devido às suas propriedades detergentes,
os sais biliares formam micelas mistas com o colesterol e os fosfolípidos, ajudando na sua
solubilização (ilustração 2). Estas micelas são secretadas via ductos e vesícula biliares para o
lúmen do intestino delgado, onde emulsionam gorduras alimentares e vitaminas lipossolúveis.
Além disso, os sais biliares intraduodenais regulam a secreção pancreática e a libertação de
péptidos gastrintestinais.
Ilustração 2: estrutura de uma micela
1
A maioria dos sais biliares são reabsorvidos eficientemente no intestino delgado e
recirculam, via sangue portal, de volta para o fígado. Esta circulação enterohepática (ilustração
3) eficiente assegura que da quantidade total humana de sais biliares (3-4g), que circula 6-10
vezes
por
dia
através
da
via
enterohepática, apenas 0.5g de sais
sejam perdidos por dia por excreção
fecal [1]. Esta perda é compensada por
síntese de novo de sais biliares a partir
de colesterol. [2]. Os sais biliares que
não são reabsorvidos do sangue portal
pelo fígado, são filtrados nos rins, no
glomérulo, e excretados para a urina,
onde
são
reabsorvidos
por
transportadores da membrana borda de
escova do túbulo contornado proximal
[1].
Ilustração 3: circulação enterohepática
Dada importância da circulação enterohepática, torna-se essencial conhecer os
transportadores hepáticos e extrahepáticos que a tornam possível. Vários estudos foram e estão a
ser realizados nesse sentido e no sentido da descoberta dos processos de formação biliar [5].
TRANSPORTADORES DE SAIS BILIARES
A)Transporte hepatocelular de sais biliares
O hepatócito é uma célula epitelial polarizada com membranas basolateral/sinusoidal e
apical/canalicular que diferem na composição bioquímica e características funcionais. Os sais
biliares são concentrados na bile por sistemas de transporte activo que estão dispostos de forma
polarizada. A captação dos constituintes biliares é iniciada na membrana basolateral que está
directamente em contacto com o sangue portal através de fenestras das células endoteliais
sinusoidais do espaço de Disse (ilustração 4). Depois de incorporados pelos hepatócitos, os sais
biliares e outros coléfilos atingem o pólo canalicular por difusão, quer através do citoplasma
aquoso, quer através de membranas lipídicas intracelulares, dependendo da sua hidrofobicidade
[1].
2
A membrana canalicular representa o pólo excretor do hepatócito e forma o bordo do
canalículo biliar. A excreção canalicular dos constituintes biliares representa o passo limitante
da secreção biliar, dado que os constituintes biliares são excretados contra altos gradientes de
concentração.
Captação basolateral
Os sistemas de transporte basolateral de sais biliares são essenciais para a formação
biliar, já que 95% dos sais biliares excretados pelo fígado para a bile são reabsorvidos no
intestino e passam por circulação enterohepática [3].
Os sais biliares não conjugados são ácidos fracos sem carga a pH fisiológico e podem
atravessar as membranas por difusão passiva, contudo a captação de ácidos biliares conjugados
com taurina ou com glicina requer um mecanismo de transporte activo [1]. A captação ocorre
contra um gradiente de concentração e é mediada por mecanismos dependentes e independentes
do sódio. Antes de serem incorporados, os sais biliares têm que se desligar da albumina, o que
ocorre em contacto com a membrana sinusoidal do hepatócito.
Em condições fisiológicas, os sais biliares são removidos do sangue sinusoidal
predominantemente por hepatócitos da zona periportal (zona 1). Os hepatócitos da zona
perivenosa (zona 3) são recrutados somente em concentrações elevadíssimas de sais biliares
(posprandialmente ou em condições de colestase). Assim, o fígado tem uma capacidade
funcional de reserva para a captação de sais biliares.
Existem vários sistemas de transporte envolvidos na captação hepática de sais biliares e
incluem um transportador Na+-dependente de alta afinidade (Ntcp/NTCP) e uma família de
transportadores multiespecíficos de aniões orgânicos que medeia a captação Na+-independente
de sais biliares (Oatps/ OATPs).
•
Via Na+-dependente: Ntcp/NTCP (“Na+-taurocholate cotransporting protein”)
A via dependente do sódio é responsável por mais de 80% da captação de sais
conjugados mas menos de 50% da captação de sais não conjugados. Já que a maioria dos sais
biliares são conjugados, o sistema Na+-dependente Ntcp/NTCP é o sistema de captação
dependente do sódio mais relevante [1]. Ntcp/NTCP é um transportador unidireccional que
medeia captação de sais biliares com uma estequiometria de 2:1 (cotransporte de dois sódios por
cada molécula de taurocolato) e electrogénico, isto é, originado pelo gradiente transmembranar
de Na+ (mantido por uma ATPase Na+-K+) e pelo potencial eléctrico intracelular originado pelas
difusões externas de K+.
3
Este transportador encontra-se exclusivamente na membrana basolateral do hepatócito
diferenciado de mamíferos, e transporta todos os sais biliares, embora a sua actividade
transportadora seja máxima para sais conjugados, como já referido [6].
O Ntcp do rato (gene Slc10a1, localizado no cromossoma 6q240) consiste em 362 a.a.,
com 5 exões separados por 5 intrões e transporta outros compostos como conjugados
estrogéneos e hormonas tireoideias [1]. É considerado o maior sistema de captação dependente
de sódio do fígado de rato [3].
O NTCP do homem (gene SLC10A1) consiste em 349 a.a. e partilha 77% de identidade
com o Ntcp do rato, embora tenha maior afinidade para o taurocolato. O gene do NTCP foi
mapeado no cromossoma 14q24.1-24.2 [3].
•
Via
Na+-independente:
Oatps/OATPS
(“organic
anion-transporting
polypeptides”)
A captação independente de sódio é determinada por vários membros da família
Oatp/OATP. Esta inclui transportadores multiespecíficos com grande preferência por substratos
anfipáticos, incluindo sais biliares conjugados e não conjugados, bilirrubina, esteróides neutros,
drogas e hormonas tireoideias [3]. A captação Na+-independente é quantitativamente menos
significante que a dependente de Na+ e parece ser largamente mediada por trocas facilitadas
com aniões intracelulares [6].
No fígado de rato, a captação basolateral Na+-independente é mediado por 3 membros
da família Oatp [3]. Oatp1 (Slc21a1) é uma glicoproteína com 670 a.a. localizada
essencialmente na membrana basolateral dos hepatócitos e na membrana apical das células
tubulares proximais do rim e é um sistema transportador multiespecífico com grande variedade
de substratos, incluindo sais biliares conjugados e não conjugados, embora com afinidade mais
baixa que Ntcp. Oatp2 (Slc21a5) está altamente presente no rim e no fígado. Trata-se de uma
glicoproteína de 661 a.a. que se localiza essencialmente na membrana basolateral do hepatócito
[3]. Enquanto que Oatp1 está homogeneamente distribuído pelos lóbulos hepáticos, Oatp2 está
predominantemente presente nos hepatócitos pericentrais, excepto nas duas camadas mais
internas [1]. Já que a maior parte da captação hepatocelular de sais biliares ocorre na região
periportal, Oatp1 é o principal responsável pela captação Na+-independente em condições
fisiológicas [3]. Oatp4 (Slc21a10) representa qualitativamente e funcionalmente a proteína mais
relevante do fígado do rato. Trata-se de um transportador multiespecífico com alta afinidade
com alta afinidade para sais biliares.
Oatp3 (Slc21a79) não está expresso no fígado, mas pode ser importante na captação de
sais biliares a nível intestinal.
4
Assim, enquanto Oatp4 trabalha em conjunto com Oatp1 e Oatp2 na membrana
basolateral do hepatócito do rato, Oatp3 é um transportador multiespecífico do intestino delgado
[1].
No humano, três OATPs específicas do fígado (OATP-A, OATP-C e OATP8)
transportam sais biliares, sendo a OATP-C a isoforma mais relevante [1]. O primeiro OATP a
ser identificado no fígado humano foi OATP-A (SLC21A3) que consiste de 670 a.a. [1]. A sua
expressão hepática é baixa e a sua contribuição para a captação hepática de sais biliares é
provavelmente minor [3].
OATP-C (SLC21A6), também conhecido como LST-1 (“liver specific transporter 1”),
OATP2 ou OATP6, consiste de 691 a.a. e está selectivamente presente na membrana basolateral
dos hepatócitos. Transporta taurocolato (com afinidade ligeiramente inferior ao NTCP),
esteróides conjugados, eicosanóides, bilirrubina conjugada, entre outros.
OATP8 (SLC21A8) também se encontra na membrana basolateral dos hepatócitos
humanos, mas a sua verdadeira função permanece desconhecida [1].
Importa notar que, embora o transporte Na+-independente de sais biliares seja uma das
características intrínsecas de vários Oatps/OATPs, cada um destes transportadores exibe
especificidades
para
substratos
adicionais.
Ilustração 4: transportadores hepáticos
de sais biliares.
Efluxo basolateral
Em condições normais o efluxo basolateral de sais biliares para o sangue portal é
mínimo. Contudo, em condições de colestase, o efluxo basolateral pode compensar, pelo menos
em parte, a secreção canalicular de sais biliares [3]. Os sistemas de transporte basolaterais
pertencentes à subfamília dos “multidrug resistance protein” (mrp/MRP) estão muito pouco
expressos em condições normais mas podem ser induzidos por situações colestáticas (upregulation) [3]. Nos humanos esta família engloba actualmente 6 membros (MRP1-6), dos quais
4 (MRP1,2,3,6) já foram identificados no fígado. Mrp3/MRP3 foi identificado na membrana
basolateral dos hepatócitos, colangiócitos e epitélio intestinal, onde pode estar envolvido nas
circulações colehepática e enterohepática. A expressão de Mrp3/MRP3 é muito maior nos
hepatócitos que nos colangiócitos e, no humano, MRP3 surge na região periportal [1].
Os membros da família Oatp/OATP também permanecem candidatos para o efluxo de
sais biliares pela membrana basolateral, já que estudos em oócitos xenopus laevis mostraram
5
que Oatp1 e 2 são capazes de operar como transportadores bidireccionais. Contudo, a verdadeira
contribuição destes transportadores para o efluxo basolateral permanece por determinar [3].
Transporte intracelular
Os mecanismos envolvidos no movimento transcelular de sais biliares pelos hepatócitos
(da membrana basolateral à canalicular) são pouco conhecidos.
Pensa-se que estão envolvidos 2 processos. Em condições fisiológicas, a maioria dos
sais biliares intracelulares liga-se a proteínas citosólicas e difunde-se até á membrana
canalicular, a favor do gradiente de concentração. Estas proteínas incluem a 3-αhidroxiesteróide desidrogenase (3αHSD), glutatião S-transferase e a proteína de ligação de
ácidos biliares (l-BABP) no fígado de rato, e uma proteína ligante de sais biliares de 36 KDa no
fígado humano [5]. Esta liga-se com maior afinidade aos sais biliares que a do rato, mas a sua
função exacta é desconhecida [3]. Em concentrações elevadas de sais biliares, os sais
hidrofóbicos são transportados em vesículas membranosas [3] mas este processo não é
significante em condições fisiológicas.
Excreção canalicular
Este é passo limitante da formação biliar [1]. A membrana canalicular contém sistemas
de transporte ATP-dependentes e ATP-independentes. Os sistemas de transporte dependentes do
ATP são membros da super família “ATP-binding cassette” (ABC) e transportam constituintes
biliares contra gradiente de concentração ao longo da membrana canalicular, graças à energia da
hidrólise do ATP [1].
Um transportador ABC típico consiste em 12 ou mais domínios membranares que
determinam a especificidade para o substrato e 2 ansas nucleotídicas intracelulares que contém
o sítio de ligação do ATP. A maior parte das proteínas ABC pertencem à família MDR
(“multidrug resistance P-glycoprotein”), também conhecida como família ABC-B [1].
•
Via Bsep/BSEP (“bile salt export pump”) para sais monovalentes
A bomba canalicular de excreção de sais biliares Bsep/BSEP (Abcb11/ABCB11) foi
originalmente conhecida como “irmã” da glicoproteína P (spgp), sendo clonada no rato [7]. O
Bsep do rato é uma proteína com 1321 a.a. e foi localizada nas microvilosidades canaliculares e
em subpopulações de vesículas membranosas canaliculares. Ele medeia transporte ATPdependente de vários sais biliares.
Bsep é altamente conservado durante a evolução dos vertebrados e a identificação do
gene BSEP humano é recente, tendo revelado grande semelhança com o do rato [8]. Este gene
está mutado na colestase intra-hepática familiar progressiva tipo 2 (PFIC2). Os atingidos por
6
esta doença não tem BSEP na membrana canalicular e têm concentrações muito baixas de sais
biliares na bile (o que sugere que BSEP é o sistema major de transporte canalicular de sais
biliares) [6].
•
Via Mrp2/MRP2
A bomba de extrusão conjugada Mrp2/MRP2 (Abcc2/ABCC2), também conhecida
como transportador canalicular multiespecífico de aniões orgânicos (cMOAT) foi originalmente
clonado num fígado de rato [1].
Mrp2/MRP2 medeia a excreção canalicular de grande variedade de aniões orgânicos,
incluindo sais divalentes com carga negativa, o mesmo não acontecendo com os monovalentes.
No entanto, basta a ocorrência de mutação num único a.a. (substituição de arginina por leucina
nas posições 586 ou 1096) para que cMOAT adquira capacidade para transportar sais
monovalentes [7].
•
Outros sistemas de transporte canalicular envolvidos na excreção biliar
Depois de terem sido excretados para a bile os sais biliares estimulam a libertação de
fosfatidilcolina e colesterol do folheto externo da membrana canalicular, com os quais formam
micelas mistas na bile [3]. Actuando deste modo, a toxicidade dos sais biliares para o epitélio do
ducto biliar é atenuada [1]. A flipase fosfolipídica Mdr2/MDR3 (Abcb4/ABCB4) assegura o
suprimento contínuo de fosfatidilcolina para o folheto externo da membrana canalicular [3]. O
colesterol é excretado via transportadores dependentes de ATP, ABCG5 e ABCG8, altamente
expressos no fígado [1].
Fic1/FIC1 (“familial intrahepatic cholestasis-1”) é uma ATPase tipo P que foi
localizada na membrana canalicular e no epitélio do ducto biliar, mas que também se encontra
presente em tecidos extrahepáticos. Mutações deste transportador resultam em variantes da
colestase intrahepática familiar, sugerindo que ele deve ter um papel importante na excreção
canalicular de sais biliares [1].
B)Transporte colangiocelular de sais biliares
As células epiteliais do ducto e vesícula biliares (colangiócitos) têm um papel
importante na secreção biliar normal (ilustração 5). Os ductos intra-hepáticos de médio e largo
calibre (> 30 µm de diâmetro) contêm vários sistemas de transporte com funções secretoras e
absortivas. Os constituintes biliares podem ser transportados da bile para os colangiócitos,
contudo, como apenas uma minoria de sais estão na bile como monómeros livres, a sua
absorção pelos colangiócitos está reduzida [3].
7
Ilustração 5: vesícula e ductos biliares
Sistemas de transporte apical no epitélio biliar
Os sais biliares são absorvidos pelo Isbt/ISBT ou Asbt/ASBT (”ileal/apical sodium
dependent bile salt transporter”), gene SLC10A2. Uma parte menor de sais biliares pode ser
absorvida na sua forma “protonada” por difusão não iónica.
A vesícula biliar, mais especificamente o seu epitélio, tem capacidade considerável de
modificar a composição da bile hepática primária por processos absortivos e secretores. MRP2 e
MRP3 foram recentemente identificados no epitélio da vesícula biliar humana, nas membranas
apical e basolateral, respectivamente, onde se pensa que captem sais biliares [2]. Além disso,
ISBT e OATP-A foram detectados em células epiteliais vesiculares, onde se supõe que medeiem
captação de taurocolato, dependente e independente de sódio [1].
Efluxo basolateral dos colangiócitos
Depois de serem captados os sais biliares sofrem extrusão pela membrana basolateral
dos colangiócitos para o plexo peribiliar. Este mecanismo é independente de sódio e pode ser
efectuado por Mrp3/MRP3, que foi identificado na membrana basolateral de colangiócitos
vesiculares de ratos e humanos [2].
C)Transporte intestinal de sais biliares
Os sais biliares, colesterol e fosfolípidos fazem a circulação enterohepática, pelo que
depois de excretados eles retornam ao fígado para reexcreção para a bile. Enquanto que os sais
biliares conjugados ficam presos ao lúmen do intestino devido aos seus valores baixos de Ka, os
sais biliares não conjugados com Ka maior que 5 podem ser absorvidos ao longo deste orgão
por difusão passiva [3].
O mecanismo de conservação de sais biliares mais eficiente é a captação Na+dependente de sais biliares conjugados no íleo terminal. No jejuno, a absorção de sais biliares é
8
um processo independente de sódio e não saturável, demonstrando a presença de captação
mediada por proteínas de alta afinidade [3].
Captação apical para os enterócitos
A captação dependente de sódio (no íleo terminal) ocorre via Isbt/ISBT
(Slc10a2/SLC10A2), também conhecido como Asbt/ASBT, e é electrogénica (cotransporte de
dois sódios por cada sal biliar). Além da localização nos enterócitos, ele foi também identificado
na membrana apical dos colangiócitos e nas células tubulares renais proximais.
Os substratos para este transportador são sais biliares primários e secundários,
conjugados e não conjugados. Em contraste com Ntcp/NTCP, que além de sais biliares
transporta outros substratos, a especificidade de Isbt/ISBT é estruturalmente limitada a sais
biliares. ISBT é o maior sistema de captação intestinal de sais biliares no humano, como é
enfatizado pelo facto de as mutações do gene resultarem em malabsorções de sais biliares [1].
O transportador de sais biliares independente de sódio Oatp3 (Slc21a7), semelhante aos
transportadores Oatp1 e Oatp2, transporta uma grande variedade de aniões anfipáticos incluindo
sais biliares [10]. A captação de sais biliares pelas vesículas da membrana em borda de escova
do jejuno é estimulada por um gradiente de dentro para fora de HCO3- [3]. No humano, o
transportador correspondente é OATP-A, que já foi localizado no intestino [3].
Transporte intracelular nos enterócitos
A informação acerca deste transporte é limitada. Alguns estudos identificaram uma
proteína de ligação a ácidos biliares (I-babp), citoplasmaticamente ligada ao Isbt, que representa
a proteína mais importante para o movimento transcelular de sais biliares pelos enterócitos [3].
O complexo de captação de sais biliares contém 4 ASBT e 4 I-BABPs [3].
Efluxo basolateral dos enterócitos
Em condições fisiológicas, um mecanismo de troca aniónica foi demonstrado na
membrana basolateral das células intestinais. Dois potenciais candidatos para estas trocas são tAsbt e Mrp3/MRP3 [1]. Este último encontra-se altamente expresso na membrana basolateral
do íleo terminal e pode servir como mecanismo de retorno de sais biliares à circulação portal,
além de permitir a absorção de drogas [3].
D)Transporte renal de sais biliares
Os sais biliares que não captados ao passar pelo fígado são filtrados nos glomérulos,
onde são reabsorvidos no rim, no túbulo contornado proximal. Assim, em condições
9
fisiológicas, as perdas urinárias de sais biliares são mínimas. Contudo, em condições de
colestase, a excreção renal de sais biliares pode tornar-se a maior via alternativa de eliminação
de sais biliares (atribuída à aumentada filtração glomerular passiva de sais biliares) [1].
Sistemas de transporte apical nos túbulos renais proximais
A membrana apical das células tubulares renais proximais contém sistemas de
transporte para reabsorção e para excreção de sais biliares. Estes são reabsorvidos pelo
transportador apical dependente de sódio, Isbt, nos túbulos contornados proximais [11]. Além
deste, Mrp2 e Oatp1 também foram localizados na membrana em borda de escova apical. MRP3
pode estar envolvido na excreção de aniões orgânicos em condições normais e excreção urinária
aumentada de sais biliares sulfatados ou glicuronados em condições colestáticas. Em contraste
com a sua localização basolateral nos hepatócitos, Oatp2 está localizado na membrana apical
dos túbulos renais proximais, mas o seu papel nesta localização permanece desconhecida [1].
Por analogia com o rato, ISBT, OATP-A, MRP2 também foram identificados nas
células tubulares renais proximais.
Sistemas de efluxo basolateral nos túbulos contornados proximais
Sabe-se pouco acerca desta temática. Evidências recentes sugerem um papel potencial
para Mrp1 [2]. Contudo, os últimos estudos localizaram Mrp3 na membrana basolateral do
túbulo contornado proximal no rato. Seria, portanto, do maior interesse verificar se Mrp3 tem
papel no efluxo basolateral de sais biliares (ilustração 6).
Ilustração
6:
Transportadores de sais
biliares
na
circulação
enterohepática.
E)Transporte placentário de sais biliares
A imaturidade do fígado do feto não dispõe de transportadores biliares até pouco antes
do nascimento. Assim, os sais biliares são minimamente excretados pelo fígado fetal sendo, em
10
vez disso, eliminados pelo fígado materno depois da translocação vectorial desde o feto até à
circulação materna, via placenta [1]. A barreira sangue-placenta começa do lado fetal com
células endoteliais dos capilares fetais, citotrofoblasto e sinciciotrofoblasto que se dirige para o
sangue maternal com a face apical. Foram identificados sistemas de transporte basolaterais e
apicais no citotrofoblasto, embora a identidade molecular destes sistemas ainda não seja
conhecida.
Membrana trofoblástica basolateral (“fetal facing”)
A captação de sais biliares ocorre através de um mecanismo bidireccional independente
do sódio. OATP-A (SLC21A3) foi encontrado na placenta de termo. Recentemente, OATP-B
(SLC21A9) foi localizado na membrana basal do cito e sinciciotrofoblasto onde pode estar
envolvido na captação placentária de esteróides sulfatados derivados do feto [1]. Estudos mais
recentes demonstraram a presença de MRP2 no endotélio da placenta de termo, sugerindo um
papel na extrusão de sais biliares fetais pelas barreiras do endotélio e sinciciotrofoblasto [12].
Membrana trofoblástica apical (maternal facing)
Foram identificados sistemas de ATP dependentes e ATP independentes, sendo estes os
mais abundantes. Apesar disso, BSEP permanece um candidato, já que foram encontrados
transcritos deste transportador na placenta de termo.
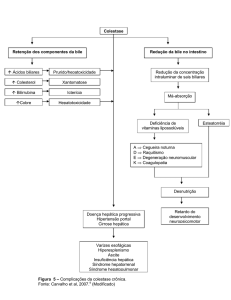
CONCLUSÃO
O progresso efectuado a nível da identificação e caracterização dos sistemas
transportadores de sais biliares permitiu um entendimento muito mais aprofundado da fisiologia
enterohepática. Contudo, é possível admitir a hipótese da existência de transportadores
adicionais ainda não identificados. Isto é verdade especialmente a nível intestinal, onde a
identidade dos sistemas de efluxo basolateral de sais biliares ainda não está clara.
Outros desafios futuros incluem a caracterização molecular detalhada das interacções
dos transportadores de sais biliares com as proteínas intracelulares adesivas de sais biliares e
com os mecanismos de transporte transcelular de lípidos e colesterol. Torna-se ainda necessário
elucidar a rede de regulação destes transportadores e as alterações que ela sofre em condições
não fisiológicas, por exemplo numa situação de colestase (paragem do fluxo biliar devido a uma
obstrução nas vias biliares).
11
BIBLIOGRAFIA
[1] Trauner M, Boyer J. L. Bile salt transporters: molecular characterization, function and
regulation. Physiological Reviews 83, 633-671, 2003.
[2] Fuchs M. Bile acid regulation of hepatic physiology- Regulation of bile acid synthesis: past,
progress and future challenges. Am J Physiol Gastrointest Liver Physiol 284: G551, 2003.
[3] Meier PJ, and Stieger B. Bile salt transporters. Annu Rev Physiol 64: 635-661, 2002
[4] Meier PJ. Molecular mechanisms of hepatic bile salt transport from sinusoidal blood into
bile. Am J Physiol Gastrointest Liver Physiol 269: G801-G812, 1995.
[5] Muller M, and Jansen PLM. Molecular aspects of hepatobiliary transport. Am J Physiol
Gastrointest Liver Physiol 272: G1285-G1303, 1997.
[6] Wolkofff A. W, Cohen D. E. Bile acid regulation of hepatic physiology: I-Hepatocyte
transport of bile acids. Am J Physiol Gastrointest Liver Physiol 284: G175-G179, 2003.
[7] Alves C, Vondippe P, Amoui M, and Levy D. Bile acid transport into hepatocyte smooth
endoplasmic reticulum vesicles is mediated by microsomal epoxide hydrolase, a membrane
protein exhibiting two distinct topological orientations. J Biol Chem 268: 20148-20155, 1993.
[8] Gerloff T, Stieger B, Hagenbuch B, Madon J, Landmann L, Roth J, Hofmann AF, and Meier
PJ. The sister P-glycoprotein represents the canalicular bile salt export pump of mammalian
liver. J Biol Chem 273: 10046-10050, 1998.
[9] Boyer JL. Bile duct epithelium: frontiers in transport physiology. Am J Physiol Gastrointest
Liver Physiol 270: G1-G5, 1996.
[10] Amelsberg A, Jochims C, Richter CP, Nitsche R, and Folsch UR. Evidence for an anion
exchange mechanism for uptake of conjugated bile acid from the rat jejunum. Am J Physiol
Gastrointest Liver Physiol 276: G737-G742, 1999.
[11] Christie DM, Dawson Pa Thevananther S, and Shneider BL. Comparative analysis of the
ontogeny of a sodium-dependent bile acid transporter in rat kidney and ileum. Am J Physiol
Gastrointest Liver Physiol 271: G377-G385, 1996.
[12] St-Pierre MV, Serrano MA, Macias RI, Dubs U, Hoechli M, Lauper U, Meier PJ, and
Marin JJ. Expression of members of the multidrug resistance protein family in human term
placenta. Am J Physiol Regul Integr Comp Physiol 279: R1495-R1503, 2000.
12