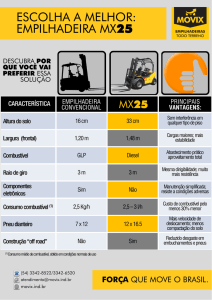
ESTUDO COMPORTAMENTAL DAS CÉLULAS COMBUSTÍVEIS
DE MEMBRANA POLIMÉRICA
JOSÉ R.CAMACHO
Lab. de Eletricidade Rural e Fontes Alt. de Energia, Faculdade de Engenharia Elétrica,
Universidade Federal de Uberlândia
Av. João Naves de Ávila, 2121, Bairro Santa Mônica, 38400-902 Uberlândia, MG
E-mail: [email protected]
RODOLFO A. COSTA
Faculdade de Engenharia Elétrica, Fundação Educacional de Barretos
Av. Prof.Roberto Frade Monte, 389, Aeroporto, 14783-226 Barretos, SP
E-mail: [email protected]
Resumo:
Este trabalho fornece informações sobre o desempenho de Células Combustíveis de Membrana Polimérica
(PEMFC) em regimes estáticos e dinâmicos de carga. Para tanto, foram desenvolvidas ferramentas
computacionais de modelagem do funcionamento da célula de combustível considerando seus parâmetros
construtivos e operacionais, sendo os resultados comparados com experimentos práticos.
ESTUDO COMPORTAMENTAL DAS CÉLULAS COMBUSTÍVEIS
DE MEMBRANA POLIMÉRICA
1 Princípio de Funcionamento das Células PEMFC
As células PEMFC utilizam hidrogênio e oxigênio para produzir eletricidade, calor e água. O conceito físico deste tipo
de célula é o oposto da eletrólise. Na eletrólise, uma corrente elétrica é conduzida através de uma solução aquosa para
produzir hidrogênio e oxigênio. Na célula combustível PEMFC, o hidrogênio e o oxigênio circulam nas laterais de uma
membrana polimérica, produzindo eletricidade, calor e água.
As reações eletroquímicas completas que ocorrem nas PEMFC são:
H2 ↔ H2,ads (Pt-H2) (adsorção)
H2,ads ↔ 2Hads (2Pt-H)
2 Hads + 2H2O ↔ 2 H3O+ + 2eReação Total no Anodo
H2 → 2H+ + 2e(Simplificada):
Catodo:
O2 ↔ O2,ads (Pt-O2) (adsorção)
O2,ads + H+ + e- ↔ O2Hads (Pt-O2H)
O2Hads + H+ + e- ↔ H2O2
H2O2 + 2H+ + 2e- ↔ 2H2O
Reação Total no Catodo
½ O2+2H++ 2e- →H2O
(Simplificada):
Reação Total na Célula:
H2+½O2→ H2O
Anodo:
(1a)
(1b)
(1c)
(1)
(2a)
(2b)
(2c)
(2d)
(2)
(3)
Durante o funcionamento, as moléculas de hidrogênio (H2) fluem por canais específicos até entrar em contato com a
platina existente no anodo, provocando sua adsorção e posterior oxidação, formando dois íons de hidrogênio (2 H+) e
liberando 2 elétrons no anodo (1). Simultaneamente, o oxigênio (O2) ou o próprio ar (que contem oxigênio), flui
também por canais específicos até entrar em contato com a platina existente no catodo provocando sua adsorção.
Como existe uma eletronegatividade natural entre um eletrodo de hidrogênio e um de oxigênio, uma força eletromotriz
é produzida entre o anodo e o catodo. Quando o circuito é fechado, uma corrente elétrica surge pelo circuito externo, ao
mesmo tempo em que os íons de hidrogênio são conduzidos através da membrana. Quando estes íons e os elétrons
chegam ao catodo, provocam a redução do oxigênio, produzindo vapor de água (2).
A equação total desta reação (3), é espontânea e exotérmica, portanto, durante seu funcionamento, a célula combustível
consumirá hidrogênio no anodo e oxigênio do catodo, sendo produzida potência elétrica no circuito externo, vapor
d’agua no catodo e calor durante a reação.
O valor da tensão de operação de uma pilha de combustível é determinado pelo número de células a combustível que a
constitui, e pelas perdas internas, determinadas pelos materiais e métodos construtivos, bem como pela intensidade da
corrente elétrica imposta pela carga e pelos procedimentos operacionais. Portanto a potência elétrica gerada pela pilha a
combustível é determinada por uma série de variáveis construtivas e operacionais.
2 Características Operacionais das Células PEMFC
Como a célula combustível funciona basicamente como uma fonte de corrente, e, portanto analisaremos a resposta de
tensão produzida pela célula a partir da variação da corrente elétrica requerida pela carga e das variáveis operacionais
básicas do sistema, sendo as principais variáveis operacionais: a corrente elétrica operacional (Iop), a temperatura de
operação(Top), e o transporte dos gases, sendo que as principais grandezas envolvidas na alimentação dos gases são:
PH 2 e PO2 – Pressão parcial de alimentação dos gases Hidrogênio e Oxigênio (em atm);
φ H 2 e φO2 – Umidade relativa dos gases Hidrogênio e Oxigênio (em porcentagem);
λ H2 ,
λO2 e λ Ar – estequiometria da alimentação dos gases Hidrogênio e Oxigênio e do Ar (adimensional).
2.1 Célula PEMFC em regime estático de carga.
O comportamento elétrico de uma célula combustível PEMFC é determinado pela tensão máxima que pode ser
produzida por uma célula (E0) e pelas perdas energéticas existentes durante sua operação.
Dentre as principais perdas a serem consideradas estão: as perdas por ativação(Vatv) e concentração(Vcon) no anodo e no
catodo, e a perda pela resistência ôhmica da célula(Vohm), sendo que cada uma delas ocorre predominantemente durante
um regime de carga (valor de corrente elétrica) operacional da célula, produzindo um comportamento típico que pode
ser representado pelo gráfico da Figura 1.
Figura 1 - Curva de Polarização Típica de uma Célula PEMFC
A tensão operacional da célula (Vop) pode ser calculada através da tensão de circuito aberto (E0), e das perdas. Ou seja:
Vop = E0 – ( Vatv + Vohm + Vcon )
(4)
2.1.1 Tensão de circuito aberto ou tensão ideal
O valor máximo de tensão produzida (tensão de circuito aberto, tensão reversível ou tensão ideal) em uma célula a
combustível é específica da reação global ocorrida na célula. No caso da PEMFC, ela pode ser calculada pela diferença
energética entre o estado inicial dos reagentes (H2 + ½ O2) e a resultante final (H2O). A máxima tensão produzida pela
célula (∆E) para a reação ocorrida na célula (H2 + ½ O2 → H2O) será calculada pela fórmula:
E0 = { ∆G + ∆S(Top – Tref) + R * Top * [ ln(PH2) + ½ ln(PO2)] } / 2F
[V]
(5)
onde F é constante de Faraday, ∆G é a variação da energia livre de Gibbs, ∆H é a variação da entalpia na reação, ∆S a
variação da entropia na reação, e Top a temperatura da reação.
2.1.2 Perdas por ativação, ôhmicas e por concentração
As perdas por ativação (Vatv) são dominantes na parte inicial da reação química, ou seja, quando a densidade de corrente
na célula é baixa. São perdas que variam com o aumento da densidade de corrente. A perda por ativação pode ser
definida através da equação de Tafel:
Vatv =
RTop
jop
ln
[V]
α nF j 0
(6)
onde R é a constante universal dos gases, F é constante de Faraday, Top é a temperatura de operação, n é o número de
mols envolvidos na reação, jop é a densidade de corrente de operação da célula, j0 é a densidade de corrente de troca no
eletrodo, e α é o coeficiente de transferência eletrônica.
A resistência ôhmica da célula ocorre devido a dois fatores distintos: a resistência que o eletrólito (membrana
polimérica) oferece ao fluxo de íons e a resistência oferecida pelos eletrodos (Rm), e a resistência dos difusores de gás e
placas separadoras ao fluxo de elétrons (Rcj). Podemos considerar as perdas ôhmicas (Vohm) na célula como sendo:
Vohm = (Rm + Rcj ).iop
[V]
(7)
Por outro lado, sempre que um dos reagentes é consumido pela reação eletroquímica nos eletrodos da célula, existe a
incapacidade da vizinhança do meio em manter a concentração inicial junto ao eletrodo. Este gradiente de concentração
do reagente próximo ao eletrodo produz uma queda no valor da tensão elétrica da célula denominada perda por
concentração. A perda por concentração (Vcon) pode ser calculada pela fórmula:
Vcon =
RTop
iop
ln 1 −
nF
iL
[V]
(8)
onde iop é a corrente operacional da célula e iL é a corrente limite de do eletrodo, possuindo valores diferentes para o
catodo (iL,c) e o anodo (iL,a). Os valores de iL dependerão das condições construtivas , como a área da célula, desenho
dos canais que levam os gases internamente a célula, características dos difusores de gás, da membrana, etc.
3.2 Célula PEMFC em regime dinâmico de carga.
Quando ocorre uma variação da carga alimentada por célula a combustível, isto provocará uma variação no valor da
tensão de trabalho da célula. Porém existe um regime transitório devido à capacitância gerada na membrana polimérica
por um efeito complexo denominado “efeito de dupla camada”. Levando-se em consideração a influência desta
capacitância, o circuito equivalente da célula PEMFC pode ser indicado de forma simplificada conforme a Figura 2:
Figura 2 – Circuito elétrico simplificado de uma célula PEMFC.
onde Rohm representa a resistência ôhmica, Ratv representa a resistência por ativação, Rcon representa a resistência por
concentração e Cdc representa a capacitância da membrana devido ao efeito de dupla camada.
A equação que representa o comportamento da tensão durante o transitório pode ser expressa por:
V ( t ) = V ( ∞) + V ( 0 + ) - V ( ∞ ) * ex p
- t
[V]
τ
(9)
onde V(∞) é o valor final ao qual a tensão tenderá após a variação da carga, e V(0+) é o valor inicial da tensão antes da
modificação do valor da carga alimentada pela célula PEMFC. A constante de tempo (τ) é uma medida de tempo
necessária para a análise de transitórios em circuitos RC, calculada pela expressão:
τ = Rth .Cdc [seg]
(10)
onde Rth é a resistência de Thevenin, vista pelo circuito.
Além dos parâmetros operacionais já citados (Top, Iop, PH 2 , PO2 , φ H 2 , φO2 , λ H 2 , λO2 ou λ Ar ), foram considerados
para a construção do simulador os parâmetros construtivos (coeficientes de transferência eletrônica e constantes do grau
de reação dos eletrodos, bem como as propriedades físico-químicas dos eletrodos e membrana), e também os
parâmetros dimensionais da pilha de combustível (Número de Células, Área da célula e Espessura da Membrana).
3 Resultados do Estudo Comparativo
A Figura 3 demonstra o comportamento de uma célula específica em temperaturas de operação de 40ºC, 60ºC e 80ºC
em regime estático de carga, sendo as curvas montadas a partir das respostas de tensão da célula de acordo com a
corrente solicitada pela carga. Curvas similares foram levantadas fixando-se a temperatura e variando-se os demais
parâmetros operacionais. Na Figura 4 é demonstrado o comportamento de uma determinada pilha combustível de duas
células PEMFC operando com parâmetros operacionais controlados, onde foi imposto um pulso de corrente de carga
durante um período de 5s (regime dinâmico de carga). Estudos semelhantes foram realizados variando-se os todos os
parâmetros operacionais, possibilitando aos projetistas interessados nesta tecnologia, inserir um grau de certeza na
otimização de projetos de controle para protótipos, antes de estes serem montados.
Figura 3 – Comportamento da célula PEMFC
em regime estático de carga.
Figura 4 – Comportamento da célula PEMFC
em regime dinâmico de carga.
* Nossos agradecimentos à UNITECH Ltda., na pessoa do seu Diretor de Pesquisa e Desenvolvimento Dr. Antonio
César Ferreira, pela possibilidade de execução deste trabalho em contato direto com as células de combustível PEMFC.