Bafômetro
Origem: Wikipédia, a enciclopédia livre.
Ir para: navegação, pesquisa
Bafômetro
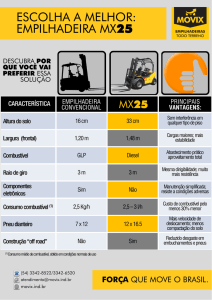
Bafômetro (ou Etilômetro) é um aparelho que permite determinar a concentração de bebida alcóolica em uma
pessoa, analisando o ar exalado dos pulmões. É um equipamento utilizado por policiais para checar o nível de
álcool etílico presente no sangue de motoristas. Alguns aparelhos são programados a apitar caso a quantidade de
álcool no sangue ultrapasse o limite estabelecido em lei.
Funcionamento
O motorista deve assoprar o bafometro com força no canudinho, que conduzirá o ar de seus pulmões para um
analisador contendo uma solução ácida de dicromato de potássio.
O princípio de detecção do grau alcóolico está fundamentado na avaliação das mudanças das características
elétricas de um sensor sob os efeitos provocados pelos resíduos do álcool etílico no hálito do indivíduo.
O sensor é um elemento formado por um material cuja condutividade elétrica é influenciada pelas substâncias
químicas do ambiente que se aderem à sua superfície. Sua condutividade elétrica diminui quando a substância é
o oxigênio e aumenta quando se trata de álcool. Entre as composições preferidas para formar o sensor destacamse aquelas que utilizam polímeros condutores ou filmes de óxidos cerâmicos, como óxido de estanho (SnO2),
depositados sobre um substrato isolante.
A correspondência entre a concentração de álcool no ambiente, medida em partes por milhão (ppm), e uma
determinada condutividade elétrica é obtida mediante uma calibração prévia onde outros fatores, como o efeito
da temperatura ambiente, o efeito da umidade relativa, regime de escoamento de ar etc., são rigorosamente
avaliados. A concentração de álcool no hálito das pessoas está relacionada com a quantidade de álcool presente
no seu sangue dado o processo de troca que ocorre nos pulmões.
[editar] Química
O álcool presente no "bafo", é convertido em ácido acético conforme mostra a reação abaixo:
Nesta reação o etanol é convertido a ácido acético e o cromo, na forma de íon cromato (amarelo alaranjado) é
transformado em Cr + 3 (coloração verde).
Quanto maior a concentração de álcool mais intensa é a coloração esverdeada obtida.
[editar] Valores permitidos
O limite máximo permitido no Brasil é 0,2 g de álcool por litro de sangue,[1] ou, 0,1 mg de álcool por litro de ar
expelido no exame do bafômetro.[2][3] No Paraguai é de 0,8 g/l, na Bolívia de 0,7 g/l, , Peru 0,5 g/l, Venezuela
0,5 g/l, Uruguai 0,8 g/l, Argentina 0,5 g/l, Reino Unido 0,8 g/l, Alemanha 0,5 g/l, França 0,5 g/l, Itália 0,5 g/l,
Bélgica 0,5 g/l e Espanha 0,5 g/l.
Etanol no sangue Etanol no sangue (gramas/litro)
Estágio Sintomas 0,1 a 0,5 Sobriedade Nenhuma influência aparente
0,3 a 1,2 Euforia Perda de eficiência, diminuição da atenção, julgamento e controle
0,9 a 2,5 Excitação Instabilidade das emoções, incoordenação muscular. Menor inibição. Perda do julgamento
crítico
1,8 a 3,0 Confusão Vertigens, desequilíbrio, dificuldade na fala e disturbios da sensação.
2,7 a 4,0 Estupor Apatia e inércia geral. Vômitos, incontinência urinária e fezes.
3,5 a 5,0 Coma Inconsciência, anestesia. Morte
Acima de 5 Morte Parada respiratória
A química do álcool
O álcool encontrado nas bebidas alcoólicas é o álcool etílico (etanol). A estrutura molecular do etanol tem essa
aparência:
H
H3C - C - O - H
H
onde C é carbono, H é hidrogênio, O é oxigênio e cada hífen é uma ligação química entre os átomos. Esclarecendo, as
ligações dos três átomos de hidrogênio com o átomo de carbono da esquerda não estão representadas.
O grupo OH (O - H) na molécula é que faz com que ela seja um álcool. Há quatro tipos de ligações nessa molécula:
carbono-carbono (C - C)
carbono-hidrogênio (C - H)
carbono-oxigênio (C - O)
oxigênio-hidrogênio (O - H)
As ligações químicas entre os átomos são pares compartilhados de elétrons. As ligações químicas são parecidas com
molas: elas podem dobrar e esticar. Essas propriedades são importantes na detecção do etanol em uma amostra usando
espectroscopia infravermelha (IV).
Para medir o álcool, o suspeito respira dentro do dispositivo. A amostra de ar borbulha em um
dos frascos através de uma mistura de ácido sulfúrico, dicromato de potássio, nitrato de prata
e água. O princípio da avaliação se baseia na seguinte reação química:
Nessa reação:
1. o ácido sulfúrico remove o álcool do ar em uma solução líquida
2. o álcool reage com o dicromato de potássio para produzir:
sulfato de cromo
sulfato de potássio
ácido acético
água
O nitrato de prata é um catalisador, uma substância que faz a reação ocorrer mais rápido,
sem participar dela. O ácido sulfúrico, além de remover o álcool do ar, proporciona também a
condição de acidez necessária para essa reação.
Durante essa reação o íon dicromato, de cor vermelho-alaranjada, muda de cor para o verde do íon cromo
quando este reage com o álcool; o grau de mudança de cor está diretamente relacionado com o nível de álcool no
ar exalado. Para determinar a quantidade de álcool naquela amostra de ar, a mistura que sofreu reação é
comparada a de um frasco contendo uma mistura que não sofreu reação no sistema de fotocélulas, produzindo
uma corrente elétrica que faz a agulha do medidor se mover do seu ponto de repouso. O operador, então, gira
um botão para trazer a agulha de volta ao ponto de repouso e lê o nível de álcool a partir do botão: quanto mais o
operador precisar girar o botão para retorná-la ao repouso, maior é o nível de álcool.
Os Dispositivos Atuais
Tipos de dispositivos: alco sensor III ou IV
A tecnologia moderna de células de combustível, que poderá algum dia gerar energia para
nossos carros e mesmo para nossas casas, tem sido aplicada nos detectores de álcool no ar
exalado. Dispositivos como o alco sensor III e IV usam células eletroquímicas.
A célula de combustível tem dois eletrodos de platina com um material poroso ácido-eletrolítico colocado
entre eles. À medida que o ar exalado pelo suspeito flui de um lado para outro da célula de combustível, a platina
oxida o álcool que houver no ar produzindo ácido acético, prótons e elétrons.
Oxidação do álcool
Se você tirar os hidrogênios do carbono direito do etanol, na
presença de oxigênio, você obterá ácido acético, o componente
principal do vinagre. A estrutura molecular do ácido acético tem
essa aparência:
O
||
H3C - C - O - H
onde C é carbono, H é hidrogênio, O é oxigênio, o hífen é uma
ligação química simples entre os átomos e o símbolo || é uma
ligação dupla entre os átomos. Esclarecendo, as ligações dos três
átomos de hidrogênio com o átomo do carbono esquerdo não
estão representadas. Quando o etanol é oxidado em ácido
acético, são também produzidos dois prótons e dois elétrons.
Os elétrons fluem através de um fio que vem do eletrodo de platina. O fio é conectado a um
medidor de corrente elétrica e o eletrodo de platina do outro lado. Os prótons movem-se
através da porção inferior da célula combustível e combinam-se com oxigênio e os elétrons
do outro lado para formar água. Quanto mais o álcool se torna oxidado, maior a corrente
elétrica. Um microprocessador mede a corrente elétrica e calcula a concentração de álcool
no sangue.
Os operadores que fazem o teste em qualquer dispositivo precisam ser treinados no uso e calibragem do
aparelho, especialmente se os resultados forem usados como provas no julgamento de motoristas flagrados
dirigindo embriagados. Os policiais podem carregar bafômetros portáteis que usam o mesmo princípio dos
aparelhos grandes. Contudo, como julgamentos podem aumentar a percepção de precisão de um teste de
bafômetro, promotores confiam nos resultados obtidos com aparelhos completos.
A célula a combustível com membrana para troca de prótons (PEMFC) é uma das tecnologias mais
promissoras. Este é o tipo de célula a combustível que acabará energizando carros, ônibus e, talvez, até mesmo
nossas casas. A PEMFC faz uso de uma das mais simples reações da célula a combustível. Primeiramente,
vejamos em que consiste uma célula a combustível de membrana de troca de prótons (PEM):
Figura 1 - Partes da uma célula a combustível PEM
Na figura 1 pode ser visto que existem 4 elementos básicos em uma PEMFC:
o ânodo, pólo negativo da célula a combustível que desempenha vários papéis. Ele
leva os elétrons liberados das moléculas de hidrogênio para que sejam usados no
circuito externo. Esse circuito possui canais que dispersam o gás hidrogênio igualmente
sobre a superfície do catalisador.
enquanto isso o cátodo, pólo positivo da célula a combustível, tem outros canais
distribuindo o oxigênio na superfície do catalisador. Ele também leva os elétrons ao
retornarem do circuito externo do catalisador, que são então recombinados com os íons
de hidrogênio e oxigênio para formar água.
o eleletrólito é a membrana trocadora de prótons. Esse material especialmente
tratado assemelha-se a um embrulho plastificado comum de cozinha e somente conduz
íons positivamente carregados. A membrana bloqueia os elétrons.
o catalisador é um material especial que facilita a reação entre o oxigênio e o hidrogênio.
Geralmente é feito de pó de platina finamente coado através de papel de carbono poroso ou
tecido. O catalisador é grosseiro e poroso, tornando possível que a máxima área superficial
da platina seja exposta ao hidrogênio e ao oxigênio. A face revestida de platina do catalisador
fica em frente da PEM.
Figura 2 gás hidrogênio pressurizado (H ) entrando na célula a
Química de
combustível do lado do ânodo. Esse gás é pressionado através do
uma célula a
catalisador. A molécula de H quando entra em contato com a
combustível
2
2
platina no catalisador divide-se em 2 íons de H e em 2 elétrons. Os
Lado do ânodo:
elétrons são levados através do ânodo, percorrem seu caminho
2H2 => 4H+ + 4e-
+
através do circuito externo (fazendo trabalho útil, como o de colocar
um motor em funcionamento) e voltam para o lado do cátodo na
célula combustível.
Lado do cátodo:
O2 + 4H+ + 4e- => 2H2O
Reação líquida:
2H2 + O2 => 2H2O
Enquanto isso, no lado do cátodo da célula a combustível, o gás oxigênio (O2) está
sendo forçado através do catalisador e acaba formando 2 átomos de oxigênio. Cada um desses átomos tem uma
forte carga negativa. Essa carga negativa atrai 2 íons de H + através da membrana, que combinam com um átomo
de oxigênio e com 2 dos elétrons do circuito externo para então formar uma molécula de água (H2O).
Esta reação, ocorrendo em uma única célula a combustível, produz apenas cerca de 0,7 volts. Para elevar essa
tensão a um valor mais significativo, muitas células a combustível separadas devem ser combinadas para formar
uma bateria de células a combustível.
As PEMFC operam em temperaturas razoavelmente baixas (cerca de 176 graus Fahrenheit ou 80 graus Celsius),
significando que podem se aquecer rapidamente e que não exigem estruturas de contenção dispendiosas.
Melhorias constantes na engenharia e nos materiais dessas células têm aumentado a densidade de energia de tal
modo que aparelhos do tamanho de pequenas malas têm conseguido movimentar automóveis.
Problemas das células a combustível
Na última seção, vimos que uma célula a combustível usa o oxigênio e o hidrogênio para produzir eletricidade.
O oxigênio exigido para uma célula a combustível vem do ar, então, em uma célula combustível PEM, o ar
atmosférico comum é bombeado para dentro do cátodo. Entretanto, o hidrogênio não é obtido com tanta
facilidade. Existem algumas limitações que o tornam impraticável para a maioria das aplicações. Por exemplo,
não existem tubulações de hidrogênio vindo das residências, e nem é possível usar bombas de hidrogênio no
posto de gasolina.
O hidrogênio é difícil de ser armazenado e distribuído. Seria bem mais conveniente se as células a combustível
pudessem usar combustíveis disponíveis com maior facilidade. Este problema é resolvido por um aparelho
chamado reformador, que transforma combustíveis de hidrocarboneto ou álcool em hidrogênio, que podem então
ser usados para alimentação da célula a combustível. Infelizmente, os reformadores não são perfeitos, geram
calor e produzem outros gases além do hidrogênio. Os reformadores se valem de vários aparelhos para purificar
o hidrogênio, mas ainda assim, não conseguem produzir hidrogênio puro, diminuindo a eficiência da célula a
combustível.
O gás natural, o propano e o metanol são considerados como os combustíveis de maior probabilidade de
aplicação. Já existem muitas residências e prédios atendidos por gás natural ou tanques de propano, de modo que
esses combustíveis são os de uso mais provável para as células a combustível domiciliares. O metanol é um
combustível líquido com propriedades semelhantes às da gasolina (fácil de transportar e distribuir) e portanto um
candidato provável para suprir de energia os carros de células a combustível.