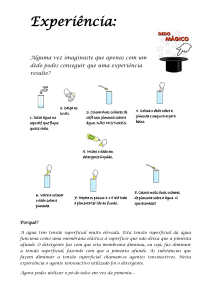
INTERFACES
GÁS-LÍQUIDO
LÍQUIDO - LÍQUIDO
INTERFACE LÍQUIDO-GÁS
• Líquidos permanecem coesos
Membrana elástica
• Como explicar a existência de uma membrana elástica?
INTERFACE LÍQUIDO-GÁS
• Nas interfaces produzem-se fenómenos
que não ocorrem no interior das fases
?
Desequilíbrio de forças
COMO REAGE O SISTEMA ?
• As moléculas situadas na superfície do líquido estão
menos “atraídas” e portanto tendem a possuir uma maior
energia
• Forças moleculares que atuam nas moléculas do líquido
são em média isotrópicas
• Moléculas na superfície estão sujeitas a uma força
resultante que as atrai para o líquido
QUAL A CONSEQUÊNCIA?
• Os sistemas tendem a minimizar a energia de superfície e a assumir a configuração
correspondente à área mínima de superfície (contração)
• É necessário trabalho para aumentar a área de superfície na interface líquidovapor, (menos moléculas no seio do líquido e mais moléculas à superfície
• Este trabalho leva a um aumento da energia do sistema
QUAL A CONSEQUÊNCIA?
• A= área da superfície livre de um líquido
que se aumenta de uma quantidade
pequena ∆A
• Trabalho reversível e infinitesimal
(∆W) necessário para aumentar a
superfície de uma área infinitesimal
(∆ A)
TENSÃO SUPERFICIAL E TRABALHO DE EXTENSÃO
• Como a área da interface tende para um valor mínimo, é necessário fornecer energia ao
sistema para aumentar a área de superfície
Pode ser visto como a energia que é necessário fornecer
para formar uma superfície com área unitária
Se o incremento de área for infinitesimal, dA, o trabalho
será igualmente infinitesimal δW
=
∆A
δ
=
A
• Unidades:
• energia por unidade de área de superfície: ergs/cm2 ou J/m2
• Aplicada só para líquidos puros
TENSÃO SUPERFICIAL
DEFINIÇÕES
• Trabalho de extensão, por unidade de área, necessário para deformar a superfície
W = γ ∆A
γ=
W
∆A
• Energia por unidade de área necessária para contrariar a minimização da área de
superfície
G = γ ∆A
G
γ=
∆A
Unidades:
ergs/cm2 ou J/m2
dyne /cm ou N/m
TENSÃO SUPERFICIAL :
VERIFICAÇÃO EXPERIMENTAL
• Considere:
F atua na superfície provocando
um aumento infinitesimal de
área
TENSÃO SUPERFICIAL:
VERIFICAÇÃO EXPERIMENTAL
Mover o fio de uma distância x ⇒ Aumento da área superficial =
∆x × l
aTrabalho efetuado ( F × ∆x ) é proporcional ao aumento dessa
área superficial
F × ∆ x = γ (∆ x × l )
W
∆A
F ×∆ x F
γ=
=
d ×l
l
TENSÃO SUPERFICIAL E FORÇA POR
COMPRIMENTO
• Força (F) que actua sobre qualquer linha
imaginária com comprimento unitário
(l), na superfície do líquido.
• Definição válida para qualquer líquido
• Se a força for perpendicular à linha,
então
• Unidades:
• Força por unidade comprimento
atuando tangencialmente à superfície
F
γ=
l
• N/m ou dyne/cm ou mN/m
• γ: Para líquidos puros é uma constante,
independente do tamanho da superfície e do
tempo.
EM RESUMO…
• As diferentes formas de definir tensão superficial
Energia (G) necessária para aumentar a superfície (A) isotermicamente e reversivelmente
Força tangencial que a superfície exerce por unidade de comprimento
∆G
γ =
=G
∆A P ,T
TENSÃO SUPERFICIAL/ TENSÃO INTERFACIAL
• Tensão Superficial – força de contração por unidade de
comprimento ao longo do perímetro de uma superfície, se a
superfície separa uma interface gás-líquido ou gás- sólido
• Tensão interfacial – força de contração por unidade de
comprimento, ao longo do perímetro de uma superfície, se a
superfície separa duas fases não gasosas
FATORES QUE INFLUENCIAM A TENSÃO
SUPERFICIAL
1- Forças intermoleculares
(natureza química)
Valores de γ à temperatura de 297 K
A TENSÃO INTERFACIAL…
É só uma estimativa!!!!!
TENSÃO SUPERFICIAL DE LÍQUIDOS PUROS
γ: Para líquidos puros é uma constante, independente do tamanho da superfície e do tempo.
TENSÃO INTERFACIAL ENTRE A ÁGUA E
OUTROS LÍQUIDOS
Líquido
T º Centígrado
Tensão superficial
Dyne/cm
Água/butanol
20
1,8
Água/benzeno
20
35,0
Água/silicone
20
44,3
Água/ fluor-polímero
25
57,0
Água/óleo
20
10-4-10-3
FATORES QUE INFLUENCIAM A TENSÃO
SUPERFICIAL
2-Temperatura
• Segundo Eötvös:
• Para a maioria dos líquidos, a tensão superficial é
uma função linear da temperatura
γ- tensão superficial (N/m); V- volume molar (m3/mol); Ttemperatura (K), Tc- temperatura crítica (K) ; K- constante
de Eotvos (2,1 x10-7 J/K mol2/3)
FATORES QUE INFLUENCIAM A TENSÃO
SUPERFICIAL
• Tipo de soluto e sua concentração
INFLUÊNCIA DOS SOLUTOS E SUA
CONCENTRAÇÃO
• Mais adiante veremos porque :
• O tipo de soluto influencia a tensão superficial
• A concentração influencia a tensão superficial
• Como calcular o excesso de concentração á superfície
• Como se organizam esses solutos em solução
CONSEQUÊNCIAS DA TENSÃO SUPERFICIAL
• A tensão superficial actua de forma a diminuir a energia livre de superfície e por isso são observados
alguns efeitos
Superfícies curvas
Coalescência de gotículas
Capilaridade
Espalhamento de gotículas
Formação de gotas
Pressão interna de bolhas
ECT, ECT….
FORÇAS DE ADESÃO E COESÃO
Coesão- se as forças atractivas são
entre moléculas semelhantes
(responsáveis pela formação de
gotas)
► Adesão- se as forças atractivas são
entre moléculas diferentes
(responsáveis formação de superfícies
curvas e pela capilaridade)
► Num líquido, as forças atractivas entre
moléculas podem ser vistas como
forças electrostáticas, chamadas
Forças de van der Walls
INTERFACE LÍQUIDO –GÁS.
TRABALHO DE COESÃO
• Forças que atuam no interior da fase
condensada (líquido ou sólido) para
manter as moléculas coesas
• Trabalho de coesão (W1,1):
• Variação de energia livre ou trabalho
reversível efetuado para separar o
material em contato
INTERFACE LÍQUIDO –GÁS.
TRABALHO DE ADESÃO
• Forças de adesão que atuam entre
superfícies de duas fases condensadas
diferentes
• Trabalho de adesão W1,2
O PROCESSO DE ADESÃO:
A EQUAÇÃO DE DUPRÉ
• Equação de Dupré:
• A varia de energia livre total
corresponde à energia interfacial WSL
• Este processo pode ser dividido em 2
passos hipotéticos:
• a) geração de novas superfícies para os
materiais S e L, para o vácuo: W = γS+ γL
WSL = γ S + γ L − γ SL
• (referido á unidade de área)
• b) promover o contato entre duas novas
superfícies: WSL
•
O trabalho de coesão e o trabalho de adesão são sempre
positivos
FORÇAS DE ADESÃO E COESÃO E MOLHABILIDADE
TENSÕES INTERFACIAIS E ÂNGULO DE CONTATO
• Considere uma gota de líquido sobre uma superfície sólida
• A gota está em equilíbrio devido ao balanço de 3 forças:
• Tensão interfacial sólido- líquido (SL)
• Tensão interfacial sólido-vapor (SV)
• Tensão interfacial líquido-vapor
• O desequilíbrio de forças intermoleculares existente na interface líquido/gás e sólido/gás é bastante maior que
entre fases condensadas,
• Então as tensões interfaciais para sistemas Líquido/Líquido ou Sólido/Líquido são sempre menores que a maior
das tensões superficiais
MOLHABILIDADE E ANGULO DE CONTATO
• No caso de interfaces sólido – líquido o
trabalho de adesão quantifica a
molhabilidade.
• Está diretamente relacionada com o
ângulo de contato formado pelo líquido
no sólido, através da equação de Young Dupré
MOLHABILIDADE E ENERGIA DE SUPERFÍCIE
EQUAÇÃO DE YOUNG- DUPRÉ:
ÂNGULO DE CONTATO
• Considere o seguinte sistema
Gás
F’’
F
θ
F’ líquido
sólido
F – tensão superficial do líquido, γL
F’ – tensão interfacial, γSL
F’’- tensão superficial do sólido, γS
θ - ângulo de contacto
Condição de equilíbrio (equação de Young):
γ S = γ SL + γ L cos θ
Assim obtém-se a equação de YoungDupré:
WSL = γ L (1+ cos θ )
θ- O ÂNGULO DE CONTATO
• O angulo de contato θ é o angulo formado por uma gota de líquido na fronteira de três
fases (líquido, gás e sólido)
• Está incluído na interseção entre o plano tangente à superfície do líquido e o plano
tangente à superfície do sólido
• O ângulo de contacto é uma medida quantitativa do molhamento de um sólido por um
líquido.
ÂNGULO DE CONTATO E MOLHABILIDADE
• A esquerda, Φ > 90° e as forcas
de coesão são maiores que as
forcas adesivas
• A direita, Φ < 90° e as forcas
adesivas são maiores que as
forcas de coesão
O SIGNIFICADO DO ÂNGULO DE CONTATO:
HIDROFILIA VS HIDROFOBIA
θ - Dá informações
sobre as superfícies
Superfícies hidrofílicas (explo
com grupos OH) têm elevada
afinidade para a água, forças
adesivas predominantes e logo,
baixo ângulo de contacto
Superfícies hidrofóbicas (explo:
polímeros e superfícies revestidas
com moléculas orgânicas) têm
forças coesivas predominantes e
o ângulo de contacto é elevado
COEFICIENTE DE ESPALHAMENTO
• Coeficiente de espalhamento
=
−
−
• S – é a diferença de energia livre entre uma superfície sólida, diretamente em contacto
com o vapor e um sólido coberto por uma película fina de líquido
• Espalhamento total → SLS>0
ÂNGULO DE CONTATO E ESPALHAMENTO
CONDIÇÕES DE ESPALHAMENTO DE UM LÍQUIDO
NUM SÓLIDO
CONSDIÇÕES DE ESPALHAMENTO DE UM LIQUIDO
NUM LÍQUIDO
• O coeficiente de espalhamento, S , é dado por:
ESPALHAMENTO & ADESÃO E COESÃO
CONSEQUÊNCIA DA TENSÃO SUPERFICIAL (DAS
FORÇAS DE ADESÃO E COESÃO)
• Formação de gotas
• Uma gota de um líquido no ar tende a ser esférica para minimizar a sua superfície. Por isso as gotas de
um líquido têm a forma esférica na ausência da gravidade.
Uma esfera é a forma geométrica
com menor superfície por unidade de
volume
S = 4πR 2
4
V = πR 3
3
S 3
=
V R
FORMAÇÃO DE GOTAS
Formação de gotas
• Enquanto a gota NÃO for suficientemente grande, a tensão superficial é suficiente para
contrabalançar a força gravítica, impedindo a separação da gota do resto do líquido
• A gota separa-se quando o seu peso igualar a força de tensão superficial que a segura
• No equilíbrio
Peso da gota = tensão superficial
FORMAÇÃO DE GOTAS
• Gota de líquido suspensa
•
=2
Em que γ é a tensão superficial (N/m)
• Gota mantém-se suspensa até que a componente vertical da tensão superficial iguale
o peso da gota
=2
•
α
• A força de tensão superficial máxima aplicada, quando α= 90 °, dá o peso máximo de
uma gota de líquido com uma dada tensão superficial
=2
•
• ENTÃO
•
=
r- raio do tubo: m- massa da
gota; g- aceleração da gravidade
CONSEQUÊNCIA DAS FORÇAS DE ADESÃO E
COESÃO: CURVATURA DAS SUPERFÍCIES
• A forma da superfície de um fluido, num
tubo, depende da adesão e da coesão do
líquido nas paredes do tubo
• Se a adesão (atração líquido-sólido) é
maior do que a coesão (interação entre
as partículas de líquido) o menisco é
côncavo. Ao contrário, o menisco é
convexo.
(a)
(b)
Mercury is suppressed in a glass tube because its contact angle is greater
than 90º. Surface tension exerts a downward force as it flattens the mercury,
suppressing it in the tube. The dashed line shows the shape the mercury
surface would have without the flattening effect of surface tension.
(b) Water is raised in a glass tube because its contact angle is nearly 0º.
Surface tension therefore exerts an upward force when it flattens the
surface to reduce its area
CAPILARIDADE
• A capilaridade resulta do jogo entre a tensão
superficial e as forças adesivas
• O liquido sobe no tubo quando as forcas
adesivas são maiores que as forças de coesão
• Na linha de contacto entre o liquido e a
superfície as forcas resultantes apontam para
cima.
COMO TRADUZIR MATEMATICAMENTE A
CAPILARIDADE
γ=
F
l
γ = F = 2 π r ou
Fazul
2π rγ = F
F
F azul = F cos θ
θ
Fh
Ou seja:
F azul = γ cos θ
ALTURA A QUE O LÍQUIDO SOBE
• A força Fv é equilibrada pelo próprio peso do
corpo líquido
Peso = m × g
p = (ρ L − ρ ar ) ⋅ V ⋅ g
m = (ρ L − ρ ar ) ⋅ V
• Como V é o volume de um cilindro cuja base é
π r 2 e a altura é h
V = π ⋅r2 ⋅h
p = (ρ L − ρ ar ) ⋅ π ⋅ r 2 ⋅ h ⋅ g
ALTURA A QUE O LÍQUIDO SOBE
• A coluna está equilibrada quando
Fazul = p coluna
liquido
F ⋅ cos θ = (ρ L − ρ ar ) ⋅ π ⋅ r 2 ⋅ h ⋅ g
2 ⋅ π ⋅ r ⋅ γ ⋅ cos θ = (ρ L − ρ ar ) ⋅ π ⋅ r 2 ⋅ h ⋅ g
• Então a altura da coluna do líquido será:
2 ⋅ γ ⋅ cosθ
h=
(ρ L − ρar ) ⋅ g ⋅ r
CAPILARIDADE E TENSÃO SUPERFICIAL:
LEI DE JURIN
(
ρ − ρ )r h g
γ=
0
2 cosθ
CURVATURA NA INTERFACE: PORQUÊ?
• A lei de Laplace relaciona a diferença de pressão
através de uma membrana elástica (ou de uma
película de líquido) fechada, com a tensão
superficial e com a forma da superfície
fechada da membrana ou película
a pressão no interior de uma superfície esférica é
sempre maior que no exterior
a diferença de pressão aumenta quando diminui o
raio da referida superfície
a diferença de pressão se anula quando a superfície
é plana (raio infinito)
SUPERFÍCIES CURVAS NAS INTERFACES LÍQUIDOAR: LEI DE YOUNG- LAPLACE
• A lei de Young – Laplace relaciona a diferença de pressão através de uma membrana
elástica (ou de uma película de líquido) fechada, com a tensão superficial e com a forma
da superfície fechada da membrana ou película
Capilar com, p.ex., água e ar
Equilíbrio Mecânico
⇓
∑ forças de tensão = ∑ forças de pressão
SUPERFÍCIES CURVAS NAS INTERFACES LÍQUIDOAR: LEI DE YOUNG- LAPLACE
π ⋅ R ( p g − pl ) = γ ⋅ 2 ⋅ π ⋅ R
2
2γ
∆ p = ( p g − pl ) =
R
O QUE DIZ A EQUAÇÃO DE YOUNG - LAPLACE
A fórmula de Young-Laplace mostra que:
que a pressão no interior de uma superfície esférica é sempre
maior que no exterior
que a diferença de pressão aumenta quando diminui o raio da
referida superfície
que a diferença de pressão se anula quando a superfície é plana
(raio infinito)
CURVATURA NA INTERFACE:
VARIAÇÃO DA PRESSÃO & TENSÃO SUPERFICIAL
• Como varia a pressão dentro de uma
superfície curva com o raio dessa
superfície, para dois valores diferentes de
tensão superficial?
∆P ⇒ 0 quando r ⇒∝
• Nota: isto ilustra a dificuldade de se formarem
pequenas bolhas. Quanto mais pequena for a
bolha , maior deverá ser a pressão no seu
interior para que ela se mantenha estável
DEDUÇÃO DA EQUAÇÃO DE YOUNG-LAPLACE
Suponha uma gota que se forma no
extremo de uma seringa ao deslocar o
êmbolo, tal como se indica na figura.
P0- pressão exterior.
Para formar a gota de raio r é necessário aplicar, mediante o êmbolo, uma pressão P > P0.
O trabalho realizado pelo embolo, sobre o líquido ao mover-se é P·dV
Mas, a gota realiza também um trabalho (P0.dV)de deslocamento do ar, no seu entorno , ao aumentar o
seu volume dV.
Nota: ambos os volumes são iguais porque o líquido é incompressível.
DEDUÇÃO DA EQUAÇÃO DE YOUNG-LAPLACE
Suponha uma gota que se forma no
extremo de uma seringa ao deslocar o
êmbolo, tal como se indica na figura.
O trabalho total sobre o líquido será
dW=(p-p0)·dV
Este trabalho é utilizado para aumentar a superfície da gota, enquanto a temperatura e o
volume de líquido se mantêm constantes.
dW=γ dA
DEDUÇÃO DA EQUAÇÃO DE YOUNG-LAPLACE
Suponha uma gota que se forma no
extremo de uma seringa ao deslocar o
êmbolo, tal como se indica na figura.
Igualando os 2 trabalhos e tendo em conta a área e o volume de uma superfície esférica:
A = 4πr 2
4
V = πr 3
3
dV=4π
r2dr,
e dA=8π r·dr
2γ
p − p0 = ∆P =
R
EQUAÇÃO DE LAPLACE: PARA SUPERFÍCIES
ESFÉRICAS
A equação de Young-Laplace é a base do método da ascensão de
líquidos em tubos capilares para medir tensões superficiais.
Dá-nos a diferença de pressão entre duas fases em equilíbrio
(∆P), em função da tensão superficial (γ) e a curvatura da
interface
Conclusão:
-entre duas fases separadas por uma
interface, sempre existirá uma diferença de
pressão em equilíbrio, sendo maior a pressão no
interior da curvatura.
LEI DE LAPLACE PARA BOLHAS E GOTAS
APLICAÇÕES DA LEI DE LAPLACE:
ASCENSÃO CAPILAR
r = R cos θ
2γ 2γ
∆p =
=
cos θ
R
r
∆p = (ρ liq − ρ ar )gh = ∆ρgh
∆p
2γ
h=
=
cos θ
∆ρg rρg
APLICAÇÕES DA LEI DE LAPLACE:
ESTABILIZAÇÃO ALVEOLAR
•
Bolhas de tamanhos diferentes ligadas a um tubo
Pint − Pext =
2γ
r
• Pressão interna maior para a gota mais pequena
• A gota mais pequena diminui
• Estabilização alveolar por tensioactivos
• ⇓ tensão superficial
• ⇑ diâmetro alveolar
• evitam o colapso dos alvéolos
P
P
ESTABILIZAÇÃO ALVEOLAR
dipalmitoyl
phosphatidylcholine
ESTABILIZAÇÃO ALVEOLAR
Bronchial tubes in the lungs branch into ever-smaller
structures, finally ending in alveoli. The alveoli act like
tiny bubbles. The surface tension of their mucous
lining aids in exhalation and can prevent inhalation if
too great.
Surface tension as a function of surface area. The surface
tension for lung surfactant decreases with decreasing area. This
ensures that small alveoli don’t collapse and large alveoli are
not able to over expand.
MÉTODOS PARA A DETERMINAÇÃO DA
TENSÃO SUPERFICIAL
Estáticos
Dinâmicos
DETERMINAÇÃO DA TENSÃO SUPERFICIAL:
MÉTODOS
Métodos Estáticos- Medida da tensão de uma superfície que não se
modifica ao longo das determinações e que se mantém constante e em
equilíbrio com a fase líquida
Métodos Dinâmicos - Medida da tensão de uma superfície, em extensão
ou em contração, e em que o equilíbrio com a fase líquida varia
constantemente durante a determinação
ANEL DE DU NOÜY
A tensão superficial do líquido é calculada a partir do diâmetro
2R do anel e do valor da força ΔF que mede o dinamómetro.
BALANÇA DE WILHELMY
MÉTODO DO CATECÓMETRO
Método da ascensão por
capilaridade
a) Com um catecómetro, medir
a altura h de ascensão do líquido
Precisão ≈ 0,01 mm
Utilização: aplicável a líquidos puros e
de elevada tensão superficial
MÉTODO DO GOTEJAMENTO
• Consiste em fazer gotejar o líquido
através de um tubo capilar fino e aplicar
um balanço de forças no momento da
queda da gota
• A gota de massa (mi) cai quando o seu
peso igualar as forças correspondentes à
tensão superficial (Fγ)
MÉTODO DE GOTEJAMENTO: PESO DA GOTA
• A força de tensão (Fγ) que mantém a gota ligada ao resto do líquido é
dada por:
• Então:
mi = massa da gota ideal
r = raio do tubo
Lei de Tate
MÉTODO DE GOTEJAMENTO: PESO DA GOTA
• Observa-se que somente a porção mais externa da gota é que alcança a posição de instabilidade e
cai. Perto de 40% do líquido que forma a gota permanece ligado ao tubo.
• Para corrigir o erro causado pelo peso da gota, introduz-se na equação um fator de correção f.
• Assim:
γ=
mi . g
2..π . r . f
• O fator de correção f é uma função do raio do tubo e do volume da gota. Estes valores são
tabelados abaixo:
MÉTODO DE GOTEJAMENTO: PESO DA GOTA
• Fator de correção para o método do peso da gota
NA PRÁTICA O QUE FAZER?
• a) Contar o número de gotas
correspondente a um determinado
volume de líquido
F = 2πr 2γ ⇒ p = 2πrγ
• n é inversamente proporcional a γ
• n é inversamente proporcional a V
• A massa de cada gota
mgota =
V ⋅ρ
V ⋅ρ⋅g
e pgota =
n
n
2 ⋅π ⋅ r ⋅ γ =
V ⋅ρ⋅g
V ⋅ρ⋅g
ou γ =
n
2 ⋅π ⋅ r ⋅ n
NA PRÁTICA O QUE FAZER?
• Repita agora o ensaio para um líquido de tensão superficial conhecida
V ⋅ ρ1 ⋅ g
γ1 =
2 ⋅ π ⋅ r ⋅ n1
• Relacione agora os dois valores
γ
V ⋅ ρ ⋅ g 2 ⋅ π ⋅ r ⋅ n1
=
x
γ 1 2 ⋅π ⋅ r ⋅ n V ⋅ ρ1 ⋅ g
γ
ρ n
= x
γ
ρ n
1
1
1
ADSORÇÃO DE LÍQUIDOS
EM SUPERFÍCIES SÓLIDAS E EM SUPERFÍCIES LÍQUIDAS
ADSORÇÃO DE LÍQUIDOS POR LÍQUIDOS
ADSORÇÃO DE LÍQUIDOS POR LÍQUIDOS
Tipo II
Tipo I
São excluídos na interface
Aumentam
γ
Adsorção negativa
Encontram-se na interface
Diminuem
γ
Adsorção positiva
EFEITO DO SOLUTO SOBRE A TENSÃO SUPERFICIAL
ADSORÇÃO POSITIVA VS ADSORÇÃO NEGATIVA
ADSORÇÃO POSITIVA:
SURFACTANTES: CONSTITUIÇÃO
Características:
Se a tensão superficial entre dois
líquidos é suficientemente
reduzida pela adição de
surfactantes podem formar-se
micro emulsões
actuam a baixas concentrações
possuem baixa tensão superficial
diminuem a energia livre de Gibbs do
sistema
TIPOS DE SURFACTANTES
SURFACTANTES NATURAIS
Carbohidratos naturais:
•Alkyl polyglucosides – Triton APGs (Union Carbide), Plantcare
(Cognis/Henkel), Lauryl glucoside, Monatrope (ICI/Uniqema)
•Sorbitan esters – Crills (Croda) and Spans (ICI/Uniqema)
•Sucrose esters – Crodestas (Croda)
BIOSURFACTANTES
COMO ATUAM OS SURFACTANTES
• Surfactantes na interface
• Micela esférica
QUANDO UM SURFACTANTE É ADICIONADO A
UM LÍQUIDO
EXCESSO INTERFACIAL (Γ)
α
área de interface
soluto i
σ
β
Excesso interfacial
niσ
Γi =
A
nT
niα
ni β
= soluto i total
= soluto i na fase α
= soluto i na fase β
niσ
= soluto i na interface
niσ = nT - (niα + niβ)
EXCESSO DE CONCENTRAÇÃO À SUPERFÍCIE
COMO TRADUZIR MATEMATICAMENTE?
ISOTÉRMICA DE GIBBS
• A isotérmica de Gibbs descreve a relação entre a concentração de soluto
(c) e o excesso de concentração à superfície (Γ) , a uma dada temperatura
c dγ
Γ=−
⋅
RT dc
1
dγ
Γ=−
⋅
RT d ln c
Γ = excesso de concentração à superfície (mol/m2)
R = constante dos gases perfeitos (8.314 J mol -1 K-1)
T= Temperatura (K)
C= concentração (mol/dm3)
γ =tensão superficial (N/m)
OU…..
dγ
Γ=−
2,303 ⋅ RT ⋅ d log C
Γ = excesso de concentração à superfície (moles m-2)
C= concentração molar ou actividade molar da substância adsorvida
γ = tensão superficial (Nm-1)
COMO CALCULAR O EXCESSO DE
CONCENTRAÇÃO À SUPERFÍCIE?
Efetuar medidas da tensão superficial de soluções com diferentes
concentrações de soluto
Efetuar o gráfico γ em função de ln C
QUE TIPOS DE GRÁFICOS PODE OBTER?
1.Subst. que se concentram na interface e fazem
baixar a tensão superficial (adsorção positiva)
dγ
<0
d ln C2
Sabões; aminas, proteínas;
ácidos gordos
2.Subst. que não se concentram na interface e fazem
aumentar a tensão superficial (adsorção negativa)
dγ
>0
d ln C2
Açucares;
polissacarídeos
CÁLCULO DO EXCESSO DE CONCENTRAÇÃO À
SUPERFÍCIE
• Use o declive da parte linear
dγ
<0
d log C
OU
dγ
<0
d ln C
• Faça o cálculo agora:
ou
Γ=−
Γ=−
dγ
2,303 ⋅ RT ⋅ d log C
1
dγ
⋅
RT d ln c
PARA QUE SERVE CALCULAR O EXCESSO DE
CONCENTRAÇÃO À SUPERFÍCIE?
• Determinar a área de superfície molecular
1
AB =
ΓB ,máx × N A
APLICAÇÃO DA ISOTÉRMICA DE GIBBS
• Tensões superficiais de soluções aquosas de um surfactante não iónico (CH 3(CH 2 )
9(OCH 2CH 2 ) 5OH) a 25ºC
DETERMINAÇÃO DA CONCENTRAÇÃO MICELAR
CRÍTICA
• Concentração de tensioactivo em que as moléculas individuais se agregam para
formar micelas
Π
Propriedade
Turbidez
Λ
γ
CMC
Concentração
FACTORES QUE INFLUENCIAM A
CONCENTRAÇÃO MICELAR CRÍTICA
• A concentração Micelar Crítica diminui com:
• O aumento das características hidrofóbicas da molécula
• A diminuição da temperatura
• O aumento da força iónica
NA CMC
SOLUBILIDADE DOS SURFACTANTES:
PONTO DE KRAFT
• Solubilidade dos surfactantes é altamente dependente
de T
• Acima de certa temperatura não é possível existirem
micelas
• O ponto onde a curva de solubilidade se encontra com
a curva de CMC, é o ponto de Kraft.
DIAGRAMAS DE FASES
Cloud Point Temperature on the
surfactant-water-temperature phase
diagram
ESCALA DE BALANÇO HIDRÓFILO-LIPÓFILO
TIPOS DE MICELAS
Misturas de sais de ácidos
gordos formam micelas:
agregados esféricos de 10 a
1000 moléculas
Diâmetro < 200 Å
Fosfolípidos e glicolípidos formam
bicamadas ou lipossomas.
As bicamadas são estruturas
planares relativamente instáveis.
Lipossomas são
vesículas com
água dentro. Resultam
do fecho
da bicamada sobre si
própria.
Diâmetro variável de
500 a 104 Å
DIAGRAMA DE FASES
A schematic phase diagram of a
surfactant-oil-water system showing
different ways of packing the
surfactant molecules depending on
concentration of components. Large
quantities of an amphiphilic material
(surfactant) and small quantities of
water and oil result in generation of
surfactant "crystals", large quantities of
water and small quantities of
surfactant and oil - micelles, etc.
A IMPORTÂNCIA ECONÓMICA DOS
SURFACTANTES
Algumas áreas importantes de
elevado impacto, para os surfactantes.
APLICAÇÕES DOS SURFACTANTES
• Detergência: remoção do material hidrofóbico em solução aquosa
• Molhamento: diminuição do ângulo de contacto entre líquido e sólido
altera a molhabilidade das superfícies
• Ex. superfície hidrofílica torna-se hidrofóbica por adsorção do
tensioactivo
• Emulsificação: estabilização da dispersão de fases líquidas imiscíveis
• Flotação: tratamento de minério por utilização de bolhas de ar e
tensioativo para separar o minério da escória
• Recuperação de petróleo: injeção de tensioactivos na rocha para
aproveitamento do petróleo restante