ESTUDO DA TOXICIDADE DA ASSOCIAÇÃO DO MELOXICAN E
CURCUMINA LIVRES E NANOENCAPSULADOS EM CAMUNDONGOS(1)
Maria Eduarda Ziani Gutierrez(2), Anne Suély Pinto Savall(3), Alexandre Osório
Roballo Guedes(3), Sandra Elisa Haas(4), Daniel Henrique Roos(5), Simone Pinton(6)
(1) Trabalho
executado com recursos do Edital MCTI/CNPQ/Universal 14/2014, Edital FAPERGS 2016 – PROBIC da PróReitoria de Pesquisa, Pós-Graduação e Inovação.
(2) Autora Principal; Acadêmica de Enfermagem, bolsista FAPERGS, Universidade Federal do Pampa, Campus
Uruguaiana, Uruguaiana, Rio Grande do Sul. [email protected];
(3)
Co-autores, Universidade Federal do Pampa, Campus Uruguaiana, Uruguaiana, Rio Grande do
[email protected]; [email protected]
(4) Docente colaboradora; Universidade Federal do Pampa. Campus Uruguaiana, Uruguaiana, Rio Grande do
[email protected]
(5) Co-orientador; Universidade Federal do Pampa. Campus Uruguaiana, Uruguaiana, Rio Grande do
[email protected]
(6) Orientadora; Universidade Federal do Pampa. Campus Uruguaiana, Uruguaiana, Rio Grande do
[email protected]
Sul.
Sul.
Sul.
Sul.
Palavras-Chave: nanocapsulas, toxicidade, meloxican, curcumina.
INTRODUÇÃO
As nanocápsulas são carreadoras de fármacos que proporcionam algumas vantagens em relação
aos fármacos convencionais principalmente pelo seu tamanho nanométrico que admite uma eficiente
absorção por diferentes tipos celulares e um acúmulo seletivo do fármaco no sítio de ação. Com o aumento
dos possíveis usos destas formulações, há também a necessidade de estudos sobre a toxicidade das
mesmas (REIS et al., 2006).
Assim, buscamos determinar os possíveis efeitos das nanocápsulas de PLC (poly ε-capro-lactona)
de Meloxican e da Curcumina, separados ou combinados sobre alguns parâmetros gerais de toxicidade e
indicadores de estresse oxidativo. Os efeitos das formas livres destes compostos também foram testados
(usando o óleo de canola como veículo de diluição).
METODOLOGIA
Foram utilizados vinte e seis camundongos Swiss machos, divididos nos grupos (N = 3-4/grupo): I)
Controle (óleo de canola); II) Meloxican (5mg/kg), III) Curcumina (10mg/kg); IV) Meloxican + Curcumina (5 e
10mg/kg, respectivamente); V) PLC vazia; VI) PLC de Meloxican (5mg/kg); VII) PLC de Curcumina
(10mg/kg); VII) PLC de Meloxican + Curcumina (5 e 10mg/kg, respectivamente). Os animais receberam
cinco doses via oral (gavage, 16 vezes o peso do corpo) em dias alternados (intervalo de 48horas), as
doses e tempo de tratamento foram baseadas em dados da literatura que indicam efeitos neuroprotetores
das nanoformulações (Ianiski et al., 2016). O peso dos animais foi monitorado durante o tratamento. Dez
dias após a primeira exposição, os camundongos foram sacrificados e além das amostras de fígado e rins,
o sangue foi coletado por punção cardíaca. Foram determinados os níveis séricos de uréia e creatinina, as
atividades das enzimas aspartato aminotransferase (AST) e alanina aminotransferase (ALT) com kits
comerciais. No fígado e no rim foram determinados os níveis de tióis não proteicos (NPSH) (Ellman, 1959),
nível das substâncias reativas ao ácido tiobarbitúrico (TBARS) (OHKAWA, et al., 1979) e espécies reativas
(ER) (LOETCHUTINAT et al., 2005), as atividades das enzimas catalase (CAT) (AEBI et al., 1984) e deltaaminolevulinato-desidratase (δ-ALA-D) (SASSA, 1982). Foram realizados testes de análise de variância de
duas vias (ANOVA) seguidos por Tukey.
RESULTADOS E DISCUSSÃO
Anais do 8º Salão Internacional de Ensino, Pesquisa e Extensão – Universidade Federal do Pampa
Nossos resultados demostraram que nenhum dos tratamentos alterou o ganho do peso corporal dos
camungondos. Os níveis de uréia e creatinina não foram alterados nos grupos. Todos os grupos
apresentaram valores similares das atividades da AST e ALT. Desta forma, podemos inferir que assim como
as formas livres de meloxican e curcumina, as nanocápsulas destes fármacos, isolados ou coencapsulados, possuem baixa toxicidade hepática e renal. Corroborando com estes resultados, a atividade
da δ-ALA-D hepática e renal, uma enzima sensível a agentes xenobióticos, não foi alterada em nenhum dos
grupos tratados. Quanto aos marcadores de estresse oxidativo, podemos inferir que nenhum dos
tratamentos altera os níveis de espécies anti e pró-oxidantes celulares, pois nenhum dos tratamentos
induziu alterações na atividade da CAT, nos níveis de ER, TBARS e NPSH no fígado e rim dos
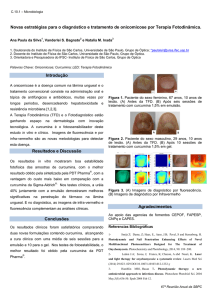
camundongos tratados. Com exceção, das nanocápsulas de curcumina, que aumentaram significativamente
os níveis de NPSH no fígado dos animais (Figura 1B), mas não alteraram os níveis de NPSH nos rins (Fig,
1A).
Figura 1: Níveis de NPSH nos (A) Rim e (B) Fígado de camundongos tratados com diferentes formulações
(diluídas em óleo de canola ou nanoencapsuladas) de curcumina, meloxicam ou curcumina e meloxican.
*diferente do controle tratatado com as nanocápsulas vazias.
CONCLUSÕES
Nossos resultados permitem afirmar que a baixa toxicidade induzida pelo consumo da associação do
meloxican e curcumina nas formulações livres e nanoencapsuladas formam uma terapia medicamentosa
possível de aplicação sem causar dano aos principais órgãos envolvidos no metabolismo dos fármacos.
REFERÊNCIAS
Aebi, H., et al.,1984.Catalaseinvitro. Methods Enzymol.105, 121–126.
Ellman GL (1959) Tissue sulfhydryl groups. Arch Biochem Biophys 82:70–77
LOETCHUTINAT C, et al. Spectrofluorometric determination of intracelular levels of reactive oxygen species
in drug-sensitive and drug-resistant cancer cells using the 20,70-dichlorofluorescein diacetate assay. Rad
Phys Chem 2005; 72: 323–331
Ohkawa H, Ohishi N, Yagi K (1979) Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction.
Anal Biochem 95:351–358
REIS, C.P.; et al.. Nanoencapsulation II. Biomedical applications and current status of peptide and protein
nanoparticulate delivery systems, Nanomedicine: Nanotechnology, Biology and Medicine 2, v.8, p. 5365, 2006.
Sassa S (1982) Delta aminolevulinic acid dehydratase assay. Enzyme 28:133–145
Anais do 8º Salão Internacional de Ensino, Pesquisa e Extensão – Universidade Federal do Pampa