Guia para o uso de testes de
Genotipagem no Brasil
Apoio
RJ Estrada do Bananal, 56 - Freguesia/Jacarepaguá - CEP: 22745-012 - (21) 2425-8878 | SP Av. Santa Catarina, 1.521 - Sala 308 - Vila Mascote CEP: 04378-300 - (11) 2539-8878 | USA 4929 Corto Drive - Orlando - FL - 32837 - 1 (321) 746-4046
www.doccontent.com.br | [email protected]
Diretor: Renato Gregório | Gerente editorial: Bruno Aires | Coordenadora editorial: Thaís Novais (MTB: 35.650/RJ) | Gerente comercial: Karina Maganhini
| Gerente do programa PróDOC: Valeska Vidal | Editor: Marcello Manes | Coordenadora de relacionamento médico: Priscila Fonseca | Coordenador
técnico-científico: Guilherme Sargentelli (CRM 541480-RJ) | Coordenador de revisão: Leonardo de Paula | Revisor: Adriano Bastos | Coordenadora de
design gráfico: Danielle V. Cardoso | Designers gráficos: Douglas Almeida, Monica Mendes e Tatiana Couto | Gerentes de relacionamento: Beatriz Piva,
Sâmya Nascimento, Selma Brandespim e Thiago Garcia | Assistentes comerciais: Heryka Nascimento, Jessica Feliciano e Katia Martinez | Coordenador de
varejo e marketing: Sandro Costa | Coordenadora administrativa: Cintia Vasconcelos | Produção gráfica: Pedro Henrique Soares e Tiago Silvestre
Copyright© 2016 by DOC Content. Todas as marcas contidas nesta publicação, desenvolvida exclusivamente pela DOC Content para o laboratório Janssen,
bem como os direitos autorais incidentes, são reservados e protegidos pelas leis 9.279/96 e 9.610/98. É proibida a reprodução total ou parcial, por quaisquer
meios, sem autorização prévia, por escrito, da DOC Content. Publicação destinada à classe médica. O conteúdo deste material é de responsabilidade de seu
autor, não refletindo necessariamente a opinião da Janssen.
Sobhie Diaz, Ricardo
Guia para o uso de testes de Genotipagem no Brasil / Ricardo Sobhie Diaz - Rio de Janeiro: DOC Content, 2016. 1a edição - 20 p.
ISBN 978-85-8400-063-0
CDD: 616.979.2
Reservados todos os direitos. É proibida a reprodução ou duplicação deste volume, no todo ou em parte, sob quaisquer formas ou por quaisquer meios
(eletrônico, mecânico, gravação, fotocópia ou outros), sem permissão expressa do autor. Direitos reservados ao autor.
Renata Carrara
Ricardo Sobhie Diaz (CRM: 57803-SP)
Professor-associado e livre-docente da disciplina de Infectologia; chefe do
laboratório de Retrovirologia da Escola Paulista de Medicina, Universidade
Federal de São Paulo (Unifesp); diretor médico do Laboratório Centro de
Genomas, São Paulo (SP)
Colaboração técnica
Tania Regina Constant Vergara (CRM: 285058-RJ)
Vice-presidente da Sociedade de Infectologia do Estado do Rio de Janeiro; coordenadora do Comitê de Terapêutica
em HIV/Aids da Sociedade Brasileira de Infectologia (SBI)
José Valdez Ramalho Madruga (CRM: 67622-SP)
Investigador principal da Unidade de Pesquisa de Medicamentos do Centro de Referência e Treinamento em
DST/Aids do Estado de São Paulo; coordenador do Comitê de Aids da SBI
Juan Cogo
Sérgio Cimerman (CRM: 79386-SP)
Presidente da Sociedade Brasileira de Infectologia
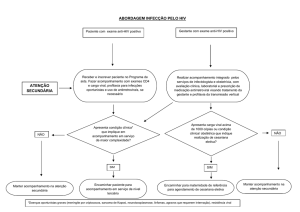
A resistência aos antirretrovirais continua sendo um problema na prática clínica para quem lida com o paciente
com HIV. Apesar da gradativa diminuição na possibilidade de falha virológica ao tratamento, a transmissão de vírus
resistentes ainda é uma realidade. Nesse contexto, a genotipagem, com sua classificação viral e busca por identificação de mutações, consiste em relevante instrumento de monitoramento para o tratamento antirretroviral. Sua
aplicação evita trocas desnecessárias de antirretrovirais, propiciando uma escolha direcionada em vez de empírica e,
evitando toxicidade desnecessária de medicamentos com pouca ou nenhuma atividade. Da mesma forma, tem muita
importância os testes de genotipagem realizados antes do início do tratamento de pacientes que nunca usaram antirretrovirais, proporcionando mais confiança ao médico e também ao paciente na escolha terapêutica mais adequada.
A importância do tema merece a assinatura autoral de um profissional com a qualidade e experiência de Ricardo
Diaz, infectologista, chefe do Laboratório de Retrovirologia da Escola Paulista de Medicina e diretor médico do laboratório Centro de Genomas de São Paulo, que descreve com propriedade todas as características e benefícios do
exame, ilustra essa importância com análises de estudos e destaca o preenchimento correto do formulário de solicitação de genotipagem. Um material com esse valor agregado tem total apoio da Sociedade Brasileira de Infectologia.
Boa leitura,
Com respeito, Sergio Cimerman
Sumário
Introdução
6
Qual a importância dos testes de genotipagem na prática clínica?
7
O que é a RENAGENO?
12
A “Cascata da falha virológica”
15
Preenchimento (correto) do Formulário de Solicitação de Genotipagem
18
Referências
19
6
Introdução
Após mais de 30 anos de descoberta da Aids e após vinte da introdução do HAART, a resistência aos antirretrovirais continua sendo um problema na prática clínica. Talvez com impacto
menor que o enfrentado há alguns anos, mas, ainda assim, um problema. Os pacientes que
iniciam tratamento antirretroviral hoje têm uma possibilidade menor de desenvolver falha virológica ao tratamento, e graças aos inibidores de protease com incremento pelo ritonavir ou
cobicistat, têm menor possibilidade de desenvolvimento de resistência extensa aos antirretrovirais. Mesmo assim, vírus com elevados graus de resistência estão presentes em pacientes
que iniciaram o tratamento há muitos anos e a transmissão de vírus resistentes e seu impacto
na resposta aos medicamentos é reconhecidamente uma realidade. Cabe a todos nós entender um pouco mais sobre a correta utilização dos testes de genotipagem e sua interpretação.
Medicamentos novos têm sido desenvolvidos, bem como novas metodologias para detecção
da resistência aos antigos e novos medicamentos. Espero que este guia prático auxilie no entendimento sobre o melhor uso deste importante instrumento de monitoramento do tratamento antirretroviral, bem como repercuta no motivo mais especial de todo o nosso trabalho
profissional: o paciente.
Qual a importância dos testes de genotipagem na prática clínica?
Esta resposta é histórica e quase ancestral. Inúmeros estudos prospectivos e com divisão
aleatória dos pacientes em grupos forneceram evidências muito sugestivas de que os testes
genotípicos têm importância fundamental na condução terapêutica após a falha do tratamento.
Um resumo destes estudos pode ser visto na Tabela 1.
Tabela 1: estudos clínicos randomizados que avaliaram prospectivamente os testes de resistência
NOME DO ESTUDO DESENHO
Genotipagem versus resgate empírico
RESULTADOS
VIRADAPT
• N= 108;
• Carga viral acima de 10.000 cópias/mL;
• Tratados com ITRN há pelo menos 6 meses;
• Tratados com IP há pelo menos 3 meses;
• Genotipagem vs. resgate empírico.
• Redução significativa da carga viral nos meses 3 e 6
no braço da genotipagem;
• Suspendido após um ano de acompanhamento.
ARGENTA
• N= 174;
• Falha terapêutica;
• 25% apresentaram falha com 3 regimes prévios;
• 41% tinham experiência de falha com ITRNs, ITRNNs, e IPs;
• Genotipagem vs. resgate empírico.
• Benefício obtido em 12 semanas perdido em 6 meses, resultado relacionado à adesão.
GART
• N= 153;
• Redução significativa da carga viral na semana 8 de
• Aumento > 3 vezes na carga viral durante a terapia;
acompanhamento no braço da genotipagem.
• Tratados com IP há mais de 16 semanas;
• Genotipagem + aconselhamento do especialista vs. resgate empírico.
7
8
Continuação da tabela 1
NOME DO ESTUDO
HAVANA
DESENHO
• N= 326;
• Carga viral acima de 1.000 cópias/mL;
• HAART estável há mais de 6 meses;
• Genotipagem vs. aconselhamento do especialista vs.
resgate empírico e genotipagem + aconselhamento do
especialista vs. resgate empírico.
RESULTADOS
• Maioria dos pacientes do braço da genotipagem com
carga viral abaixo de 400 cópias/mL na semana 24;
• Aconselhamento do especialista foi benéfico apenas entre pacientes que apresentavam falha na segunda linha ou mais de terapia na entrada.
Fenotipagem versus resgate empírico
VIRA3001
• N= 272;
• Carga viral acima de 2.000 cópias/mL;
• HAART com uso prévio de IP;
• Fenotipagem vs. resgate empírico.
• Maioria dos pacientes no braço da fenotipagem
com carga viral abaixo de 400 cópias/mL na semana
16 na avaliação por intenção de tratamento.
CCTG 575
• N= 238;
• Carga viral acima de 400 cópias/mL;
• HAART estável há mais de 6 meses;
• Uso prévio de 1-2 IPs;
• Fenotipagem vs. resgate empírico.
• Sem benefício nas semanas 6 ou 12 devido ao excelente desempenho do resgate empírico.
Genotipagem vs. fenotipagem vs. resgate empírico
CERT
• N= 450;
• Carga viral média entre 2,7-2,8log cópias/mL;
• HAART estável há mais de 8 semanas;
• Histórico médio de exposição a 3,9 drogas;
• Genotipagem vs. fenotipagem vs. resgate empírico.
• Teste de fenotipagem aumentou significativamente
o tempo até a falha virológica somente nos pacientes tratados com quatro ou mais esquemas prévios e
naqueles que tinham usado ITRNN antes da entrada;
• Sem benefícios com o teste de genotipagem.
NARVAL
• N= 541;
• Carga viral acima de 1.000 cópias/mL;
• Uso de HAART baseado em IPs;
• Genotipagem vs. fenotipagem vs. resgate empírico.
• Sem diferenças na semana 12 entre fenotipagem e
resgate empírico. Interpretação da fenotipagem superestimou sensibilidade do d4T e ddI. Vantagem no
braço da genotipagem.
Genotipagem + fenotipagem vs. genotipagem
ERA
• N= 311;
• Carga viral acima de 2.000 cópias/mL;
• Em HAART;
• Exposição média a 7,7 drogas;
• Genotipagem + fenotipagem vs genotipagem.
• Sem diferenças significativas após 12 meses de
acompanhamento.
Fenotipagem virtual vs. fenotipagem real
GenPheRex
• N= 201;
• Carga viral acima de 1.000 cópias/mL;
• Em HAART há mais de 2 anos;
• HAART estável há 6 meses;
• Fenotipagem virtual vs. fenotipagem.
• Sem diferenças significativas nos resultados virológicos
na semana 48.
RealVirFen
• N= 300;
• Carga viral acima de 1.000 cópias/mL;
• Em HAART;
• Fenotipagem virtual vs. fenotipagem.
• Vantagem para a fenotipagem nos resultados virológicos da semana 24.
9
10
Em resumo, todos esses estudos definiram de forma inequívoca que a eficiência no resgate aos
antirretrovirais se beneficia do uso de testes de genotipagem.
Ajuda potencial dos testes de resistência na prática clínica
1) Evita trocas desnecessárias de antirretrovirais
2) Levanta suspeita com relação à falta de adesão (falha virológica com vírus sem mutações)
3) Propicia trocas direcionadas ao invés de trocas empíricas de antirretrovirais.
4) Propicia o uso de medicamentos ativos por períodos mais prolongados.
5) Economiza custos relacionados a trocas de medicamentos.
6) Evita toxicidade desnecessária de medicamentos com pouca ou nenhuma atividade.
7) Fornece uma perspectiva mais realista do desempenho futuro do tratamento, especialmente nos casos de resistência muito extensa.
Considerações importantes para interpretação dos testes:
Considerações
Observações
Testes de resistência devem ser realizados com carga
viral detectável.
Alguns laboratórios podem acessar o DNA pró-viral em vez de RNA plasmático, possibilitando o teste mesmo com carga viral indetectável (utilidade potencial na necessidade de troca de medicamentos por toxicidade, por exemplo).
Sangue deve ser coletado na vigência do uso da
medicação.
As mutações devem persistir até duas semanas após a interrupção, mas algumas,
como a do códon 184 da TR, podem desaparecer rapidamente na ausência de medicação.
Falha virológica deve ser confirmada por dois testes de
carga viral com intervalo superior a três semanas.
A transativação heteróloga, secundária a infecções transitórias e vacinação, pode
aumentar a carga viral por períodos curtos de tempo sem que haja repercussões
relacionadas à falha virológica.
Falha virológica pode ser decorrente de fatores não
relacionados à resistência viral.
Outros fatores, como adesão ou interações medicamentosas, devem ser investigados
antes da solicitação do teste. Resistência celular pode também ser a causa da falha.
Interpretação dos testes pode ser complexa e necessitar da interação entre os clínicos assistentes e virologistas clínicos.
A importância do assim chamado médico de referência em genotipagem, ou MRG.
Os testes apresentam valor preditivo positivo alto.
Uma vez detectadas as mutações a um medicamento ou grupo de medicamentos, é
muito provável que esse medicamento apresente a ação desejada.
Os testes apresentam valor preditivo negativo baixo.
A ausência da detecção da resistência não significa necessariamente que a mesma
não exista.
Manipulação antirretroviral prévia e resultado de testes
anteriores devem ser considerados na interpretação
de padrões de resistência apontados nos testes atuais.
Mutações selecionadas no passado podem desaparecer na ausência do medicamento que a selecionou. Essas mutações reemergem rapidamente quando o medicamento é reintroduzido (falsa reversão de mutações na ausência dos medicamentos).
11
12
É também inegável a importância dos testes de genotipagem relacionados antes do início do tratamento entre pessoas que nunca usaram antirretrovirais. A resistência transmitida aos antirretrovirais
associa-se com a falha ao tratamento1, especialmente quando inibidores da transcriptase reversa não
análogos aos nucleosídeos são utilizados na primeira linha de tratamento, como é o caso da diretriz
brasileira para início do tratamento antirretroviral. Os dados mais recentes da RENIC, rede nacional
que monitora a resistência transmitida aos antirretrovirais, apontam que locais como as cidades de
São Paulo e Salvador apresentam prevalências preocupantes de resistência transmitida (dados não
publicados). Entendemos que, ao modelo do que ocorre no mundo desenvolvido, testes de genotipagem pré início de tratamento devem ser incorporados no Brasil em futuro próximo.
O que é a RENAGENO?
O pioneirismo era nossa característica. Em 1991, a zidovudina foi disponibilizada em nosso sistema público de saúde. Em 1996, foi viabilizada a associação de três medicamentos no
sistema público de saúde, em um esquema conhecido como HAART. Ao final de 1996 e início
de 1997, foi estabelecida uma rede nacional também no sistema público de saúde, disponibilizando os testes de contagem de células T CD4+ e de carga viral para o RNA do HIV. Aqui
nossa primeira grande surpresa. A falha virológica era extensa! Em, 2001, menos de 50% dos
pacientes em tratamento apresentavam carga viral indetectável2. Em 2001, foi estabelecida
a Rede Nacional de Genotipagem, ou RENAGENO. O Brasil passou a ser naquele momento
o primeiro país no mundo a oferecer gratuitamente em sua rede os medicamentos e testes
de monitoramento que incluíam a genotipagem. A RENAGENO logo passou a contar com 20
laboratórios públicos executando testes de genotipagem em 11 estados e no Distrito Federal,
além de um Laboratório de Referência (Laboratório de Retrovirologia da UNIFESP) para “resgatar” as amostras onde o resultado não havia sido obtido pelo laboratório executor.
O Brasil inovou mais uma vez. Observando os resultados do estudo espanhol HAVANA, notou-se que o resgate baseado em genotipagem levou 55,5% dos pacientes a obterem carga viral
indetectável, enquanto que esta porcentagem foi de 42,5% no segundo com resgate antirretroviral empírico (p= 0,01)3. O mais interessante nesse estudo foi o fato de que o grupo que teve
na abordagem o auxílio da genotipagem foi dividido em dois subgrupos, sendo que um deles
recebia a orientação de um especialista (virologista clínico) na análise da genotipagem. Como
resultado, o grupo de pacientes cujo médico recebia a orientação do especialista na análise da
genotipagem obteve 69,2% de cargas virais indetectáveis comparados com 36,4% no grupo onde
o médico assistente analisava a genotipagem sem esta ajuda (p= 0,001)3,4. Em outras palavras, a
ausência de uma interpretação adequada ou de um “aconselhamento virológico” para interpretação da genotipagem leva a um desempenho semelhante ao do grupo que não realizou a genotipagem. Nesse momento, decidiu-se criar o que foi chamado de “médico de referência em
13
14
genotipagem (MRG)”. Estes médicos tornaram-se especialistas treinados em tratamento antirretroviral, resgate antirretroviral e especialmente na interpretação de testes de resistência. Dessa
forma, o Brasil conta com 256 MRGs distribuídos pelo país e mais 100 MRGPe, que são pediatras
com o mesmo tipo de tratamento. Os MRGs são os responsáveis por orientarem médicos assistentes no resgate aos antirretrovirais baseados em genotipagem.
Na RENAGENO foi também implementado o monitoramento do controle de sua qualidade com painéis de amostras para controle de qualidade e resultados de sequenciamento
para interpretação correta dos dados brutos do sequenciamento genômico (quality control/
quality assurance)5. Foi desenvolvido também e disponibilizado um software nacional para análise dos resultados de sequenciamento para detecção de contaminação laboratorial por produtos
de PCR, o que é uma frequente causa de erro laboratorial (http://189.28.129.134/).
Desde o seu início, a RENAGENO também desenvolveu um algoritmo próprio de interpretação dos resultados de genotipagem de acordo com a contribuição consensual vinda dos
melhores especialistas nacionais, que é disponibilizada em http://50.116.24.135:8080/HIV/resistencia.jsp. Além da interpretação, este site descreve as mutações das sequências submetidas e
analisa a sequência como um todo, fazendo a classificação de acordo com o subtipo do HIV.
Em 2015, para mitigar a heterogeneidade entre os laboratórios da RENAGENO e para que
houvesse uma maior profissionalização do serviço, em ato inovador e corajoso, o Departamento
Nacional de DST/Aids e hepatites virais decidiu terceirizar a execução dos testes de genotipagem
para um laboratório privado. Após licitação nacional onde três laboratórios habilitados concorreram a esta licitação, o Laboratório Centro de Genomas® foi contratado para captação das amostras
em território nacional e execução dos testes de genotipagem da RENAGENO, com início das atividades em janeiro de 2016. A partir de então, os resultados devem ser liberados em um prazo
máximo de 12 dias úteis. Os desafios agora, dentre muitos outros, passaram a ser a disponibilização
mais ampla dos testes e ampliação do acesso a esse importante instrumento.
A “Cascata da falha virológica”
A falha virológica ao tratamento antirretroviral deve ser detectada precocemente. Os motivos para tal são vários. Principalmente porque a viremia proporcionada pelo HIV é deletéria para
órgãos e tecidos, porque a resistência incrementa ao longo do tempo e porque sempre existe a
possibilidade de transmissão de vírus resistentes. Com os recursos terapêuticos que temos hoje,
o tratamento deveria manter as pessoas com a carga viral indetectável para sempre. Obviamente,
por uma série de motivos que não serão discutidos aqui, isso não ocorre. Podemos observar na
figura 1 abaixo, que ao longo do tempo, o desempenho do tratamento aumenta; boa notícia, mas
o número de pessoas em falha virológica ainda é elevado; má notícia.
15
16
Figura 1: porcentagem de pessoas em tratamento antirretroviral com carga viral indetectável no Brasil
ao longo do tempo, de acordo com a faixa etária (retirado de Diaz et al, 2015)
% de pacientes com VL < 400
cópias RNA/mm3 plasma
100
Porcentagem de pacientes por idade, com carga viral
80
13-21
22-50
>50
Total
60
40
20
2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011
Ano
De acordo com os dados do Programa Nacional de DST/Aids e hepatites virais, mais de 50 mil
pessoas, teoricamente, seriam candidatas a realizar um teste de genotipagem no Brasil por apresentarem carga viral com valores superiores a 1.000 cópias/mL (Figura 2). O ponto é que cerca de 10 mil
genotipagens somente são realizadas por ano
no país. Onde estariam portanto esses pacientes? Nitidamente, um esforço maior deveria
ser feito para expandir o acesso a esses testes.
Inicialmente, tais pacientes precisam ser identificados. Os serviços de atenção aos pacientes
deveriam, portanto, ter mais recursos para a
busca ativa desses indivíduos. Os médicos deveriam também estar mais sensibilizados com
relação a importância de se abolir a viremia dos
pacientes em falha virológica, e estes deveriam
ter mais acesso aos testes de carga viral, para
que se detecte a falha e se estabeleça uma ação
corretiva com relação à adesão e necessidade
de tratamento de resgate.
O Programa Nacional percebeu isso! Teoricamente, todos os pacientes em tratamento
Figura 2: cascata de cuidado contínuo no Brasil
900
800
700
600
781
100%
649
83%
623
80%
500
514
68%
400
405
52%
300
356
46%
200
100
0
Infectados Diagnospelo HIV
ticados
Vinculados
Retidos
Tarv
Com CV
indetectável
(<1000)
Fonte: MS/SVS/Departamento de DST, Aids e Hepatites Virais/ Sistema
de Controle de Exames Laboratoriais (Siscel) e Sistema de Controle
Logístico de Medicamentos (Siclom)
17
18
deveriam realizar uma carga viral a cada 6 meses. Em tese os testes de carga viral deveriam estar amplamente disponíveis no território nacional. Assim sendo, instituiu-se que os medicamentos antirretrovirais só deveriam ser liberados pelo SICLOM através da apresentação de um resultado de
carga viral com validade inferior a 6 meses. Isto causou inicialmente muito desconforto em médicos
e em pacientes. Mas a intenção parece boa.
Preenchimento (correto) do Formulário de solicitação de Genotipagem
Uma combinação que nunca foi muito promissora ou popular é a que ocorre entre os médicos
e os formulários. A vida atribulada dos médicos, que por vezes mal tem o tempo para despender
com os pacientes da forma que gostariam, pode ser ainda mais prejudicada pelo excesso de burocracia. Entretanto, entendo também que o registro de informações pode ajudar o governo a
tomadas de decisões e na rastreabilidade de resultados e condutas tomadas frente aos pacientes.
Em função do preenchimento incompleto dos formulários, o Laboratório Centro de Genomas®
foi obrigado a descartar aproximadamente 40% das amostras recebidas nos primeiros meses de
sua atividade. Dessa forma, torna-se primordial também que o formulário seja adequadamente
preenchido. Inicialmente, devemos ter claro quais são os critérios para seleção de pacientes
elegíveis para realização de genotipagem.
Referências
1) Gagliani LH, Maia WTA, Sá-Filho D, Sucupira MC, Caseiro MM, Diaz RS. The association between primary antiretroviral resistance and HAART virologic failure in a developing set. AIDS Res Hum Retroviruses, 2011;27(3):251-256.
2) Diaz RS, Inocêncio LA, Sucupira MCA, Pereira AA, Hunter J, Ferreira JE, Araújo LV, Souza DFC, Sabino EC. The
Virological and Immunological Characteristics of the HIV-1-Infected Population in Brazil: from Initial Diagnosis to
Impact of Antiretroviral Use. PLoS One. 2015 Oct 28;10(10):e0139677. doi: 10.1371/journal.pone.0139677.
3) Tural C, Ruiz L, Holtzer C, Schapiro J, Viciana P, Gonzalez J, Domingo P, Boucher C, Rey-Joly C, Clotet B,
Havana Study Group (2002). Clinical utility of HIV-1 genotyping and expert advice: the Havana trial. AIDS,
Jan 25;16(2):209-18.
4) Badri SM, Adeyemi OM, Max BE, Zagorski BM, Barker DE (2003). How does expert advice impact genotypic
resistance testing in clinical practice? Clin. Infect. Dis. Sep 1;37(5):708-13.
5) Souza DCF, Sucupira MC, Brindeiro R, Fernandez JCC, Sabino EC, Inocencio LA, Diaz RS. The Brazilian Network
for HIV-1 Genotyping (RENAGENO) External Quality Control Assurance Program (EQA). Journal of International
AIDS Society, J. Int. AIDS Soc. 2011 Sep 21;14(1):45.
19
Apoio