Salvador, Bahia · Quinta-feira
15 de Novembro de 2012
Ano · XCVII · No 20.998
PORTARIA Nº. 1603 DE 14 DE NOVEMBRO DE 2012
Instituir o Protocolo técnico para a dispensação de análogos de insulina
de ação basal e ultra-rápida para pacientes com diagnóstico de
Diabetes Mellitus
O SECRETÁRIO DA SAÚDE DO ESTADO DA BAHIA, no uso das
suas atribuições legais que lhe confere o Decreto Simples, publicado
no Diário Oficial do Estado em 02 de janeiro de 2007,
Considerando que o Diabetes Mellitus configura-se como uma
epidemia mundial, com elevada interferência na qualidade de vida,
traduzindo-se em grande desafio para os sistemas de saúde de todo o
mundo e que embora não tenha cura, pode ser controlado por um
diagnóstico e tratamento adequado;
Considerando a Lei n. 11.347 de 27 de setembro de 2006, que dispõe
sobre a distribuição gratuita de medicamentos e materiais necessários
à sua aplicação e à monitoração da glicemia capilar aos portadores de
diabetes inscritos em programas de educação para diabéticos;
Considerando o aumento da prevalência de Diabetes Mellitus no
Estado da Bahia no período compreendido entre os anos de 2006 a
2011;
Considerando o compromisso do Estado da Bahia, através da
Secretaria de Saúde, de garantir assistência terapêutica integral à
saúde à população baiana;
Considerando a Política de Assistência Farmacêutica do Estado da
Bahia, aprovada pelo Decreto n° 11.935 de 19 de janeiro de 2010, que
visa garantir à população desse Estado o acesso qualificado a
medicamentos essenciais em todos os níveis de atenção à saúde,
promovendo o seu uso racional, o atendimento humanizado nos
serviços farmacêuticos, o desenvolvimento da cadeia produtiva e a
indústria farmacêutica pública local;
Considerando a necessidade de garantir o atendimento às reais
necessidades dos pacientes, mas também o uso adequado dos
recursos públicos, por meio da implantação do processo de regulação,
fiscalização, controle e avaliação da atenção e manejo do Diabetes;
Considerando que a Secretaria da Saúde do Estado, através do Centro
de Diabetes e Endocrinologia do Estado da Bahia – CEDEBA e da
Superintendência de Assistência Farmacêutica, Ciência e Tecnologia
em Saúde - SAFTEC, juntamente com os representantes da Sociedade
Brasileira de Endocrinologia e Metabologia e Sociedade Brasileira de
Diabetes – Regionais Bahia, elaboraram e validaram o referido
Protocolo, normas e fluxos;
RESOLVE:
Artº. 1º Instituir e homologar o Protocolo Técnico para a dispensação
de análogos de insulina de Ação Basal e Ultra-Rápida, conforme
descrito no Anexo I a esta Portaria;
Artº. 2º Caberá à Secretaria da Saúde do Estado da Bahia, através do
Centro de Diabetes e Endocrinologia do Estado da Bahia e da
Superintendência de Assistência Farmacêutica, Ciência e Tecnologia
em Saúde – SAFTEC, adotar as medidas necessárias à implantação
do Protocolo Técnico instituído nesta Portaria;
Artº. 3º O Protocolo Técnico será implantado após 90 (noventa) dias da
data da publicação desta Portaria;
Artº. 4º Esta Portaria entra em vigor na data de sua publicação.
JORGE JOSÉ SANTOS PEREIRA SOLLA
Secretário
ANEXO I da PORTARIA Nº. 1603 DE 14 DE NOVEMBRO DE 2012
PROTOCOLO TÉCNICO PARA A DISPENSAÇÃO DE ANÁLOGOS DE
INSULINA DE AÇÃO BASAL E ULTRA-RÁPIDA
1. DIRETRIZES GERAIS
1.1. Este protocolo tem por objetivo normatizar a dispensação dos
análogos de insulina de ação basal e ultra-rápida na rede pública do
estado da Bahia.
1.2. Todas as solicitações de tratamento deverão ser encaminhadas à
Unidade de Saúde de Referência do Estado designada pelo gestor
competente para disponibilização dos medicamentos específicos e
serão analisadas por comissão constituída por técnicos desta Unidade.
1.3. Por este Protocolo, só serão admitidos pacientes com diagnóstico
comprovado de Diabetes Mellitus (CID E10 e E11).
1.4. Antes de ser atendido em sua solicitação, cada paciente deverá
ser avaliado clínico-laboratorialmente pelo seu médico assistente,
atendendo a todas as exigências do formulário-padrão para
dispensação do análogo solicitado, que se encontrará disponível na
Unidade de Saúde de Referência do Estado. Não serão aceitos
formulários incompletos ou preenchidos com rasuras.
1.5. À Comissão de avaliação da Unidade de Saúde de Referência é
reservado o direito de solicitar a presença do paciente para avaliação
clínica e/ou laboratorial complementar, nos casos em que os relatores
do processo julgarem necessária.
2. CRITÉRIO DE INCLUSÃO NO PROGRAMA ESTADUAL DE
FORNECIMENTO DE ANÁLOGOS DE INSULINA
2.1. INÍCIO DE TRATAMENTO COM ANÁLOGOS DE INSULINA DE
AÇÃO BASAL (refere-se a paciente que necessite e aceite iniciar o uso
dos análogos de ação basal fornecidos pelo Estado, mas que ainda se
encontram em uso de outros esquemas terapêuticos)
É necessário o preenchimento de pelo menos uma das condições
descritas nos itens 2.1.1., 2.1.2., 2.1.3., 2.1.4., juntamente com as
descritas nos item 2.1.5. e 2.1.6.
2.1.1.
Apresentar
hipoglicemias
moderadas
de
repetição,
caracterizadas por presença de sintomas adrenérgicos e/ou
neuroglicopênicos, com freqüência igual ou superior a 02 vezes por
semana, que obrigam o paciente a interromper, temporariamente, suas
atividades, com comprometimento da qualidade de vida e/ou da
atividade laborativa do paciente. Estas hipoglicemias deverão ser
confirmadas através de relatório médico e, quando necessário, por
meio de exame de monitorização glicêmica contínua (CGMS).
2.1.2. Ter diagnóstico de diabetes lábil, caracterizado por instabilidade
glicêmica diária, com episódios de hipoglicemia (glicemia < 50 mg/dl,
com sintomas adrenérgicos e/ou neuroglicopênicos) e hiperglicemia
(glicemia > 270 mg/dl), com requerimento de dose de insulina muito
variável, apesar de plano alimentar e exercícios físicos regulares
rigorosamente controlados. O referido diagnóstico deverá ser
confirmado através de relatório médico e, quando necessário, por meio
de exame de monitorização glicêmica contínua (CGMS).
2.1.3. Apresentar lipoatrofia insulínica em 02 (dois) ou mais locais de
aplicação de insulina, resultando em limitação na área de aplicação,
mediante a apresentação de relatório médico comprobatório.
2.1.4. Apresentar mau controle persistente do diabetes, caracterizado
por níveis de HbA1c 1% acima das metas preconizadas para idade
(anexo1) em método laboratorial de cromatografia líquida de alta
pressão (HPLC), apesar de boa adesão ao tratamento afastando-se
situações de hipoglicemias freqüentes, confirmada mediante a
apresentação de relatório médico e exame laboratorial HbA1c (HPLC)
e, quando necessário, do exame de monitorização glicêmica contínua
(CGMS).
2.1.5. Ter feito uso terapêutico prévio de pelo menos seis meses de
insulina humana intermediária, NPH, devidamente comprovado através
de relatório médico.
2.1.6. Ter idade cronológica mínima para uso do análogo conforme
bula registrada na ANVISA.
2.2. INÍCIO DE TRATAMENTO COM ANÁLOGOS DE INSULINA DE
AÇÃO ULTRA-RÁPIDA (refere-se a paciente que necessite e aceite
iniciar o uso dos análogos de ação ultra-rápida fornecido pelo Estado,
mas que ainda se encontram em uso de outros esquemas
terapêuticos):
É necessário o preenchimento de pelo menos uma das condições
descritas nos itens 2.2.1., 2.2.2., 2.2.3., juntamente com a descrita no
item 2.2.4.
2.2.1.
Apresentar
hipoglicemias,
moderadas
de
repetição,
caracterizadas por presença de sintomas adrenérgicos e/ou
neuroglicopênicos, com freqüência igual ou superior a 02 vezes por
semana, que obrigam o paciente a interromper, temporariamente, suas
atividades; com comprometimento da qualidade de vida e/ou da
atividade laborativa do paciente. Estas hipoglicemias deverão ser
confirmadas através de relatório médico e, quando necessário, por
meio de exame de monitorização glicêmica contínua (CGMS).
2.2.2. Ter diagnóstico de diabetes lábil, caracterizado por instabilidade
glicêmica diária, com episódios de hipoglicemia (glicemia < 50 mg/dl,
com sintomas adrenérgicos e/ou neuroglicopênicos) e hiperglicemia
(glicemia > 270 mg/dl), com requerimento de dose de insulina muito
variável, apesar de plano alimentar e exercícios físicos regulares
rigorosamente controlados. O referido diagnóstico deverá ser
confirmado através de relatório médico e, quando necessário, por meio
de exame de monitorização glicêmica contínua (CGMS).
2.2.3. Apresentar mau controle persistente do Diabetes, caracterizado
por níveis de HbA1c 1% acima das metas preconizadas para idade
(anexo1) em método laboratorial de cromatografia líquida de alta
pressão (HPLC), confirmada mediante a apresentação de relatório
médico e exame laboratorial HbA1c (HPLC).
2.2.4. Ter idade cronológica mínima para uso do análogo conforme
bula registrada na ANVISA.
3.3 TRATAMENTO COM ANÁLOGOS DE INSULINA EM PACIENTES
JÁ EM USO DA MEDICAÇÃO: (refere-se a paciente que pleteie o uso
dos análogos de ação basal fornecidos pelo Estado, e que já se
encontram em uso do esquema preconizado):
É necessário o preenchimento de pelo menos uma das condições
abaixo comprovadas por relatório médico e exames prévios:
3.3.1 HbA1c < do que 1% acima das metas preconizadas para idade
(anexo1) para tratamentos iniciados há mais de doze meses,
confirmada mediante a apresentação de relatório médico e exame
laboratorial HbA1c (HPLC).
3.3.2 Redução de pelo menos 50% do valor de Hba1c (HPLC)
excedente a 1% acima das metas preconizadas para idade (anexo1).
Esta redução deverá ter ocorrido no período de seis meses após o
início do tratamento com análogo de insulina para os pacientes em
tratamento iniciados há menos de 12 meses, confirmada mediante a
apresentação de relatório médico e exame laboratorial HbA1c (HPLC),
demonstrando a referida redução.
4 MANUTENÇÃO DO TRATAMENTO NO PROGRAMA ESTADUAL
DE FORNECIMENTO DE ANÁLOGOS DE INSULINA
É necessário o preenchimento das condições descritas nos itens 4.1 e
4.2.
4.1 Manter boa adesão ao tratamento, comprovando-se através de
relatório do médico assistente, indicando a adesão ao plano alimentar e
à prática de exercícios físicos regulares controlados.
4.2 Manter monitoramento regular e, semestralmente, enviar para a
Unidade de Saúde de Referência do Programa, relatórios e exames
estabelecidos no formulário padrão de continuação do tratamento.
4.3 Poderá ser redirecionado para recebimento de outro tipo de
insulina, o paciente que, durante as avaliações semestrais, não
preencher pelo menos uma das seguintes condições:
4.3.1 Apresentar redução de pelo menos 50% do valor de HbA1c
excedente a 1% acima das metas preconizadas para idade (anexos1 e
2) nos últimos 06 (seis) meses, comprovada pela evolução dos exames
complementares.
4.3.2 Atingir HbA1c até 1% acima da meta para idade (anexo1) após
12 (doze) meses de tratamento, salvo se houver doenças
intercorrentes ou uso de medicamentos que possam promover
descompensação metabólica. Neste caso, o relatório, a prescrição
médica do período e os exames comprobatórios deverão ser fornecidos
no momento da entrega semestral do Formulário de Continuação de
Tratamento para que o fornecimento de análogos não seja
interrompido.
Caso o paciente não preencha os itens 4.3.1 e 4.3.2 deste protocolo, o
mesmo receberá um relatório explicativo com orientações.
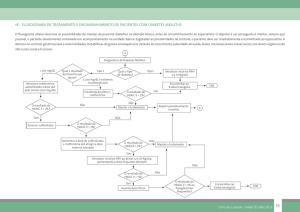
5 FLUXO DE FORNECIMENTO DE ANÁLOGOS DE INSULINA –
ATENDIMENTO AO PACIENTE PORTADOR DE DIABETES
1. Paciente portador de Diabetes que necessita de análogos de
Insulina deverá ser encaminhado
ao CEDEBA, apresentando a prescrição médica.
2. O CEDEBA fornecerá ao paciente formulário denominado Solicitação de Análogos de Insulinas - ,orientando-o quanto à forma de
preenchimento a ser observada pelo Médico Clínico ou
Endocrinologista que o assiste.
3. O formulário devidamente preenchido será avaliado pela equipe
médica do CEDEBA
4. Caso seja deferido pela equipe médica, o paciente será cadastrado
na Unidade, mediante a apresentação dos seguintes documentos: RG,
CPF, cartão SUS e comprovante de residência.
5. Caso o paciente não se enquadre no protocolo, será justificado
através de carta padronizada (“Justificativa de não Fornecimento”).
7. Conforme disposto neste Protocolo, o paciente deverá apresentar,
semestralmente, Formulário de continuação do tratamento com
Análogos de Insulina, devidamente preenchido por seu médico
assistente, que será encaminhado juntamente com os formulários
anteriores para nova análise pela câmara técnica do CEDEBA.
ANEXO II da PORTARIA Nº. 1603 DE 14 DE NOVEMBRO
DE 2012
Intervalo de idade
Metas glicêmicas de HbA1c
0 a 5 anos completos
6 a 12 anos completos
13 a 19 anos completos
Com idade igual ou
superior a 20 anos
8,5%
8,0%
7,5%
7%
Fonte: Diretrizes da Sociedade Brasileira de Diabetes (SBD), 2009
Intervalo de idade
Metas glicêmicas de HbA1c
65 a 80 anos completos
8,0%
Fonte: Diretrizes da American Diabetes Association (ADA), 2011