Instituto Oswaldo Cruz
Curso de Pós-graduação em Biologia Celular e Molecular
DESENVOLVIMENTO EMBRIONÁRIO DO OVO DE
Schistosoma mansoni SAMBON, 1907
ARNON DIAS JURBERG
Dissertação apresentada ao Instituto Oswaldo Cruz como
requisito parcial à obtenção do título de Mestre em
Ciências na área de Biologia Celular e Molecular
Orientadores: Dr. Henrique Leonel Lenzi
Dr. Paulo Marcos Zech Coelho
Julho de 2008
Livros Grátis
http://www.livrosgratis.com.br
Milhares de livros grátis para download.
Instituto Oswaldo Cruz
Curso de Pós-graduação em Biologia Celular e Molecular
ARNON DIAS JURBERG
DESENVOLVIMENTO EMBRIONÁRIO DO OVO DE
Schistosoma mansoni SAMBON, 1907
Orientadores: Dr. Henrique Leonel Lenzi
Dr. Paulo Marcos Zech Coelho
Banca examinadora:
1 Naftale Katz (presidente)
2 José Roberto Machado-Silva (membro)
3 Gerson Cotta-Pereira (membro)
4 Lycia de Brito Gitirana (revisora/suplente)
5 Arnaldo Maldonado Jr. (suplente)
18/07/2008
ii
A minha mãe,
Vania Maria Mello Dias,
por todo amor, dedicação e incentivo
na minha formação pessoal e profissional.
Sem ela, esse trabalho não
teria sido possível.
e
À Raquel Miscow Ferraz de Mendonça,
com muito amor e carinho.
iii
“The egg cell is... a universe.”
Ernest Just, 1939.
“Muito louco isso.”
Henrique Lenzi, 2007.
“Afinal, mestrado é pra gente se divertir.”
Luís Fernando Ferreira, 2007.
iv
AGRADECIMENTOS
A realização desse trabalho somente foi possível com o envolvimento e a
participação, direta ou indireta, de pessoas muito especiais. A elas, meu
profundo reconhecimento:
Aos meus queridos orientadores, Dr. Henrique Leonel Lenzi e Dr. Paulo
Marcos Zech Coelho, pelos seus exemplos como seres humanos e
profissionai; pelo convívio e estimulantes discussões científicas e culturais;
pelos inúmeros incentivos e pela confiança. Por toda a dedicação e paciência,
mas, sobretudo, pela afetuosa amizade. Aos senhores, o meu mais sincero
agradecimento.
À Tiana Gonçalves e Tatiane Andrade Costa, pela imensurável contribuição
na realização desse trabalho. Ao Bernardo Miguel de Oliveira Pascarelli,
pelas inumeráveis horas de análise ao microscópio confocal de varredura a
laser. A vocês, pelos inesquecíveis momentos de convivência e aprendizado.
Por todo o apoio e incentivo, mas principalmente pela amizade, que espero
carregar para o resto da vida. Sem vocês, esse trabalho não teria sido
possível.
A todos os amigos do Laboratório de Patologia-IOC, que sempre contribuíram
de alguma forma muito especial, além dos agradáveis momentos de
convivência e descontração. Em especial, ao Dr. Marcelo Pelajo-Machado,
por toda a dedicação em proporcionar as melhores condições possíveis de
trabalho no laboratório; pelo incentivo e paciência. À equipe do setor de
histotecnologia – Luzia Fátima G. Caputo, Luciana Silva Souza, Luzia Helena
Pereira Barros, Marcelo Barbosa dos Santos e Alexandra Menezes dos
Santos – pelas excelentes preparações histológicas, fundamentais para a
realização desse trabalho. À Iolanda Deolinda Pedro, Filomena de Fátima
Cruz, Andréa Natividade e Juciara Felisbino de Souza, pela manutenção do
ciclo biológico do Schistosoma mansoni e do biotério do laboratório. Ao Pedro
Paulo de Abreu Manso e à Priscila Tavares Guedes, pela ajuda na realização
de reações de imuno-histoquímica; ao Pedro Paulo, também por auxiliar na
aquisição de imagens ao microscópio confocal. À Rosinei Miranda Ferreira e
à Alexandra Corrêa Pereira, pelo auxílio e apoio burocrático.
v
A todos os amigos do laboratório de Esquistossomose-IRR, que me
acolheram tão bem durante as minhas estadias. Em especial, à Ana Carolina
de Mattos, Ana Karine Sarvel, Neuza de Araújo e ao Áureo Almeida de
Oliveira, pela inestimável contribuição e grande paciência na realização de
alguns experimentos. À Vera de Paula Ribeiro e ao Dr. John R. Kusel (da
Glasgow
University),
pelas
valiosas
revisões
de
inglês
dos
artigos
submetidos/publicados.
Ao Marcelo Ribeiro Alves, da Plataforma de Desenvolvimento em Tecnologia e
Insumos em Saúde (PDTIS), Nanotecnologia e Microarranjos – Centro de
Desenvolvimento Tecnológico em Saúde (CDTS)/Fiocruz, pela inestimável
modelagem estatística dos dados de crescimento dos ovos. Ao Bruno
Eschenazi, do setor Produção e Tratamento de Imagens/IOC, pela belíssima
representação esquemática do desenvolvimento embrionário dos ovos (artigo
2).
À Dra. Jane Arnt Lenzi e à Dra. Lycia de Brito Gitirana, pela minuciosa
revisão dessa dissertação.
Ao Laboratório de Biologia Celular/IOC, na pessoa da Dra. Andréa Henrique
Pons, por permitir a utilização do criostato na obtenção de secções
histológicas para a realização de imunomarcações indiretas.
À Flávia Rachel Moreira Lamarão, Kelly Grace Magalhães, Mariana
Acquarone, bem como ao Thiago Parente e Gustavo Lázaro Rezende, pelo
incentivo, sugestões e ajudas, além dos empréstimos de reagentes e,
sobretudo, pelo agradável convívio.
À Coordenação do Programa de Pós-graduação em Biologia Celular e
Molecular do Instituto Oswaldo Cruz, nas figuras de seu Coordenador, Dr.
Milton Ozório Moraes, e de Daniele Lobato, secretária executiva, pelo apoio
burocrático e suporte financeiro em eventos científicos.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e
à Fundação Oswaldo Cruz (Fiocruz), pelo suporte financeiro durante a
vi
realização desse trabalho. À Coordenação de Aperfeiçoamento de Pessoal
Superior (CAPES), pela criação e manutenção do portal de acesso de
periódicos internacionais (http://www.periodicos.capes.gov.br), muito útil
na redação dessa dissertação.
Por fim, mas não menos importante, à minha família, por todo o apoio e
incentivo. Em especial, à minha querida mãe, Dra. Vania Maria Mello Dias,
por toda a sua dedicação e suporte na minha formação pessoal e
profissional. Ao meu irmão Igor, pelo grande exemplo de garra e
determinação, mesmo continuando a um oceano de distância. Ao meu pai,
Dr. Pedro Jurberg, pelas proveitosas conversas e ensinamentos. À Raquel
Miscow Ferraz de Mendonça, minha amada namorada (calma, agora só falta
o doutorado para o casório), por todos os inúmeros e especiais momentos e o
aconchegante carinho.
vii
Este trabalho foi desenvolvido no Laboratório de Patologia do Instituto
Oswaldo
Cruz
(IOC),
Rio
de
Janeiro,
RJ,
e
no
Laboratório
de
Esquistossomose do Instituto René Rachou, Belo Horizonte, MG, ambos da
Fundação Oswaldo Cruz (Fiocruz). Este trabalho recebeu suporte financeiro
da Fiocruz e do Conselho Nacional de Desenvolvimento Científico e
Tecnológico (CNPq).
viii
Sumário
Lista de figuras ..................................................................................................
xi
Lista de abreviaturas .........................................................................................
xii
Resumo .............................................................................................................
xiii
Abstract .............................................................................................................
xiv
I – Considerações iniciais ...............................................................................
15
1. Introdução .............................................................................................
16
2. Fundamentação teórica ..........................................................................
18
2.1. Classificação taxonômica .................................................................
18
2.2. Características gerais dos esquistossomos .......................................
18
2.3. Esquistossomose mansoni ...............................................................
19
2.4. O ciclo biológico do Schistosoma mansoni ........................................
21
2.5. O desenvolvimento embrionário dos platielmintos ...........................
22
2.5.1. Conceitos básicos em biologia do desenvolvimento ...................
23
2.5.2. Filogenia dos platielmintos, com ênfase em Schistosomatidae e
Schistosoma ......................................................................................
38
2.5.3. Visão geral do desenvolvimento embrionário dos platielmintos .
53
2.6. O desenvolvimento embrionário do ovo do Schistosoma mansoni ......
66
2.6.1. Fecundação .............................................................................
66
2.6.2. Formação da casca do ovo .......................................................
67
2.6.3. Desenvolvimento embrionário dos ovos ....................................
69
2.7. Reação granulomatosa (granuloma periovular) .................................
71
2.7.1. Antígenos solúveis do ovo ........................................................
72
2.8. Morfologia do miracídio de Schistosoma mansoni .............................
79
II – Objetivos ..................................................................................................
82
1. Objetivo geral .....................................................................................
83
2. Metas ……………………………………………………………………………....
83
III – Justificativa ……………………………………………………………………………
84
IV – Artigos ………………………………………………………………………………….
86
ix
Artigo 1. Trematode embryology: a new method for whole-egg analysis
by confocal microscopy …………………………………………………………...
87
Artigo 2. The embryonic development of the trematode Schistosoma
mansoni …………………………………………………………………..……….….
93
V – Considerações finais e Conclusões ……………………………………………….
148
1. Discussão ........................................................................................
149
1.1. Sistemas de classificação .........................................................
150
1.2. Desenvolvimento embrionário in vivo e in vitro ..........................
151
1.3. Desenvolvimento embrionário e filogenia ..................................
153
1.4. Desenvolvimento embrionário e granulomatogênese .................
156
2. Conclusões ......................................................................................
160
VI – Referências bibliográficas ………………………………………………………….
165
x
Lista de figuras
Figura 1.1. Casal de vermes adultos de Schistosoma mansoni ......................................
19
Figura 1.2. Ciclo biológico de Schistosoma mansoni ......................................................
22
Figura 1.3. Ciclo celular de blastômeros e células somáticas ........................................
24
Figura 1.4. Planos da clivagem holoblástica total .........................................................
26
Figura 1.5. Resumo dos principais padrões de clivagem ...............................................
27
Figura 1.6. Clivagem em espiral do molusco Trochus ....................................................
28
Figura 1.7. Clivagem em espiral ...................................................................................
32
Figura 1.8. Tipos de movimentos celulares durante a gastrulação ................................
34
Figura 1.9. Modos de formação do mesoderma na gástrula tardia ................................
35
Figura 1.10. Formação do celoma por esquizocelia .......................................................
37
Figura 1.11. Formação do celoma por enterocelia .........................................................
37
Figura 1.12. Dendogramas exemplificando três tipos de táxons ....................................
39
Figura 1.13. Geração de genes ortólogos e parálogos ....................................................
40
Figura 1.14. Resumo das relações filogenéticas dos platielmintos .................................
47
Figura 1.15. Filograma dos trematódeos de tetrápodes .................................................
50
Figura 1.16. Estratégias de desenvolvimento em diferentes táxons de platielmintos .....
54
Figura 1.17. Clivagem em espiral de um policlado ........................................................
59
Figura 1.18. Larva de Muller ........................................................................................
59
Figura 1.19. Desenvolvimento inicial de embriões F1 de Gyrodactylus gasterostei ........
64
Figura 1.20. Miracídio de Schistosoma mansoni por microscopia confocal de varredura
a laser (CLSM) .............................................................................................................
xi
81
Lista de abreviaturas
AB
alcian blue (azul de Alciano)
CLSM
microscopia confocal de varredura a laser
COPT
do inglês, circumoval precipitin reactions
DDC
dietilditiocarbamato
DNA
ácido desoxirribonucléico
E
exsudativo
EP
exsudativo-produtivo
ESP
proteínas totais secretadas pelo ovo
evo-devo
biologia evolutiva do desenvolvimento
FaRPs
peptídeos FMRFamida-relacionados
HSPs
proteínas de choque térmico
i.e.
isto é
IL
interleucina
INF-gama
interferon-gama
kDa
kiloDalton
LSU
grandes subunidades de RNAr
MHC
complexo principal de histocompatibilidade
RNAmi
micro-ácido ribonucléico
RNAm
ácido ribonucléico mensageiro
mtDNA
ácido desoxirribonucléico mitocondrial
NPFs
neuropeptídeos Fs
P
produtivo
p.ex.
por exemplo
p.i.
após a infecção
PAS
reação do ácido periódico de Schiff
pH
pontencial hidrogeniônico
pI
ponto isoelétrico
RI
reação inicial
RNAr
ácido ribonucléico ribossomal
SEA
antígeno solúvel do ovo
SSU
pequenas subunidades de RNAr
xii
INSTITUTO OSWALDO CRUZ
DESENVOLVIMENTO EMBRIONÁRIO DO OVO DE
Schistosoma mansoni SAMBON, 1907
RESUMO
DISSERTAÇÃO DE MESTRADO
Arnon Dias Jurberg
Na patogênese da esquistossomose e na continuidade do ciclo de vida do parasito,
os ovos possuem um papel central. Tradicionalmente, o amadurecimento dos ovos é
classificado a partir da simples relação entre os tamanhos do embrião e do ovo
propriamente dito (classificação de Vogel e de Prata, “VP”). A proporção de cada
estádio (oograma) tem sido considerada como um critério confiável para a avaliação
de drogas esquistossomicidas. Contudo, pouco se sabe sobre a sua biologia do
desenvolvimento propriamente dita. A presente dissertação objetivou descrever os
eventos morfológicos durante a embriogênese dos ovos de Schistosoma mansoni
através de histologia convencional e análise de preparados inteiros. Os eventos
foram divididos em dez estádios, adaptando uma classificação prévia inicialmente
introduzida para um rabdocelo de vida livre. O amadurecimento dos ovos no
hospedeiro e em cultura (meio RPMI-1640) foi também avaliado por modelagem
estatística da área média de cada estádio (considerando a classificação VP) e então,
morfologicamente, pela análise de ovos inteiros sob microscopia confocal a laser
(nosso sistema de estagiamento aqui proposto). Devido ao difícil reconhecimento
dos eventos morfológicos observados em ovos vivos não-corados, uma correlação
com a classificação VP é apresentada. De fato, o desenvolvimento embrionário dos
ovos de esquistossomos é mais complexo do que considerado previamente (como na
classificação de Vogel). A diferenciação das estruturas embrionárias e seus
prováveis papéis na granulomatogênese são discutidos. O sistema de estadiamento,
aqui proposto, pode contribuir para uma melhor compreensão da biologia do ovo e
embasar futuros estudos sobre a produção e difusão dos antígenos do ovo na
reação granulomatosa.
xiii
INSTITUTO OSWALDO CRUZ
THE EMBRYONIC DEVELOPMENT OF
Schistosoma mansoni SAMBON, 1907 EGGS
ABSTRACT
MASTER DISSERTATION
Arnon Dias Jurberg
In pathogenesis of schistosomiasis and in its life cycle, the eggs have a central role.
Traditionally, the primary screening of antischistosomal drugs uses as main criteria
the Vogel and Prata’s classification (VP’s), which is based on the relation of
embryo/eggshell sizes and the qualitative oogram. However, little is known on egg
developmental biology itself so far. The present work aimed to describe the
morphological events during the Schistosoma mansoni egg embryogenesis by using
conventional histology and whole-mount preparations. These events were divided in
ten stages, adapting a previous classification initially introduced for a free-living
rhabdocoel. Egg maturation in the host and in culture (RPMI-1640 medium) were
also evaluated by statistical modeling of the mean area for each stage (considering
VP’s classification) and then morphologicaly by whole-mount eggs under the
confocal laser microscopy (our proposed staging system herein). Due to difficult
recognition of the morphological events in live, unstained eggs, a further correlation
to the VP’s classification is presented. Indeed, schistosome egg embryonic
development is more complex than previous considered (as in VP´s classification).
The
differentiation
of
embryonic
structures
and
their
probable
role
in
granulomatogenesis is discussed. The stage system here proposed may contribute
to a better comprehension of the egg biology and underlies further studies on egg
antigen production and its diffusion in the the granuloma reaction.
xiv
Considerações Iniciais
Dissertação de Mestrado
I – Considerações Iniciais
15
Considerações Iniciais
Dissertação de Mestrado
I – Considerações Iniciais
I. 1 – Introdução
Como um organismo se forma? Como se produz um outro ser? A busca pelo
entendimento dessas questões e de inúmeras outras mais específicas fez da
Biologia do Desenvolvimento um dos campos mais fascinantes em biologia.
Organismos tão diferentes quanto borboletas, ouriços-do-mar, peixes, primatas e
vermes originam-se a partir de uma única célula, o zigoto. Para esses seres (e
outros vários), a construção de uma estrutura adulta perpassa por estádios
transitórios. O tempo é fundamental.
Nos esquistossomos, causadores da esquistossomose humana, o zigoto é
circundado por células vitelínicas individualizadas, ainda no sistema reprodutivo da
fêmea adulta. Ao redor dessa massa celular é polimerizada uma casca de formato
peculiar (diferente para cada espécie de esquistossomo). Os ovos possuem um papel
ainda
mais
intrigante:
eles
são
os
agentes
primários
na
patologia
da
esquistossomose. Após serem liberados pelas fêmeas adultas na corrente sanguínea
do hospedeiro vertebrado, eles são passivamente carregados até ficarem retidos em
vasos de calibre mais reduzido. Nesse momento, tais ovos são capazes de atuar
como agentes granulomatogênicos, podendo causar fibrose periportal e hipertensão,
além de varizes esofagianas, que, ao se reomperem, podem muitas vezes levar ao
óbito. Apesar do seu papel central na biologia dos esquistossomos e na patogenia
da esquistossomose, o desenvolvimento embrionário dos ovos tem sido alvo de
estudos esporádicos, quase sempre superficiais. Por exemplo, sua classificação é
atualmente baseada simplesmente na relação entre o tamanho do embrião em
relação ao ovo (Vogel 1942; Prata 1957). Pouco se conhece sobre as moléculas do
ovo relacionadas com a patogenia e menos ainda sobre os mecanismos moleculares
que regem o seu desenvolvimento. Frequentemente, ovos isolados para avaliações
moleculares (genômica, transcriptômica, glicômica, lipidômica e outros) são
considerados como uma entidade única, sem os diferentes estádios de maturação.
Assim, essa dissertação tem por finalidade a descrição da embriogênese dos
ovos de Schistosoma mansoni Sambon, 1907 em seu hospedeiro experimental
murino. Para fins de comparação, o desenvolvimento de ovos em cultura também
foi avaliado. O cultivo de ovos é amplamente utilizado em estudos moleculares e
imunológicos, bem como em avaliações quimioterapêuticas. É necessário, portanto,
determinar se as condições de cultura empregadas nesse trabalho são, de fato,
válidas para o estudo do amadurecimento dos ovos em circunstâncias livres de
variações intrínsecas desconhecidas, como em hospedeiros animais. Em outras
16
Considerações Iniciais
Dissertação de Mestrado
palavras, é preciso definir se as condições de cultura utilizadas, por si só, não
afetam o desenvolvimento dos ovos e seus processos biológicos. Outra intenção
dessa dissertação é propor um sistema de estadiamento para o desenvolvimento
ovular de S. mansoni a partir de critérios morfológicos e morfogenéticos, como
previamente introduzido por Hartenstein e Ehlers (2000) para outros platielmintos.
A
identificação
morfológica
desses
estádios
permite
comparar
eventos
do
desenvolvimento, tais como movimentos morfogenéticos, expressão gênica e
diferenciação celular. Isso é especialmente útil no caso dos esquistossomos, já que
seus ovos são encontrados em diferentes momentos de amadurecimento nos tecidos
do hospedeiro. Por fim, a presença de certos antígenos do ovo foi avaliada durante a
sua embriogênese.
17
Considerações Iniciais
Dissertação de Mestrado
I. 2 – Fundamentação Teórica
I. 2. 1 – Classificação Taxonômica
Reino: Metazoa
Filo: Platyhelminthes
Classe: Trematoda
Subclasse: Digenea
Ordem: Strigeidida
Família: Schistosomatidae
Gênero: Schistosoma
Espécie: Schistosoma mansoni
I. 2. 2 – Características gerais dos esquistossomos
Os
esquistossomos
são
trematódeos
(do
grego
trematodes,
furado)
digenéticos (do grego dis, duplo; genos, raça), inteiramente adaptados ao
parasitismo e com ciclo biológico complexo. O termo trematódeo refere-se a
estruturas notáveis da superfície do corpo – as ventosas. Uma delas, situada
ventralmente, é particularmente bem desenvolvida e delimitada do parênquima por
uma cápsula distinta, sendo denominada acetábulo. Uma segunda ventosa dispõese em torno da boca nas espécies parasitas – é a ventosa oral. Os trematódeos
possuem ainda um sistema reprodutivo com canal de Laurer e um cirro como órgão
masculino copulatório (também encontrado em outros grupos, mas provavelmente
não-homólogo). Poro(s) excretor(es) localiza(m)-se posteriormente. Eles têm também
uma larva (miracídio) com células epidérmicas ciliadas, com núcleos intra-epiteliais
(neoderme). O hospedeiro invertebrado é preponderantemente um molusco
(raramente, um anelídeo), enquanto o hospedeiro vertebrado pode ser facultativo ou
obrigatório.
Por sua vez, o termo digenético refere-se aos dois tipos de geração no ciclo
de vida: (1) os esporocistos, que parasitam o hospedeiro intermediário e
reproduzem-se assexualmente; e (2) o adulto, que é primariamente endoparasito de
vertebrados
(exceto
Cyclostomata)
e
reproduz-se
sexualmente.
Outras
características desse grupo referem-se à organização em fileiras transversais
regulares das células epidérmicas ciliadas dos miracídios, bem como a presença de
outra forma larvar, chamada cercária. Usualmente, os vermes adultos nesse grupo
são
hermafroditas;
porém,
os
esquistossomos
18
(Fig.
1.1)
e
poucos
outros
Considerações Iniciais
Dissertação de Mestrado
trematódeos são dióicos (do grego di, dois; oykos, casa), ou seja, possuem sexos
separados.
Figura 1.1. Casal de vermes adultos de Schistosoma mansoni. A fêmea, destacada
artificialmente na cor verde, fica alojada no canal ginecóforo do macho. Na região anterior
do macho é possível visualizar as duas ventosas (setas). Fonte: Scientific American Brasil.
2004 (28) Set.
I. 2. 3 – Esquistossomose mansoni
As
histórias
sobre
o
descobrimento
e
os
primeiros
estudos
da
esquistossomose como moléstia humana são um pouco obscuras e fontes ainda de
grandes debates entre as escolas médicas (ver Katz 2008). O primeiro relato escrito
sobre esquistossomose humana data do antigo Egito (Olds e Dasarathy 2001,
citando Girges 1934). Neste relato, a presença de um verme foi associada com
sangramento urinário. Todavia, a primeira descrição formal desse verme foi
somente realizada no século XIX, pelo patologista alemão Theodor Bilharz (18251862). Bilharz (1853a) relatou a presença de vermes adultos na veia porta hepáticointestinal de um homem jovem autopsiado (apud Olds e Dasarathy 2001). Em sua
homenagem, portanto, a denominação bilharziose, que é utilizada ainda hoje em
alguns países. Bilharz (1853b, 1856) também relatou alterações patológicas
características, bem como sintomas clínicos da esquistossomose.
Na época, os vermes apresentados por Bilharz foram denominados de
Distomium haematobium (Bilharz 1853b). Poucos anos depois, Wienland e Cobbold
sugeriram o nome Schistosoma, pois constataram que apenas uma das duas
ventosas do então Distomum levava a uma cavidade oral (Cobbold 1859; Warren
19
Considerações Iniciais
Dissertação de Mestrado
1973). A etimologia do termo Schistosoma refere-se à fenda (“schisto”) no corpo
(“soma”) do macho, atualmente denominada canal ginecóforo. Assim, desde 1864, a
nomenclatura
científica
oficial
utilizada
para
essa
doença
tem
sido
“esquistossomose”.
Alguns anos mais tarde, ao examinar as fezes de um paciente, o médico
escocês Patrick Manson (1844-1922) sugeriu a existência de uma nova espécie, com
ovos com espinho lateral (Manson 1902). Pouco tempo depois, a partir da análise de
um único verme adulto macho, o médico italiano Louis Westenra Sambon (18651931) descreveu uma nova espécie (Sambon 1907a, b), a qual denominou
Schistosoma mansoni em homenagem ao seu admirado amigo e mestre (Wilkinson
2002; Katz 2008).
Embora Bilharz (1853b) tenha observado ovos com um espinho terminal na
urina de seus pacientes, ele também encontrou ovos nas fezes e vermes adultos na
veia porta hepático-intestinal. Tais achados não deixavam explícito qual das
espécies de Schistosoma (S. haematobium ou S. mansoni) havia sido descrita. Em
1908, o médico brasileiro Manuel Augusto Pirajá da Silva (1873-1961) publicou o
primeiro trabalho sobre esquistossomose no Brasil (Pirajá da Silva 1908a),
relatando que havia observado quatro anos antes, mas que não sabia explicar, ovos
com espinho lateral nas fezes de pacientes. Somente após a leitura dos trabalhos de
Manson e Sambon que Pirajá da Silva pôde compreender o seu achado (Pirajá da
Silva 1908a; Katz 2008). Ele avaliou os 20 primeiros casos humanos da doença na
Bahia, forneceu seu diagnóstico e descreveu suas manifestações clínicas. Em três
oportunidades, o médico brasileiro realizou a necrópsia dos pacientes e encontrou
apenas um verme nos dois primeiros casos e 24 vermes (19 machos, uma fêmea e
dois casais) no terceiro. Pirajá da Silva ainda fotografou um ovo com espinho lateral
no útero de uma fêmea, além de outras características particulares do referido
parasito. A eclosão do miracídio também foi observada por Pirajá da Silva. A
descrição precisa do tamanho e características dos vermes fizeram Pirajá da Silva
concluir que tais exemplares constituíam uma espécie diferente de S. haematobium
(Pirajá da Silva 1908a, b, 1909; Katz 2008). Todos esses indícios destacados pelo
médico brasileiro contribuíram fortemente para a consolidação da espécie S.
mansoni na comunidade científica internacional da época (Andrade 2002; Katz
2008).
A distribuição geográfica do S. mansoni abrange o continente africano, a
América do Sul e as Antilhas (Rey 2001). Os vermes normalmente determinam uma
infecção assintomática ou oligossintomática, a depender principalmente da carga
parasitária e de características do hospedeiro; o quadro inicial é geralmente
20
Considerações Iniciais
discreto,
com
Dissertação de Mestrado
exantema
(erupções
cutâneas),
prurido
(coceira)
e
outras
manifestações alérgicas locais, devido à penetração das cercárias. Com o tempo
(cerca de oito dias após a infecção), os vermes começam a atingir o sistema porta
intra-hepático e amadurecem. Febre (aumento da temperatura corporal), eosinofilia
(aumento da taxa de eosinófilos no sangue), linfadenopatia (inflamação dos
linfonodos), esplenomegalia (aumento patológico do volume do baço) e urticária
(lesão cutânea, causada por edema localizado) podem manifestar-se. O fígado pode
aumentar
também
de
tamanho
(hepatite
difusa).
Ulcerações
necróticas
hemorrágicas da mucosa disseminam-se por todo o intestino. Com a produção
continuada de ovos, lesões nodulares (granulomas) levam a extensa fibrose do
fígado e outros órgãos, como o baço. Casos graves exibem fibrose periportal,
hipertensão porta e hepatoesplenomegalia, com acentuado comprometimento do
funcionamento dos órgãos. Lesões cardiopulmonares, renais e neurológicas também
podem ocorrer, devido à embolização de ovos para tais regiões. O rompimento de
varizes esofagianas pode causar o óbito do paciente (Rey 2001; Lenzi et al. 2008).
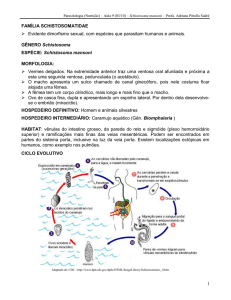
I. 2. 4 – O Ciclo Biológico do Schistosoma mansoni
Eventos complexos são decisivos para a patogênese, o sucesso reprodutivo e
a continuação do ciclo biológico dos esquistossomos (Fig. 1.2). De forma
simplificada, um vertebrado infectado libera ovos de S. mansoni em suas fezes.
Caso esses ovos atinjam a massa de água, em condições adequadas de
temperatura, luminosidade, salinidade e pH, há a eclosão de uma forma larvar,
chamada miracídio. Os miracídios nadam livremente e têm a capacidade de infectar
caramujos do gênero Biomphalaria. Nesses hospedeiros intermediários, uma série
de divisões celulares e modificações morfológicas levam à formação de cercárias. A
cercária é o agente penetrante na pele ou na mucosa de mamíferos suscetíveis
(humanos e outros primatas, carnívoros, marsupiais, edentatas, arctiodáctilos e
insetívoros). Tais mamíferos recebem a denominação de hospedeiros definitivos, por
abrigarem a forma do parasito que realiza reprodução sexuada.
Aspectos da localização e do reconhecimento, bem como a subsequente
penetração através da pele, as fases de desenvolvimento e a migração até o sistema
porta-hepático intestinal desses mamíferos suscetíveis foram revistos recentemente
em um capítulo de livro ainda a ser publicado (Lenzi et al. 2008a) no livro
“Esquistossomose mansoni: uma visão multidisciplinar” (Carvalho et al. 2008). Esse
21
Considerações Iniciais
Dissertação de Mestrado
capítulo, intutilado “Migração e desenvolvimento do Schistosoma mansoni no
hospedeiro definitivo” (Lenzi et al. 2008a).
Figura 1.2. Ciclo biológico de Schistosoma mansoni. O casal em cópula aloja-se
preferencialmente nas veias porta e mesentéricas do hospedeiro mamífero. A fêmea libera os
ovos na corrente sanguínea, que são carregados passivamente até ficarem retidos em
delgados capilares do sistema porta-hepático intestinal. Os ovos devem ser eliminados junto
com as fezes para dar continuidade ao ciclo. Na água, os miracídios eclodem e penetram em
caramujos do gênero Biomphalaria, se desenvolvendo em esporocistos primários e
secundários, até originarem as cercárias, forma infectante para o vertebrado suscetível.
Após
a
penetração
em
hospedeiro
definitivo,
as
cercárias
se
transformam
em
esquistossômulos, que amadurecem no sistema porta-hepático intestinal. Fonte: Panasco
MS. Estudo morfo-funcional do tecido linfo-mielóide celomático em camundongos normais e
infectados por Schistosoma mansoni, sua caracterização em humanos e resposta a vários
outros agentes infecciosos e parasitários [tese]. Rio de Janeiro: Instituto Oswaldo
Cruz/Fiocruz; 2006.
22
Considerações Iniciais
Dissertação de Mestrado
I. 2. 5 – Desenvolvimento Embrionário dos Platielmintos
Diversos livros-texto sobre embriologia animal ou humana, zoologia geral ou
de
biologia
do
desenvolvimento
propriamente
ditos
têm
como
capítulos
introdutórios extensas revisões sobre conceitos fundamentais para a compreensão
dos fenômenos biológicos relacionados ao desenvolvimento dos animais e suas
relações filogenéticas. Com o objetivo de facilitar o entendimento dos termos
utilizados nesse trabalho e embasar as discussões subsequentes, alguns desses
conceitos serão sumariados a seguir. Exceto quando indicado, as informações dessa
seção foram extraídas de Gilbert (2003) e Brusca e Brusca (2003).
I.2.5.1 – Conceitos básicos em biologia do desenvolvimento
Tradicionalmente, o estudo do desenvolvimento animal era conhecido como
embriologia e compreendia a fase de um organismo entre a fertilização e o seu
nascimento. No entanto, o desenvolvimento não termina ao nascimento. A maioria
dos animais se mantém em constante renovação de células, mesmo durante o
envelhecimento. Por sua vez, alguns organismos sofrem metamorfose ou podem
apresentar uma notável capacidade de regeneração, como as planárias. Por essa
razão, a disciplina que estuda os processos embrionários e do desenvolvimento
passou a ser conhecida como biologia do desenvolvimento. Basicamente, o
desenvolvimento busca gerar diversidade celular e ordem, além de garantir a
continuidade da vida, de uma geração para a seguinte.
De forma geral, as células dos animais se organizam em unidades
funcionais, primeiramente como tecidos e então como órgãos, podendo formar
sistemas de órgãos. Nesse tipo de divisão didática, cada uma dessas estruturas tem
papéis específicos, inter-relacionados e interdependentes, que sustentam a vida de
todo o organismo. Suas atividades complexas são coordenadas em padrões
adaptativos previsíveis, também interdependentes. Segundo Maturana e Varela
(1994), a organização caracteriza-se como o conjunto de relações entre os seus
componentes, que define a identidade do sistema. Organização difere de estrutura,
que configura fisicamente os componentes estruturais e suas relações concretas. A
estrutura do sistema pode alterar-se sem que haja perda de organização percebida
pelo observador. Isso acontece durante o desenvolvimento de um ser vivo: fenótipos
adultos resultam a partir de sequências hierárquicas específicas dos estádios do
desenvolvimento e padrões evolutivos revelam-se, em grande parte, através das
ontogenias.
23
Considerações Iniciais
Dissertação de Mestrado
A ontogenia de um organismo do reino animal tem início com a fecundação,
que é resultante do encontro de duas células sexuais especializadas, os gametas. O
gameta masculino ou espermatozóide, localiza, reconhece e penetra ativamente no
gameta feminino, ou oócito. Nesse momento, ocorre a fusão dos pró-núcleos
haplóides em um núcleo diplóide, que contém as metades do genoma dos
genitores. O zigoto sofre uma série de divisões mitóticas, conhecidas coletivamente
por clivagem, que dividem o grande volume de citoplasma em numerosas células
nucleadas menores, os blastômeros. As divisões celulares são frequentemente
referidas como iguais ou desiguais, indicando tamanhos comparativos entre os
blastômeros. Três tipos de blastômeros podem ser produzidos a partir de diferentes
modos de clivagem: em divisões iguais, as células resultantes possuem o mesmo
volume e recebem o nome de mesômeros; em divisões desiguais, originam-se
células grandes, ou macrômeros, e células menores, os micrômeros. Quando as
células resultantes são apenas levemente diferentes em tamanho, diz-se que a
divisão celular foi sub-igual. O volume citoplasmático das células-filha não
aumenta durante a clivagem, devido à supressão do período de crescimento entre
as divisões celulares (Fig. 1.3).
Certos aspectos dos padrões de clivagem são determinados pela quantidade e
distribuição de nutrientes, coletivamente designados como vitelo, que auxiliam no
desenvolvimento inicial do embrião. Em geral, o vitelo retarda ou mesmo impede as
divisões celulares. Alguns fatores citoplasmáticos maternos, como reguladores
protéicos e RNAm, também são determinantes na clivagem, influenciando o ângulo
de formação do fuso mitótico e o tempo de sua polimerização.
Figura 1.3. Ciclo celular de blastômeros e células somáticas. (A) O simples ciclo celular
bifásico de precoces blastômeros de anfíbio tem apenas dois estados, S (de síntese de DNA,
do inglês DNA synthesis) e M (de mitose, do inglês mitosis). A síntese de ciclina B (do inglês,
24
Considerações Iniciais
Dissertação de Mestrado
cyclin B) permite a progressão para M, enquanto a degradação de ciclina B permite que as
células passem para a fase S. (B) Ciclo celular de uma típica célula somática. A mitose é
seguida de uma fase de “intérfase” (do inglês, interphase). Esse período é subdividido nas
fases G1, S e G2. As células que estão diferenciando-se estão usualmente “fora” do ciclo
celular, em uma fase G1 estendida, denominada G0. As ciclinas responsáveis pela
progressão através do ciclo celular e suas respectivas quinases (do inglês, kinase) são
mostradas nos seus pontos de regulação do ciclo celular. Fonte: Gilbert SF. Developmental
Biology. 7ª ed. Sunderland: Sinauer Associates. 2003.
A produção de vitelo (vitelogênese) é, geralmente, a fase mais longa da
produção de ovos. Todavia, sua duração varia enormemente entre as espécies e
suas taxas de produção são dependentes das estratégias empregadas. Por exemplo,
espécies oportunistas (ou r-selecionadas) produzem uma grande quantidade de ovos
e, por isso, necessitam fazer uma rápida conversão de nutrientes para a produção
de vitelo; espécies especialistas (ou k-selecionadas), por outro lado, utilizam padrões
mais vagarosos e, consequentemente, têm uma menor produção de ovos.
Zigotos isolécitos contêm uma quantidade relativamente escassa de vitelo,
uniformemente distribuída por todo seu citoplasma. Nesse caso, a clivagem é total
ou holoblástica, isto é, o sulco de clivagem estende-se por toda a célula. Esse tipo
de clivagem é encontrado em equinodermos, anfioxos, anelídeos, moluscos,
platielmintos, tunicados, mamíferos e nematóides. Em anfíbios, a disposição
moderada de vitelo em seus zigotos (mesolécito) causa um ligeiro deslocamento
dos sulcos de clivagem. Em certos casos, pode ocorrer concentração de vitelo em
alguma região da célula-ovo, usualmente definindo sua polarização (eixo animalvegetal): o pólo rico em vitelo é denominado pólo vegetal, enquanto que o outro,
com pouco ou nenhum vitelo, é chamado pólo animal. Essa polaridade pode ser
aparente
ou
tornar-se
reconhecível
somente
com
o
prosseguimento
do
desenvolvimento. Zigotos com esse padrão são conhecidos como telolécitos e
sofrem clivagem meroblástica, onde somente uma parte do citoplasma é clivada.
Frequentemente, o núcleo desses zigotos fica deslocado para o pólo animal. Ovos
telolécitos ocorrem em cefalópodes, peixes, répteis e pássaros. Na maioria dos
insetos, o vitelo concentra-se no centro do zigoto. Tal localização define os ovos
como centrolécitos. As divisões mitóticas ocorrem superficialmente (clivagem
superficial), somente em uma estreita região do citoplasma na periferia da célulaovo.
Os padrões de clivagem recebem ainda outros nomes específicos, segundo as
orientações de seus sulcos de divisão (Fig. 1.4). A Figura 1.5 sumaria esses
25
Considerações Iniciais
Dissertação de Mestrado
padrões. Em razão do objeto de estudo dessa dissertação, apenas a clivagem em
espiral, presente em platielmintos, anelídeos e moluscos, será detalhada a seguir.
Detalhes sobre os outros tipos de clivagem podem ser encontrados em Gilbert
(2003).
Figura
1.4.
Planos
da
clivagem
holoblástica total. (A) Clivagem igual. (B)
Clivagem desigual produz micrômeros e
macrômeros. (C-E) Planos de clivagem em
relação ao eixo animal-vegetal do zigoto. (C)
Clivagem
paralela
longitudinal
ao
eixo
(=meridional),
animal-vegetal.
(D)
Clivagem equatorial, perpendicular ao eixo
animal-vegetal e dividindo o zigoto em duas
metades
animal
e
vegetal
iguais.
(E)
Clivagem latitudinal, perpendicular ao eixo
animal-vegetal, mas sem passar pelo plano
equatorial. Fonte: Brusca RC, Brusca GJ.
Invertebrates. 2ª ed. Sunderland (MA):
Sinauer Associates. 2003.
26
Considerações Iniciais
Dissertação de Mestrado
Figura 1.5. Resumo dos principais padrões de clivagem. Para mais informações, ver
Gilbert SF. Developmental Biology. 7ª ed. Sunderland: Sinauer Associates. 2003.
27
Considerações Iniciais
Dissertação de Mestrado
Na clivagem holoblástica espiral, os planos de clivagem são formados em
ângulos oblíquos. Com isso, as células-filha se deslocam para sobre os sulcos de
clivagem entre duas outras células (Fig. 1.6). Quando a divisão envolve o
deslocamento das células no sentido horário (visto do pólo animal), ela é chamada
dextrotrópica; quando ocorre no sentido anti-horário, recebe o nome levotrópica.
Esses tipos de giro ocorrem em alternância, aproximadamente até o estádio de 64células. Todavia, as divisões celulares não são necessariamente sincrônicas.
Portanto, nesse padrão de clivagem, as células assumem a orientação mais
termodinamicamente estável de agregação.
Figura 1.6. Clivagem em espiral do molusco Trochus. (A) Visão do pólo animal. (B) Visão
do lateral. As células derivadas do blastômero A estão coloridas. Os fusos mitóticos,
representados apenas nos estádios iniciais, dividem as células desigualmente e em um
ângulo oblíquo aos eixos vertical e horizontal. Fonte: Gilbert SF. Developmental Biology. 7ª
ed. Sunderland: Sinauer Associates. 2003.
Geralmente, os embriões que realizam esse tipo de clivagem sofrem menos
divisões celulares antes de se reorganizarem para a estruturação de seus tecidos
(processo conhecido como gastrulação, relatado adiante), o que facilita a
identificação das linhagens celulares formadas. Representações gráficas dessa
diferenciação celular em um embrião são comumente chamadas de mapas de
destino. Atualmente, corantes vitais ou marcadores genéticos podem ser usados
com essa finalidade. As células individuais são acompanhadas para verificar que
28
Considerações Iniciais
Dissertação de Mestrado
estruturas da larva ou do adulto elas originarão. Isso é possível porque o destino
celular é estreitamente regulado por interações célula-célula ou pela distribuição
assimétrica particular de moléculas de padronização (morfógenos).
Em alguns casos, os destinos celulares são determinados muito inicialmente
no desenvolvimento, ainda na primeira ou segunda clivagem. Quando isso ocorre, a
clivagem é dita determinada, pois o blastômero faltante impede o correto
desenvolvimento posterior. Em outros casos, alguns animais mantêm seu adequado
padrão de desenvolvimento, mesmo quando seus blastômeros são separados
durante os estádios iniciais de duas ou quatro-células, ou mesmo em estádios mais
tardios. Nesse caso, os blastômeros que se perdem durante o desenvolvimento são
substituídos por outros e a clivagem é dita indeterminada. Com isso, os destinos
celulares são determinados apenas mais tardiamente no desenvolvimento.
Em 1892, ao estudar o desenvolvimento embrionário do poliqueto Neanthes
succinea, o zoólogo e geneticista americano Edmund B. Wilson propôs um sistema
de codificação na determinação dos destinos celulares para padrões de clivagem em
espiral (Wilson 1892). Tal sistema tem aplicação geral, servindo como referência
para a descrição dos padrões de clivagem de outros grupos animais.
No início da clivagem em espiral, após a primeira divisão, as duas célulasfilha recebem os códigos AB e CD. Em seguida, no estádio de 4-células, as células
resultantes são codificadas como A, B, C e D, segundo o sentido horário, quando
analisadas a partir do pólo animal. Essas quatro células são referidas como um
quarteto de macrômeros, podendo ser coletivamente codificadas por Q. A clivagem
subsequente é desigual e as quatro células menores são deslocadas em modo
dextrotrópico, posicionando-se no pólo animal da mórula. Tais células formam o
primeiro quarteto de micrômeros (coletivamente chamadas de células 1q) e recebem
os códigos individuais 1a, 1b, 1c e 1d. Mesmo que macrômeros e micrômeros
possam ter tamanhos similares em alguns casos, tais termos são sempre utilizados
na descrição da clivagem em espiral.
Nesse sistema, o algarismo que precede as letras indica o número de vezes
que os macrômeros originais (Q = A, B, C, D) se dividiram para corresponder ao
número do quarteto de micrômeros produzidos, isto é, o algarismo “1” no embrião
no estádio de oito-células indica que as células Q dividiram-se uma vez. As letras
minúsculas referem-se aos respectivos macrômeros de origem, enquanto as letras
maiúsculas continuam designando os macrômeros (agora também precedidos pelo
algarismo “1”, indicando a formação do primeiro conjunto de micrômeros). Assim, a
mórula no estádio de oito-células possui quatro pares de células-filha (1Q = 1A, 1B,
1C, 1D; 1q = 1a, 1b, 1c, 1d):
29
Considerações Iniciais
Dissertação de Mestrado
1a
A
1b
1c
B
1A
C
1B
1d
D
1C
1D
A clivagem seguinte, do estádio de oito para 16-células, ocorre de modo
levotrópico. Os macrômeros 1Q se dividem para produzir um segundo quarteto de
micrômeros (2q = 2a, 2b, 2c, 2d). O primeiro quarteto de micrômeros (1q) também
se divide, formando oito células-filha. Tais células continuam sendo identificadas
pela letra correspondente ao macrômero-pai, mas passam a ostentar também
numerais expoentes. Assim, o micrômero 1a (do embrião de 8-células) produz duas
células-filhas, codificadas por 1a1 e 1a2. O expoente “1” se refere à célula
fisicamente mais próxima do pólo animal, enquanto que a outra célula recebe
expoente “2”. Apenas os prefixos dos macrômeros são modificados com as divisões
subsequentes (indicando o número de divisões individuais que tais células
sofreram). O estádio de 16-células, portanto, inclui as seguintes células:
Derivadas de 1q
Derivadas de 1Q
1a1, 1b1, 1c1, 1d1
1a2, 1b2, 1c2, 1d2
2q = 2a , 2b, 2c, 2d
2Q = 2A , 2B, 2C, 2D
Na transição do estádio de 16 para 32-células, a próxima clivagem ocorre
com o deslocamento das células de modo dextrotrópico. Os macrômeros 2Q dividem
desigualmente, originando o terceiro quarteto de micrômeros (3q = 3a, 3b, 3c, 3d) e
outro quarteto de macrômeros-filho (3Q = 3A, 3B, 3C, 3D). Todos os doze
micrômeros previamente existentes também se dividem. Desse modo, expoentes são
adicionados às células derivadas dos primeiro e segundo quarteto de micrômeros,
segundo a regra de posicionamento anteriormente mencionada. Portanto, a célula
1b1 divide-se para produzir as células 1b11 e 1b12; a célula 1a2 produz as células
1a21 e 1a22; a célula 2c origina as células 2c1 e 2c2 e assim por diante. Os expoentes
não devem ser considerados como números de dois dígitos (isto é, “vinte e um” ou
“vinte e dois”), mas interpretados como sequências de dois dígitos (isto é, “um-um”,
“um-dois”, “dois-um” ou “dois-dois”), refletindo a linhagem precisa de cada célula. O
estádio de 32-células é composto das células:
30
Considerações Iniciais
Dissertação de Mestrado
1a11, 1b11, 1c11, 1d11
1a12, 1b12, 1c12, 1d12
Derivadas de 1q
1a21, 1b21, 1c21, 1d21
1a22, 1b22, 1c22, 1d22
Derivadas de 2q
Derivadas de 2Q
2a1, 2b1, 2c1, 2d1
2a2, 2b2, 2c2, 2d2
3q = 3a , 3b, 3c, 3d
3Q = 3A , 3B, 3C, 3D
A divisão subsequente, para o estádio de 64-células, segue o mesmo padrão,
com as alterações apropriadas na codificação. O deslocamento das células ocorre de
modo levotrópico, resultando nas seguintes células:
1a111, 1b111, 1c111, 1d111
1a112, 1b112, 1c112, 1d112
1a121, 1b121, 1c121, 1d121
1a122, 1b122, 1c122, 1d122
Derivadas de 1q
1a211, 1b211, 1c211, 1d211
1a212, 1b212, 1c212, 1d212
1a221, 1b221, 1c221, 1d221
1a222, 1b222, 1c222, 1d222
2a11, 2b11, 2c11, 2d11
2a12, 2b12, 2c12, 2d12
Derivadas de 2q
2a21, 2b21, 2c21, 2d21
2a22, 2b22, 2c22, 2d22
Derivadas de 3q
Derivadas de 3Q
3a1, 3b1, 3c1, 3d1
3a2, 3b2, 3c2, 3d2
4q = 4a , 4b, 4c, 4d
4Q = 4A , 4B, 4C, 4D
31
Considerações Iniciais
Dissertação de Mestrado
O sistema de codificação de Wilson é simples e bastante elegante, pois cada
codificação conta a história e a posição de cada célula no embrião. Por exemplo, no
embrião de 32-células, o código 1d11 indica que: (1) a célula deriva do primeiro
quarteto de micrômeros; (2) que seu macrômero de origem é a célula D; (3) que o
micrômero original 1d se dividiu duas vezes desde a sua formação, e; (4) que essa
célula particular está na região mais apical do embrião, em relação às suas célulasirmãs. Nenhuma das células divide o mesmo código, possibilitando a identificação
individual precisa dos blastômeros e de suas linhagens (ver Fig. 1.6).
Em certos animais, padrões característicos de distribuição celular, formados
pela orientação de alguns micrômeros apicais do primeiro quarteto, aparecem
tardiamente. Mais próximas do topo, as células 1q111 assumem um aspecto
semelhante a uma roseta. Em anelídeos e equiúros, os micrômeros 1q112 parecem
formar uma cruz grosseira nos ângulos retos da roseta. Essa cruz recebe o nome de
cruz anelídeo. Em moluscos e sipunculados, tal cruz persiste e, adicionalmente,
forma-se outra cruz a partir das células 1q12 e suas derivadas. A cruz molusco
posiciona-se entre as células da cruz anelídeo (Fig. 1.7). Essas cruzes são
características embriológicas únicas, importantes na determinação das relações
filogenéticas naturais entre certos grupos de metazoários.
Figura 1.7. Clivagem em espiral. (A-D)
Divisões sincrônicas, até o estádio de 32células. As células estão marcadas segundo
o sistema de codificação de E.B. Wilson
(visão do pólo animal). (E) Representação
esquemática
de
um
embrião
composto
aproximadamente no estádio de 64-células,
mostrando as posições de roseta, cruz
anelídeo e cruz molusco. Fonte: Brusca RC,
Brusca GJ. Invertebrates. 2ª ed. Sunderland
(MA): Sinauer Associates. 2003.
32
Considerações Iniciais
Dissertação de Mestrado
Ao final da clivagem, os blastômeros do embrião compõem uma estrutura
denominada blástula, que antecede a formação das camadas germinativas. Pelo
menos quatro tipos são identificados nos invertebrados: (1) a celoblástula, (2) a
estereoblástula, (3) a discoblástula e (4) a periblástula. A celoblástula é uma esfera
oca, formada por uma parede celular. O espaço no interior dessa esfera de células é
chamado de blastocele, ou de cavidade corporal primária. Por sua vez, a
estereoblástula é uma esfera sólida de células, obviamente sem blastocele. Esse é o
tipo de blástula dos platielmintos. Na discoblástula, um disco de células se localiza
no pólo animal do embrião, sobre a massa de vitelo não clivada. Finalmente, a
periblástula é similar à celoblástula, mas a cavidade interior é preenchida por
vitelo acelular. Nos mamíferos, a blástula é chamada de blastocisto.
Após o término da clivagem, as células primordiais da blástula se
reorganizam em camadas germinativas através de um processo chamado
gastrulação. Usualmente, tal processo envolve todo o embrião em uma combinação
de alguns tipos básicos de movimentos celulares: (1) invaginação, (2) involução, (3)
ingressão, (4) delaminação e (5) epibolia. Na invaginação, ocorre uma dobra de
uma camada de células (frequentemente, no pólo vegetal) para o interior do
embrião, como um saco. A camada celular interna é chamada de endoderma e o
saco, por ela definido, delimita o intestino primitivo, ou arquêntero. A camada
celular que se mantém externamente é denominada ectoderma. Na involução, as
células nas extremidades do embrião (geralmente uma discoblástula) proliferam
sob o disco, estendendo-se adjacentes à superfície basal das células que
permanecem no exterior. Na ingressão, algumas células se separam da superfície
do embrião e migram independentemente para a blastocele, eventualmente
preenchendo-a como uma sólida massa de endoderma. Na ingressão unipolar, esse
processo ocorre somente no pólo vegetal, enquanto na ingressão multipolar, ocorre
por praticamente toda a blástula. Na delaminação, uma camada celular da
blástula se divide em duas camadas mais ou menos paralelas. Embora semelhante
à ingressão, esse tipo de movimento celular resulta na formação de uma camada de
células inteiramente nova ou, eventualmente, uma massa sólida de endoderma. Na
epibolia, há a expansão do ectoderma presuntivo em volta das camadas mais
profundas do embrião. As células do pólo animal proliferam rapidamente em
direção ao pólo vegetal, empurrando as células para baixo para circundar o
endoderma. Pode ocorrer também pela modificação de suas formas ou por diversas
camadas intercalando-se em menos camadas. Frequentemente, os três mecanismos
ocorrem
concomitantemente.
Tipicamente,
33
o
arquêntero
é
formado
Considerações Iniciais
Dissertação de Mestrado
secundariamente, como um espaço dentro do endoderma desenvolvido. A Figura
1.8 representa esquematicamente tais movimentos celulares.
As camadas germinativas do embrião regem a formação de sistemas de
órgãos específicos. Uma característica marcante da unidade dos metazoários é a
consistência dos destinos dessas camadas. O ectoderma gera a camada mais
externa do embrião (epiderme) e o sistema nervoso; o endoderma transforma-se na
camada mais interna do embrião, originando o epitélio do tudo digestório e órgãos
associados; uma terceira camada, quando presente, posiciona-se entre o ectoderma
e o endoderma, constituindo o envoltório celômico, o sistema circulatório e a
maioria das estruturas internas de suporte e musculatura. Quando a terceira
camada deriva do endoderma, ela é denominada endomesoderma, ou mesoderma
verdadeiro. Geralmente, é simplesmente referida como mesoderma.
Figura 1.8. Tipos de movimentos celulares durante a gastrulação. A gastrulação de
qualquer organismo em particular é um conjunto de diversos desses movimentos. Fonte:
Gilbert SF. Developmental Biology. 7ª ed. Sunderland: Sinauer Associates. 2003.
Dois processos básicos podem originar o mesoderma. Na maioria dos filos
que realizam clivagem espiral (p.ex. platielmintos, anelídeos e moluscos), um único
micrômero – a célula 4d ou mesentoblasto – produz o mesoderma por proliferação,
se posicionando entre o arquêntero (endoderma) e a parede corporal (ectoderma). As
outras células do quarteto 4q e as células 4Q usualmente contribuem para o
endoderma; em outros táxons (p.ex. equinodermos e cordados), o mesoderma surge
a partir da parede propriamente dita do arquêntero (i.e., do endoderma préformado), como folheto sólido ou como bolsa oca (Fig. 1.9).
Os organismos que apresentam essas três camadas são agrupados como
triploblásticos. Entretanto, alguns organismos como os poríferos, cnidários e
ctenóforos, carecem de um mesoderma verdadeiro. A camada intermediária é
34
Considerações Iniciais
Dissertação de Mestrado
derivada do ectoderma, sendo em grande parte acelular. Por tal razão, é referida por
ectomesoderma. Esses animais são considerados diploblásticos.
Figura 1.9. Modos de formação do mesoderma na gástrula tardia. Secção frontal. (A)
Mesoderma forma-se a partir de derivados dos mesentoblastos. (B) Mesoderma formado por
embolsamento arquentérico. Fonte: Brusca RC, Brusca GJ. Invertebrates. 2ª ed. Sunderland
(MA): Sinauer Associates. 2003.
A partir da aquisição evolutiva de um mesoderma verdadeiro, os filos
triploblásticos alcançaram novas sofistificações corporais, que possibilitaram o
aumento de sua complexidade estrutural. Uma das mais importantes tendências na
evolução foi o surgimento de uma cavidade corporal preenchida por um fluído,
entre parede corporal externa e o tubo digestório. Essa nova organização, de “umtubo-dentro-de-outro-tubo”, permitiu que os órgãos internos (tubo digestório e seus
anexos) não fossem mais espacialmente limitados pelos seus pontos de contato com
a parede corporal, exceto nas suas extremidades. Além de servir para amortecer
mecanicamente o contato entre esses dois grandes tubos independentes, a cavidade
corporal preenchida por fluído possibilitou o desenvolvimento e a expansão de
novas estruturas dentro do corpo. Outrossim, a câmara corporal serviu também
como uma câmara de armazenamento de produtos corporais, bem como exerceu os
papéis de meio para circulação e de esqueleto hidrostático incipiente.
Em certos triploblásticos, no entanto, o mesoderma verdadeiro não origina
dessa cavidade corporal. Ao invés disso, produz um mesênquima, no qual as
células ficam esparsamente espalhadas em uma matriz gelatinosa (ou mesóglea). O
grupo acelomado (do grego a, “sem”; coel, “oco”, “cavidade”) é composto por
Platyhelminthes, Entoprocta, Gnathostomulida e Gastrotricha. Por sua vez,
virtualmente todos os outros animais triploblásticos desenvolvem uma cavidade
35
Considerações Iniciais
preenchida
por
fluído
Dissertação de Mestrado
entre
a
parede
corporal
e
o
intestino.
Animais
blastocelomados (p.ex. rotíferos, nematóides e outros) possuem uma cavidade
revestida apenas parcialmente pelo mesoderma; como na maioria dos casos esse
espaço representa resquícios da blastocele, essa estrutura é atualmente referida
como blastoceloma. Já os metazoários eucelomados (p.ex. moluscos, anelídeos,
artrópodes e cordados) têm a cavidade corporal originada a partir do mesoderma
propriamente dito e revestida completamente por uma delgada membrana de
origem também mesodérmica, chamada peritôneo. Essa cavidade é referida como
celoma verdadeiro (ou euceloma).
A formação do celoma está intimamente relacionada com a formação do
mesoderma. Quando o mesoderma é produzido pela proliferação do mesentoblasto,
a cavidade corporal origina-se por esquizocelia. As massas sólidas de mesoderma,
localizadas
lateralmente
no
embrião,
expandem-se
e
tornam-se
ocas;
eventualmente, transformam-se em espaços celômicos, de parede celular delgada
(Fig. 1.10). A quantidade de tais espaços pareados pode variar enormemente,
estando frequentemente associada com a segmentação (p.ex. em anelídeos). Na
enterocelia, o surgimento do celoma ocorre concomitantemente com a formação do
mesoderma. Nesse caso, ambos os eventos compreendem o mesmo processo, que é
chamado de embolsamento arquentérico. Nele, expansões em forma de bolsa se
desprendem do arquêntero como compartimentos celômicos completos e suas
paredes celulares são definidas como mesoderma. Em alguns casos, primeiro surge
o mesoderma como um folheto sólido; posteriormente, essa massa celular torna-se
uma bolsa oca. Frequentemente, a conclusão da formação do celoma por
enterocelia define um arranjo tripartido, no qual as cavidades corporais são
designadas protocele, mesocele e metacele (Fig. 1.11).
Mesmo com as camadas germinativas estabelecidas, os órgãos não se
formam independentemente: interações celulares e novos rearranjos teciduais
precisam ocorrer para produzi-los. Esse processo é chamado de organogênese.
Nele, diversos órgãos do jovem organismo podem ser formados por células de mais
de uma camada germinativa. A comunicação celular é essencial, seja entre células
adjacentes ou entre células distantes. Sinais moleculares, como hormônios, fatores
de crescimento e morfógenos, modificam o comportamento celular de determinados
tecidos, em momentos adequados. Esse fenômeno é coletivamente conhecido por
indução, enquanto tal aptidão de resposta a um determinado indutor específico é
denominada competência. A competência de resposta é ativamente adquirida
durante o desenvolvimento. Alguns tipos celulares realizam longas migrações até se
estabelecerem em sua localização final. Nesse momento, o reconhecimento seletivo
36
Considerações Iniciais
Dissertação de Mestrado
e as adesões célula-célula ou célula-matriz extracelular necessitam ser altamente
precisos. A própria morte celular, programada e estreitamente regulada, auxilia na
modelagem de algumas estruturas. Ao final da organogênese, o jovem organismo
emerge para o ambiente externo, seja através da eclosão do ovo ou pelo nascimento.
Entretanto, o seu desenvolvimento continua até a sua morte.
Figura 1.10. Formação do celoma por esquizocelia. Secção frontal (A) Condição précelomática, com pacotes pareados de
mesoderma. (B)
Esvaziamento
dos
pacotes
mesodérmicos para produzir um par de espaços celômicos ocos. (C) Proliferação progressiva
de pares de espaços celômicos arranjados seriadamente. Esse processo ocorre em anelídeos
metaméricos. Fonte: Brusca RC, Brusca GJ. Invertebrates. 2ª ed. Sunderland (MA): Sinauer
Associates. 2003.
Figura 1.11. Formação do celoma por enterocelia. Secção frontal (A) Embolsamento
arquentérico. (B) Proliferação e subsequente esvaziamento de uma placa de mesoderma a
partir do arquêntero. (C) Arranjo tripartido típico dos celomas em um embrião
deuterostomado. Fonte: Brusca RC, Brusca GJ. Invertebrates. 2ª ed. Sunderland (MA):
Sinauer Associates. 2003.
37
Considerações Iniciais
Dissertação de Mestrado
I.2.5.2 – Filogenia dos platielmintos, com ênfase em Schistosomatidae e Schistosoma
Basicamente, o termo filogenia refere-se ao relacionamento evolutivo entre
organismos, desde o aparecimento das primeiras espécies até o presente. Todavia,
até pouco tempo atrás, a tarefa de remontar tal história evolutiva esbarrava na
ausência de testemunhos fósseis adequadamente preservados. Provavelmente, os
ancestrais metazoários careciam de estruturas rígidas que pudessem favorecer o
processo de preservação (fossilização) por centenas de milhares de anos, desde o
período Pré-cambriano e o início do Cambriano. Portanto, a solução seria fazer uma
“paleontologia sem fósseis” – termo cunhado pelo biólogo molecular Sean Carrol
(segundo DiSilvestro 1997) – ou melhor, procurar no genoma das espécies atuais
pistas sobre seus ascendentes mais próximos. Tais pistas são encontradas em
genes homólogos. Isso somente foi possível com o advento e o aperfeiçoamento de
técnicas
moleculares,
como
o
sequenciamento
e
alinhamento
de
ácidos
ribonucléicos (p.ex. DNA, DNAmt, RNAr, RNAmi) e de proteínas.
Homologia é um conceito-chave na biologia comparativa, pois se refere a
similaridades compartilhadas entre grupos taxonômicos, a partir de uma mesma
característica presente em um ancestral em comum (Creighton 1999). Em
filogenética sistemática (ou cladística), uma característica ancestral é dita
plesiomórfica, enquanto o seu estado derivado (novo) é referido como apomórfico.
Quando esse estado derivado é restrito a um único táxon, é chamado de
autapomorfia; mas se compartilhado por dois ou mais táxons, é nomeado de
sinapomorfia. Já que sinapomorfias são características homólogas herdadas de um
ancestral
comum
imediato,
todos
os
homólogos
podem
ser
considerados
sinapomorfias em (apenas) um único nível do relacionamento filogenético; em todos
os níveis inferiores, eles constituem simplesiomorfias. Assim, em certo nível
filogenético, todas as características homólogas definem grupos monofiléticos.
Nesse grupo, todos os seus membros são relacionados entre si por uma história
única de descendência (com modificações) a partir de um ancestral comum.
Quando alguns de seus descendentes não estão contidos nesse grupo, ele é dito
parafilético. Assim, o termo que nomeia o clado (i.e., o nome do táxon, tal como
“Turbellaria”) deve ser escrito utilizando-se aspas, para indicar o seu status
parafilético. Por sua vez, um grupo é polifilético quando compreende integrantes
que surgiram de dois ou mais ancestrais imediatos diferentes (Fig. 1.12).
38
Considerações Iniciais
Dissertação de Mestrado
Figura 1.12. Dendogramas exemplificando três tipos de táxons. O táxon W, que
compreende três espécies, é monofilético, pois contém todos os descendentes (espécies C e
D) do ancestral comum imediato (espécie B), mais esse ancestral. O táxon X é parafilético,
pois inclui um ancestral (espécie A), mas somente alguns de seus descendentes (espécie E a
I, deixando de fora as espécies B, C e D). O táxon Y é polifilético porque contém táxons que
não são derivados de um mesmo ancestral comum imediato; as espécies M e P podem
parecer similares como resultado de convergência evolutiva ou paralelismo e, portanto,
foram agrupadas juntas em um único táxon. O táxon Z é parafilético. Nesse caso, trabalhos
adicionais nas espécies de J a P devem, eventualmente, revelar a correta relação entre os
táxons. A espécie M deve ser classificada com as espécies K e L; já a espécie P, com as
espécies N e O. Fonte: Brusca RC, Brusca GJ. Invertebrates. 2ª ed. Sunderland (MA):
Sinauer Associates. 2003.
Embora originalmente o termo homologia fosse mais utilizado para
características morfológicas, o emprego da biologia molecular tornou a utilização
desse conceito bastante trivial na análise filogenética de genes e proteínas. Genes
homólogos podem ser: parálogos, quando surgem por duplicação de um mesmo
gene em uma espécie ancestral em comum, ou ortólogos, quando são passados
como cópias simples durante os eventos de especiação. A comparação entre táxons
intimamente relacionados, ou mesmo entre táxons distantes, se baseia na condição
de que, em duas espécies diferentes, genes ortólogos são expressos em uma posição
similar; essas áreas ou regiões são consideradas homólogas, mesmo quando entre
filos. Tais genes, portanto, devem ter estados presentes em seu último ancestral
comum, mantendo-se presentes nas duas novas espécies dado o seguimento da
especiação (Fig. 1.13). Em geral, os genes ortólogos têm a mesma função em cada
uma das espécies resultantes e somente eles podem ser utilizados para a
reconstrução de árvores filogenéticas (ou seja, da genealogia). Por sua vez, os
genes parálogos estão no genoma como membros de uma família gênica, tendo
usualmente adquirido diferentes funções no transcurso da evolução da espécie em
questão.
39
Considerações Iniciais
Dissertação de Mestrado
Figura 1.13. Geração de genes ortólogos e parálogos. Para detalhes, ver o texto. Fonte:
Creighton TE. Encyclopedia of Molecular Biology. Vol. 1-4. Nova York (NY): John Wiley e
Sons. 1999.
A comparação entre genes de várias espécies abriu uma perspectiva
inteiramente nova para a análise da evolução. Embora a genética de populações
tenha estabelecido o princípio de que a evolução se deve às alterações nos genes,
nenhum exemplo havia sido identificado até o momento. Assim, permanecia a
pergunta de como as mudanças evolutivas podiam ocorrer. A revelação somente
surgiu com a descoberta dos genes que controlavam a embriogênese em moscas.
Esses genes têm homólogos exatos na maioria dos animais, desempenhando as
mesmas funções, ou seja, animais tão diversos quanto vermes, moscas e
camundongos possuem os mesmos conjuntos de genes envolvidos com a formação
e diferenciação de suas características morfológicas e fisiológicas. “A construção das
formas depende da ativação e desativação de determinados genes em diferentes
momentos e posições ao longo da embriogênese”, registrou Carrol (2005). A partir
daí, estabeleceu-se uma nova síntese evolutiva, cujo princípio fundamental propõe
que “a evolução é causada por modificações herdáveis no desenvolvimento dos
organismos” (ver Valentine 1997 e Gilbert 2003). A importância da embriogênese
para a evolução, todavia, já havia sido sugerida há mais de um século, por Darwin
(1859; 1871), Huxley (1863) e Roux (1894). Surgiu, enfim, um novo campo
interdisciplinar na biologia – a biologia evolutiva do desenvolvimento, ou
simplesmente “evo-devo”.
Apesar dos recentes avanços moleculares, a origem e a filogenia do filo
Platyhelminthes (do grego platy, achatado; helminth, verme) ainda permanecem
bastante controversas. Predominantemente, os representantes desse grupo são
parasitas pertencentes às classes Trematoda (como no caso do objeto desse
40
Considerações Iniciais
Dissertação de Mestrado
trabalho, o S. mansoni), Monogenea ou Cestoda. Completa o filo outro grupo,
conhecido por Turbellaria, preponderantemente de vida-livre. Como será visto
adiante, essa antiga classe é considerada inválida, por não ser monofilética (Tyler et
al. 2006). O termo “turbelário”, no entanto, pode ainda ser aplicado aos vermes
anteriormente contidos nesse táxon.
Tradicionalmente, a origem dos platielmintos era postulada estar relacionada
ao surgimento da simetria bilateral ou mesmo com a origem dos metazoários,
como revisto por Brusca e Brusca (2003). A hipótese ciliado-para-acelomado
remete à teoria sincicial para a origem da condição metazoária. Nessa teoria, o
ancestral metazoário seria um protista ciliado, multinucleado e bilaterado. Com
hábito bêntico, tal ancestral rastejaria sobre o substrato com sua abertura oral
voltada baixo; seus núcleos então teriam se separado entre si, pela formação de
membranas celulares e a epiderme celular resultante circundaria uma massa
sincicial interna, definindo uma criatura semelhante a um platielminto. Tal
hipótese, entretanto, não é mais sustentável em sua forma original. Em diversos
acelomados, a natureza sincicial do endoderma é, provavelmente, secundariamente
derivada de um ancestral com um intestino celular.
Outra proposta foi nomeada de hipótese ctenóforo-policlado, sugerindo que
um ctenóforo achatado teria originado um turbelário policlado. Nesse cenário, tal
ancestral assumiria um estilo de vida bêntico, também rastejante, com a boca
direcionada para o substrato. A condição bilaterada teria sido obtida com a redução
dos tentáculos e seu posterior posicionamento junto ao órgão sensorial apical. Pelo
menos em teoria, a organização policlada teria sido alcançada com o aumento da
ramificação intestinal e a formação de uma faringe pregueada. Todavia, essa
hipótese também não possui mais sustentação científica.
Atualmente, ainda persistem outros cenários alternativos. Em um deles, os
platielmintos teriam surgido a partir de uma série de reduções em um ancestral
vermiforme celomado (teoria arquicelomado). Isso implicaria que os surgimentos
do eixo dorso-ventral (simetria bilateral) e do mesoderma provavelmente teriam
ocorrido simultaneamente com os aparecimentos do celoma e da segmentação
corporal. Dessa forma, os animais acelomados (bem como os blastocelomados)
teriam sido originados a partir de um clado celomado, segmentado e derivado de
cnidários acelomados, radialmente simétricos e não-segmentados (ver revisão por
Baguñà et al. 2008). Essa idéia sugere que as bolsas gástricas dos cnidários seriam
homólogas com as bolsas gástricas (enteroceles) que formam as cavidades
celômicas dos deuterostomados (ver Willmer 1990; Rieger e Ladurner 2001). Seria
possível, portanto, que tais linhagens acelomadas tivessem surgido por neotenia
41
Considerações Iniciais
Dissertação de Mestrado
dos estádios embrionários desse ancestral celomado, isto é, que o desenvolvimento
somático desses animais tenha sido retardado em algum estádio larvar de corpo
sólido (ou mesmo com blastoceloma), antes da formação da cavidade celômica
propriamente dita.
Outro cenário mais gradual vem despertando progressivo interesse científico
atualmente. Nele, os turbelários platelmintos teriam surgido por progênese
(obtenção de maturidade sexual em formas larvais) a partir de uma protoplânula
(ou arquiplânula) pelágica ancestral, radialmente simétrica e diploblástica (teoria
planulóide-acelomado; von Graff 1882). A plânula é o tipo larvar básico dos
cnidários atuais. De fato, um crescente conjunto de evidências morfológicas e
moleculares tem sugerido que os cnidários são, de fato, bilaterados verdadeiros
secundariamente derivados para simetria radial (externa), devido ao seu estilo de
vida predominantemente séssil (Finnerty et al. 2004; Martindale 2005; Baguñà et
al. 2008).
Os indícios que suportam esse panorama referem-se às homologias entre o
eixo oral-aboral (O-AB) dos cnidários e o eixo antero-posterior (A-P) dos bilaterados,
bem como entre o “eixo diretivo” dos cnidários e o eixo dorso-ventral (D-V) dos
bilaterados. Inicialmente baseada na expressão assimétrica transitória de genes
ortólogos
cnidários
caracterização
da
BMP2/4/dpp,
expressão
tal relação
assimétrica
de
vem
sendo
outros
corroborada
genes,
envolvidos
pela
na
diferenciação do endoderma, mesoderma e neural (Martindale 2005; Matus et al.
2006). Assim, a análise filogenética com marcadores quantitativos, como genes
ribossomais (18S+28S) e nucleares, bem como com marcadores qualitativos, como
agregados de genes HOX e conjuntos de RNAmi, têm reforçado o posicionamento
dos cnidários como grupo-irmão de um clado bilaterado menos abrangente,
chamado Triploblastica. Esse clado, portanto, compreende os bilaterados atuais
com mesoderma verdadeiro (Baguñà et al. 2008). É possível que o último ancestral
comum dos bilaterados tenha sido pequeno, bêntico, com desenvolvimento direto e
sem segmentos, cavidades celômicas, nefrídeos e um cérebro verdadeiro (Jondelius
et al. 2002).
Dentro de Triploblastica, teria então ocorrido a ramificação precoce do clado
parafilético “Acoelomorpha”, inicialmente com os vermes Acoela e, posteriormente,
com os Nemertodermatida (Carranza et al. 1997; Ruiz-Trillo et al. 1999, 2002,
2004; Sempere et al. 2007; Wallberg et al. 2007; Philippe et al. 2007; Baguñà et al.
2008). Os representantes atuais dos “Acoelomorpha” possuem organização corporal
muito simples, carecendo de nefrídeos, glândulas digestivas, cordões nervosos
longitudinais e uma massa nervosa verdadeira, com neurópilo (Ehlers 1984, 1985;
42
Considerações Iniciais
Dissertação de Mestrado
Raikova et al. 1998; Reuter et al. 1998). Eles ainda compartilham um sistema ciliar
radiculado, cílios curvados e, provavelmente, padrão de clivagem espiral duetosímile (Smith et al. 1986; Haszprunar 1996). Tradicionalmente, os acelomorfos
eram agrupados como ordens da classe Turbellaria, do filo Platyhelminthes (revisto
por Brusca e Brusca 2003). Atualmente, esse novo clado é considerado grupo-irmão
dos Eubilateria ou, como também referido por alguns autores, dos Nephrozoa,
devido ao aparecimento de um sistema excretor (Jondelius et al. 2002; Ruiz-Trillo et
al. 2002; Sempere et al. 2007; Baguñà et al. 2008).
Nesse
cenário,
as
apomorfias
de
todos
os
bilaterados
seriam
o
estabelecimento e consolidação de um novo eixo D-V e a subsequente simetria
bilateral, além do aparecimento de um agregado básico de genes HOX (dois genes
HOX/dois genes ParaHOX) e um conjunto mínimo (dois de três genes) de RNAmi.
Baguñà et al. (2008) ainda destacaram que outra apomorfia importante dos
Triploblastica é a reunião de células nervosas na extremidade anterior, de onde
feixes longitudinais de fibras nervosas se originam. Provavelmente, esses caracteres
surgiram concomitantemente à primeira expansão dos agregados HOX/ParaHOX
(grupo três e genes HOX centrais) e a novos RNAmi (Baguñà et al. 2008). As
plesiomorfias desse grupo, compartilhadas com os ctenóforos, seriam um eixo A-P
(O-AB nos cnidários e ctenóforos), diploblastia (ectoderma e endoderma) e a
presença de um mesoderma verdadeiro (Burton 2008).
Após
a
divergência
dos
“acelomorfos”
e
de
outros
grupos
acelomados/pseudocelomados atuais (Xenoturbellida) ou extintos, a radiação dos
Nephrozoa (ou eubilaterados) resultou em protonefrídeos, um intestino ininterrupto
e o desenvolvimento progressivo de um sistema nervoso mais concentrado (camadas
de células nervosas circundando um neurópilo e definidas como cordas nervosas
ventrais). O aparecimento de estruturas mais elaboradas também foi acompanhado
por conjuntos completos de agregados de genes HOX/ParaHOX e novos grupos de
RNAmi (Baguñà et al. 2008). Dentro dos nefrozoários encontram-se dois grandes
clados: os protostomados e os deuterostomados.
Os protostomados (do grego proto, “primeiro”; stome, “boca”) foram assim
denominados porque sua boca é formada primeiro, perto ou na abertura do tubo
digestório. Quando presente, o ânus se forma posteriormente, em outra localização.
Nesse grupo, outra grande divisão pode ser feita: a linhagem Lophotrochozoa é
caracterizada por apresentar clivagem espiral, uma forma característica de
alimentação através de um conjunto de tentáculos que circundam a boca (lofóforo)
ou uma forma comum de larva ciliada, nadadora (trocófora) (Halanych et al. 1995).
Todavia, é possível que esse agrupamento necessite ser revisado, pois nem todos os
43
Considerações Iniciais
Dissertação de Mestrado
seus membros possuem um lofóforo ou mesmo uma larva trocófora (Giribet 2002;
Brusca e Brusca 2003; Sánchez Alvarado 2003). Platielmintos, briozoários,
anelídeos e moluscos são alguns de seus representantes; por sua vez, nos
Ecdysozoa, estão agrupados os animais que realizam muda de seus esqueletos
externos (exoesqueleto), como no filo Nematoda (vermes cilíndricos) e no filo
Arthropoda (insetos, aracnídeos, ácaros, crustáceos e miriápodes). Cada uma
dessas duas linhagens é considerada monofilética.
Nos deuterostomados (do grego deutero, “segundo”; stome, “boca”), a
abertura oral surge somente após a formação da abertura anal. Ao contrário dos
protostomados, nesse grupo, o blastóporo define o local do ânus. Cordados e
equinodermos são seus representantes, embora os adultos dos equinodermos
exibam simetria radial; suas larvas são originariamente bilaterais.
Assim, os platielmintos têm uma posição central em todos os cenários sobre
a história primordial dos bilaterados. Todavia, a ausência de sinapomorfias
convincentes tem dificultado o agrupamento natural de seus membros, i.e., a
formação de táxons monofiléticos (Carranza et al. 1997; revisto em Baguñà e
Riutort 2004a, b). Na realidade, as características usualmente consideradas como
autapomorfias dos platielmintos são questionáveis. A posse de neoblastos (célulastronco capazes de substituírem outras células já diferenciadas), como apontado por
Ehlers (1986), ainda não foi devidamente avaliada em diversos outros filos. A
presença de um intestino em fundo-de-saco (i.e., ausência da abertura anal) é,
provavelmente, uma retenção de uma condição primitiva (simplesiomorfia) dos
eumetazoários, que também precisa ser reapreciada em outros bilaterados (p.ex.
Gnathostomulida, Gastrotricha) (revisto em Baguña e Riutort 2004a; Philippe et al.
2007). Ehlers (1985, 1986, 1995) ainda propôs como características autapomórficas
dos platielmintos a presença de protonefrídeos (na realidade, uma sinapomorfia dos
Nephrozoa) e de células epidérmicas multiciliadas sem centríolos, além da ausência
de mitose em células somáticas em todos os estádios pós-embrionários (ver também
Ax 1987). Entretanto, diversos autores têm contestado tais características (Smith et
al. 1986; Rohde 1990). De fato, como visto anteriormente, o filo Platyhelminthes é
polifilético em pelo menos duas de suas ordens (Acoela e Nemertodermatida)
(Carranza et al. 1997; Littlewood et al. 1999a; Ruiz-Trillo et al. 1999, 2002, 2004;
Jondelius et al. 2002; Pasquinelli et al. 2003; Telford et al. 2003; ver Baguñà e
Riutort 2004a; Sempere et al. 2007; Wallberg et al. 2007; Philippe et al. 2007;
Baguñà et al. 2008).
Dessa forma, os Platyhelminthes stricto sensu podem ser subdivididos em
ainda duas distintas linhagens (ver Ruiz-Trillo et al. 1999; Baguñà e Riutort 2004a;
44
Considerações Iniciais
Dissertação de Mestrado
Telford et al. 2005). Os Catenulida ocupam uma posição mais basal. Eles possuem
uma massa nervosa verdadeira, com neurópilo e cordões nervosos; um único
protonefrídeo, localizado dorso-medianamente; um sistema reprodutor completo,
com testículos e poro genital masculino localizados dorsalmente na metade anterior
do corpo, além de espermatozóides imóveis, aciliares (ver Baguñà e Riutort 2004a).
Os Rhabditophora compreendem um táxon monofilético, assim denominado devido
à presença, pelo menos primitivamente, de rabditos lamelados (secreções sólidas
com uma camada cortical composta de lamelas arranjadas concentricamente e uma
medula,
de
consistência
homogênea
para
granular)
(Ax
1996).
Outras
sinapomorfias do grupo referem-se a um par de órgãos glandulares adesivos e a
presença de protonefrídeos pareados com bulbo flamejante multiciliado e canal
celular interdigitante para formar uma barragem (Ehlers 1985; Littlewood et al.
1999a). Os rabditóforos reúnem a maioria das espécies, primariamente abrangendo
os Macrostomorpha e os Trepaxonemata. Os Macrostomorpha dividem-se ainda
em Haplopharyngida e Macrostomida; nos Trepaxonemata, encontram-se os
Polycladida basais e os Neoophora. O termo Neoophora se refere ao modo de
desenvolvimento dos ovos, no qual pequenos oócitos são circundados por células
vitelínicas individualizadas, formadas por um órgão especializado (vitelário); nos
táxons mais ancestrais, como macrostomídeos e policlados, os oócitos propriamente
ditos são ricos em vitelo e realizam um tipo modificado de clivagem em espiral
(Younossi-Hartenstein e Hartenstein 2000; Morris et al. 2004). Eles formam um
grupo parafilético, conhecido por “Archoophora”.
Os neoóforos se dividem ainda em “Lecithoepitheliata” e Eulecithophora. Os
eulecitoforados então abrangem os clados Prolecithophora, Rhabdocoela e “Seriata”.
Os Rhabdocoela são ainda divididos em mais seis sub-clados: “Dalyellioida”,
Endoaxonemata,
Kalyptorhynchia,
“Typhloplanoida”,
Temnocephalida
e
Revertospermata. Por sua vez, os Revertospermata estão reunidos os Fecampiida e
os Mediofusata. Os Mediofusata ainda abrangem as famílias Urastomidae,
Genostomatidae e o grupo parasita Neodermata, que inclui as tradicionais classes
Trematoda, Cestoda e Monogenea. Os “Seriata” são parafiléticos (Carranza et al.
1997). Eles reúnem os Proseriata, Bothrioplanida e Tricladida, que ainda é
subdividido em Maricola, Cavernicola, Paludicola e Terricola (Tyler et al. 2006; ver
também Norén e Jondelius 1999, 2002; Lockyer et al. 2003a).
Os Neodermata são um grupo monofilético, como primeiramente proposto
por Ehlers (1984, 1985) (Littlewood et al. 1999b). As sinapomorfias desse grupo
são: substituição da epiderme larvar por uma neoderme com pericários abaixo da
superfície (tegumento sincicial), ausência de radículas ciliares verticais dos cílios
45
Considerações Iniciais
epidérmicos,
Dissertação de Mestrado
presença
de
colares
elétron-densos
de
receptores
sensoriais
“neodermato-símile” característicos, axonemas dos espermatozóides incorporados
no corpo celular por fusão próximo-distal e incorporação de hospedeiro vertebrado
no ciclo de vida. Dentro dos Neodermata, a análise gênica de pequenas (SSU) e
grandes (LSU) subunidades de RNAr agrupa os Trematoda e os Cestoda, embora
nenhuma sinapomorfia morfológica seja conhecida para esse clado (Lockyer et al.
2003). Nesse trabalho, o suposto clado Cercomeromorphae (Monogenea + Cestoda)
foi rejeitado, ainda que não significativamente. Os trematódeos ainda dividem-se em
Aspidogastrea e Digenea (Littlewood et al. 1999a; Rohde 2001). Entre os cestódeos,
agrupam-se
os
Gyrocotylidea,
Amphilinidea
e
Eucestoda.
Por
fim,
Monopisthocotylea e Polyopisthocotylea definem o monofilético táxon Monogenea,
grupo-irmão de Trematoda + Cestoda (Littlewood et al. 1999b; Lockyer et al. 2003).
Um sumário dessas supostas relações filogenéticas apresentadas está representado
na Fig. 1.14. Tais relações ainda estão sendo avaliadas em novas investigações. É
provável que, em breve, outros indícios morfológicos e moleculares possam resultar
em modificações adicionais nesse cenário.
A neoderme foi, provavelmente, uma importante aquisição evolutiva ao
parasitismo nos platielmintos stricto sensu. A localização dos pericários em
camadas mais profundas do tegumento possivelmente foi útil na proteção contra
reações abrasivas ou imunológicas. Nesse contexto, a ausência de radículas
verticais nas placas epidérmicas ciliadas das formas larvais pode ter facilitado a sua
liberação durante a infecção de um hospedeiro. Além disso, a neoderme possui um
importante papel na aquisição de nutrientes, através de uma área superficial
bastante aumentada por microvilosidades, microcristas e concavidades, além de um
vigoroso glicocálice envolvido na incorporação ativa de nutrientes e seu transporte
subsequente (Halton 1997; Tyler e Tyler 1997). Na realidade, uma variedade de
adaptações comportamentais foi necessária para o estabelecimento do parasitismo
entre os platielmintos. Entre elas, a localização e o reconhecimento do hospedeiro
suscetível, a adesão de ovos e sua eclosão em resposta a sinais do hospedeiro,
ritmos endógenos de eclosão e comportamentos especiais das larvas. De fato, não
houve apenas uma única inovação crítica ao sucesso dos platielmintos parasitas.
Como outras associações ecológicas, o parasitismo surgiu diversas vezes entre os
“turbelários” (ver Littlewood et al. 1999b).
46
Considerações Iniciais
Dissertação de Mestrado
Figura 1.14. Resumo das relações filogenéticas dos platielmintos. Para mais detalhes e
referências, ver o texto.
O último suposto ancestral comum dos Neodermata ainda é incerto.
Littlewood e colaboradores (1999b) postularam que o ciclo de vida desse ancestral
era direto, por um único hospedeiro vertebrado. A favor dessa hipótese, os autores
argumentaram que os hospedeiros vertebrados são comuns nos ciclos de vida de
todos os Neodermata atuais e que a aceitação do endoparasitismo como modo
primordial de interação seria mais parcimoniosa, já que apenas os Monogenea
apresentam hábito ectoparasita, ao passo que mantêm a neoderme (Littlewood et al.
1999b). Controversamente, Zamparo e colaboradores (2001) defendem que esse
ancestral tinha um ciclo de vida com dois hospedeiros, relacionado com a adição de
um hospedeiro vertebrado ao plesiomórfico ciclo de vida direto em um hospedeiro
artrópode, como primeiramente sugerido por Brooks e colaboradores (Brooks et al.
1985;
Brooks
1989a,
b;
Brooks
e
McLennan
1993).
Nesse
cenário,
o
endoparasitismo de vertebrados pode ter surgido a partir da predação de artrópodes
(Zamparo et al. 2001).
Dentre
os
trematódeos,
a
separação
dos
Aspidogastrea
e
Digenea
provavelmente ocorreu concomitantemente com a divergência dos condrictes (p.ex.,
tubarões e raias) e osteíctes (peixes ósseos) (Brooks et al. 1989a). Os trematódeos
47
Considerações Iniciais
Dissertação de Mestrado
digenéticos são bastante comuns em membros de todas as classes de vertebrados,
exceto nos Chondrichthyes. Nesses animais, apenas poucos vermes digenéticos
conseguem lidar com a uréia presente em seus tecidos (ver Schmidt e Roberts
2000). Por outro lado, os Cestoda são tolerantes à uréia e podem, inclusive,
degradá-la; com isso, uma diversa gama de cestódeos pode ser encontrada em raias
e tubarões (Read et al. 1959; ver Caira e Jensen 2001).
Os Digenea talvez representem o maior grupo de metazoários endoparasitas,
com cerca de 18.000 espécies nominais (Cribb et al. 2001). Recentemente, Olson e
colaboradores (2003) estimaram a filogenia dos Digenea via parsimônia máxima e
inferência Bayesiana, ao analisar duas sequências gênicas ribossomais (SSU e LSU)
de 163 táxons de vermes digenéticos (compreendendo 77 famílias nominais) e sete
táxons de Aspidogastrea como grupo-externo (representado três famílias). Os
autores concluíram que os trematódeos digenéticos se ramificam em dois clados
principais: os Plagiorchiida e um segundo grupo, que foi nomeado Diplostomida. Os
Plagiorchiida compreendem um vasto grupo de 13 linhagens independentes (para
mais detalhes, ver Olson et al. 2003). Os Diplostomida se dividem ainda em outras
três linhagens: os Brachylaimoidea, no qual os Leucochloridiidae foram agrupados
dentro de “Brachylaimidae”; os Diplostomoidea, com Diplostomidae e “Strigeidae”
misturados, e; os Schistosomatoidea, que reúnem as famílias de ambiente
sanguíneo Sanguinicolidae (parasitas de peixes), “Spirorchiidae” (parasitas de
tartarugas) e Schistosomatidae, além de Clinostomidae (Brooks et al. 1985, 1989a,
b; Olson et al. 2003).
Embora os clinostomídeos não residam no sangue de seus vertebrados, eles
possuem uma íntima relação com as famílias supracitadas, como primeiramente
sugerido por La Rue (1957). Uma prega natatória corporal dorsal na cercária pode
ser a sinapomorfia dos Schistosomatoidea, embora reduzida nos Spirorchiidae e
aparentemente secundariamente ausente nos Schistosomatidae (Pearson 1992);
sua presença ocorre nos Clinostomidae, sugerindo seu agrupamento dentro desse
clado.
Ademais,
Olson
e
colaboradores
(2003)
apontaram
que
o
táxon
Schistosomatoidea somente é monofilético com a inclusão da família Clinostomidae.
Por outro lado, a análise individual ou combinada dos genes ribossomais SSU e
LSU indica que a família Spirorchiidae é, de fato, parafilética; seus membros,
entretanto, são agrupados basalmente dentro de Schistosomatoidea, enquanto os
monofiléticos esquistossomatídeos ocupam uma posição mais derivada (Snyder
2004).
Das mais de 100 famílias nominais de vermes digenéticos, com mais de
10.000 espécies reunidas, apenas duas não são hermafroditas (LoVerde e Chen
48
Considerações Iniciais
Dissertação de Mestrado
1991; Platt e Brooks 1997). Entre essas duas, a família Schistosomatidae reúne
membros que parasitam pássaros, mamíferos e crocodilos, além de usarem um
gastrópode como hospedeiro intermediário. Usualmente, seus representantes estão
associados a ambientes de água doce, em regiões temperadas e tropicais. Os
esquistossomatídeos ainda podem ser subdivididos em quatro clados: ocupando
uma posição basal, o clado AO, composto pelos gêneros Autrobilharzia e
Ornithobilharzia,
forma
Orientobilharzia
definem
o
grupo-irmão
o
clado
de
SO;
Schistosoma;
Heterobilharzia
já
e
Schistosoma
e
Schistosomatium
compreendem o clado HS, e; com uma posição mais derivada, o clado BTDG
abrange Bilharziella, Trichobilharzia, Dendritobilharzia e Gigantobilharzia (Lockyer et
al. 2003; Olson et al. 2003; Snyder 2004) (Fig. 1.15).
A localização basal do clado AO reforça o posicionamento de três gêneros de
espirorquídeos que parasitam tartarugas marinhas como grupo-irmão monofilético
de Schistosomatidae, ainda que a família Spirorchiidae seja parafilética e
taxonomicamente inválida (Snyder 2004; ver também Brant e Loker 2005). Como
todos
os
espirorquídeos,
as
cercárias
das
espécies
de
Autrobilharzia
e
Ornithobilharzia possuem ocelos (Lockyer et al. 2003). Outros cinco gêneros
exclusivamente parasitam tartarugas (como hospedeiro definitivo) e caramujos
(como hospedeiro intermediário) de água doce. Eles ocupam uma posição basal na
filogenia dos trematódeos sanguíneos de tetrápodes (Snyder 2004). De fato, as
tartarugas marinhas são consideradas derivadas de um ancestral criptodiro de
água doce, que divergiu há cerca de 90-120 milhões de anos (Shaffer et al. 1997).
Isso sugere que os espirorquídeos marinhos originaram-se a partir de um ancestral
dulcícola, que passou a infectar gastrópodes e tartarugas de ambientes marinhos.
Além
disso,
esse
cenário
assume
um
destacado
papel
na
origem
dos
esquistossomatídeos e seu respectivo estado dióico, já que seus membros atuais
mais
basais
(gêneros
Autrobilharzia
e
Ornithobilharzia)
também
utilizam
gastrópodes marinhos como hospedeiros intermediários e possuem pronunciado
dimorfismo sexual. Nesse caso, é possível que um ancestral espirorquídeo tenha
conseguido colonizar uma ave marinha como hospedeiro vertebrado (Snyder 2004;
Brant e Loker 2005; ver também a revisão de Platt e Brooks 1997). Outros autores
sugerem que os esquistossomatídeos originaram como parasitos de crocodilos e
evoluíram secundariamente dentro das aves e então mamíferos (Carmichael 1984;
Basch 1991; Morand e Müller-Graf 2000).
49
Considerações Iniciais
Dissertação de Mestrado
Figura 1.15. Filograma dos trematódeos de tetrápodes. Baseado em inferência Bayesiana
de dados combinados das subunidades ribossomais pequena e grande de DNA. A topologia
da árvore é idêntica à produzida por análise de parcimônia máxima dos dados combinados.
As famílias as quais pertencem os gêneros dos trematódeos de peixes ou de tetrápodes estão
indicadas à direita da figura; Clinostomum pertence à Clinostomidae. Os hospedeiros
definitivos estão indicados por ícones a direita dos nomes dos gêneros. Para maiores
informações, ver Snyder SD. Phylogeny and paraphyly among tetrapod blood flukes
(Digenea: Schistosomatidae and Spirorchiidae). Int J Parasitol. 2004 Nov;34(12):1385-92.
Indícios adicionais são necessários para determinar a origem da diocia
nesses vermes. Coincidentemente, outras características singulares entre os
Digenea surgiram nos esquistossomatídeos (discutidas por diversos autores, como
Grossman et al. 1981; Short 1983; Carmichael 1984; Basch 1990; Combes 1991;
Basch 1991; Després e Maurice 1995; Platt e Brooks 1997; Morand e Müller-Graf
2000; Snyder 2004; Brant e Loker 2005). A aquisição de corpos mais finos
provavelmente favoreceu o pareamento entre vermes de diferentes sexos (exceto em
Schistosomatium), bem como a cooperação e divisão de funções entre machos e
fêmeas. Geralmente, a fêmea possui um corpo pouco musculoso, com menos
50
Considerações Iniciais
Dissertação de Mestrado
parênquima e faringe reduzida; isso dificulta a sua migração intravascular e a sua
digestão. O macho é o oposto, i.e., ele abriga a fêmea no seu canal ginecóforo,
diminuindo o contato dela com sistema imunológico do hospedeiro, além de
transportá-la pela vasculatura hepático-intestinal; os machos aproveitam para
inseminar constantemente as fêmeas. Além disso, a musculatura desenvolvida do
macho auxilia no processo digestório da fêmea, através de inúmeras contrações.
Com uma menor quantidade de tecidos, as reservas energéticas das fêmeas ficam
direcionadas para a produção de ovos e o tamanho mais delgado permite que elas
atinjam vasos de menor calibre, para ovipor. A oviposição em vasos pequenos
aumenta as chances de que os ovos abandonem o território vascular e atinjam a luz
intestinal (Basch 1990; Read e Nee 1990; Platt e Brooks 1997; Morand e MüllerGraf 2000).
Outras características apontadas como possíveis causas para a diocia dos
esquistossomatídeos se referem à endotermia (Grossman et al. 1981; Short 1983) e
à mudança do ambiente arterial para o venoso, acompanhada pelo desenvolvimento
de um sistema porta homeotérmico e a subsequente colonização de hospedeiros
terrestres, como proposto por Basch (1991). Embora Morand e Müller-Graf (2000)
tenham refutado essa hipótese ao destacar a localização arterial de Griphobilharzia
em crocodilos (ver Platt et al. 1991), Brant e Loker (2005) defendem que
Griphobilharzia amoena esteja, de fato, mais intimamente relacionada aos
espirorquídeos de tartarugas de água doce. Duas implicações então emergem: a
variedade de hospedeiros dos espirorquídeos passa a incluir outros répteis e os
esquistossomatídeos parasitam apenas hospedeiros endodérmicos (Brant e Loker
2005). A colonização do sistema venoso pode ainda ter conduzido a evolução dos
esquistossomatídeos ao causar constantes flutuações ambientais, como aquelas
geradas pelos elaborados sistemas imunológicos dos hospedeiros (Combes 1991). A
habilidade em responder a essas alterações seria favorecida pela presença de um
mecanismo de geração de variabilidade genética, como a reprodução cruzada ou a
existência da diocia. Nesse contexto, a sofistificação dos sistemas imunológicos dos
vertebrados teria um papel central na co-evolução dos esquistossomatídeos.
No entanto, outras duas espécies de esquistossomatídeos residem no sistema
arterial de seus hospedeiros (ver revisão de Loker e Brant 2006): Dendritobilharzia
pulverulenta parasita patos, liberando seus ovos em artérias relativamente grandes,
que são depois carregados pelo fluxo sanguíneo para os leitos capilares do intestino,
e; Schistosoma hippopotami, que se localiza preferencialmente em artérias
pulmonares e nas câmaras direitas do coração, assim como nas principais veias e
no sistema porta hepático do hipopótamo. Os sítios de oviposição não são
51
Considerações Iniciais
Dissertação de Mestrado
conhecidos e poucas informações estão disponíveis sobre essa espécie de
esquistossomo (Kruger et al. 1988). É possível que tais espécies sejam exceções à
regra (Loker e Brant 2006). Assim, estudos adicionais são ainda necessários.
Por fim, há 14 gêneros reconhecidos na família Schistosomatidae, com cerca
de 100 espécies de esquistossomos (Khalil 2002). Dessas, cerca de 20 espécies
estão incluídas no gênero Schistosoma. Tais espécies foram inicialmente divididas
em quatro grupos, tendo como base a morfologia de seus ovos, do gênero do
hospedeiro intermediário encontrado naturalmente infectado e nas suas respectivas
distribuições geográficas (ver Rollinson e Southgate 1987). Cada grupo foi nomeado
a partir de seu exemplar considerado mais importante. Todavia, a partir da análise
filogenética de três genes (SSU, LSU e citocromo oxidase 1 mitocondrial), Lockyer e
colaboradores (2003b) sugeriram que o gênero Orientobilharzia seja sinônimo de
Schistosoma. Contudo, o tradicional agrupamento foi pouco comprometido, sendo
agora melhor representado por seis linhagens.
O grupo “japonicum” posiciona-se fortemente na base, como grupo-irmão de
todos os outros esquistossomos (Snyder e Loker 2000; Lockyer et al. 2003b;
Webster et al. 2006). Por esta razão, é provável que o último ancestral comum do
gênero Schistosoma tenha surgido na Ásia (Hirai et al. 2000; Morgan et al. 2003;
Agatsuma 2003). O grupo inclui S. japonicum, S. sinensium, S. mekongi e S.
malayensis. A espécie S. hippopotami ramifica-se individualmente, como um clado
africano (Morgan et al. 2003; Webster et al. 2006). Orientobilharzia e S. incognitum
definem um terceiro clado, ainda pouco resolvido (Lockyer et al. 2003b; Webster et
al. 2003). O grupo “mansoni” é definido pela espécie S. mansoni, objeto dessa
dissertação, e por S. rodhaini, que parasita roedores. O grupo “indicum” é formado
pelas espécies S. indicum, S. nasale e S. spindale, enquanto o grupo “haematobium”
compreende as espécies S. haematobium, S. mattheei, S. intercalatum e S.
guineensis, que infectam o homem e as espécies S. margrebowiei, S. leiperi, S. bovis
e S. curassoni parasitam principalmente ovelhas e o gado (Webster et al. 2006). Pelo
menos 165 milhões de bovinos são afetados pela esquistossomose (de Bont e
Vercruysse 1997).
Na África, a divergência entre os grupos “mansoni” e “haematobium”
provavelmente ocorreu há mais de cem milhões de anos, que corresponde ao tempo
de divergência dos respectivos hospedeiros caramujos, Biomphalaria e Bulinus
(Davis et al. 1980, 1993). Por outro lado, a colonização da América do Sul pelo S.
mansoni parece ser bem mais recente, causada pelo advento do tráfego negreiro
oriundo da África Ocidental (Snyder e Loker 2000; Morgan et al. 2005). Todos os
52
Considerações Iniciais
Dissertação de Mestrado
isolados brasileiros de S. mansoni têm haplotipos de DNAmt praticamente idênticos,
sugerindo a ocorrência de efeito fundador no seu estabelecimento e dispersão
(Morgan et al. 2005).
I.2.5.3 – Visão geral do desenvolvimento embrionário dos platielmintos
Como descrito anteriormente, a filogenia dos platielmintos ainda é bastante
controversa e o estudo da embriogênese desse grupo pode auxiliar na determinação
das suas relações de parentesco. De fato, o desenvolvimento e a reprodução podem
estar estreitamente interligados nesse grupo, principalmente entre os “turbelários”
terrestres e dulcícolas. Eles possuem uma impressionante capacidade regenerativa
(revisto por Egger et al. 2007). A reprodução assexuada pode ocorrer por fissão
transversal simples, fissão transversal múltipla e fragmentação. Por sua vez, os
trematódeos (como no caso de S. mansoni) multiplicam assexuadamente suas
formas larvais em determinado ponto de seus ciclos, o que determinou uma
importante aquisição adaptativa na sobrevivência dessas espécies. Já a reprodução
sexuada assegura a variabilidade da prole pelo intercâmbio de material genético,
mesmo nos platielmintos hermafroditas. De fato, uma grande variedade de formas
do sistema reprodutor é encontrada nos platielmintos: no sistema masculino, os
testículos podem ser únicos, pareados ou múltiplos; enquanto que no sistema
feminino, a organização depende do tipo de ovo produzido. Nessa seção, o
desenvolvimento
embrionário
dos
táxons
de
platielmintos
será
brevemente
exemplificado a partir de algumas espécies selecionadas. Uma comparação das
estratégias de desenvolvimento nos diferentes táxons de platielmintos está
representada na Fig. 1.16.
53
Considerações Iniciais
Dissertação de Mestrado
Figura 1.16. Estratégias de desenvolvimento em diferentes táxons de platielmintos.
Representação esquemática de secções sagitais de embriões em diferentes estádios (A zigoto
fertilizado; B clivagem; C gastrulação/camadas germinativas; D organogênese; E embrião
maduro). Os diferentes tipos de tecidos estão destacados em cores diferentes (ver legenda).
Para maiores informações, ver Hartenstein V, Ehlers U. The embryonic development of the
rhabdocoel flatworm Mesostoma lingua (Abildgaard, 1789). Dev Genes Evol. 2000 Sep;210(89):399-415.
54
Considerações Iniciais
Dissertação de Mestrado
I.2.5.3.1 – “Arcoóforos”
Os membros desse grupo são reunidos por conveniência, pois todos têm ovos
endolécitos, i.e., os oócitos propriamente ditos são ricos em vitelo. Tipicamente, eles
também possuem um órgão produtor tanto de ovos quanto de vitelo. Tal órgão é o
germovitelário, que pode ser único ou pareado. Contudo, esse grupo não é
taxonomicamente válido.
Acoela e Nemertodermatida
Embora
diversas
evidências
moleculares
recentes
e
alguns
indícios
morfológicos considerem os Acoela e os Nemertodermatida como grupos externos
aos platielmintos stricto sensu (Carranza et al. 1997; Littlewood et al. 1999a; RuizTrillo et al. 1999, 2002, 2004; Reuter et al. 2001; Jondelius et al. 2002; Pasquinelli
et al. 2003; Telford et al. 2003; Baguñà e Riutort 2004a, b; Egger e Ishida 2005;
Sempere et al. 2007; Wallberg et al. 2007; Philippe et al. 2007; Baguñà et al. 2008),
a embriogênese desses grupos será sumariada para comparação.
Os acoelos possuem organização corporal muito elementar: quando presente,
a faringe é simples; a cavidade digestória não é permanente; a boca ou faringe
levam a uma massa sincicial sólida ou a uma massa celular endodérmica. Esses
animais são pequenos (1-5 mm) e marinhos. Alguns poucos são planctônicos ou
simbiontes (Brusca e Brusca 2003). A espécie Neochildia fusca tem um padrão de
clivagem espiral em dueto, no qual a segunda clivagem ocorre em um plano oblíquo
levotrópico em relação ao eixo animal-vegetal. No estádio de quatro-células, o plano
da primeira clivagem corresponde ao plano de simetria bilateral. As clivagens
restantes são simétricas ao plano sagital. Os primeiros três duetos de micrômeros
originam somente derivados ectodérmicos; o ectomesoderma não se forma. O
terceiro dueto de macrômeros forma o endomesoderma, com a complexa
estruturação de fibras musculares circulares, longitudinais e oblíquas, além do
parênquima periférico e central. Os acoelas exibem um padrão único de
desenvolvimento, pouco parecido com outros espiralianos (p.ex. policlados) (Henry
et al. 2000).
Os Nemertodermatida também possuem uma simples faringe, quando
presente. A cavidade digestória possui processos interdigitantes a partir de seu
revestimento intestinal. Os espermatozóides são uniflagelados, enquanto os outros
platielmintos possuem espermatozóides com dois ou nenhum flagelo. Habitam em
zonas marinhas subtidais de lodo e areia. Um gênero (Meara) é parasita de pepinosdo-mar (Brusca e Brusca 2003). Não foram encontradas informações sobre o
desenvolvimento embrionário desse grupo.
55
Considerações Iniciais
Dissertação de Mestrado
Catenulida
Os vermes catenulídeos são alongados, marinhos ou dulcícolas; possuem
uma faringe simples e um sistema digestório em fundo de saco elementar. Em
alguns casos, o mesênquima é reduzido em uma matriz fluída (Brusca e Brusca
2003). Os catenulídeos reproduzem-se assexuadamente por fissão transversal,
formando cadeias de zoóides (Hyman 1951; ver também Egger et al. 2007). No
entanto, não foram encontradas informações sobre o desenvolvimento embrionário
desse grupo.
Macrostomorpha
Esse táxon compreende os Haplopharyngida e os Macrostomida. Como
observado em acoelos e catenulídeos, o modo de reprodução dos macrostomorfos
está intimamente associado com a capacidade regenerativa (revisto por Egger et al.
2007). Os Haplopharyngida são organismos diminutos, com até 6 mm de
comprimento, e possuem uma probóscide e uma faringe simples. A probóscide
separa-se da faringe, sob a extremidade anterior do corpo. O poro anal é
ligeiramente desenvolvido, mas permanente. O cérebro é encapsulado por uma
membrana única (Brusca e Brusca 2003). Não foram encontradas informações
sobre o desenvolvimento embrionário desse grupo.
Os
macrostomídeos
são
pequenos
e
predominantemente
intertidais,
marinhos ou dulcícolas. Possuem uma faringe elementar e um intestino em fundode-saco também simples (Brusca e Brusca 2003). A espécie Macrostomum sp. sofre
um padrão de clivagem espiral modificado, em quartetos; os micrômeros não são
tão menores em comparação com os macrômeros. A estereoblástula resultante é
circundada por uma camada vitelínica externa, que se origina a partir de grandes
células vegetais periféricas. Tais células vegetais se destacam do embrião e
achatam-se (membrana externa, do inglês hull membrane). Essas células,
primeiramente descritas por Seilern-Aspang (1957) para M. appendiculatum e Tyler
(1981)
para
M.
hystricinum,
formam
o
envoltório
vitelínico
externo,
que
gradualmente desaparece durante o desenvolvimento (Morris et al. 2004). Células
periféricas anteriores e laterais geram o primórdio somático, que formará a parede
corporal e o sistema nervoso. No centro do embrião, algumas células originam o
grande primórdio digestório, rico em vitelo. Os primórdios da faringe e da massa
nervosa aparecem como densidades simétricas antero-ventrais, dentro do primórdio
somático. O neurópilo central da massa nervosa é formado a partir da extensão dos
axônios neuronais. A camada celular mais externa do primórdio somático
diferencia-se em epitélio epidérmico ciliado. Outros cílios surgem no lúmen do
56
Considerações Iniciais
Dissertação de Mestrado
primórdio faringiano, no sistema protonefridial e, mais tardiamente, no lúmen
intestinal. Em seguida, o primórdio somático estende-se ao redor da superfície
ventral e dorsal, formando completamente a parede corporal. Os precursores
musculares se diferenciam em miofilamentos de uma rede ortogonal de fibras
circulares, diagonais e longitudinais altamente organizadas. Por fim, neurônios do
primórdio nervoso originam uma comissura no neurópilo, da qual se estende
posteriormente um par único de troncos nervosos ventro-laterais (cordões
longitudinais
principais).
O
lúmen
do
primórdio
faringiano
fusiona-se
proximalmente com a epiderme ventral e distalmente com o intestino, formando um
tubo digestório contínuo. O corpo da larva assume um formato em “U”, enquanto o
sistema nervoso enfim se condensa. Nesse momento, a larva está pronta para
eclodir (Morris et al. 2004).
Polycladida
A maioria dos vermes policlados possui faringe pregueada e intestino multiramificado, com divertículos. Esses animais compreendem um grupo diverso, com
formas relativamente grandes; geralmente, habitam zonas litorâneas, especialmente
nos trópicos. São, predominantemente, bentônicos e de vida-livre. Poucos são
pelágicos ou simbiontes (Brusca e Brusca 2003). Diversos policlados tiveram sua
embriogênese documentada (Lang 1884; Surface 1907; Kato 1940; Boyer et al.
1996, 1998; Younossi-Hartenstein e Hartenstein 2000; Younossi-Hartenstein et al.
2000).
Em geral, os dois primeiros planos de clivagem são oblíquos ao plano de
simetria
bilateral
e
os
blastômeros
do
estádio
de
quatro-células
têm,
aproximadamente, o mesmo destino daqueles de outros Spiralia mais derivados
(Henry et al. 1995). O estádio de quatro-células de Hoploplana inquilina consiste de
dois blastômeros vegetais grandes, que se encontram sobre o sulco de clivagem, e
dois blastômeros menores, no pólo animal. A segunda clivagem dá origem ao
primeiro quarteto de micrômeros, que produzirá a maioria do ectoderma anterior e
lateral da larva resultante. O segundo quarteto de micrômeros forma o ectoderma
dorsal e ventral, além dos músculos circulares. Já o terceiro quarteto de
micrômeros origina apenas pequenos clones de ectoderma. Como observado por
Surface (1907) e Kato (1940), somente a célula 4d do quarto quarteto contribui para
a estrutura interna da larva, produzindo o endoderma, o mesênquima e os
músculos longitudinais (Boyer et al. 1998). Contudo, segundo van den Biggelaar e
colaboradores (1997), a célula 4d se divide assimetricamente em células-filha
animal (4d1) e vegetal (4d2). Apenas a célula 4d1 se divide então simetricamente em
57
Considerações Iniciais
Dissertação de Mestrado
células-tronco esquerda e direita dos cordões mesodérmicos. O mesentoblasto em
policlados forma-se então uma geração após do que em moluscos e anelídeos (van
den Biggelaar et al. 1997). Além disso, o quarto quarteto de células 4a, 4b e 4c não
forma apenas endoderma, mas contribui também para a formação do ectoderma
(Boyer et al. 1996). A figura 1.17 exibe os estádios iniciais do desenvolvimento dos
policlados. Ao final da embriogênese dos policlados, dois tipos larvais podem
emergir: a larva de Müller, com oito lobos ventrais ciliados, e; a larva de Götte, com
apenas quatro (Fig. 1.18) (Nielsen 1995; Brusca e Brusca 2003).
Na espécie Imogine mcgrathi, os quartetos de micrômeros 1-3 formam uma
camada dupla irregular de células mesenquimais, que se expande durante a
gastrulação (por epibolia) sobre o quarto quarteto de micrômeros. O micrômero 4d
se divide em diversos precursores mesendodérmicos grandes, que definem o lado
ventral do embrião. Essas células formam com os micrômeros sub-superficiais do
pólo animal uma profunda camada, que originará todas as estruturas internas do
embrião (sistema nervoso, musculatura, protonefrídeos e intestino). Os micrômeros
4a-c são células vitelínicas grandes que são incorporadas no lúmen intestinal; elas
não contribuem para o epitélio desse órgão. Logo após a gastrulação, ocorre a
diferenciação celular, em um padrão bastante
similar ao dos rabdocelos
(Hartenstein e Ehlers 2000; Younossi-Hartenstein e Hartenstein 2000): as células
da superfície assumem características epiteliais e formam cílios; já outras células
um pouco mais profundas, posicionadas lateralmente, formam os protonefrídeos.
Na região anterior do embrião, um agregado de cerca de 50 células forma a massa
nervosa. A pigmentação dos ocelos ocorre assincronicamente. A faringe forma-se a
partir de uma invaginação ectodérmica, que se fusiona posteriormente com o
intestino densamente ciliado. Após cerca de sete dias, uma larva tipo de Götte está
pronta para eclodir (Younossi-Hartenstein e Hartenstein 2000).
58
Considerações Iniciais
Dissertação de Mestrado
Figura 1.17. Clivagem em espiral de um policlado. Visão do pólo animal, excetuando o
estádio de quarto quarteto (fourth quartet), visto do pólo vegetal. O grande quarto quarteto
de micrômeros (4a-4d) e os diminutos macrômeros (4A-4D) são característicos desse grupo.
No estádio de 4-células, os blastômeros B e D encontram-se no sulco de clivagem vegetal.
Tipicamente, os micrômeros derivados dos quadrantes B e D encontram-se no sulco de
clivagem animal. Para maiores informação, ver Boyer BC, Henry JJ, Martindale MQ. The cell
lineage of a polyclad turbellarian embryo reveals close similarity to coelomate spiralians.
Dev Biol. 1998 Dec 1;204(1):111-23.
Figura 1.18. Larva de Müller. Visão
da “face” da larva do policlado
Planocera. Fonte: Brusca RC, Brusca
GJ. Invertebrates. 2ª ed. Sunderland
(MA): Sinauer Associates. 2003.
59
Considerações Iniciais
Dissertação de Mestrado
I.2.5.3.2 – Neoóforos
Como mencionado, esse é um táxon monofilético. A sinapomorfia de todos os
seus integrantes é a produção de ovos ectolécitos, ou seja, de oócitos pequenos,
circundados por células acessórias individualizadas. Essas células são as células
vitelínicas, produzidas por um órgão especializado, chamado vitelário, ou
glândulas vitelínicas.
“Lecithoepitheliata”
Esse grupo parafilético apresenta variadas organizações de faringe, mas
intestino simples. Cerca de 30 espécies estão reunidas nesse clado por dividirem
uma condição intermediária entre ovos endolécitos e ectolécitos (Brusca e Brusca
2003). Poucas informações sobre a embriogênese desse grupo foram encontradas.
Segundo Hartenstein e Ehlers (2000), citando Reisinger et al. 1974a, b), o quarteto
de micrômeros expande-se (por epibolia) sobre os macrômeros, incluindo parte do
vitelo dentro da cavidade corporal embrionária primária. As células ectodérmicas
“extra-embrionárias” dão origem a uma membrana externa (hull membrane)
transitória, enquanto que alguns dos micrômeros reconstituem o ectoderma
embrionário propriamente dito: a monocamada plana formada define a superfície
ventral do primórdio embrionário. Esse ectoderma embrionário gradualmente
cresce, circundando o embrião e o vitelo localizado abaixo da membrana externa. A
epiderme então se diferencia e as camadas internas do primórdio embrionário
originam a massa nervosa, a musculatura, a faringe e os nefrídeos.
Prolecithophora
Os prolecitóforos têm uma faringe pregueada ou bulbosa e intestino simples.
São animais pequenos, de vida-livre, marinhos ou dulcícolas (Brusca e Brusca
2003). Não foram encontradas informações sobre o desenvolvimento embrionário
desse grupo.
“Seriata”
Esse grupo parafilético reúne os Proseriata, os Bothrioplanida e os Tricladida.
Os Seriata possuem uma grande capacidade regenerativa, que é utilizada como
estratégia de reprodução assexuada. De fato, essa habilidade em Bothrioplanida
ainda não foi extensivamente avaliada (revisto por Egger et al. 2007). Por causa
dessa impressionante característica, o táxon Tricladida tem recebido especial
atenção. Seus membros possuem uma faringe cilíndrica pregueada e o intestino tri-
60
Considerações Iniciais
Dissertação de Mestrado
ramificado, com numerosos divertículos (Brusca e Brusca 2003). As planárias (p.ex.
Dugesia e Schmidtea) estão entre os representantes mais conhecidos e melhor
estudados desse grupo.
Na espécie de planária Schmidtea polychroa, os ovos possuem de dois a seis
oócitos envoltos por células vitelínicas, que se fusionam em um sincício.
Particularmente, os triclados têm um tipo único de clivagem entre os platielmintos,
denominado anarquia dos blastômeros. Ao invés de formar uma mórula ordenada
de micrômeros e macrômeros, os blastômeros perdem o contato e migram
ativamente para diversas posições, dentro do sincício vitelínico. Mais tarde, a
maioria dos blastômeros se reassocia para formar o embrião. No entanto, alguns
blastômeros permanecem no vitelo e sofrem divisões como uma população de
células espalhadas. Outro grupo de blastômeros se diferencia em uma epiderme
embrionária transitória (membrana externa, do inglês hull membrane), que circunda
parcialmente o sincício vitelínico e a faringe embrionária. A membrana externa
mantém uma abertura pela qual o vitelo exterior pode movimentar-se para dentro
da cavidade gástrica limitada por ela, no centro do sincício vitelínico. Essa abertura
tem um anel muscular que atua como faringe e define o pólo posterior do embrião.
O sincício e os blastômeros contidos na cavidade gástrica são então comprimidos
em uma delgada camada periférica. Perto da faringe, precursores de cordões
nervosos ventrais bilateralmente simétricos estendem-se para a região anterior.
Uma massiva proliferação celular dá então início à diferenciação dos primeiros
tecidos embrionários definitivos, enquanto grandes células ricas em vitelo, que
revestiam o sincício, formam a gastroderme. O sincício vitelínico externo é
reabsorvido e as células embrionárias contidas nele diferenciam-se em um
arcabouço irregular de células musculares e nervosas. A epiderme embrionária
transitória é enfim substituída por células epidérmicas verdadeiras. Populações
frouxamente espalhadas de células em diferenciação consolidam estruturalmente
os órgãos do embrião, que assume uma característica vermiforme. Os eventos
morfogenéticos da embriogênese de S. polychroa assemelham-se ao cenário
regenerativo. Para informações adicionais e outras referências, ver Cardona et al.
(2005).
Rhabdocoela
Os rabdocelos formam um grupo diverso e amplo, dividido em “Dalyellioida”,
Endoaxonemata,
Kalyptorhynchia,
“Typhloplanoida”,
Temnocephalida
e
Revertospermata. Todos os rabdocelos possuem uma faringe bulbosa e intestino em
61
Considerações Iniciais
Dissertação de Mestrado
fundo-de-saco simples, sem divertículos. Os ovários são completamente separados
do vitelário (Brusca e Brusca 2003).
Aparentemente, o tifloplanóide Mesostoma lingua não segue o padrão típico
para a clivagem em espiral: os quartetos regulares de macrômeros e micrômeros
não foram identificáveis por Hartenstein e Ehlers (2000). No centro do ovo, o zigoto
sofre quatro ou cinco clivagens, dando origem a um disco sólido, grosseiramente
circular (estereoblástula). Esse disco migra para a periferia do ovo, onde adquire
simetria bilateral: o contato com a superfície do ovo define a futura superfície
ventral do embrião. Ao contrário dos neoóforos basais (p.ex. “Lecithoepitheliata”), a
membrana externa (hull membrane) é formada pelas células vitelínicas, ao invés dos
blastômeros.
Essa
membrana
circunda
todo
o
vitelo,
desde
o
início
da
embriogênese. Os primeiros primórdios de órgãos (massa nervosa e faringe) surgem
a partir de massas mesenquimais de células. Não há gastrulação em Mesostoma e a
organogênese tem início com a formação do epitélio epidérmico na superfície ventral
do embrião. Células mais internas se diferenciam em neurônios, células
musculares (somáticas e da faringe) e em células epiteliais faringianas e excretoras
(protonefrídeos).
A
diferenciação
dos
ocelos
destaca-se
pela
produção
de
pigmentação. A massa nervosa compacta-se, enquanto as células musculares
(miócitos) assumem aspecto filiforme. Contrações da larva tornam-se aparentes em
ovos vivos, quando a larva está pronta para eclodir (ver Hartenstein e Ehlers 2000).
A embriogênese de outra espécie de rabdocelo, o dalielídeo Gieysztoria
superba, apresenta diversas similaridades com Mesostoma, como a clivagem
irregular, o primórdio embrionário mesenquimal e a ausência de gastrulação.
Entretanto, em comparação com outros rabdocelos, Gieysztoria exibe uma precoce
diferenciação do epitélio intestinal e no aparelho genital masculino. Na metade da
embriogênese,
a
camada
epidérmica
invagina
(“invaginação
embrionária”),
deslocando o embrião para o centro do vitelo. Em seguida, a organogênese tem
início. Nos estádios finais do desenvolvimento, o embrião everte-se de volta à
superfície, onde o primórdio epidérmico expande-se ao redor do vitelo para fecharse dorsalmente. No Mesostoma, essas estruturas são formadas após a eclosão (ver
Younossi-Hartenstein e
Hartenstein
2000). A embriogênese dos
rabdocelos
temnocefalídeos Craspedella pedum e Diceratocephala boschmai também foi
estudada por Younossi-Hartenstein e Hartenstein (2001).
Monogenea
A maioria de seus membros é ectoparasita, usualmente de peixes. Poucos
são endoparasitas de vertebrados ectotérmicos (Brusca e Brusca 2003). Possuem
62
Considerações Iniciais
Dissertação de Mestrado
um corpo recoberto por tegumento, a ventosa oral é reduzida ou ausente e não
possuem acetábulo. Esses animais têm um pró-haptor anterior e um órgão
posterior de fixação, o opistohaptor. O ciclo de vida passa apenas por um único
hospedeiro (Brusca e Brusca 2003).
A embriogênese desse grupo é bastante peculiar. Em Gyrodactylus sp., cada
geração de embriões é sequencialmente encapsulada e nutrida pela sua geração
anterior, por pelo menos 20 gerações (Braun 1966; Harris 1998). Isto é, os embriões
se desenvolvem dentro de outros mais antigos, que surgiram a partir do mesmo
zigoto. Todos os embriões dentro desse grupo têm o mesmo genótipo (Harris 1993,
1998). A reprodução dessa espécie segue um padrão específico: o desenvolvimento
da primeira progênie ocorre assexuadamente, enquanto seu progenitor ainda é um
embrião. As progênies subsequentes se desenvolvem a partir de oócitos, que
adentram o útero após o nascimento da geração precedente. Somente após o início
do desenvolvimento da segunda progênie, o sistema reprodutor masculino torna-se
funcional (Harris 1985) e as progênies subsequentes desenvolvem-se tanto
partenogeneticamente quanto sexualmente (Harris 1993).
Após a entrada de um oócito no útero, a primeira clivagem divide o zigoto
longitudinalmente em dois blastômeros iguais, os quais podem ser encontrados
dissociados no útero, devido à atividade muscular do progenitor. A dissociação e
redistribuição das células dentro do útero continuam enquanto as clivagens iniciais
prosseguem. As células podem mover-se livremente e se associarem ou se
dissociarem umas das outras (anarquia dos blastômeros, como nos triclados).
Subsequentemente, pares de micrômeros posicionam-se predominantemente na
região anterior, sobre o sulco entre dois macrômeros. O destino de células
individuais é de difícil determinação por técnicas convencionais de microscopia.
Diversos rearranjos ocorrem no estádio de oito-células. A clivagem não é em
mosaico, mas deve ser altamente regulada. A presença de um ou dois macrômeros
quiescentes dentro da massa de micrômeros também é fonte de variação: eles
podem se dividir entre os estádios de 30 a 150-células (Fig. 1.19). Os mecanismos
de diferenciação e separação do tegumento de um dos embriões (progênie) e da
parede uterina do outro (progenitor) ainda não são conhecidos. Estruturas como o
intestino, o sistema excretor e o aparelho de adesão se diferenciam mais tarde, pósembrionariamente (Cable e Harris 2002). Para informações adicionais, ver os
trabalhos de Cable et al. (1998), Cable et al. (2002) e Cable e Harris (2002).
63
Considerações Iniciais
Dissertação de Mestrado
Figura 1.19. Desenvolvimento inicial de embriões F1 de Gyrodactylus gasterostei.
Representação esquemática a partir de preparações inteiras, visualizadas por microscopia
de contraste de fase. A Segunda e terceira clivagem, gerando micrômeros e macrômeros. B
Conformações diferentes dos estádios de oito-células. C Ambos os macrômeros em divisão,
nos estádios de 50- e 150-células. Para maiores informações, ver Cable J, Harris PD.
Gyrodactylid developmental biology: historical review, current status and future trends. Int
J Parasitol. 2002 Mar;32(3):255-80.
Trematoda
Como mencionado anteriormente, os trematódeos têm um tegumento
especializado e duas ventosas. A maioria de seus membros é endoparasita de dois
ou três hospedeiros durante o seu ciclo de vida (Brusca e Brusca 2003). Em geral,
pouco se sabe sobre a embriogênese dos ovos de trematódeos: apenas as espécies
de importância médica ou veterinária foram alvos de alguns estudos (p.ex., para
Schistosoma, ver Vogel 1942; Prata 1957; para Fasciola, Horstmann 1962; Schmidt
1998; para Echinostoma, Idris e Fried 1996; Schmidt 1998; Fujino et al. 2000). Uma
revisão das informações disponíveis sobre o desenvolvimento embrionário dos ovos
de S. mansoni será apresentada na seção 2.6.
64
Considerações Iniciais
Dissertação de Mestrado
Cestoda
Exclusivamente endoparasitas, as tênias possuem um corpo recoberto por
tegumento, dividido em um escólex anterior, um curto pescoço e um estróbilo. O
estróbilo é formado por uma série de segmentos, ou proglótides. O tubo digestório é
ausente (Brusca e Brusca 2003). A morfologia do primeiro estádio larval pode variar
bastante entre os diferentes subtáxons de Cestoda. Os girocotilideanos e
anfilinidianos, que parasitam peixes marinhos, produzem uma larva licófora, que
exibe diversas características das larvas ou formas juvenis de platielmintos de vidalivre (Rohde e Georgi 1983; Xylander 1986, 1987). As larvas licóforas possuem um
corpo alongado, uma massa nervosa anterior, um sistema de protonefrídeos
pareados e uma epiderme ciliada. Na região distal, os girocotilidianos e
anfilinidianos têm um conjunto de dez ganchos para fixação ao hospedeiro
crustáceo, que necessitam ativamente localizar e penetrar.
Os cestódeos mais derivados (Cestoidea), que são parasitas de vertebrados
aquáticos e terrestres, possuem dois tipos de larvas: coracídio, para aqueles de
ambiente aquático, e oncosfera, para os terrestres. Nos dois casos, as larvas têm
estrutura simplificada e precisam ser ingeridas pelo hospedeiro para continuarem
seus ciclos de vida. Ambas as larvas são diminutas esferas (menos de 20 µm de
diâmetro), com até 100 células (revisto em Rybicka 1966; Ubelaker 1980). Em
Hymenolepis diminuta, a oncosfera madura tem menos de 50 células. No início da
embriogênese, o oócito sofre clivagem total e desigual (a clivagem em espiral não é
aparente), gerando cinco grandes macrômeros e diversos micrômeros. Os primeiros
dois macrômeros fusionam-se em para formar o envoltório externo. Os três
macrômeros restantes formam outro sincício, que se expande e envolve a massa de
micrômeros em divisão. O envoltório interno, ou embrióforo, é desprovido de cílios
e resistente, sendo considerado homólogo à epiderme ciliada primária de outras
larvas de cestódeos. Os micrômeros sofrem diversas outras divisões, formando uma
massa mesenquimal bilateralmente simétrica. Aparentemente, não há folhetos
embrionários na massa celular e a gastrulação também parece não ocorrer (ver
Hartenstein e Jones 2003).
A diferenciação celular tem início com a formação de três pares de ganchos
(descrito por Swiderski 1973, para Catenotaenia pusilla), cujos primórdios
aparecem adjacentes aos grandes núcleos ovóides dos oncoblastos. Os ganchos
crescem e rompem a membrana dessas células, alcançando seu tamanho e forma
(lâmina, colar ou haste) finais. Entre os oncoblastos, dois pares de células
precursoras das glândulas epidérmicas se localizam no pólo posterior do embrião.
Essas células precursoras se achatam e emitem projeções em direção à região
65
Considerações Iniciais
Dissertação de Mestrado
anterior do embrião, onde encontram processos semelhantes, de outras células
glandulares. Ao lado do par de precursores das glândulas epidérmicas anteromediais, localizam-se precursores neurais, que emitem pequenos processos
direcionados posteriormente. Nesse momento, os mioblastos se diferenciam em
fibras musculares ao redor dos ganchos e da parede corporal. A parede corporal
compreende uma fina camada sincicial e o epitélio embrionário. Esse epitélio
envolve o sistema de células glandulares, formando-se pelo posicionamento do
corpo celular de uma célula binucleada em camadas profundas, no centro da
oncosfera; ele corresponde à neoderme sincicial, não-ciliada, que forma o
tegumento dos cestódeos. A glândula de penetração origina-se a partir de um
sincício de células repletas com grânulos, arranjadas em “U”. Ao término da
embriogênese, a oncosfera, ao ser ingerida, perde seus envoltórios protetores e
penetra na parede intestinal do hospedeiro primário. Na cavidade corporal, a
oncosfera sofre metamorfose em um segundo tipo larva, chamado cisticercóide (ver
Hartenstein e Jones 2003).
I. 2. 6 – Desenvolvimento Embrionário do Ovo de Schistosoma mansoni
Historicamente, a biologia dos ovos dos esquistossomos vem sendo tratada
apenas marginalmente, com a atenção voltada principalmente para a formação de
granulomas e o efeito de tratamentos quimioterapêuticos na oviposição das fêmeas.
Apesar dos recentes avanços em estudos moleculares (genômica, transcriptômica,
glicômica, lipidômica e outros), os ovos continuam sendo considerados como uma
entidade única, invariável durante o tempo. Obviamente, isso não é verdade e os
ovos provavelmente apresentarão perfis de expressão gênica e ativação de proteínas
distintos durante a sua embriogênese. Todavia, apenas estudos esporádicos
abordam o desenvolvimento embrionário do ovo, alguns ainda superficialmente (ver
Neill et al. 1988; Swiderski 1984, 1994; Ashton et al. 2001; Freitas et al. 2007). A
escassez de informações sobre essa fase do ciclo dos esquistossomos pode ser
reflexo das dificuldades técnicas para estudá-los (ver Neill et al. 1988; Ashton et al.
2001; Jurberg et al. 2008a). A seguir, as informações disponíveis sobre a biologia do
desenvolvimento dos ovos de S. mansoni serão sumariadas.
I.2.6.1 – Fecundação
Na fêmea acasalada, logo após deixar o ovário, o oócito maduro é
provavelmente fecundado na porção posterior do oviducto. Nessa região, Erasmus
66
Considerações Iniciais
Dissertação de Mestrado
(1973) identificou a presença de espermatozóides em fêmeas maduras, mas não em
fêmeas
imaturas
ou
de
infecções
unissexuais.
Também
conhecido
como
receptáculo seminal, essa câmara no oviducto possui paredes lamelares que
ajudam a reter os espermatozóides (Spence e Silk 1971). Em S. japonicum, Yang e
colaboradores (2003) observaram que a fecundação ocorre em uma região especial,
carente de lamelas, logo antes do receptáculo seminal. Como sugerido, isso
possibilitaria que os espermatozóides tenham livre movimentação para encontrar e
fecundar um oócito.
Grânulos corticais nos oócitos maduros evitam a polispermia (fecundação
múltipla) (Erasmus 1973; Orido 1988). Tais grânulos não são observados após a
fecundação (Orido 1988) ou em oócitos de fêmeas de infecções unissexuais
(Erasmus 1973). Em mamíferos, grânulos desse tipo rapidamente se fusionam com
a membrana plasmática do oócito após a penetração do espermatozóide. Diversas
enzimas são liberadas, atuando na modificação ou destruição de sítios de ligação de
receptores para os espermatozóides. Além disso, uma espessa camada é formada,
impossibilitando a entrada de outros espermatozóides. Os mecanismos bioquímicos
que regem esse fenômeno ainda são desconhecidos nos esquistossomos.
Com a fecundação, a primeira divisão meiótica é completada e os
cromossomos reaparecem. O zigoto é formado a partir da fusão dos pró-núcleos
masculino e feminino, após a segunda divisão meiótica e a extrusão do corpúsculo
polar, como observado em S. japonicum (Yang et al. 2003). A célula-ovo passa
através do receptáculo seminal cheio de espermatozóides, migra pelo oviducto e
então pelo vitelo-oviducto. Nesse momento, células vitelínicas maduras circundam
o zigoto (modo de desenvolvimento ectolécito, característico em vermes neoóforos).
O preciso número de células vitelínicas ao redor do zigoto de S. mansoni ainda é
incerto – variando de 20 a cerca de 40 células (Erasmus 1987; Smyth e Clegg 1959;
Smyth e Halton 1983; Wells e Cordingley 1991). Então, as contrações musculares
dos vermes em cópula auxiliam a rápida passagem desse aglomerado celular para o
oótipo, onde ocorre a formação da casca (Moczon et al. 1992).
I.2.6.2 – Formação da casca do ovo
A formação do ovo propriamente dito tem início com a polimerização de sua
casca em uma câmara especializada do sistema reprodutor da fêmea. Nessa
câmara, ou oótipo, a massa de células vitelínicas que circunda o zigoto encontra
um ambiente viscoso, ligeiramente alcalino (pH 7,0-7,5), devido às secreções das
glândulas de Mehlis (Wells e Cordingley 1991). O meio alcalino provoca a secreção
de vesículas ácidas, que contêm as proteínas precursoras da casca e enzimas fenol
67
Considerações Iniciais
Dissertação de Mestrado
oxidases. De fato, todos os componentes necessários para a formação da casca
estão presentes nessas vesículas (Wells e Cordingley 1991), tendo sido previamente
sintetizados pelas células vitelínicas, ainda nas glândulas vitelínicas (vitelário)
(Threadgold 1982; Koster et al. 1988; Erasmus 1987). Assim, é possível que o sinal
desencadeante para a formação da casca seja uma pequena molécula (ainda
desconhecida) que interaja com um receptor nas células vitelínicas, disparando
uma série de eventos intracelulares (Berridge e Irvine 1989). Esses eventos
culminam no aumento do cálcio intracelular, que causa a exocitose dessas
vesículas (Wells e Cordingley 1991).
A exocitose das vesículas ácidas diminui ligeiramente o pH do fluído em
torno da massa celular, suficiente para prevenir a fusão imediata dos grânulos
precursores da casca. Nesse momento, o oótipo se contrai vigorosamente e relaxa
por algumas vezes, provavelmente modelando a nova casca em seu formato
característico (Wells e Cordingley 1991). A casca do ovo se forma então pela ligação
cruzada de monômeros de pelo menos três famílias distintas de proteínas – P14,
P34 e P48 (Ebersberger et al. 2005), presumivelmente em um processo baseado no
enrijecimento de quinonas mediado por fenol oxidases (Wells e Cordingley 1991;
Fitzpatrick et al. 2007). A inibição de duas dessas enzimas (tirosinases 1 e 2, ou
SmTYR1 e SmTYR2), mediada pela incubação de ácido de Kojic em cultura de
vermes adultos, diminui significantemente a produção de ovos fenotipicamente
normais, sem defeitos em suas cascas (Fitzpatrick et al. 2007). Outro inibidor da
atividade dessa família de enzimas, o dietilditiocarbamato (DDC), também previne a
formação da casca de ovos em esquistossomos (Bennet e Gianutsos 1978).
A polimerização da casca do ovo, como suposto por Wells e Cordingley
(1991), seria resultado da perda das cargas positivas na superfície dos grânulos
precursores da casca, na interface de contato com as secreções alcalinas das
glândulas de Mehlis. Com isso, os grânulos precursores se fusionariam e
enrijeceriam. A ocorrência de microespinhos apenas na superfície externa da casca
seria resultante desse contato com o ambiente alcalino das secreções do oótipo. Ao
final de sua formação, a casca emite fluorescência natural (autofluorescência)
quando observada em microscopia de fluorescência (Wells e Cordingley 1991).
Observações na formação da casca dos ovos de Fasciola hepatica sugerem que esse
mecanismo possa ser comum para outras espécies de trematódeos (Colhoun et al.
1998).
68
Considerações Iniciais
Dissertação de Mestrado
I.2.6.3 – Desenvolvimento embrionário dos ovos
Após a formação da casca no oótipo, o ovo é liberado no útero da fêmea, onde
fica brevemente. A curta permanência no útero suscita questionamentos sobre a
importância desse órgão no desenvolvimento dos ovos. Como diversos outros
helmintos parasitas, o S. mansoni apresenta padrão oportunista (r-selecionado) de
produção de ovos e precisa direcionar rapidamente os nutrientes absorvidos pelas
fêmeas para a geração dos ovos e, em especial, das células vitelínicas. As fêmeas
produzem cerca de 300 ovos por dia (Moore e Sandground 1956; Pellegrino e Coelho
1978), cerca de um ovo a cada cinco minutos. Todavia, outros autores reportaram
valores diferentes para o número de ovos produzidos por dia pelas fêmeas (Faust et
al. 1934; Valadares et al. 1981; Cheever 1994a, b; Lenzi JA 1998). Essa variação
pode ter sido causada pelo ser emprego de métodos, animais e/ou isolados de S.
mansoni diferentes. De fato, a maioria dos trabalhos aponta para números entre
150 a 300 ovos por fêmea/dia. Nesse caso, as fêmeas chegam a gerar até 12.000
células vitelínicas por dia.
Os ovos são então ovipostos na corrente sanguínea do hospedeiro vertebrado,
ainda imaturos. Nesse momento, eles possuem cerca de 112 µm de comprimento
por 44 μm de largura (Ashton et al. 2001) e exibem um conspícuo espinho lateral,
característico da espécie S. mansoni. Nos tecidos do hospedeiro ou em cultura, o
desenvolvimento embrionário completo tem duração de seis a sete dias (Prata 1957;
Pellegrino et al. 1962; Michaels e Prata 1968). Swiderski (1984) descreveu
sucintamente as fases iniciais da embriogênese dos ovos: a clivagem é total e
desigual, gerando blastômeros de três tipos. Os micrômeros e mesômeros darão
origem ao miracídio; enquanto os macrômeros e alguns mesômeros formarão os
envoltórios do ovo ao redor do embrião em desenvolvimento. Nenhuma menção à
organogênese foi feita.
Três camadas da casca são morfologicamente distintas à microscopia
eletrônica de transmissão: o envoltório externo ou camada de Reynolds é ausente
nos ovos mais prematuros e engrossa progressivamente conforme o ovo amadurece,
principalmente nos pólos. Esse envoltório se forma a partir de dois macrômeros que
se soltam em pólos opostos da superfície do embrião e se fusionam com o sincício
vitelínico, previamente formado a partir de resquícios das células vitelínicas. Ele
transforma-se em uma matriz acelular e fibrilar que se posiciona entre a margem
interna da casca do ovo propriamente dita e o outro envoltório do ovo. O envoltório
interno, mais conhecido por envoltório de von Lichtenberg, é formado por três a
quatro mesômeros que também se destacam da superfície do embrião em
desenvolvimento após a formação do envoltório externo. O citoplasma dessas
69
Considerações Iniciais
Dissertação de Mestrado
células também se fusiona em uma camada que envolve o embrião, logo abaixo do
envoltório externo. Em estádios avançados da embriogênese do ovo, esse envoltório
é caracterizado pela presença de núcleos grandes e achatados pertos dos pólos do
ovo, apresentando nucléolos esféricos evidentes e densas ilhas de heterocromatina.
Conforme o miracídio amadurece, os núcleos se deterioram; o citoplasma contém
retículo endoplasmático rugoso bem desenvolvido, numerosas gotículas lipídicas e
extensos agregados de rosetas α de glicogênio e de partículas β de glicogênio; por
fim, a lacuna de Lehman é o espaço entre a membrana plasmática apical do
envoltório interno e o próprio embrião. Durante os momentos mais iniciais do
desenvolvimento, essa cavidade é preenchida por um fluído elétron-luminescente,
com corpúsculos lipóides espalhados, espirais mielinóides e resquícios de células
vitelínicas e/ou células vitelínicas ainda íntegras. Nos estádios mais tardios, essa
lacuna
contém
discretas
massas
grandes
de
material
grânulo-focular,
os
corpúsculos de Cheever (Neill et al. 1988; Swiderski 1994).
Classicamente, entretanto, o amadurecimento dos ovos dos esquistossomos é
classificado apenas considerando as dimensões do embrião em relação ao tamanho
do ovo propriamente dito (Vogel 1942; Prata 1957). Essa classificação foi
denominada de oograma (Pellegrino et al. 1962; Cunha et al. 1962). No estádio I, o
embrião mede cerca de um terço do diâmetro transversal do ovo. No estádio II, ele
ocupa um pouco mais da metade do diâmetro transversal do ovo. Já no estádio III,
o embrião alonga-se e passa a ocupar cerca de 2/3 do diâmetro longitudinal do ovo.
O estádio IV engloba os embriões que ocupam todo o interior do ovo, que ainda
apresenta alguns vestígios de vitelo em seus pólos. O último estádio (estádio V)
refere-se ao miracídio completamente desenvolvido, que apresenta movimentação,
batimento ciliar, contração muscular e atividade das células-flama. Obviamente, o
estádio V é mais facilmente determinado em observados frescos de esmagados de
intestino ou em ovos isolados viáveis. As mudanças na abundância desses
diferentes estádios do desenvolvimento, i.e, no oograma, têm sido utilizadas como
um critério simples, sensível e confiável na avaliação primária de drogas para a
esquistossomose (Pellegrino e Faria 1965).
Ao final da embriogênese, os ovos necessitam sair do território vascular e
atravessar a parede do intestino, especialmente a camada mucosa (que engloba o
epitélio e a lâmina própria), para serem liberados junto com as fezes, dando
continuidade ao complexo ciclo biológico do parasito (ver Fig. 1.2). Nessa fase, os
ovos maduros podem permanecer vivos nos tecidos do hospedeiro por um período
máximo de 12 dias (Prata 1957; Cançado et al. 1965). Ao atravessarem a mucosa
70
Considerações Iniciais
Dissertação de Mestrado
intestinal, os ovos são eliminados com as fezes e eclodem caso alcancem condições
adequadas em tempo útil (ver revisão de Coelho et al. 2008).
I. 2. 7 – Reação Granulomatosa (Granuloma Periovular)
Os ovos liberados pelas fêmeas de S. mansoni começam a se desenvolver já
na corrente sanguínea do hospedeiro, sendo carregados passivamente para diversos
órgãos, como fígado, intestino delgado e grosso, pâncreas, baço e pulmões. Ao
atingirem vasos de menor calibre, os ovos ficam retidos e podem atuar como
agentes granulomatogênicos, isto é, causar um tipo de reação inflamatória peculiar,
denominada granuloma. Entretanto, é interessante notar que, de alguma maneira,
a formação dos granulomas seja dependente do amadurecimento dos ovos, como
destacado por Prata (1957). Ele relatou jamais ter encontrado granulomas cercando
ovos imaturos isolados.
No intestino, a reação inflamatória intravascular inicial ao redor dos ovos
possibilita que estes saiam dos vasos e atinjam os tecidos adjacentes (Lenzi et al.
1987). É possível que os ovos também possam ser passivamente transferidos para o
espaço perivenular pela ação não-específica de células endoteliais (File 1995). Às
vezes, agregados de ovos comprometem o fluxo sanguíneo, gerando necrose da
parede vascular (Bloch 1980). A passagem dos ovos pela mucosa intestinal é
dependente de células inflamatórias periovulares, especialmente macrófagos e
eosinófilos, que degradam a membrana basal epitelial e, com isso, criam um
ambiente de fácil penetração para os ovos. Assim, o peristaltismo intestinal expulsa
os ovos para a sua luz (Lenzi et al. 1987, 1991) e, ao atingirem as fezes, os ovos
podem dar continuidade ao ciclo desse parasito, caso encontrem condições
adequadas para a eclosão dos miracídios.
No fígado, a retenção dos ovos embolizados nos finos vasos portais causa a
dilatação dos ramos periportais. Caso a produção de ovos continue, a subsequente
oclusão desses ramos pode provocar reação granulomatosa, angiogênese e fibrose.
O granuloma esquistossomótico é um sistema adaptativo complexo de células
migrantes e componentes heterogêneos de matriz extracelular que se organizam em
uma estrutura dinâmica, ao redor do ovo. Como sistema complexo, o granuloma é
caracterizado pelas seguintes propriedades: (1) dinamismo, (2) irreversibilidade, (3)
homeostasia, (4) agregação, (5) não-linearidade, (6) fluência, (7) diversidade, (8)
rotulagem, (9) modelos internos, (10) blocos de construção ou de montagem (Lenzi e
Romanha 2003; Lenzi et al. 2006; Romanha 2007). Basicamente, o granuloma é
71
Considerações Iniciais
Dissertação de Mestrado
uma reação inflamatória crônica local, compacta e organizada, caracterizada pela
presença de células da linhagem macrofágica, onde outros tipos celulares (p.ex.
células epitelióides) também podem estar presentes (ver Lenzi et al. 1998).
A literatura sobre o granuloma esquistossomótico por S. mansoni é bastante
extensa e inumeráveis revisões já foram realizadas (p.ex. Lenzi et al. 1998;
Cummings e Nyame 1999; Weinstock et al. 1999; Rumbley e Phillips 1999;
Stadecker 1999a, b; Boros 1999; Wynn 1999; Infante-Duarte e Kamradt 1999;
Stadecker et al. 2001; Cheever et al. 2002; Asahi e Stadecker 2003; Stavitsky 2004;
Wynn et al. 2004; Abath et al. 2006; Wilson et al. 2007; Lenzi et al. 2008b). Por
isso, apenas alguns aspectos-chave da granulomatogênese, relacionados com o
desenvolvimento dos ovos, serão destacados a seguir.
I.2.7.1 – Antígenos solúveis do ovo
Durante a presença dos ovos nos tecidos do hospedeiro, alguns de seus
componentes são ativamente secretados ou mesmo disponibilizados para o meio
circundante após a morte e desintegração do ovo. Acredita-se que a reação
granulomatosa periovular atue na contenção da difusão desse material exógeno ao
hospedeiro (Adams 1983; Reis e Andrade 1987), coletivamente conhecido como
“antígeno solúvel do ovo”, ou SEA, do inglês soluble egg antigen. O granuloma,
portanto, impediria que tais antígenos alcançassem o sistema vascular e fossem
então levados para outros órgãos, distantes de seu local original de produção (p.ex.,
fígado). No entanto, a produção acentuada de ovos e o consequente elevado número
de
granulomas
podem
ocasionar
fibrose
hepática,
hepatoesplenomegalia
e
hipertensão portal.
Tradicionalmente, considerava-se que o SEA era composto por pelo menos
trinta glicoproteínas imunogênicas, com peso molecular aparente variando de 10 a
mais de 200 kDa (Asahi et al. 1999; Stadecker et al. 2001). Entretanto, um estudo
recente utilizando Tecnologia de Identificação Multidimensional de Proteínas (do
inglês, Multidimensional Protein Identification Technology) apontou, de fato, 188
proteínas secretadas pelo ovo (“secretoma do ovo”). Essas proteínas estão
envolvidas
em
balanço
redox,
chaperonamento
e
montagem
protéica,
no
desenvolvimento e na sinalização celular, na remoção de detritos e em cascatas
metabólicas e modulação da resposta imunológica. Além disso, 32 novas proteínas,
ainda não caracterizadas, foram também identificadas (Cass et al. 2007).
No caso da granulomatogênese, a atividade das proteínas imunogênicas está
restrita à presença de unidades terminais LacNAc (Galβ1-4GlcNAc, como na
asialofetuina) ou LacdiNAc (GalNAcβ1-4GlcNAc) (van de Vijver et al. 2006),
72
Considerações Iniciais
Dissertação de Mestrado
previamente identificadas nos ovos de esquistossomos por Khoo e colaboradores
(1997). O SEA também medeia a migração tecidual dos ovos e sua adesão ao
endotélio vascular, bem como a passagem para a luz intestinal, agregação
plaquetária e processos relacionados à angiogênese (Lenzi et al. 1987; Ngaiza e
Doenhoff 1990; File 1995; Lejoly-Boisseau et al. 1999; Loeffler et al. 2002; Stanley
et al. 2003; Doenhoff et al. 2003). Ao atingir o meio periovular, os antígenos do ovo
são internalizados e processados por células dentríticas derivadas de monócitos e
apresentados às células T via MHC de classe II (van Liempt et al. 2007). Suas
imunogenicidade e patogenicidade irão variar de acordo com fatores geneticamente
determinados do hospedeiro, como os haplotipos de MHC e o repertório de células T
(revisto por Abath et al. 2006). Apesar dos recentes avanços na imunopatologia da
inflamação granulomatosa na esquistossomose, a origem da maioria desses
antígenos e seus epítopos de células T permanecem amplamente desconhecidos
(Asahi e Stadecker 2003).
A imunolocalização das proteínas totais secretadas pelo ovo (ESP) identificou
o envoltório interno do ovo, também conhecido como envoltório de von Lichtenberg,
ao invés do miracídio propriamente dito, como fonte dessas proteínas (Ashton et al.
2001). Quando madura, tal estrutura possui um retículo endoplasmático rugoso
desenvolvido, que indica elevados níveis de síntese protéica, e grandes agregados de
material granular, que pode significar o armazenamento dessas proteínas recémsintetizadas antes da sua exocitose (Ashton et al. 2001). Esse envoltório surge
precocemente no desenvolvimento do ovo (Swiderski 1994; Ashton et al. 2001) (ver
seção 2.6). Anticorpos monoclonais anti-LacdiNAc também revelaram a localização
desse carboidrato na superfície externa da casca do ovo (van Remoortere et al.
2000; van den Berg et al. 2004). Outro estudo também localizou uma importante
proteína do ovo (IPSE/alfa-1), capaz de estimular basófilos a degranularem e
liberarem IL-4, na mesma região adjacente a casca (Schramm et al. 2006).
Entretanto, como os próprios autores reconheceram, os momentos nos quais a
síntese dessas moléculas tem início e que seus estímulos indutores ainda
permanecem desconhecidos. Assim, é preciso não apenas identificar quais
antígenos ocorrem, mas determinar suas estruturas e suas localizações espaciais
durante o desenvolvimento do ovo; se os antígenos são secretados ou não e ainda se
eles são compartilhados com outras fases do ciclo de vida do esquistossomo.
A seguir, uma breve descrição dos antígenos ovulares secretados mais
abundantes será apresentada (ver também Stadecker et al. 2001; Asahi e Stadecker
2003; Cass et al. 2007). Os outros antígenos secretados, com abundância relativa
intermediária ou mínima, foram sumariados em Cass e colaboradores (2007).
73
Considerações Iniciais
Dissertação de Mestrado
IPSE/alfa-1 (ou ainda Sm-p25)
É o antígeno de maior abundância relativa no secretoma do ovo (Cass et al.
2007). Inicialmente chamado de alfa-1 (Dunne et al. 1991), esse antígeno é idêntico
ao princípio indutor de IL-4 dos ovos de S. mansoni (IPSE, do inglês IL-4-inducing
principle of S. mansoni eggs) (Schramm et al. 2006) e ao antígeno Sm-p25
(Schramm et al. 2003). Esse antígeno é uma glicoproteína estádio-específica de 20
kDa, que forma um homodímero de 40 kDa com capacidade de estimular a
desgranulação de basófilos e a liberação de IL-4 (Schramm et al. 2003, 2006). Essa
interleucina atua na proliferação de células T e na mudança de fenótipo da resposta
imunológica para Th-2, bem como na proliferação de mastócitos, megariócitos e
precursores eritróides; além de estimular a secreção de anticorpos por linfócitos B
(troca de isotipo para IgE) (Abbas e Lichtman 2005). A localização de IPSE/alfa-1 se
restringe à área subjacente a casca, presumivelmente nos envoltórios interno
(envoltório de von Lichtenberg) e externo (camada de Reynolds) do embrião maduro,
e no entorno dos ovos, bem como em algumas células da camada central do
granuloma (Schramm et al. 2006).
Ômega-1
Segundo antígeno em abundância relativa no secretoma do ovo (Cass et al.
2007), o antígeno ômega-1 foi primeiramente caracterizado por Dunne e
colaboradores (1991) como uma glicoproteína monomérica estádio-específica, de 31
kDa e pI maior que 9,0. Esse antígeno é uma ribonuclease funcional, com atividade
hepatotóxica (Dunne et al. 1991; Fitzsimmons et al. 2005). Não há ainda dados
disponíveis sobre a sua localização e produção durante o desenvolvimento do ovo e
a granulomatogênese.
Sm-p40 e proteínas de choque térmico (HSPs)
Outro antígeno de grande abundância relativa no secretoma do ovo (Cass et
al. 2007), a proteína de 40 kDa do S. mansoni (Sm-p40) foi primeiramente
identificada por Nene e colaboradores (1986) em ovos e miracídios. A sua sequência
de 354 resíduos de aminoácidos compartilha homologia com a família de αcristalinas e de proteínas de choque térmico (HSPs) (Nene et al. 1986; Cass et al.
2007). As α-cristalinas podem atuar como chaperonas para outros antígenos do ovo
durante a migração tecidual, prevenindo a agregação de proteínas e facilitando a
sua montagem (Nene et al. 1986; Horwitz et al. 1992). É possível também que esse
antígeno possa de alguma forma proteger o ovo dentro do ambiente oxidativo do
74
Considerações Iniciais
Dissertação de Mestrado
granuloma (Cass et al. 2007). Nas cepas murinas H-2k, C3H e CBA (formadoras de
granulomas grandes), o antígeno Sm-p40 causa uma forte resposta celular Th
CD4+; em contraste, evoca respostas muito mais fracas na cepa BL/6, que forma
granulomas consideravelmente menores (Fanning et al. 1981; Cheever et al. 1987;
Hernandez et al. 1997a, b; Stadecker e Hernandez 1998; Stadecker et al. 2001). Em
humanos, o Sm-p40 também é imunogênico (Stadecker 1999a). Isso implica que a
origem genética do hospedeiro possivelmente modula a intensidade da inflamação
granulomatosa e sugere que o reconhecimento diferencial dos antígenos pode ser
um dos fatores determinantes (Stadecker e Hernandez 1998; Stadecker et al. 2001).
Ao contrário do SEA total não-fracionado, que polariza uma resposta imunológica
para o fenótipo Th-2 (Pearce et al. 1991), o antígeno Sm-p40 possui um epítopo
imunodominante de célula T que evoca uma resposta fortemente inclinada ao
fenótipo Th-1 e pelo menos outros dois epítopos subdominantes (Cai et al. 1996;
Hernandez et al. 1998; Chen e Boros 1998; Hernandez e Stadecker 1999). Embora
um anticorpo monoclonal anti-Sm-p40 já tenha sido desenvolvido (Hernandez et al.
1998; Abouel-Nour et al. 2006), não há ainda dados disponíveis sobre a localização
e produção desse antígeno durante o desenvolvimento do ovo e a formação de
granulomas.
Proteínas de choque térmico, como HSP86/90, -70, -60, -40 e -10, também
foram identificadas no secretoma do ovo (Cass et al. 2007). Em geral, essa classe de
proteínas está envolvida em respostas a condições de estresse, como no aumento de
temperatura. As HSP estão entre as proteínas celulares mais prolíficas, presentes
de bactérias até humanos. De fato, a proteína HSP86/90 foi primeiramente
identificada por Johnson e colaboradores (1989) em vermes adultos, sendo
homóloga à HSP90 de Saccharomyces cerevisae e à HSP83 de Drosophila
melanogaster (Johnson et al. 1989). Por sua vez, anticorpos específicos anti-HSP70
de S. mansoni foram utilizados para detectar infecções crônicas em humanos.
Entretanto, foram observadas reações cruzadas contra indivíduos com filaríase ou
malária. Soros de pacientes infectados com S. haematobium também reconheceram
a HSP70 de S. mansoni; o mesmo não aconteceu com soro de pacientes infectados
com S. japonicum (Moser et al. 1990). Já a proteína HSP60 foi previamente
identificada em cercárias, vermes adultos e esporocistos. Um anticorpo monoclonal
anti-HSP60 de S. mansoni também foi produzido (Tielens et al. 1993). Embora
anticorpos
contra
esses
antígenos
tenham
sido
desenvolvidos
ou
estejam
disponíveis comercialmente, ainda não há informações sobre a localização e síntese
dessas proteínas durante o desenvolvimento do ovo e a granulomatogênese. Dados
adicionais sobre as HSP40 e -10 de S. mansoni são ainda necessários.
75
Considerações Iniciais
Dissertação de Mestrado
Niemann-Pick tipo C2 (NPC2)
Pela primeira vez identificada em secreções parasitárias e em Schistosoma
(Cass et al. 2007), essa pequena e ubíqua proteína intra-lisossomal é essencial ao
tráfego de colesterol, via compartimentos endossomais/lisossomais (Vanier e Millat
2004; Cheruku et al. 2006). As NPC2 de S. mansoni e humana compartilham 37%
de identidade e 55% de similaridade (Cass et al. 2007), bem como os resíduos de
aminoácidos Phe-66, Val-96 e Tyr-100 essenciais para a ligação com o colesterol
(Ko et al. 2003; Cass et al. 2007). Essencial para o funcionamento da NPC2
humana, um sítio de N-glicosilação foi predito na NPC2 de S. mansoni (Cass et al.
2007). O papel da NPC2 nos ovos precisa ser avaliado, mas é possível que ela esteja
envolvida na absorção de colesterol, bem como de outros glicolipídeos. A NPC2 de S.
mansoni pode ainda participar na permuta de moléculas imunomodulatórias com o
hospedeiro (Cass et al. 2007). Por exemplo, Sprong e colaboradores (2006)
observaram
que
glicoproteínas
circulantes
de
S.
mansoni
em
partículas
lipoprotéicas de baixa-densidade do hospedeiro rompem com homeostasia de
lipídeos nas células imunológicas, induzindo apoptose.
Frutose-1,6-bisfosfato aldolase
Identificada no secretoma do ovo (Cass et al. 2007), essa enzima da cascata
glicolítica foi primeiramente clonada e caracterizada por El-Dabaa e colaboradores
(1998). Composta por 363 resíduos de aminoácidos, essa proteína apresenta 66% e
65% de identidade com as isoenzimas humanas C e A, respectivamente. Entretanto,
ensaios de ativação e ligação ao substrato sugerem que esse antígeno assemelha-se
a aldolase tipo A. Usando anticorpos contra a enzima recombinante purificada, uma
banda de 40 kDa foi reconhecida em extratos de cercárias, de esquistossômulos
(cinco e 25 dias), de vermes adultos e de ovos. Em vermes adultos, sua localização é
tegumentar (El-Dabaa et al. 1998). Não foram realizadas imunolocalizações nas
outras fases do ciclo.
Peptidilglicina alfa hidroxilante mono-oxigenase (SmPHM)
A
SmPHM
foi
primeiramente
clonada
e
caracterizada
por
Mair
e
colaboradores (2004). Essa enzima é fundamental para a conversão de um peptídeo
intermediário glicina-estendido em um produto aminado na extremidade Cterminal. A SmPHM foi localizada por todo o sistema nervoso dos vermes adultos,
na massa nervosa anterior, nos cordões nervosos longitudinais dorsais e nas
comissuras transversais interconectantes. Nos machos, a SmPHM foi identificada
nos plexos nervosos subtegumentares e dentro dos tubérculos. Já nas fêmeas, a
76
Considerações Iniciais
Dissertação de Mestrado
SmPHM também estava presente nas células nervosas e fibras do oótipo.
Ultraestruturalmente, a SmPHM se localiza na rede-trans do complexo de Golgi e
em vesículas secretoras dos nervos centrais e periféricos de ambos os vermes. A
ampla presença dessa enzima confirma o importante papel dos neuropeptídeos
aminados nos esquistossomos, como os peptídeos FMRFamida-relacionados
(FaRPs) e os neuropeptídeos Fs (NPFs) que terminam com uma fenilalanina-amida
(Day e Maule 1999; Mair et al. 2004). Nos ovos, a SmPHM foi identificada no
secretoma e localizada na superfície externa da casca, via reação de precipitação ao
redor do ovo (COPT; do inglês, circumoval precipitin reactions) (Cass et al. 2007).
Glutationa S-transferase de 26 kDa (SmGST-26)
Também
identificada
no
secretoma
do
ovo
com
uma
abundância
relativamente alta (Cass et al. 2007), essa proteína antioxidante foi clonada em
vermes adultos por Trottein e colaboradores (1990) e Henkle e colaboradores (1990).
Sua sequência predita de resíduos de aminoácidos mostrou forte homologia com
GST-26 de S. japonicum (SjGST-26) e um menor nível de homologia com as
isoenzimas GST de classe µ dos mamíferos. Além disso, não foi constatada
homologia significante com a SmGST-28. Ultraestruturalmente, a SmGST-26 foi
identificada no tegumento e em células parênquimais subepidérmicas, da mesma
forma que SmGST-28. Por sua vez, apenas SmGST-26 é encontrada nas digitações
citoplasmáticas da câmara apical delineada pelo corpo celular dos protonefrídeos,
sugerindo que esse antígeno seja ativamente excretado pelos vermes adultos
(Trottein et al. 1990). Cass e colaboradores (2007) localizaram essa proteína ao
redor do ovo, via COPT. Dados adicionais sobre a localização e síntese dessa e
outras GSTs durante o desenvolvimento do ovo e a granulomatogênese são
necessários.
Fosfoenolpiruvato carboxiquinase-GTP (SmPEPCK)
Essa enzima da cascata gliconeogênica e outras três (glicose-6-fosfatase,
frutose-1,6-bisfosfatase e piruvato carboxilase) foram detectadas em homogenatos
de vermes adultos por Tielens e colaboradores (1991). Em condições anaeróbicas,
esporocistos de S. mansoni produzem lactato e uma ampla quantidade de sucinato,
via atividade da SmPEPCK. Na presença de oxigênio, esse estádio larval deriva a
maior parte de sua energia a partir da degradação aeróbica de glicose a dióxido de
carbono (Tielens et al. 1992). Ainda em esporocistos, essa enzima participa na
gliceroneogênese (produção de glicerol a partir de precursores, como a glutamina)
(Khayath et al. 2006). Também identificada no secretoma do ovo (Cass et al. 2007),
77
Considerações Iniciais
Dissertação de Mestrado
essa enzima de 62 kDa possui uma forte ação estimulatória na proliferação de
células T CD4+ de camundongos C57BL/6 infectados (Asahi et al. 1999). Por sua
vez, embora uma SmPEPCK recombinante de 626 resíduos de aminoácidos também
evoque uma forte resposta proliferativa de células Th CD4+ em camundongos
C57BL/6, CBA e BALB/c, a resposta imunológica é polarizada para o fenótipo Th-1,
com significante produção de INF-gama e, em dimensão, de IL-2 e IL-5. Um epítopo
de célula T, de doze aminoácidos (DKSKDPKAHPNS), foi demonstrado na região dos
resíduos 398 a 409 (Asahi et al. 2000). Não há ainda informações sobre a
localização
desse
antígeno
durante
o
desenvolvimento
do
ovo
e
a
granulomatogênese.
Tioredoxina peroxidase 1/Peroxiredoxina 1 (SmTPx-1/SmPrx-1)
Membro de uma ampla e ubíqua família de proteínas antioxidantes,
conhecidas como peroxiredoxinas, essa enzima de 26 kDa foi primeiramente
identificada por Kwatia e colaboradores (2000) em vermes machos e fêmeas. Já
Williams e colaboradores (2001) apontaram sua presença no envoltório interno
(envoltório de von Lichtenberg) de ovos maduros, bem como sua secreção para o
meio periovular (confirmado por Cass et al. 2007). Essa enzima consiste de 185
resíduos de aminoácidos, com dois resíduos de cisteína (48 e 169) funcionais
(Kwatia et al. 2000). A SmTPx-1/SmPrx-1 estimula a proliferação significativa de
células T CD4(+) em camundongos C57BL/6 e CBA com oito semanas e meia de
infecção, além de uma produção mista de citocinas dos tipos Th-1 e Th-2. A
produção de anticorpos mais significante ocorre após o início da oviposição
(Williams et al. 2001). No miracídio, a SmTPx-1/SmPrx-1 e outra peroxiredoxina
(SmTPx-2/SmPrx-2) são encontradas na papila apical (ou terebratório); nos
esporocistos, elas são localizadas no tegumento sincicial e liberadas com as
proteínas secretadas/excretadas durante a transformação da larva em cultura,
sugerindo sua participação antioxidante também na fase intra-molusco (Vermeire e
Yoshino 2007).
Tioredoxina glutationa reductase (SmTGR)
Essa enzima antioxidante multifuncional possui uma abundância relativa
intermediária no secretoma ovo (Cass et al. 2007), mas será abordada devido a sua
destacada posição como novo alvo quimioterapêutico (Sayed et al. 2008).
Primeiramente identificada por Alger e Williams (2002) em vermes adultos, a
SmTGR é a principal responsável pelas atividades tioredoxina redutase, glutationa
redutase e glutaredoxina do sistema antioxidante dessa fase do ciclo. A inibição
78
Considerações Iniciais
Dissertação de Mestrado
dessa enzima por tecnologia de RNA de interferência provocou uma diminuição
substancial da taxa de sobrevivência de esquistossômulos incubados em condições
aeróbicas ou anaeróbicas, após quatro dias de tratamento (Kuntz et al. 2007). Uma
avaliação quantitativa automatizada de alta produção (do inglês, automated
quantitative high-throughput; qHTS) analisou a atividade de 71.028 compostos como
potenciais inibidores da SmTGR e identificou diversas séries promissoras de amidas
fosfínicas
e
2-óxido
oxidiazóis
(Simeonov
et
al.
2008).
O
tratamento
de
camundongos (por cinco dias consecutivos, com injeção intraperitoneal de 10
mg/kg) em diferentes tempos de infecção (com início após 1, 23 e 37 dias de
infecção) com o composto 4-fenil-1,2,5-oxadiazol-3-carbonitrila-2-óxido causou
acentuada redução na carga parasitária, indicando que tal droga é eficaz contra a
fase dérmica, pulmonar e adulta do parasito. Macroscopicamente, o número de
granulomas hepáticos foi consideravelmente menor do que nas infecções controles
(Sayed et al. 2008). Não há ainda informações sobre a localização desse promissor
antígeno durante o desenvolvimento do ovo e a granulomatogênese.
I. 2. 8 – Morfologia do miracídio de Schistosoma mansoni
Ao atingirem uma massa de água em condições adequadas de luminosidade,
salinidade, temperatura e pH, os ovos maduros eclodem rapidamente e liberam
uma forma larvar ciliada, chamada miracídio (revisto por Coelho et al. 2008). O
miracídio é o primeiro estádio infectivo (de caramujos) do complexo ciclo de vida do
S. mansoni. A eclosão é possivelmente iniciada pela ativação de uma leucina
aminopeptidase específica (Xu e Dresden 1986), em baixos níveis de salinidade
(Donnelly et al. 1984). Na água, os miracídios passam a realizar rápidos
movimentos no interior do ovo, até provocarem a ruptura de sua casca, que
geralmente ocorre em sentido transversal (Kusel 1970). Recém liberado, os
miracídios nadam em direção à luz através da agitação coordenada de seus cílios,
devendo encontrar rapidamente o seu hospedeiro invertebrado suscetível para dar
continuidade ao seu ciclo biológico. Os mecanismos de localização, reconhecimento
e penetração nesses hospedeiros foram recentemente revistos por Coelho e
colaboradores (2008) e não serão abordados nessa seção.
A morfologia do miracídio de S. mansoni foi alvo de dois extensos trabalhos.
Ottolina (1957) realizou a primeira descrição da anatomia, citologia e fisiologia
desse estádio larval por microscopia de campo claro. Mais tarde, Pan (1980)
revelou, por microscopia eletrônica de transmissão, delicados detalhes desses
79
Considerações Iniciais
Dissertação de Mestrado
componentes celulares (Fig. 1.20). O conhecimento minucioso das estruturas e
sistemas de órgãos dessa larva é imprescindível para fundamentar a descrição da
embriogênese dos ovos, já que o miracídio é a forma final da primeira etapa de
desenvolvimento do ciclo de vida desse parasito. Suas estruturas e respectivas
localizações servem como referência para a descrição dos eventos morfogenéticos
que ocorrem no embrião em desenvolvimento. A seguir, portanto, uma breve
descrição do miracídio será apresentada.
O miracídio tem forma ligeiramente cilíndrico-cônica e cerca de 180 µm de
comprimento por 60 µm de diâmetro (Ottolina 1957). Células epidérmicas ciliadas,
arranjadas em placas dérmicas, permitem o movimento natatório, através de seus
batimentos ciliares sincronizados. As células da epiderme formam um delgado
sincício, com núcleos redondos proeminentes e intensamente basófilos, e uma
conspícua membrana basal separa as células da epiderme da dupla camada
muscular subjacente.
Na extremidade anterior, encontra-se o terebratório ou papila apical, por
onde perpassam e terminam os ductos das duas glândulas laterais – também
conhecidas como glândulas de adesão – e o ducto da glândula apical ou glândula de
penetração. Antigamente, a glândula de penetração era confundida com um tubo
digestório primitivo ou saco digestório (Ottolina 1957). De fato, o tubo digestório
primitivo está ausente nesse estádio larval (Pan 1980). No terebratório, há um
conjunto de cílios maiores e espículos anteriores, provavelmente relacionados com o
processo de penetração nos moluscos, bem como terminações nervosas, com
funções tácteis e sensoriais (Pan 1980). O sistema excretor é formado por quatro
células-flama e seus ductos coletores, que são drenados para uma ampola excretora
que se abre em um poro excretor. O sistema nervoso consiste de uma massa
esferóide central, com núcleos neuronais perifericamente localizados e envolvendo
numerosos axônios e dendritos (neurópilo). Os núcleos são irregulares, ligeiramente
ovais e achatados, contendo um pequeno nucléolo evidente. Por meio de cordões
nervosos, formados por células bipolares, há a comunicação com células nervosas
periféricas, que regem a contratilidade e mobilidade do miracídio, ao comandar a
camada muscular subepitelial (Pan 1980). Cerca de 20 células intersticiais
preenchem os espaços intercelulares e aparentemente atuam no armazenamento de
energia. Células germinativas, também em número aproximado de 20, darão
continuidade ao ciclo no hospedeiro invertebrado. Tais células contêm um grande
núcleo pobre em heterocromatina e um proeminente nucléolo, citoplasma granular
escasso repleto com numerosos ribossomos, diversas pequenas mitocôndrias e
80
Considerações Iniciais
Dissertação de Mestrado
poucos retículos endoplasmático rugoso e partículas β de glicogênio (Pan 1980,
1996).
Uma vez que o miracídio penetra no caramujo, ele sofre uma profunda
reorganização morfológica e fisiológica para desenvolver-se e multiplicar-se
assexuadamente (Pan 1996). Ao final da segunda etapa de desenvolvimento do ciclo
(revisto por Coelho et al. 2008), um outro estádio infectivo, chamado cercária, é
liberado no meio aquático. As cercarias devem localizar, aderir e penetrar na pele
ou na mucosa de mamíferos suscetíveis para dar continuidade ao ciclo de vida
desse parasito (revisto por Lenzi et al. 2008a).
Figura 1.20. Miracídio de Schistosoma mansoni por microscopia confocal de
varredura a laser (CLSM). Plano intermediário. GA, glândula apical; mn, massa nervosa; cg,
células germinativas; Ep, epiderme; c, cílios. As glândulas laterais e o terebratório não foram
visualizados nesse plano focal. Coloração por carmim clorídrico. Fonte: Jurberg AD,
Gonçalves T, Costa TA, Mattos ACA, Pascarelli BM, Manso PPA, Ribeiro-Alves M, PelajoMachado M, Coelho PMZ, Lenzi HL, manuscrito em preparação (artigo 2 dessa dissertação).
81
Objetivos
Dissertação de Mestrado
II – Objetivos
82
Objetivos
Dissertação de Mestrado
II – Objetivos
II. 1 – Objetivo Geral
Detalhar morfologicamente e classificar o desenvolvimento embrionário do
ovo de S. mansoni, segundo critérios morfológicos e morfogenéticos.
II. 2 – Metas
1. Descrever a embriogênese do ovo no interior da fêmea, através de análise
histológica convencional ao microscópio de campo claro e de análise de fêmeas
inteiras coradas com carmim clorídrico ao microscópio confocal de varredura a
laser;
2. Documentar e classificar a embriogênese miracidiana de S. mansoni no
hospedeiro experimental murino e em condições in vitro, a partir de critérios
morfológicos e morfogenéticos, através de cortes histológicos e da análise de ovos
inteiros;
3. Detalhar a diferenciação e formação dos sistemas nervoso, muscular,
tegumentar e osmorregulatório do miracídio em desenvolvimento, por histologia
convencional (com colorações específicas e seletivas), por microscopia confocal de
ovos inteiros corados com carmim clorídrico.
83
Justificativa
Dissertação de Mestrado
III – Justificativa
84
Justificativa
Dissertação de Mestrado
III – Justificativa
Com base na fundamentação teórica, o estudo detalhado da biologia do
desenvolvimento dos ovos de S. mansoni poderá contribuir para: 1) uma melhor
intelecção da granulomatogênese e da patogenia resultante; 2) a compreensão dos
mecanismos de expulsão dos ovos do sistema vascular para os tecidos, bem como a
passagem pela parede intestinal para o lúmen do órgão; 3) o entendimento dos
processos básicos do desenvolvimento, como a determinação dos eixos corporais e a
organogênese, visto que muitos dos mecanismos moleculares e suas cascatas de
regulação são compartilhados por todos os organismos conhecidos atualmente
(revisto por Rudel e Sommer 2003); 4) uma melhor compreensão das relações
filogenéticas dos platielmintos; 5) o refinamento de estudos moleculares (genômica,
transcriptômica, glicômica, lipidômica e outros) ao considerar os diferentes estádios
da embriogênese do ovo; 6) a criação de linhagens transgênicas ou nocaute para
genes específicos, e; 7) o desenvolvimento de novas estratégias quimioterapêuticas,
a partir do descobrimento de novos alvos para tratamento.
85
Artigos
Dissertação de Mestrado
IV – Artigos
86
Artigo 1
Jurberg et al. – Development, Genes and Evolution
Trematode embryology: a new method for
whole-egg analysis by confocal microscopy
Arnon D Jurberg, Bernardo M Pascarelli, Marcelo Pelajo-Machado,
Arnaldo Maldonado Jr., Ester M Mota, Henrique L Lenzi
Publicado no periódico Development, Genes and Evolution 2008;218:267-271.
Estado do conhecimento
A
embriogênese
de
trematódeos
tem
sido
ainda
pouco
explorada,
principalmente devido às dificuldades técnicas para analisar seus ovos (ver, p.ex.,
Neill et al. 1988). A grande presença de células vitelínicas ao redor do
zigoto/embrião torna árdua a visualização dos estádios iniciais do desenvolvimento
em ovos vivos ou em preparações inteiras. A casca do ovo por si só também impede
a impregnação adequada de resinas para a realização de estudos histológicos,
imuno-histoquímicos e ultra-estruturais. A proposta dessa nota técnica é divulgar
uma nova ferramenta para a análise de ovos inteiros de trematódeos (no caso,
Schistosoma mansoni e Echinostoma paraensei), a partir da modificação de uma
coloração amplamente utilizada no estudo morfológico de “helmintos” adultos
inteiros.
Questão
- É possível visualizar o desenvolvimento embrionário de ovos inteiros de S.
mansoni e E. paraensei, a partir de uma coloração (carmim clorídrico) que fluoresce
ao microscópio confocal de varredura a laser (CLSM)?
- É possível reduzir a autofluorescência da casca dos ovos com a realização
de uma etapa de clareamento em hidróxido de potássio (KOH)?
Resultados principais
Essa técnica de coloração ao CLSM mostrou-se promissora no estudo da
embriogênese dos ovos de trematódeos, destacando eventos morfológicos não
distinguíveis à microscopia de campo claro. A incubação em KOH não causou os
efeitos esperados de redução da autofluorescência da casca. Ao contrário, causou
uma redução da fluorescência da coloração quando observada ao CLSM.
87
Artigo 1
Jurberg et al. – Development, Genes and Evolution
88
Artigo 1
Jurberg et al. – Development, Genes and Evolution
89
Artigo 1
Jurberg et al. – Development, Genes and Evolution
90
Artigo 1
Jurberg et al. – Development, Genes and Evolution
91
Artigo 1
Jurberg et al. – Development, Genes and Evolution
92
Artigo 2
Jurberg et al. – Development, Genes and Evolution
The embryonic development of the parasite
trematode Schistosoma mansoni
Arnon D Jurberg, Tiana Gonçalves, Tatiane A Costa, Ana Carolina A de
Mattos, Bernardo M Pascarelli, Marcelo Ribeiro-Alves, Pedro Paulo de A
Manso, Marcelo Pelajo-Machado, Paulo Marcos Z Coelho, Henrique L Lenzi
Em preparação para o periódico Development, Genes and Evolution
Estado do conhecimento
Apesar da sua destacada importância na infecção esquistossomótica, a
biologia dos ovos tem sido considerada apenas superficialmente. Classicamente, o
amadurecimento dos ovos é classificado a partir da simples relação entre os
tamanhos do embrião e o da casca (Vogel 1942; Prata 1957). Pouco se sabe sobre os
eventos morfológicos, moleculares e bioquímicos durante a sua embriogênese.
Questão
- Como ocorre o desenvolvimento embrionário dos ovos de S. mansoni?
Resultados principais
Nesse
trabalho,
descrevemos
os
eventos
morfológicos
durante
a
embriogênese dos ovos de S. mansoni. A partir dessas características, um novo
sistema de estadiamento é proposto, dividido em dez estádios. Entretanto, como
tais evidências morfológicas são de difícil visualização em ovos inteiros não-corados,
correlacionamos a classificação proposta com aquela de Vogel (1942) e de Prata
(1957).
Comparações
por
modelagem
estatística
e
análise
morfológica
do
desenvolvimento de ovos mantidos em cultura (RPMI-1640) e isolados do
hospedeiro experimental murino sugerem que a embriogênese entre esses dois
grupos é similar (no fenótipo), mas ocorre em ritmos diferentes. O papel da
diferenciação das estruturas embrionárias na formação de granulomas é discutido.
93
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Title page:
Authors: Arnon D Jurberg, Tiana Gonçalves, Tatiane A Costa, Ana Carolina A de Mattos1,
Bernardo M Pascarelli, Pedro Paulo de A Manso, Marcelo Ribeiro-Alves2, Marcelo PelajoMachado, Paulo Marcos Z Coelho1, Henrique L Lenzi
Title: The embryonic development of the parasite trematode Schistosoma mansoni
Institutional Affiliation: Laboratório de Patologia – Instituto Oswaldo Cruz (IOC)/Fundação
Oswaldo Cruz (Fiocruz). Pavilhão Gomes de Faria. Av. Brasil, 4365 – Manguinhos. CEP:
21040-900. Rio de Janeiro, RJ. Brazil. 1Laboratório de Esquistossomose – Instituto René
Rachou (CPqRR)/Fiocruz. 2Centro de Desenvolvimento Tecnológico em Saúde
(CDTS)/Fiocruz.
Communicating author: Henrique L Lenzi
E-mail address: [email protected]
Telephone: 55 21 2598-4350
Fax number: 55 21 2573-8673
Number of words: 14,067
Expected printed length: ±25 pages
94
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Abstract
Schistosomiasis is a water-borne parasitic illness caused by neoophoran trematodes of the
genus Schistosoma. Besides its importance in schistosome’s life cycle, eggs have a central
role in the pathogenesis of the disease by inducing granuloma formation. Using classical
histological techniques and whole-mount preparations, the present work describes the
embryonic development of Schistosoma mansoni eggs in the murine host and compares it
with egg maintained under in vitro conditions (RPMI-1640 medium). Two pre-embryonic
stages occur inside the female worm: the pre-zygotic stage is characterized by the release of
mature oocyte from the female ovary until its fecundation. The zygotic stage encompass the
migration of the zygote to the ootype, where the eggshell is formed, and then to the uterus.
Fully formed eggs are laid still undeveloped, without suffering any cleavage. In the outside
environment, eight embryonic stages can be defined: stage 1 refers to early cleavages and the
beginning of yolk fusion. Stage 2 represents late cleavage, with the formation of a
stereoblastula and the onset of outer envelope differentiation. Stage 3 is defined by the
elongation of the embryonic primordium and the onset of inner envelope formation. In stage
4, the first organ primordia arise. During stages 5-7, tissue and organ differentiation occur
(neural mass, epidermis, terebratorium, musculature, and miracidial glands). Stage 7 is
characterized by nuclear condensation of brain neurons. Stage 8 refers to the fully formed
larva, presenting muscular contraction, cilia and flame-cell beating. This staging system was
compared to a previous classification, which considers only the simple relation of
embryo/eggshell sizes. The differentiation of embryonic structures and their probable roles in
granulomatogenesis receive particular attention. The staging system proposed here could
underlie further studies on egg antigen production and its diffusion in the host tissue.
95
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Introduction
Schistosomiasis is a general denomination to human infections caused by trematode worms of
the genus Schistosoma. One of the main etiological agents of this disease is the species S.
mansoni, which remains endemic in sub-Saharan Africa, Brazil, Egypt, and others countries
(Chitsulo et al. 2000; WHO 2006). To humans, infection may be a debilitating illness
affecting liver function and the kidney. Periportal fibrosis, portal hypertension, and
esophageal varices may cause death. Unlike other platyhelminths, schistosomes have separate
sexes and reside as couples for years in the portal hepatic system of the susceptible vertebrate
host (including other mammals than humans).
Among other parasitic worms, schistosomes arise as an exciting field of study for a
multidisciplinary approach to parasitologists and developmental biologists. Eggs mature in the
host tissues prior to be expelled into the gut lumen with the feces, but are also the major cause
of illness. In brief, inside the host vasculature, each inseminated female adult worms release
approximately 300 eggs/day (Moore & Sandground 1956; Pellegrino & Coelho 1978). When
feces with eggs reach freshwater, a ciliated larva hatches. This so-called miracidium has to
localize and penetrate a snail intermediate host of the genus Biomphalaria. Within the
molluscan host, some cycles of asexual reproduction drive to the emergence of cercaria, the
infecting form to humans. Cercariae actively swim towards the susceptible hosts and penetrate
the skin, where a second set of morphological changes (with no reproduction) will originate
the adult worms. However, about half of the laid eggs lodge in smaller blood vessels as liver
sinusoids, and intestinal capillaries, where they act as granulomatogenic triggers (Warren
1978). Schistosome granulomatous response is an organized complex focal inflammatory
reaction around the egg. This reaction is characterized of a set of cells of the mononuclear
phagocyte lineage to protect the host tissues from egg secretions, collectively known as
soluble egg antigens (SEA) (Reis & Andrade 1987; Turk 1992; Lenzi et al. 1998).
96
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Granuloma formation is strictly dependent of viable mature eggs (Sorour 1929; Espin 1941),
not occurring around single immature eggs (Prata 1957). Recently, Ashton et al. (2001)
suggested that the secretion of egg proteins (ESP) to periovular tissues may be related to the
formation of eggshell underlying structures during schistosome egg maturation. These
structures are known as the Reynold’s layer and the von Lichtenberg’s envelope (Neill et al.
1988). However, as stated by Swiderski (1994), the use of such distinct terminology is not
justified since these envelopes share ontogenetic, structural, and functional similarities to
other platyhelminth eggs (for example, cestodes). Further references to the schistosome
eggshell structures in this paper will consider their positions within the egg. The Reynolds’
layer will be referred as the “outer envelope” and the von Lichtenberg’s envelope as the
“inner envelope”.
Despite its importance in pathogenesis and life cycle continuity, egg embryogenesis has been
superficially considered, probably because of technical limitations. Although the eggshell is
transparent, structural details of the embryonic development are not easily followed in the
live, isolated eggs due to the great amount of yolk material at early stages (Jurberg et al.
2008b). The eggshell is also relatively impermeable to some embedding resins, which leads to
ultrastructural observations restricted only to the surrounding envelopes and to brief notes of
embryo internal structures in abstracts (von Lichtenberg 1967; Stenger et al. 1967; Michaels
& Prata 1968; Race et al. 1969; Race et al. 1971; Eklu-Natey et al. 1982; Swiderski et al.
1982; Swiderski 1984, 1985, 1986a, b; Neill et al. 1988; Ashton et al. 2001; Swiderski 1994).
No information on miracidial organogenesis is available so far.
Classically, maturation of schistosome eggs was first classified into five stages based on a
simple relation between the embryo size itself and the eggshell size (Vogel 1942; Prata 1957).
Here, Vogel and Prata’s staging system will be referred in roman numerals: stage I, embryo
97
Artigo 2
Jurberg et al. – Development, Genes and Evolution
occupies one-third of the diameter of the egg; stage II egg, embryo occupies one-half of the
diameter of the egg; stage III, embryo has two-thirds of the length of the egg; stage IV,
embryo almost occupies the entire interior of the egg; stage V corresponds to the mature
embryo, presenting cell-flame and cilia beating, and muscle contraction. Pellegrino´s group
adapted this staging system to the “oogram” technique by calculating each stage frequency in
compressed fragments of intestine as a reliable criterion for the primary screening of
schistosomicidal drugs (Pellegrino et al. 1962; Cunha et al. 1962; Pellegrino & Faria 1965).
Recently, Hartenstein & Ehlers (2000) introduced a different staging system for the freeliving rhabdocoel Mesostoma lingua. This system considers morphological events during its
embryogenesis and has shown to be applicable for other free-living flatworms (Hartenstein &
Ehlers 2000; Younossi-Hartenstein et al. 2000; Younossi-Hartenstein & Hartenstein 2000b,
2001; Ramachandra et al. 2002; Hartenstein & Jones 2003; Morris et al. 2004; Cardona et al.
2005, 2006). Briefly, stage 1 refers to early cleavages, during which the zygote divides
basically in a spiral pattern. Stage 2 represents late cleavage, in which a proliferating mass
(the embryonic primordium) is formed. Stage 3 is defined by the expansion and
diversification of the embryonic primordium. In the stage 4 some embryonic primordia can be
distinguished. Stage 5 is characterized by the onset of tissue and organ differentiation. In the
stage 6 occurs the complete formation of the epidermis. During stage 7 occurs the elongation
of the embryo. The neural mass primordium condenses. Finally, stage 8 refers to the fully
formed mature larva.
In the present paper, we describe the morphological events during S. mansoni egg
embryogenesis by using histological and whole-mount techniques. Since S. mansoni mature
larvae (miracidia) have no eyespots and digestive system (Pan 1980), morphological
hallmarks have been determined by analyzing whole-mount miracidia prior to study egg
98
Artigo 2
Jurberg et al. – Development, Genes and Evolution
development. Then, a new staging system (in arabic numerals) is proposed and then further
correlated to the previous existing one by Vogel (1942) and Prata (1957) (stages in roman
numerals). Egg development under in vitro conditions was also evaluated considering this
new staging system.
Materials and Methods
Parasites
Five-day old Swiss Webster mice were exposed to 70 or 150 cercariae of S. mansoni (LE
strain) and euthanatized in a CO2 chamber at 45-60 days after infection, in accordance to the
Ethical Committee for Animal Use-Fiocruz (CEUA L-0013/07). Adult worms were recovered
by direct incisions of the portal hepatic intestinal system or by perfusion (Smithers & Terry
1965), using RPMI-1640 plus heparin as the perfusing fluid (Kusel et al. 2006). Miracidia
were obtained from blended livers by using a modified hatching method as described
previously (Jurberg et al. 2008a). Eggs were isolated by sieving homogenized intestines
(Dresden & Payne 1981) followed by purification through a Percoll gradient (Dalton et al.
1997).
Histology
Intestines and livers from infected mice were fixed in Carson’s modified Millonig’s
phosphate-buffered formalin (Carson et al. 1973), pH 7.4, and embedded in paraffin.
Recovered female worms fixed in a 70% alcohol-formalin-acetic acid solution (AFA) and
embedded in paraffin were also processed as follows. Serial sections of 5 μm were stained by
the following methods for bright field microscopy (BM): hematoxylin and eosin (H&E) and
Lennert’s Giemsa (Lennert 1978) for cellular characterization, periodic acid-Schiff counter99
Artigo 2
Jurberg et al. – Development, Genes and Evolution
stained with hematoxylin (PASH) for neutral polysaccharides and glycoproteins (Lillie &
Fullmer 1976), PAS-Alcian Blue pH 1.0 (PAS-AB) to differentiate between neutral and acidic
mucosubstances, and Masson trichrome for collagen and smooth muscle (Bancroft & Stevens
1996).
In vitro attainment of eggs
To compare the maturation of eggs laid in vitro and eggs isolated from the murine host (as
described above), adult worms were recovered by perfusion, and washed in RPMI-1640 with
no serum supplements. They were then maintained in RPMI-1640 containing penicillin (100
U/ml) and streptomycin (100 μg/ml), and 5% bovine fetal serum at 37° C in 5% CO2 (Kusel
et al. 2006). The medium was changed every two days. At these conditions, worm couples lay
eggs continuously for several days. Development was followed every day under an inverted
microscope, until the complete formation of the miracidium. Miracidium maturity was
inferred by movements inside the eggshell, muscle contractions and flame-cell beating (Vogel
and Prata’s stage V). Other cultivated eggs in different times of maturation were fixed in
Carson’s Millonig-formalin for whole-egg analysis.
Measurement of egg growth
At each day of incubation, eggs were collected and mounted on regular flat slides using solid
vaseline as spacers. For comparison of egg growth, isolated eggs from the murine host were
also obtained and analyzed. Eggs were classified in accordance to the Vogel and Prata’s
staging system due to the lack of morphological resolution when analyzed as unstained
whole-mounts by BM. As this staging system is based on the ratio of egg size and the embryo
itself, the area of the egg was defined as a simple character to compare the embryonic
development between each stage under these two different conditions (isolated from the host
and cultivated). At random, thirty eggs in each stage of maturation obtained at these two
100
Artigo 2
Jurberg et al. – Development, Genes and Evolution
conditions were measured (length and width) at 100X magnification using the KS300
software 3.0 (Zeiss), totalizing 300 eggs (Table 1).
Statistical analysis
The area A of each egg was estimated by considering its longest length (major axis) and its
longest width (minor axis), in accordance to the area formula of an ellipse: A = (Π * major
axis * minor axis) / 4. An analysis of variance, two-way ANOVA, followed by Tukey's Post
Hoc Test were carried out in the R software (version 2.6.2, available at
http://cran.stat.auckland.ac.nz/) with the following model for the elliptical estimated area of
the egg
Aij = μ + Ci + Sj + (CS) ij + εij
(1)
where, μ denotes the area global mean, C and S are eggs source and maturation stage main
effects, respectively. Indices i and j stands for the levels of the main effects C (cultivated and
isolated) and S (stages I to V). The term CS captures the interaction effect between egg source
and maturation stage. Two interaction plots were built, one for each main effect. The
nonparallel nature of lines connecting the mean area at levels of one main source hierarchized
by the levels of the other main source suggests interaction (see Supplementary Materials). The
residual ε term accounts for sources of area variation not incorporated in the model. It is
expected to have mean 0 and variance sigma square, ε ~ Ν (0, δ²), for well fitted models.
Modeling assumptions were confirmed after the residual diagnostics. Residuals were
evaluated graphically using the Q-Q norm plot of sample quantiles versus the theoretical
quantiles of the normal distribution (see Supplementary Materials), and statistically by the
Shapiro-Wilk Normality test. Statistical significance was set as P ≤ 0.05.
101
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Whole-mount analyses: carmine staining and basic fuchsine staining
Adult female worms, miracidia, and eggs obtained by sieving homogenized intestines or by
culturing worm couples were all stained in hydrochloric carmine for confocal microscopy.
Female worms were fixed in AFA and processed as described by Machado-Silva et al. (1998).
Miracidia and eggs were fixed in Carson’s Millonig-formalin and stained using conical
centrifuge tubes. Staining procedures were modified based on a previous work (Jurberg et al.
2008b). In brief, fixed eggs were stained overnight in carmine under agitation, dehydrated in
graded alcohol series and mounted as whole-preparations in ethylene glycol between
depression slides and coverslips. Tomographic images were obtained by confocal laser
scanning microscopy (CLSM; LSM 510-META, Zeiss), using a HeNe 543nm laser and a LP
560 filter.
Other isolated or cultivated eggs were stained in accordance to a basic fuchsine technique
previous introduced by Zalokar & Erk (1977) and widely used by the Hartenstein group for
studying platyhelminth embryogenesis (Hartenstein & Ehlers 2000; Younossi-Hartenstein et
al. 2000; Younossi-Hartenstein & Hartenstein 2000b, 2001; Hartenstein & Jones 2003; Morris
et al. 2004). Briefly, following fixation in Carson’s Millonig-formalin, eggs were washed
three times in 70% ethanol (5 min each) and in distilled water (5 min). They were incubated
in 2 N HCl (10 min) at 60° C for DNA desnaturation, and washed again in distilled water (5
min). After two washes in 5% acetic acid, eggs were stained for 15 min in a 2% solution of
filtered basic fuchsine in 5% acetic acid. All steps were carried out using conical centrifuge
tubes. Following staining, eggs were placed within a small wire mesh basket for removing
cytoplasmic fuchsine in a 5% acetic acid wash. They were dehydrated in graded ethanol series
(70%, 80%, 90%, 95%, and 100%; 5 min each) and mounted in ethylene glycol on depression
slides. Abnormal and dead (semitransparent, without embryonic disc or granular) eggs were
not examined.
102
Artigo 2
Jurberg et al. – Development, Genes and Evolution
The intestinal scraping technique
This simple technique is based on scraping the mucosal layer by a scalpel. Fragments of 1.0
cm of small intestine from infected mice were collected, opened in full-length and washed in
0.9% saline for removing fecal debris. These fragments were dried on an absorbent paper and
placed between slides and coverslips. Scraping the mucosal layer makes a thinner sample that
can be microscopically examined.
The oogram technique by CLSM
Freshly obtained small intestines were opened lengthwise and brief washed in 0.9% saline for
removing fecal debris. Then, fragments of 0.5 cm were cutted off, slightly dried in absorbent
paper, and maintained strongly pressed between glass slides with rubber bands during fixation
overnight in 70 % alcohol under agitation. Top slides were removed and flattened samples
were stained overnight in carmine under agitation, at room temperature. Intestinal fragments
were dehydrated in graded alcohol series (equal to isolated eggs) and mounted in ethylene
glycol. Examination of the slides was carried out under confocal microscopy with the same
settings cited above for whole-mount eggs.
Results
Miracidium morphology by CLSM
Whole-mounted, carmine stained miracidia were analyzed under CLSM to detail internal
organs as reference to classify the embryonic development of the eggs. Histological sections
of mature eggs in the small intestine were also considered. The following structures were
easily visualized for both methods: (1) neural mass (spherical, with a peripheral layer of onetwo small irregular nuclei circumventing an acellular mass, called neuropile), (2) lateral
glands (a pair, unicellular), (3) apical gland (single, with three nuclei), (4) terebratorium (in
103
Artigo 2
Jurberg et al. – Development, Genes and Evolution
the apical region), (5) ciliated tegument, (6) germ cells (generally grouped at the posterior
region). Although evident in the miracidium, germ cells were not considered as a reference
feature due to their similarity with early immature cells (blastomeres). They possess large
round nucleus, prominent nucleolus and scarce cytoplasm (Fig. 1).
Female reproductive system and intrafemale egg development
Just a brief period of the egg development occurs inside the female reproductive system. The
single ovary presented small, hexagonal cells, with a central nucleus, lining its walls at the
distal pole. Maturation occurred in the direction of the proximal pole, near a short segment of
the oviduct, just before the seminal receptacle (Fig. 2a). Mature oocytes were bigger than
immature ones, with a large central, basophilic nucleus. Nucleolus was evident, intensely
basophilic, and presented a very prominent, slightly eosinophilic nucleolar inclusion.
Cytoplasm was abundant and homogeneously blue on Giemsa-stained sections, indicating the
wide presence of ribosomes or poliribosomes (Fig. 2b). In the brief prezygotic stage, each
oocyte left the ovary at a single moment through the projection of its cytoplasm (pseudopod)
(Fig. 2c). In the oviduct, shortly before the seminal receptacle full of sperm, the oocyte was
fecundated, giving rise to the zygotic stage (also named as stage 0). The zygote passed
through the sperms towards the oviduct and then the vitelline-oviduct. In the vitelline-oviduct,
the zygote was surrounded by approximately 40-45 vitelline cells (vitellocytes), which leads
to a production of about 13,500 vitelline cells per female worm per day. Vitelline cells were
smaller than the zygote, with central, eosinophilic nucleus, and azurophilic cytoplasm full of
blue-stained yolk granules on Giemsa. On PASH and Masson trichrome-stained sections, the
vitelline cell cytoplasm was slightly eosinophilic with weakly red and green-blue tinge,
respectively. This cell mass entered the ootype, where the eggshell was formed (Fig. 2d). At
this moment, the zygotic cell did not suffer any division. The fully formed egg, with its
characteristic conspicuous lateral spine, was released in the uterus (Fig. 2e). Then, it was
104
Artigo 2
Jurberg et al. – Development, Genes and Evolution
deposited through the gonopore just beneath the ventral sucker of the female, without
suffering any cleavage, as observed on newly laid eggs in vitro (Fig. 2f).
Egg growth under in vivo and in vitro conditions
Eggs laid under in vitro conditions developed completely and released viable infective
miracidia (data not shown). Regarding the estimated egg area as a simple character, the effect
of two different environments on egg growth while embryo develops (assessed by the Vogel
and Prata’s staging system under BM) was modeled according to the equation 1. Goodness of
fitting was checked by graphical (Supplementary Materials) and statistical residual analysis (P
≤ 0.001). Considering only the effect of each environment in the mean area of the eggs (with
no distinction in regard to egg age), a significant difference was detected between eggs
obtained from host tissues and eggs cultivated in vitro (P = 0.00017). When considering only
the maturation stages with no distinction in regard to egg origin, the mean egg area also
differed significantly between each stage and its following one (P < 0.0001), except between
the stages I and II (P = 0.976). Both main effects (egg origin and stage) interacted to explain
area variability (P = 0.0001) as suggested by line crosses in its interaction plots (see
Supplementary Materials). Considering matching stages of both environments between
themselves, differences in mean area were statistically significant for all stages (P < 0.0001),
but less impressive between eggs from stage I (P = 0.017) and not significant between mature
eggs (stage V) (P = 0.445).
A clear increase in egg size during miracidium embryogenesis in culture was statistically
significant between each stage and its following one, although no difference in the mean areas
occurred between eggs from stage I and stage II (P = 1.000). In fact, the mean area of eggs in
stage II was smaller than the mean area of eggs in stage I under such in vitro conditions,
despite minimum and maximum values of eggs in stage II have been bigger than in stage I. In
105
Artigo 2
Jurberg et al. – Development, Genes and Evolution
sequence, eggs in stage II were significant smaller than in its following stage III (P < 0.0001),
which were also smaller than eggs in stage IV (P < 0.005). Eggs in stage IV were also
significant smaller than mature eggs (P < 0.0001) (Fig. 3a).
A similar growing pattern was also noted in eggs obtained from the murine host. Eggs in
stages I and II did not differ statistically in size (P = 0.969) such as eggs in stages II and III (P
= 0.390). On the other hand, eggs in stage III were significantly smaller than eggs in stage IV
(P < 0.0001), and eggs in stage IV were also significantly smaller than mature eggs (stage V)
(P < 0.0001) (Fig. 3b).
Comparing the interaction of both main effects on egg mean area, eggs in stage I from both
environments did not show significant differences among themselves (P = 0.325). Isolated
eggs from stage II were significantly bigger than their matching cultivated stage (P < 0.005),
while isolated stage III and stage IV-eggs were significantly smaller than their respective
matching cultivated stages (P < 0.0001). No statistically significant difference between egg
mean areas of mature eggs (stage V) was detected (P = 0.999) (Fig. 3c, d; Table 2).
Stages in Schistosoma mansoni egg embryogenesis
Stage 1
Newly laid eggs were passively carried by the blood flow until they were trapped in small
vessels of the murine host. In the onset of this stage (also corresponding to Vogel and Prata’s
stage I), the embryo was too small to be visible in isolated, stained or unstained, whole eggs
by BM (Figs. 4a, 10). Carmine-stained eggs under CLSM and histological sections revealed
that the first cleavage was total and subequal, producing two blastomeres slightly different in
size (Fig. 4b). They showed a central large round nucleus, homogeneously stained but without
106
Artigo 2
Jurberg et al. – Development, Genes and Evolution
heterochromatin delineation (“ground glass” aspect), with a very prominent and intense
basophilic nucleolus. Nucleolar inclusions were visualized under BM. The cytoplasm was
abundant and homogeneously blue when stained with PASH, and Giemsa (Fig. 4b, c). These
features indicate that the cells were actively engaged in protein synthesis. Embryonic cells
were difficult to be seen on PAS-AB-stained slides, due to the very weak staining of both
nucleus and cytoplasm (Fig. 11a). Vitelline cells exhibited an apparently vacuolated
cytoplasm, slightly stained in red on PASH (Fig. 4b) and in green-blue on Masson trichrome
(Fig. 4d), but heavily stained on PAS-AB-stained slides (Fig. 11a). This staining pattern
suggests the presence of neutral polysaccharides or neutral glycoproteins. As soon as the first
cleavages occur, the vitelline cells started to fuse into a single yolk syncytium. The remnant
vitelline nuclei were small, basophilic, irregularly shaped (Fig. 4d). Following cleavages
occurred asynchronously, resulting in the formation of the animal-vegetal axis. By the end of
stage 1, the embryo formed a roughly circular disc, 2-3 cells in diameter (Fig. 4e). The
embryonic primordium was now visible in the center of whole, unstained eggs as a clear disc,
occupying about the half of the transversal length of the egg (now corresponding to Vogel and
Prata’s stage II) (Figs. 4f, 10).
Stage 2
The embryonic primordium increased in size (Fig. 4g, 9e, 10). The number of embryonic
cells, visible in carmine-stained whole-mounts under CLSM or by histology, reached 4-6 cells
wide and 6-8 cells long (Figs. 4h-m, 9e). Morphological features of embryonic cells and the
yolk syncytium remained similar to the previous stage (Figs. 4h-m, 9e). Mitotic figures were
visualized throughout the embryo (Figs. 4l, m). Other cells presented pycnotic nuclei on
PASH, Giemsa, and Masson trichrome-stained sections (Fig. 4m), suggesting the occurrence
of apoptosis during early embryonic development. Vitelline cells fused completely. Some
macromeres seemed to detach from the embryo poles, adhering to the eggshell (Fig. 4l). They
107
Artigo 2
Jurberg et al. – Development, Genes and Evolution
will give rise to the outer envelope of the egg, also named the Reynolds’ layer. These
macromeres had a large, round nucleus, with “ground glass” aspect (slightly
heterochromatic). The nucleolus was round, intensely basophilic, and very prominent, with a
punctiform light nucleolar inclusion. Their cytoplasms were scarce, and apparently basophilic,
being stained in blue on H&E, PASH, and Giemsa (Fig. 4l). Some vitelline nuclei also
seemed to adhere to the eggshell. By the end of stage 2, a solid proliferating cell mass
(stereoblastula) occupied the whole transversal length of the egg (corresponding also to Vogel
and Prata’s stage II) (Figs. 4m, 10).
Stage 3
In whole eggs, the clear area corresponding to the embryo increased in size, assuming an
elongated form, that occupies two-thirds of the longitudinal length of the egg (like in Vogel
and Prata’s stage III) (Figs. 4n, 9f, 10). On histological sections, the yolk syncytium remained
heavily stained in red on PAS-AB, while the embryo itself remained difficult to be visualized.
Cellular differentiation began, giving rise to at least two types of cells (Figs. 4o-p, r). Type I
cells preserved the immature morphology, possessing a large, round nucleus, with “ground
glass” aspect, prominent nucleolus, and scarce cytoplasm, stained in blue on Giemsa. Type II
cells (neuroblasts?) seemed to be concentrated in the center of the embryo. They had small,
slightly irregular nucleus, with a close chromatin pattern, and scarce cytoplasm. The nucleus
was slightly stained green-blue on Masson trichrome, and a punctiform nucleolus was
evident. The embryo had about 7-10 cells wide, and 9-12 cells long (Figs. 4o-p, r). Several
mitotic figures were seen at this stage throughout the embryo (Fig. 4r). Signs of apoptosis as
pycnotic nuclei were present mainly in the periphery of the embryo (Fig. 4r). Other peripheral
embryonic cells seemed to be compromised in the differentiation of the inner envelope (also
known as the von Lichtenberg’s envelope). Their nuclei were slightly flattened (Fig. 4r). In
the outer envelope, the differentiation initially started at stage 2 with the adhesion of
108
Artigo 2
Jurberg et al. – Development, Genes and Evolution
macromeres to the eggshell and subsequent syncytium formation, seemed to continue with the
fusion to the yolk syncytium.
Stage 4
Considering the previous stage, it was not possible to distinguish morphological changes in
whole, unstained eggs (corresponding to the Vogel and Prata’s stage III) (Fig. 10). On
histology, the differentiation of the inner envelope became apparent with the formation of a
detaching syncytium surrounding the whole embryo (Fig. 5). On PAS-AB-stained sections,
the cytoplasm of these cells were lightly stained in red, while the yolk mass was heavily
stained, and the embryo itself was barely stained (Fig. 11b). On PASH, the inner envelope
syncytium was also stained in red, while on Giemsa its cytoplasm was stained in blue,
suggesting the wide presence of ribosomes (Figs. 5a-c). The flattened nuclei remained with
their “ground glass” aspect, with a pronounced lateral nucleolus. The outer envelope was
fused to the yolk syncytium and seemed to disappear progressively towards the development
(Fig. 5b). These events were also visualized in whole carmine-stained eggs under CLSM
(Figs. 5d-i). Vitelline nuclei were visible at the poles of the egg. In the center of the embryo,
the neural mass primordium arose from a roughly spherical group of cells with small,
heterochromatic nuclei, and punctiform nucleolus (type II cells). These neuroblasts were
arranged in a layer of 1-2 cells thick around an acellular region (neuropile). On Masson
trichrome, such nuclei stained slightly in blue-green (Fig. 5j). Immature cells (type I cells)
concentrated mainly in the periphery of the embryo (Figs. 5b, c, e-i).
Stage 5
The embryo occupied almost the whole egg interior, although some vitelline remnants were
present at the poles (corresponding to the Vogel and Prata’s stage IV) (Fig. 6a, d-i, 10). The
outer envelope assumed a thin, granular, and anucleate aspect, that difficult its visualization
109
Artigo 2
Jurberg et al. – Development, Genes and Evolution
on histological sections. The inner envelope was heavily stained in red with PASH and PASAB, and it kept its syncytial aspect (Fig. 6b-i). The neural mass primordium increased in size,
expanding its central, acellular region (Fig. 6b, c, g-i). The epidermis started to differentiate
from the most peripheral cells of the embryo (Fig. 6b, c, e-i). These small, cuboidal
primordial cells fused to form another syncytium just beneath the inner envelope (Fig. 6).
Such epidermal primordium had round nucleus with no pattern of heterochromatin delineation
(“ground glass” aspect). Its basophilic cytoplasm were stained in blue on Giemsa sections
(Fig. 6b), indicating an active engagement in protein synthesis. In the anterior region of the
embryo, two large, immature cells are positioned at each side of the neural mass primordium.
Stage 6
Taking into consideration the Vogel and Prata’s classification, no differences were identified
between this stage and the previous analyzing whole, unstained eggs. On PASH-stained
sections, the lateral, anterior immature cells exhibited cytoplasmatic granules heavily-positive
to the PAS method (Fig. 7a, b). The nucleus remained large and round, without
heterochromatin delineation. Nucleolus was prominent. Such cells will give rise to the lateral
glands of the miracidium. An anterior group of immature, small cells presented a weaker
pattern of cytoplasmic positive staining to the PAS reaction (Fig. 7a, b). This group will form
the apical gland of the mature larvae. The epidermis of the anterior region of the embryo
seemed to project onwards, elongating in a cone-like structure, called terebratorium (Fig. 7a,
g-h). The neuropile of the neural mass primordium exhibited a weak positive stain to PAS,
similarly to the embryonic parenchyma staining (Fig. 7a). In the posterior region of the
embryo, groups of three to five cells with immature features (large, round nucleus with
“ground glass” aspect, and scarce, basophilic cytoplasm) were positioned (Fig. 7g-i). They
correspond to the germ cells of miracidia. The inner envelope showed the same features of the
previous stages, with large, round, “ground glass” nuclei, and prominent nucleoli (Fig. 7a, c110
Artigo 2
Jurberg et al. – Development, Genes and Evolution
i). The syncytial cytoplasm was homogenously stained in red on PASH sections (Fig. 7a). At
the end of this stage, the epidermal epithelium was clearly distinguishable from the
mesenchyme (Fig. 7b-i).
Stage 7
Elongated embryo occupied the whole eggshell interior, but no movement was observed in
freshly isolated and cultivated eggs or by the oogram (Fig. 9a) and intestinal scraping
techniques. A small amount of dark yolk material was positioned in the poles of the egg (Fig
10d). Eggs in this stage still correspond to Vogel and Prata’s stage IV (Fig. 10). In
histological sections, the unicellular lateral glands were strongly stained in red on PASH and
in green on Masson trichrome (Fig. 8a, b). They extended (gland ducts) towards the
terebratorium (Fig. 8m, n). Their nuclei were smaller, irregularly round, and heterochromatic.
The apical gland was formed by the fusion of three immature cells, positioned in the anterior
region of the embryo and flanked by the two lateral glands (Fig. 8a). The apical gland was
also stained in red on PASH and in green on Masson trichrome, but exhibited a granular,
heterogeneous pattern (Fig. 8a, b). Three small, irregularly shaped nuclei were localized in
center of the apical gland. They were bigger than the lateral gland nuclei. The localization and
staining pattern of both lateral glands and apical glands allowed the distinction between them
(Fig. 8a, b). In this stage, the neural mass exhibited nuclei condensation (Fig. 8c, d),
suggesting that brain differentiation was completed. This process of neuronal nuclei
condensation was followed by an increasing in neuropile volume. The neurons had small
nuclei, roughly round or elongated, and heterochromatic. Posteriorly, no pattern modification
occurred to the immature cells (germ cells) (Fig. 8a, b). The eggshell was thicker in the poles.
Under BM, the outer envelope was difficult to be recognized in this stage. The inner envelope
kept its previous characteristics (Fig. 8a, b). The subepidermical musculature was revealed
throughout the embryo by the Masson trichrome staining (Fig. 8b).
111
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Stage 8
Embryos occupied the whole interior of the egg. In freshly isolated and cultivated eggs or in
the oogram (Fig. 9) and the intestinal scraping techniques, they move rapidly and make
circumvolutions inside the eggshell. Muscular contractions, cilia and flame-cell beating were
also indicative of maturity in live eggs. They were ready to hatch if reach appropriate
conditions. This stage corresponds to the final stage V of the Vogel and Prata’s classification
(Fig. 10). Even in unstained eggs, the neural mass was easily recognized in the mid-anterior
region of the miracidium (Fig. 10d). In sections, one to two layers of neurons were organized
peripherally around the roughly round neuropile (Fig. 8d, f-g). In the anterior region, the
terebratorium, the apical gland, and both lateral glands were fully formed (Fig. 8e-n).
Morphological signs of gland secretions to the interior of the egg were observed inside the
murine host (Fig. 8f). Epidermal cells were distributed in ciliated epidermal plates, forming a
thin syncytium with round, basophilic nuclei (Fig. 8h). A conspicuous basal membrane
separated the epidermal cells from the muscular adjacent layer. It was revealed in negative by
the PAS-AB method (Fig. 11c). No mitotic figures were seen throughout the embryo. Germ
cells were arranged posteriorly in groups of three to five cells (Fig. 8, 9d). Taking into
consideration the eggshell structures, the outer envelope kept its previous features, while the
inner envelope seemed less thick (Fig. 8h-n). Whole stained eggs analyzed under CLSM
exhibited a granular material (Cheever corpuscules?) within the space between the apical
membrane of the inner envelope and the miracidium itself (Fig. 8l-n). This space was named
Lehman lacuna by Neill (1988).
Discussion
Based on a recently introduced morphological staging system and adapted to other flatworm
species (Hartenstein & Ehlers 2000; Younossi-Hartenstein et al. 2000; Younossi-Hartenstein
& Hartenstein 2000a, b, 2001; Ramachandra et al. 2002; Morris et al. 2004; Cardona et al.
112
Artigo 2
Jurberg et al. – Development, Genes and Evolution
2005, 2006), the present investigation has demonstrated that the schistosome egg development
is complex, and described for the first time the sequence of its morphological events up to the
complete formation of the ciliated larva (miracidium) (see Fig. 10). Egg maturation under in
vivo and in vitro conditions has been also evaluated statistically by using the ratio embryo/egg
size as a simple character, and morphologically by using carmine staining of whole-eggs.
Schistosomes have the neoophoran mode of development, in which a specialized organ
(vitellarium or vitelline gland) provides individualized vitelline cells that surround the zygote
in the vitelline-oviduct, before entering the eggshell forming apparatus (the ootype). The
number of vitelline cells within the newly formed egg capsule of S. mansoni is not precise in
the literature, varying from 20 to 40 cells (Gonnert 1955; Wells & Cordingley 1991;
Swiderski 1994; Michel et al. 2003; Knobloch et al. 2006). Our preliminary findings on
eggshell formation in whole-mount mature females analyzed by CLSM pointed
approximately 40-45 individualized vitelline cells in each newly enclosed egg, but additional
analyses must be carried out for a statistically significant result. In schistosomes, these cells
probably have a key role in eggshell formation and a reduced importance in embryo
nourishment (Erasmus 1975; Erasmus et al. 1982; Bobek et al. 1986; Johnson et al. 1987;
Koster et al. 1988; Reis et al. 1989; Chen et al. 1992; Schussler et al. 1995; Fitzpatrick et al.
2004; Fitzpatrick et al. 2007). The eggshell has cribriform-like pores, which allow the uptake
of exogenous nutrients during egg migration through host tissues (Lewert et al. 1970;
Stjernholm & Warren 1974; Neill et al. 1988; Swiderski 1994).
The present findings on the reproductive system of S. mansoni female worms are in
accordance to Neves et al. (2005), although the morphology of the Mehlis’ gland has not been
examined. These authors suggested that the Mehlis’ gland of S. mansoni mature females is
formed by thick cuboidal epithelial cells with flabby chromatin, which line the ootype. Their
113
Artigo 2
Jurberg et al. – Development, Genes and Evolution
description is controversial, since ultrastructural investigations by Spence & Silk (1971a, b),
Irie et al. (1983), and Moczon et al. (1992) have pointed a set of unicellular glands with
narrow cytoplasmic projections in the lateroposterior region of the ootype as seen in other
trematodes (for S. margrebowiei, see Awad & Probert 1990; for echinostomes, see Rao 1963;
Lie 1965; for Fasciola spp., see Rao 1959; Threadgold & Irwin 1970; Anuracpreeda et al.
2006). In the ootype, the quite viscous secretions of the Mehlis’ gland create an alkaline
interface around peripheral acidic eggshell precursor granules exocytosed from the vitelline
cells. This promotes the coalescence of these eggshell precursor granules to form the eggshell
(Wells & Cordingley 1991) that hardens in the female uterus by a process dependent of two
tyrosinases (Swiderski 1994; Fitzpatrick et al. 2007). As noted by several authors,
schistosome eggs are not retained in the female parental uterus and are laid still undeveloped.
Before studying egg embryogenesis, we examined the morphology of the miracidium by
histology and whole-mount preparations in order to define “hallmark” structures for each
stage of embryo formation. Previously, the morphology of the fully formed, newly hatched
larva of S. mansoni was extensively studied by two authors, using BM (Ottolina 1957) and
transmission electron microscopy (TEM) (Pan 1980). Our findings on the miracidium
morphology are in agreement with Pan (1980). But unlike Hartenstein & Ehlers (2000) for the
rhabdocoel Mesostoma lingua, such references were difficult to recognize in live eggs, even
under differential interference contrast microscopy (data not shown). In mature eggs, muscle
contraction, cilia and flame-cell beating are easily observed and indicative of miracidium
viability (Prata 1957). These movements were seen in all the techniques performed prior to
fixation. However, flame-cell differentiation was not determined yet. It probable occurs late
during organogenesis, perhaps starting in stage 7. Further investigations to clarify the
formation of embryo excretory system are now in progress.
114
Artigo 2
Jurberg et al. – Development, Genes and Evolution
An alternative attempt to improve embryo survey was to remove the eggshell from live eggs,
but we were not successful in the present time (data not shown). To circumvent this
drawback, we had previously adapted a staining protocol for single whole-eggs by confocal
microscopy (Jurberg et al. 2008b) and we now present the use of the same staining (carmine)
in conjunction to the oogram technique and confocal microscopy (Fig. 9). The classical
technique by Pellegrino & Faria (1965) is commonly used to infer interruption of egg-laying
on chemotherapeutical evaluations, which causes changes of egg frequencies in host tissues
(in this case, intestine). However, whether it occurs, this technique does not access the effect
of drug treatment on the egg embryonic development. The oogram technique in conjunction
to carmine staining under CLSM has revealed in great details the morphological events during
egg embryogenesis in situ (Fig. 9d-f). It is important to emphasize the need to compress very
well the intestinal samples during preparation. The analyses of whole eggs from in vivo and in
vitro conditions could bring additional information to egg biology, especially seeking
phenotypic changes in drug evaluations and in RNA interference–mediated knockdown
studies, as performed by Freitas et al. (2007). It is possible that removing the eggshell will
further improve embryo visualization, probably facilitating embryonic cell lineage tracing and
future studies.
Although difficult to visualize the described morphogenetic events in live eggs, it is possible
to correlate them with Vogel and Prata’s staging system (Vogel 1942; Prata 1957) (Fig. 10).
These authors do not classify the egg formation inside the female, which we divided in two
stages: the prezygotic stage refers to the release of mature oocyte from the multi-lobated
ovary until its fecundation in the short segment of the oviduct, just before the seminal
receptacle, while zygotic stage (also stage 0) is characterized by the following migration of
the early-fertilized zygote. Early cleavages correspond both to our stage 1 and Vogel and
Prata’s stage I, in which the embryonic primordium is too small to be visible under BM. At
115
Artigo 2
Jurberg et al. – Development, Genes and Evolution
the end of this stage, the embryo becomes visible as a clear central disc, occupying one-third
of the diameter of the egg. Our stage 2 represents late cleavages, in which the embryonic mass
becomes bigger (stereoblastula) and occupies one-half of the diameter of the egg. This is
correspondent to Vogel and Prata’s stage II. The Vogel and Prata’s stage III, when embryo
elongates to occupy two-thirds of the length of the egg, was divided by us into two novel
stages: in stage 3, when cellular differentiation starts producing at least two cell types, while
in stage 4, the first embryonic primordium (neural mass) arises from a mesenquimal mass of
cells. In the Vogel and Prata’s stage IV, embryo increases in size occupying almost the entire
egg. This stage comprehends the main steps of organogenesis and can be also divided in: our
stage 5, that refers to the beginning of epidermis formation; in stage 6, when occur
terebratorium and miracidial glands differentiations; while in stage 7, the neural mass suffers
nuclear condensation. In both staging system, the last stage (Vogel and Prata’s stage V and
our stage 8) refers to the fully formed larva before hatching (Fig. 10).
Comparison between the development of eggs laid in vitro and of eggs isolated from the
murine host were assessed by statistical (using only the Vogel and Prata’s staging system) and
morphological (using both staging systems) analyses of whole-mount eggs in different stages
of maturation. Despite the lack of information on its embryonic development, schistosome
eggs have been commonly maintained under culture conditions for a wide variety of purposes,
as drug screening, antibody production, and RNA-interference knockdown (Asahi &
Stadecker 2003; Schramm et al. 2006; Freitas et al. 2007; de Araujo et al. 2007; Cass et al.
2007). However, as reviewed by Gobert et al. (2007) for mechanically transformed
schistosomula, culturing parasites in vitro should be considered with caution, especially at
molecular or biochemical levels. Michaels & Prata (1968) have followed egg maturation in
two distinct culture media and defined the M199 containing 10% calf serum as adequate to
support egg embryogenesis and miracidial life span as well as the host environment. On the
116
Artigo 2
Jurberg et al. – Development, Genes and Evolution
other hand, some authors use the RPMI-1640 culture medium (Ashton et al. 2001; Kusel et al.
2006; Schramm et al. 2006). Here, we evaluated the embryonic development of S. mansoni
eggs in this medium and compare it with data obtained from isolated eggs.
At the conditions used here, undeveloped eggs laid in vitro are capable of mature completely
and hatch when placed in water. The fully formed larva also infects Biomphalaria glabrata
snails, with cercaria release (data not shown). To both environments (culture and host), eggs
significantly increased in size during development, which was previously reported by Prata
(1957) to eggs in the host and by Michaels & Prata (1968) to cultivated eggs. Ashton et al.
(2001) confirmed this growth by calculating a factor of biomass gain in 3.33. Considering egg
growth between each following Vogel and Prata’s stage, no significant difference was
observed during early stages (stages I and II). In fact, unlike observed in isolated eggs in these
early stages, the mean estimated area of cultivated eggs in stage II was smaller than in stage I,
despite minimum and maximum values of eggs in stage II have been bigger than in stage I.
This indicates a great dispersion of area values in cultivated eggs from stage II, which may be
explained by a natural phenotypic plasticity of egg size under in vitro conditions. It is also
possible that eggs do not increase in size during early stages of development because they
probably should adapt to the new, external environment (culture or host). To both
environments, eggs increased significantly in size in the following stages, reaching maximum
values when mature. The statistical significant differences in the mean estimated areas of
cultivated and isolated eggs between distinct stages of maturation may suggest unequal rates
of maturation, since the gross morphology of each matching stage seems to be similar.
Moreover, mature eggs from both environments exhibited no significant differences in area
when compared among themselves. In this case, culturing eggs for studying morphological
events during embryogenesis may be useful, although it should raise questions on interpreting
biochemical and molecular data as stressed by Gobert et al. (2007) for schistosomula. A chief
117
Artigo 2
Jurberg et al. – Development, Genes and Evolution
difference among eggs cultivated in vitro refers to the lack of evident signs of death when
compared with eggs from the host (Michaels & Prata 1968). Sarvel et al. (2006) used the
fluorescent probe Hoechst 33258 to differentiate dead eggs from live ones by labeling nuclei
of damaged cells. We tried to perform this method in conjunction to carmine staining, but we
were not successful, even modifying the staining steps sequence (data not shown).
As seen in culture conditions, eggs within the female reproductive system did not undergo any
cleavage and the first mitotic division occurs only in the female external environment (host
bloodstream or culture). The triggering signal(s) is(are) still unknown. Before the first total,
unequal cleavage, vitelline cells start to fuse progressively into a single syncytium, as also
reported by Swiderski (1994). Cell fusion is a key process for plant and animal development
and is quite common during miracidium embryogenesis (in the formation of inner and outer
envelopes, apical gland and epidermis). Other several examples are available in the literature
(Podbilewicz 2006; Oren-Suissa & Podbilewicz 2007; Larsson et al. 2008). Generally, it
involves bringing two lipid bilayers into close proximity, followed by the formation of a
fusion pore and cytoplasmic mixing, to form a syncytium (Oren-Suissa & Podbilewicz 2007).
However, nothing is known on vitelline fusion during the embryonic development of
schistosome eggs. It is possible that yolk syncytium formation facilitates nutrient availability
to the embryo, including the uptake of host metabolites via eggshell pores (Lewert et al. 1970;
Stjernholm & Warren 1974). Remnants of the vitelline cells also fuse to two macromeres that
have detached from the poles of the developing stereoblastula and adhered to the internal
surface of eggshell to form the outer envelope (Reynolds’ layer), as also reported by
Swiderski (1994). This starts to occur in the period that we have classified as stage 2 (late
cleavage) and disappear progressively around stage 4 (organ primordia formation).
Ultrastructurally, the outer envelope thickens as maturation proceeds, especially at the poles
of the eggshell. In later stages, is characterized as an acellular matte of arborizing and
118
Artigo 2
Jurberg et al. – Development, Genes and Evolution
anastomosing electron-dense fibrils in a finely granular matrix with many free ribosomes in
mature eggs (Neill et al. 1988; Swiderski 1994). On the other hand, the egg inner envelope
(von Lichtenberg’s envelope) arises exclusively from peripheral embryonic cells that start to
differentiate in a stage which we had classified as stage 3. Nevertheless, it becomes apparent
in the following stage 4, while fusion proceeds to encircle the embryo as a detaching syncytial
layer slightly positive to PAS. During these later stages, the inner envelope expands while
embryo grows and adheres to the remnants of the outer envelope. Nuclei are flattened and
large, with scant heterochromatin and prominent nucleoli, while the cytoplasm is thin, with
developed granular reticulum, abundant polysomes, elongate mitochondria, and several lipid
droplets. In mature eggs, this envelope deteriorates (Neill et al. 1988; Swiderski 1994; Ashton
et al. 2001), which may facilitate the release of egg antigens to the surrounding environment.
A marked change in positive reaction in PAS and PAS-AB methods occurs during the
embryonic development of schistosome eggs (Fig. 11). These stainings reveal the production
of neutral glycoproteins, first by the inner envelope (beginning in stage 4) and then by
miracidial glands (in stage 6). Mature embryos are strongly positive to PAS reactions. This
may suggest that late production of glycoproteins is related to previous observations by Prata
(1957), in which granuloma formation does not occur around single immature eggs, but only
around mature eggs.
Indeed, Andrade & Barka (1962) first suggested that host-immunogenic antigens are
polysaccharides or glycoproteins. It is now known that schistosome eggs secrete at least 188
proteins of a wide variety of functions (Cass et al. 2007), and that granulomatogenic activity
is triggered specifically by glycoconjugates with terminal Galβ1-4GlcNAc (LacNAc) or
LacdiNAC elements (Van de Vijver et al. 2006). The localization of these egg secreted total
proteins (ESP) was attributed to egg envelopes instead of the miracidium itself (Ashton et al.
2001). However, as first pointed by Lewert & Lee (1954), miracidial glands are also positive
119
Artigo 2
Jurberg et al. – Development, Genes and Evolution
to the PAS reaction. Our results showed that both types of miracidial glands (lateral and
apical) differentiate late in development (stages 6 and 7), producing PAS-positive granules,
and secrete them to the interior of the egg in the fully formed miracidium. In this case, like in
egg envelopes (Ashton et al. 2001; Schramm et al. 2006; Van de Vijver et al. 2006), it is
possible that gland material also contributes to granuloma formation. Besides the production
of immunogenic components, egg envelopes may play another important role, acting as a
slow antigen-releasing barrier to the surrounding environment and preventing premature egg
expulsion to gut lumen (Ashton et al. 2001). The differentiation of miracidial glands also
strengthens this scenario, since their glycoprotein production start late during egg
development. Further histochemical (lectins) and immunohistochemical studies should be
performed to evaluate the role of specific egg antigens during embryo formation and to clarify
the role of miracidial glands during granulomatogenesis. So far, just a few egg antigens had
been located, exclusively in mature eggs (Williams et al. 2001; Schramm et al. 2006; Van de
Vijver et al. 2006).
Apoptosis in platyhelminths was first reported in the free-living Macrostomum sp. (Nimeth et
al. 2002) and then observed in planarians during regeneration (Hwang et al. 2004). Nuclear
morphology assessed by Giemsa staining is considered a reliable criterion for apoptosis
determination (e.g. see Baskic et al. 2006). In schistosome egg embryogenesis, signs of
programmed cell death as pycnotic nuclei were found during late cleavage, the blastula stage,
and early organogenesis. Presumably, cell death is involved in tissue formation and
arrangement. However, its role on tissue homeostasis during embryonic development of
schistosome eggs remains to be better evaluated in further studies.
Following envelopes formation, organogenesis starts to occur (beginning in stage 5).
Phylogeneticaly, schistosome egg development was quite similar to the rhabdocoel pattern
120
Artigo 2
Jurberg et al. – Development, Genes and Evolution
showed by Mesostoma lingua, in which gastrulation does not seem to occur (see Hartenstein
& Ehlers 2000). The cleavage-resulting solid blastula gives rise to organ primordia, such as
neural mass, epidermis, and other organs from mesenchymal cells, but unlike rhabdocoels,
schistosome embryo do not form pharynx and gut during egg development. The lack of such
structures is probable associated with the parasitic lifestyle. They will appear only during
miracidium-sporocyst-cercariae transformation within the snail intermediate host (Pan 1996;
Dorsey et al. 2002). Another similar event is the formation of egg embryonic envelopes,
which might be derivatives of the huell membrane of turbellarian flatworms. For instance, in
Mesostoma, this transient membrane arises from vitelline cells that surround the embryo
ventrally and disappear progressively around stage 6 (Hartenstein & Ehlers 2000). However,
as other parasitic platyhelminths (e.g. cestodes) schistosomes have two envelopes, which may
be also an adaptation to parasitism. They protect the developing and fully formed miracidium,
act as nutrient producing and storage compartments, secrete immunogenic materials which
can contribute to egg expulsion to gut lumen, and provide motility for miracidial movements
prior to hatching (Neill et al. 1988; Swiderski 1994; Ashton et al. 2001; see also Conn &
Swiderski 2008). Both envelopes are cellular in origin, syncytial in nature, and enclose the
embryo (Swiderski 1994). Nevertheless, the outer envelope has mixed origin (from
macromeres and vitelline cells) and disappears gradually such as the huell membrane, while
the inner envelope arises from mesomeres and persists until egg hatching.
Epidermis formation begins during stage 5 by fusion of an embryonic peripheral monolayer,
just underneath the inner envelope. As differentiation proceeds, single epidermal cells form
hundreds of cilia that became identifiable around stage 7 by BM and CLSM. However, it is
possible that their formation start a little earlier. The body wall of S. mansoni miracidia is
arranged in four tiers of 6, 8, 4, and 3 plates, from the anterior to the posterior end (Pan 1980;
Eklu-Natey et al. 1985). These plates are separated from each other by epidermal ridges,
121
Artigo 2
Jurberg et al. – Development, Genes and Evolution
interconnected by their cell bodies and narrow cytoplasmic bridges, except in the first tier
where no ridges separate them (Pan 1980; Eklu-Natey et al. 1985). As noted by Pan (1980,
1996), the terebratorium appears to be a modified epidermal ridge, which contains at least 12
peripheral sensory organelles and the openings of miracidial gland ducts. In S. mansoni, it has
a ‘honeycomb’ pattern (Eklu-Natey et al. 1985). The underlying muscle layer was visible in
mature embryos, but its differentiation should be detailed by immunohistochemical and
ultrastructural studies. Epidermis formation, cilia growth, and terebratorium differentiation
should be also detailed by TEM in further studies. Parasitic platyhelminths belong to the
monophyletic group Neodermata (Ehlers 1985; Littlewood et al. 1999), in which the larval
ciliated epidermis is replaced by a syncytial nonciliated epidermis with “insunk” nuclei
(tegument) in the adult, called neodermis (Tyler & Tyler 1997).
In late stages of miracidium embryogenesis, when the larva is almost fully formed, germ cells
were evident in whole-mounts or histological sections, but were not considered as a reference
feature due to their similarity with early immature cells (blastomeres). They possess large
round nucleus, prominent nucleolus and scarce cytoplasm. Based on ultrastructural
observations of the miracidium-sporocyst transformation in the snail host (Pan 1996), we
postulate that the miracidial germ cells may be homologous to neoblasts of other
platyhelminth worms, although no accounts of regeneration potential has been given for any
of schistosomal evolutive stages. Both cell types have remarkable proliferative capacity and
are morphologically defined by a prominent nucleus and a small rim of basophilic cytoplasm,
by free ribosomes and a relatively small amount or lack of endoplasmic reticulum. Miracidial
germ cells have many mitochondria unlike well-established neoblasts (Pan 1980;
Gschwentner et al. 2001).
122
Artigo 2
Jurberg et al. – Development, Genes and Evolution
The staging system introduced by the Hartenstein group for free-living flatworms (Hartenstein
& Ehlers 2000) was very useful to detail and classify schistosome egg embryogenesis. The
assumption considered by Younossi-Hartenstein & Hartenstein (2001) that the temporal
sequence in which homologous morphogenetic events occur, and the spatial framework in
which these events unfold, is sufficiently similar between some flatworms proved to be valid
also for the trematode parasite S. mansoni. However, miracidia of schistosomes do not have
primitive gut and eyespots (for S. mansoni, see Pan 1980).
In conclusion, this work proposes a new staging system for S. mansoni egg maturation, in
which two pre-embryonic stages occur inside the female worm and then eight embryonic
stages occur after egg-laying. Stage 1 refers to early cleavages and the beginning of yolk
fusion. Stage 2 represents late cleavage, with the formation of a stereoblastula and the onset of
outer envelope differentiation. Stage 3 is defined by the elongation of the embryonic
primordium and the onset of inner envelope formation. In stage 4, the first organ primordia
arise. During stages 5-7, tissue and organ differentiation occur (neural mass, epidermis,
terebratorium, musculature, and miracidial glands). Stage 7 is characterized by nuclear
condensation of brain neurons. Stage 8 refers to the fully formed larva, presenting muscular
contraction, cilia and flame-cell beating. However, since these morphological events are
difficult to visualize in live eggs, our classification should be considered simultaneously to the
Vogel and Prata’s staging system whenever convenient. In the future, the staging system
proposed here could contribute to a better comprehension of S. mansoni egg biology, by the
generation of cell-lineage fate map and the localization of molecular components (as
granuloma-triggering antigens) during embryogenesis (“egg localizome”).
123
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Acknowledgments
The authors acknowledge the staffs of the Laboratório de Patologia /IOC and of the
Laboratório de Esquistossomose/CPqRR for technical assistance, Mr. Bruno Eschenazi from
the Setor de Produção e Tratamento de Imagens/IOC for the schematic drawing of S. mansoni
embryonic development, and Dr. John R Kusel from the Glasgow University for critical
review of the manuscript. ADJ and TG received fellowhips from the Conselho Nacional de
Desenvolvimento Científico e Tecnológico (CNPq) – Brazil. TAC and ACA de M received
fellowhips from the Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES)
– Brazil. The work was supported by Fundação Oswaldo Cruz (Fiocruz).
124
Artigo 2
Jurberg et al. – Development, Genes and Evolution
References
Andrade ZA, Barka T (1962) Histochemical observations on experimental schistosomiasis of
mouse. Am J Trop Med Hyg 11: 12-16
Anuracpreeda P, Wanichanon C, Chaithirayanon K, Preyavichyapugdee N, Sobhon P (2006)
Distribution of 28.5 kDa antigen in the tegument of adult Fasciola gigantica. Acta Trop
100: 31-40
Asahi H, Stadecker MJ (2003) Analysis of egg antigens inducing hepatic lesions in
schistosome infection. Parasitol Int 52: 361-367
Ashton PD, Harrop R, Shah B, Wilson RA (2001) The schistosome egg: development and
secretions. Parasitology 122: 329-338
Awad AH, Probert AJ (1990) Scanning and transmission electron microscopy of the female
reproductive system of Schistosoma margrebowiei Le Roux, 1933. J Helminthol 64:
181-192
Bancroft JD, Stevens A (1996) Theory and Practice of Histological Techniques. 4ed.
Churchill Livingstone, New York.
Baskic D, Popovic S, Ristic P, Arsenijevic NN (2006) Analysis of cycloheximide-induced
apoptosis in human leukocytes: fluorescence microscopy using annexin V/propidium
iodide versus acridin orange/ethidium bromide. Cell Biol Int 30: 924-932
Bobek L, Rekosh DM, van Keulen H, LoVerde PT (1986) Characterization of a femalespecific cDNA derived from a developmentally regulated mRNA in the human blood
fluke Schistosoma mansoni. Proc Natl Acad Sci U S A 83: 5544-5548
Cancado JR, da Cunha AS, Carvalho DD, Carvalho DG, Cambraia JN (1965) Evaluation of
the treatment of human Schistosoma mansoni infection by the quantitative oogram
technique. Bull World Health Organ 33: 557-566
Cardona A, Hartenstein V, Romero R (2005) The embryonic development of the triclad
Schmidtea polychroa. Dev Genes Evol 215: 109-131
125
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Cardona A, Hartenstein V, Romero R (2006) Early embryogenesis of planaria: a cryptic larva
feeding on maternal resources. Dev Genes Evol 216: 667-681
Carson FL, Martin JH, Lynn JA (1973) Formalin fixation for electron microscopy: a reevaluation. Am J Clin Pathol 59: 365-373
Cass CL, Johnson JR, Califf LL, Xu T, Hernandez HJ, Stadecker MJ, Yates JR, 3rd, Williams
DL (2007) Proteomic analysis of Schistosoma mansoni egg secretions. Mol Biochem
Parasitol 155: 84-93
Chen LL, Rekosh DM, LoVerde PT (1992) Schistosoma mansoni p48 eggshell protein gene:
characterization, developmentally regulated expression and comparison to the p14
eggshell protein gene. Mol Biochem Parasitol 52: 39-52
Chitsulo L, Engels D, Montresor A, Savioli L (2000) The global status of schistosomiasis and
its control. Acta Trop 77: 41-51
Conn DB, Swiderski Z (2008) A standardised terminology of the embryonic envelopes and
associated developmental stages of tapeworms (Platyhelminthes: Cestoda). Folia
Parasitol (Praha) 55: 42-52
Cunha AS, Pellegrino J, Oliveira CA, Alvarenga RJ (1962) Observations on the oogram in
guinea pigs and rabbits experimentally infected with Schistosoma mansoni. Rev Inst
Med Trop Sao Paulo 4: 242-248
Dalton JP, Day SR, Drew AC, Brindley PJ (1997) A method for the isolation of schistosome
eggs and miracidia free of contaminating host tissues. Parasitology 115 ( Pt 1): 29-32
de Araujo SC, de Mattos AC, Teixeira HF, Coelho PM, Nelson DL, de Oliveira MC (2007)
Improvement of in vitro efficacy of a novel schistosomicidal drug by incorporation into
nanoemulsions. Int J Pharm 337: 307-315
Dorsey CH, Cousin CE, Lewis FA, Stirewalt MA (2002) Ultrastructure of the Schistosoma
mansoni cercaria. Micron 33: 279-323
126
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Dresden MH, Payne DC (1981) A sieving method for the collection of schistosome eggs from
mouse intestines. J Parasitol 67: 450-452
Ehlers U. (1985) Das phylogenetische System der Plathelminthes. Fischer, Stuttgart
Eklu-Natey DT, Swiderski Z, Moczon T, Striebel H, Huggel H. 1982. Ultrastructure and
histochemistry of egg-shell formation in Schistosoma haematobium. In Proc 5th Intl
Cong Parasitol, 703. Mol Biochem Parasitol.
Eklu-Natey DT, Wuest J, Swiderski Z, Striebel HP, Huggel H (1985) Comparative scanning
electron microscope (SEM) study of miracidia of four human schistosome species. Int J
Parasitol 15: 33-42
Erasmus DA (1975) The subcellular localization of labelled tyrosine in the vitelline cells of
Schistosoma mansoni. Z Parasitenkd 46: 75-81
Erasmus DA, Popiel I, Shaw JR (1982) A comparative study of the vitelline cell in
Schistosoma mansoni, S. haematobium, S. japonicum and S. mattheei. Parasitology 84:
283-287
Espin J (1941) La sustancia meplasmática en los nódulos producidos por Schistosoma
mansoni. Rev Pol Caracas 10: 73-90
Fitzpatrick JM, Hirai Y, Hirai H, Hoffmann KF (2007) Schistosome egg production is
dependent upon the activities of two developmentally regulated tyrosinases. FASEB J
21: 823-835
Fitzpatrick JM, Johansen MV, Johnston DA, Dunne DW, Hoffmann KF (2004) Genderassociated gene expression in two related strains of Schistosoma japonicum. Mol
Biochem Parasitol 136: 191-209
Freitas TC, Jung E, Pearce EJ (2007) TGF-beta signaling controls embryo development in the
parasitic flatworm Schistosoma mansoni. PLoS Pathog 3: e52
Gobert GN, Chai M, McManus DP (2007) Biology of the schistosome lung-stage
schistosomulum. Parasitology 134: 453-460
127
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Gonnert R (1955) Schistosomiasis-Studien, 1. Beitrage zur Anatomie und Histologie von
Schistosoma mansoni. Z Tropenmed Parasitol 6: 18-33
Gschwentner R, Ladurner P, Nimeth K, Rieger R (2001) Stem cells in a basal bilaterian. Sphase and mitotic cells in Convolutriloba longifissura (Acoela, Platyhelminthes). Cell
Tissue Res 304: 401-408
Hartenstein V, Ehlers U (2000) The embryonic development of the rhabdocoel flatworm
Mesostoma lingua (Abildgaard, 1789). Dev Genes Evol 210: 399-415
Hartenstein V, Jones M (2003) The embryonic development of the bodywall and nervous
system of the cestode flatworm Hymenolepis diminuta. Cell Tissue Res 311: 427-435
Hwang JS, Kobayashi C, Agata K, Ikeo K, Gojobori T (2004) Detection of apoptosis during
planarian regeneration by the expression of apoptosis-related genes and TUNEL assay.
Gene 333: 15-25
Irie Y, Basch PF, Beach N (1983) Reproductive ultrastructure of adult Schistosoma mansoni
grown in vitro. J Parasitol 69: 559-566
Johnson KS, Taylor DW, Cordingley JS (1987) Possible eggshell protein gene from
Schistosoma mansoni. Mol Biochem Parasitol 22: 89-100
Jurberg AD, Oliveira AA, Lenzi HL, Coelho PM (2008a) A new miracidia hatching device
for diagnosing schistosomiasis. Mem Inst Oswaldo Cruz 103: 112-114
Jurberg AD, Pascarelli BM, Pelajo-Machado M, Maldonado A, Jr., Mota EM, Lenzi HL
(2008b) Trematode embryology: a new method for whole-egg analysis by confocal
microscopy. Dev Genes Evol 218: 267-271
Knobloch J, Kunz W, Grevelding CG (2006) Herbimycin A suppresses mitotic activity and
egg production of female Schistosoma mansoni. Int J Parasitol 36: 1261-1272
Koster B, Dargatz H, Schroder J, Hirzmann J, Haarmann C, Symmons P, Kunz W (1988)
Identification and localisation of the products of a putative eggshell precursor gene in
the vitellarium of Schistosoma mansoni. Mol Biochem Parasitol 31: 183-198
128
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Kusel JR, Oliveira FA, Todd M, Ronketti F, Lima SF, Mattos AC, Reis KT, Coelho PM,
Thornhill JA, Ribeiro F (2006) The effects of drugs, ions, and poly-l-lysine on the
excretory system of Schistosoma mansoni. Mem Inst Oswaldo Cruz 101 Suppl 1: 293298
Larsson LI, Bjerregaard B, Talts JF (2008) Cell fusions in mammals. Histochem Cell Biol
129: 551-561
Lennert K (1978) Malignant Lymphomas other than Hodgkin’s Disease. Springer-Verlag,
Berlin
Lenzi HL, Kimmel E, Schechtman H, Pelajo-Machado M, Romanha WS, Pacheco RG,
Mariano M, Lenzi JA (1998) Histoarchitecture of schistosomal granuloma development
and involution: morphogenetic and biomechanical approaches. Mem Inst Oswaldo Cruz
93 Suppl 1: 141-151
Lewert RM, Lee CL (1954) Studies on the passage of helminth larvae through host tissues. I.
Histochemical studies on the extracellular changes caused by penetrating larvae. II.
Enzymatic activity of larvae in vitro and in vivo. J Infect Dis 95: 13-51
Lewert RM, Para J, Ozcel MA (1970) Miracidial uptake of glucose in intact eggs of
Schistosoma mansoni. J Parasitol 56: 1250-1251
Lie KJ (1965) Studies on Echinostomatidae (Trematoda) in Malaya - IX. The Mehlis' gland
complex in echinostomes. J Parasitol 51: 789-792
Lillie RD, Fullmer HM (1976) Histopathological technic and pratical histochemistry.
McGraw Hill, New York
Littlewood DTJ, Rohde K, Bray RA, Herniou EA (1999) Phylogeny of the Platyhelminthes
and the evolution of parasitism. Biol J Linn Soc Lond 68: 257-287
Machado-Silva JR, Pelajo-Machado M, Lenzi HL, Gomes DC (1998) Morphological study of
adult male worms of Schistosoma mansoni Sambon, 1907 by confocal laser scanning
microscopy. Mem Inst Oswaldo Cruz 93 Suppl 1: 303-307
129
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Michaels RM, Prata A (1968) Evolution and characteristics of Schistosoma mansoni eggs laid
in vitro. J Parasitol 54: 921-930
Michel A, Knobloch J, Kunz W (2003) P19: a female and tissue specifically expressed gene
in Schistosoma mansoni, regulated by pairing with the male. Parasitology 127: 519-524
Moczon T, Swiderski Z, Huggel H (1992) Schistosoma mansoni: the chemical nature of the
secretions produced by the Mehlis' gland and ootype as revealed by cytochemical
studies. Int J Parasitol 22: 65-73
Moore DV, Sandground JH (1956) The relative egg producing capacity of Schistosoma
mansoni and Schistosoma japonicum. Am J Trop Med Hyg 5: 831-840
Morris J, Nallur R, Ladurner P, Egger B, Rieger R, Hartenstein V (2004) The embryonic
development of the flatworm Macrostomum sp. Dev Genes Evol 214: 220-239
Neill PJ, Smith JH, Doughty BL, Kemp M (1988) The ultrastructure of the Schistosoma
mansoni egg. Am J Trop Med Hyg 39: 52-65
Neves RH, de Lamare Biolchini C, Machado-Silva JR, Carvalho JJ, Branquinho TB, Lenzi
HL, Hulstijn M, Gomes DC (2005) A new description of the reproductive system of
Schistosoma mansoni (Trematoda: Schistosomatidae) analyzed by confocal laser
scanning microscopy. Parasitol Res 95: 43-49
Nimeth K, Ladurner P, Gschwentner R, Salvenmoser W, Rieger R (2002) Cell renewal and
apoptosis in Macrostomum sp. [Lignano]. Cell Biol Int 26: 801-815
Oren-Suissa M, Podbilewicz B (2007) Cell fusion during development. Trends Cell Biol 17:
537-546
Ottolina C (1957) El miracidio del Schistosoma mansoni: anatomía, citología, fisiología. Rev
Sanid Asist Soc 22: 1-412; discussion 413-420
Pan SC (1980) The fine structure of the miracidium of Schistosoma mansoni. J Invertebr
Pathol 36: 307-372
130
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Pan SC (1996) Schistosoma mansoni: the ultrastructure of larval morphogenesis in
Biomphalaria glabrata and of associated host-parasite interactions. Jpn J Med Sci Biol
49: 129-149
Pellegrino J, Coelho PM (1978) Schistosoma mansoni: wandering capacity of a worm couple.
J Parasitol 64: 181-182
Pellegrino J, Faria J (1965) The oogram method for the screening of drugs in schistosomiasis
mansoni. Am J Trop Med Hyg 14: 363-369
Pellegrino J, Oliveira CA, Faria J, Cunha AS (1962) New approach to the screening of drugs
in experimental schistosomiasis mansoni in mice. Am J Trop Med Hyg 11: 201-215
Podbilewicz B (2006) Cell fusion. WormBook: 1-32
Prata A (1957) Biópsia retal na esquistossomose mansoni - bases e aplicações no diagnóstico
e tratamento. Serviço Nacional de Educação Sanitária-Ministério da Saúde, Rio de
Janeiro
Race GJ, Martin JH, Moore DV, Larsh JE, Jr. (1971) Scanning and transmission electron
microscopy of Schistosoma mansoni eggs, cercariae, and adults. Am J Trop Med Hyg
20: 914-924
Race GJ, Michaels RM, Martin JH, Larsh JE, Jr., Matthews JL (1969) Schistosoma mansoni
eggs: an electron microscopic study of shell pores and microbarbs. Proc Soc Exp Biol
Med 130: 990-992
Ramachandra NB, Gates RD, Ladurner P, Jacobs DK, Hartenstein V (2002) Embryonic
development in the primitive bilaterian Neochildia fusca: normal morphogenesis and
isolation of POU genes Brn-1 and Brn-3. Dev Genes Evol 212: 55-69
Rao KH (1959) Observations on the Mehlis' gland complex in the liver fluke Fasciola
hepatica L. J Parasitol 45: 347-351
131
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Rao KH (1963) The structure of Mehlis' gland complex and histochemistry of
Artyfechinostomum mehrai (Faruqui) (Trematoda, Echinostomatidae) from a girl at
Andhra Pradesh, India. Parasitology 53: 1-5
Reis MG, Andrade ZA (1987) Functional significance of periovular granuloma in
schistosomiasis. Braz J Med Biol Res 20: 55-62
Reis MG, Kuhns J, Blanton R, Davis AH (1989) Localization and pattern of expression of a
female specific mRNA in Schistosoma mansoni. Mol Biochem Parasitol 32: 113-119
Sarvel AK, Kusel JR, Araujo N, Coelho P, Katz N (2006) Comparison between
morphological and staining characteristics of live and dead eggs of Schistosoma
mansoni. Mem Inst Oswaldo Cruz 101 Suppl 1: 289-292
Schramm G, Gronow A, Knobloch J, Wippersteg V, Grevelding CG, Galle J, Fuller H,
Stanley RG, Chiodini PL, Haas H, Doenhoff MJ (2006) IPSE/alpha-1: a major
immunogenic component secreted from Schistosoma mansoni eggs. Mol Biochem
Parasitol 147: 9-19
Schussler P, Potters E, Winnen R, Bottke W, Kunz W (1995) An isoform of ferritin as a
component of protein yolk platelets in Schistosoma mansoni. Mol Reprod Dev 41: 325330
Smithers SR, Terry RJ (1965) The infection of laboratory hosts with cercariae of Schistosoma
mansoni and the recovery of the adult worms. Parasitology 55: 695-700
Sorour F (1929) Contribution a l'etude des tumeurs irratitives bénignes et malignes produites
par les Bilharzies. Ann Parasit 7: 381-398
Spence IM, Silk MH (1971a) Ultrastructural studies of the blood fluke--Schistosoma mansoni.
V. The female reproductive system--a preliminary report. S Afr J Med Sci 36: 41-50
Spence IM, Silk MH (1971b) Ultrastructural studies of the blood fluke--Schistosoma
mansoni. VI. The mehlis gland. S Afr J Med Sci 36: 69-76
132
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Stenger RJ, Warren KS, Johnson EA (1967) An ultrastructural study of hepatic granulomas
and schistosome egg shells in murine hepatosplenic schistosomiasis mansoni. Exp Mol
Pathol 7: 116-132
Stjernholm RL, Warren KS (1974) Schistosoma mansoni: utilization of exogenous
metabolites by eggs in vitro. Exp Parasitol 36: 222-232
Swiderski Z (1984) Embryonic development of Schistosoma mansoni. S Afr J Med Sci 80:
434
Swiderski Z (1985) Embryonic development of Schistosoma mansoni and S. haematobium:
egg envelope formation. S Afr J Med Sci 81: 48
Swiderski Z (1986a) Blastomere differentiation during development of Schistosoma mansoni.
Proc 11th Int Cong Electron Microscopy (abstr) 3321-3322
Swiderski Z (1986b). Schistosoma matthei egg-shell degratation in the liver of Praomys
(Mastomys) natalensis during chronic infection. Proc 11th Int Cong Electron
Microscopy (abstr) 3567-3568
Swiderski Z (1994) Origin, differentiation and ultrastructure of egg envelopes surrounding the
miracidia of Schistosoma mansoni. Acta Parasitol 39: 64-72
Swiderski Z, Eklu-Natey DT, Moczon T, Subilia L, Huggel H (1982) Embryonic
development of Schistosoma mansoni and S. haematobium. Proc 5th Intl Cong Parasitol
(abstr) 708-709
Threadgold LT, Irwin SW (1970) Electron microscope studies of Fasciola hepatica. IX. The
fine structure of Mehlis' gland. Z Parasitenkd 35: 16-30
Turk JL (1992) Granulomatous diseases. In: McGee JOD, Isaacson PG, Wright NA, Dick
HM, Slack MPE (eds) Oxford Textbook of Pathology. Oxford University Press, USA,
Oxford. pp 394-406
Tyler S, Tyler MS (1997) Origin of the epidermis in parasitic platyhelminths. Int J Parasitol
27: 715-738
133
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Van de Vijver KK, Deelder AM, Jacobs W, Van Marck EA, Hokke CH (2006) LacdiNAcand LacNAc-containing glycans induce granulomas in an in vivo model for schistosome
egg-induced hepatic granuloma formation. Glycobiology 16: 237-243
Vogel H (1942) Über Entwicklung, Lebensdauer und Tod der Eier vom Bilharzia japonica im
Wirtsgewebe. Dtsch Tropenmed Ztsch 46: 57-91
von Lichtenberg F (1967) The bilharzial pseudotubercle: a model of the immunopathology of
granuloma formation. PAHO Orig Sci Pub 107-127
Warren KS (1978) The pathology, pathobiology and pathogenesis of schistosomiasis. Nature
273: 609-612
Wells KE, Cordingley JS (1991) Schistosoma mansoni: eggshell formation is regulated by pH
and calcium. Exp Parasitol 73: 295-310
WHO – World Health Organization (2006) Report of the Scientific Working Group meeting
on Schistosomiasis. Geneva
Williams DL, Asahi H, Botkin DJ, Stadecker MJ (2001) Schistosome infection stimulates
host CD4(+) T helper cell and B-cell responses against a novel egg antigen, thioredoxin
peroxidase. Infect Immun 69:1134-41
Younossi-Hartenstein A, Ehlers U, Hartenstein V (2000) Embryonic development of the
nervous system of the rhabdocoel flatworm Mesostoma lingua (Abilgaard, 1789). J
Comp Neurol 416: 461-474
Younossi-Hartenstein A, Hartenstein V (2000a) Comparative approach to developmental
analysis: the case of the dalyellid flatworm, Gieysztoria superba. Int J Dev Biol 44: 499506
Younossi-Hartenstein A, Hartenstein V (2000b) The embryonic development of the polyclad
flatworm Imogine mcgrathi. Dev Genes Evol 210: 383-398
134
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Younossi-Hartenstein A, Hartenstein V (2001) The embryonic development of the
temnocephalid flatworms Craspedella pedum and Diceratocephala boschmai. Cell
Tissue Res 304: 295-310
Zalokar M, Erk I (1977) Phase-partition fixation and staining of Drosophila eggs. Stain
Technol 52: 89-95
135
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Legends
Figure 1. Miracidial morphology by confocal laser scanning microscopy (CLSM). Virtual
sections in ventral view of the same whole mount miracidium stained with hydrochloric
carmine. a Panoramic view of an intermediate plane. b Detail of the anterior region, showing
the terebratorium (t) and the apical gland (ag). c Detail of the neural mass (nm) flanked by the
lateral glands (lg). d Detail of posterior region, showing three germ cells (gc). np neuropile; c
cilia. Scale bars 20 µm.
Figure 2. Intrafemale egg development. a-b Bright field micrographs of female worms. c-f
Confocal laser scanning microscope images of wholemount females (a-e) and in vitro laid egg
(f) stained with hydrochloric carmine. a Female ovary. The arrow represents the direction of
oocyte maturation. H&E-staining. b-c Detail of the ovary, showing mature oocytes (o). Note
in b the vitelline duct full of vitelline cells (vc). Giemsa-staining. In c, a mature oocyte leaves
the ovary by projecting a pseudopod (arrow). d Eggshell formation in the ootype (ot). This
zygote was surrounded by 40 vitelline cells. e Egg in the uterus. This egg has 45 vitelline
cells. f Early laid egg in culture. Notice no cleavage during intrafemale egg development.
Plasma membranes seem to disappear progressively. z zygote; ds digestive system; sr seminal
receptacle. Scale bars 50 µm.
Figure 3. Statistical analysis of egg growth. a-b Only the biological relevant relationships
were plotted, i.e., M-I:M-II, M-II:M-III, M-III:M-IV, and M-IV:M-V, where M is the
maturation stage in roman numerals (according to the Vogel and Prata’s classification). a
Simultaneous 95% confidence intervals for comparing estimated mean areas of cultivated
eggs during growth under in vitro conditions (RPMI-1640 medium). b Simultaneous 95%
confidence intervals for comparing estimated mean areas of isolated eggs during growth in the
136
Artigo 2
Jurberg et al. – Development, Genes and Evolution
murine host. The overlapping of confidence intervals with the vertical dotted line at abscissa 0
indicates no pairwise difference between maturation stages at a level of confidence set as
0.05. Positive significant mean differences are bigger than 0 for the lower intervals, while
negative significant mean differences are lower than 0 for higher intervals. See details in the
text. c Box plot of egg area in different stages of maturation (M) in regard to egg source (S).
S1 refers to eggs obtained from the host and S2 refers to eggs maintained in culture. d
Simultaneous 95% confidence intervals for comparing estimated mean areas of each matching
stages for both sources (isolated and cultivated), i.e. M-I:M-I, M-II: M-II, M-III:M-III, MIV:M-IV, and M-V:M-V.
Figure 4. Early stages of S. mansoni embryonic development. a, f, g, n Bright field
micrographs of whole eggs obtained from the host. a, g, n Basic fuchsine-staining. f
Unstained egg. b-e, l, m, q, r Bright field micrographs of eggs in the intestine of the host. b, l,
m, r PASH-staining. c Giemsa-staining. e Masson trichrome-staining. q PAS-AB pH 1.0. h-j,
o, p Confocal laser scanning microscope images of wholemount eggs stained with
hydrochloric carmine. Both eggs were obtained from the host. a-f Stage 1, early cleavage. a
The embryonic disc is not visible. The egg is full of yolk (yk). Note yolk nuclei. b, c, e
Embryonic cells (em) in early cleavage. The surrounding vitelline cells fuse. d Detail of the
vitelline cells stained in green. Cytoplasmic vacuoles seem to occur. e Transversal section of
the vegetal pole, showing six macromeres. f Late stage 1. The light embryonic disc (em) in the
center of the egg. Yolk is dark. g-m Stage 2, late cleavage. g The embryonic disc (em)
increases in size, occupying one-half of the diameter of the egg. h, j Virtual sections of the
same egg, showing the stereoblastula. i Detail of h (inset). A highly vacuolated vitelline cell
in degradation process. l, m The stereoblastula exhibits several mitotic figures (mi) and
pycnotic nuclei (py). A macromere detaches from the embryo and adheres to the eggshell,
giving rise to the outer envelope (oe). n-r Stage 3. n The embryonic disc (em) elongates. o, p
137
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Virtual sections of the same egg reveal at least two types of cells (considering the nuclear
morphology) and the outer envelope (oe). q A marked difference on the staining pattern
between the embryonic cells and the yolk syncytium is evident. Yolk (yk) is stained with the
PAS reaction, indicating a rich neutral glycoconjugate content. r The embryo still exhibits
several mitotic figures (mi) and some pycnotic nuclei (py). At one pole some cells seems to be
compromised with the inner envelope (ie) differentiation. Scale bars 20 µm.
Figure 5. Stage 4 of S. mansoni embryonic development. a-c, j Bright field micrographs of
eggs in the intestine of the host. a-c Giemsa-staining. j Masson trichrome-staining. d-i
Confocal laser scanning microscope images of the same whole-mounted egg isolated from the
host stained with hydrochloric carmine. a, b Parasagittal sections of the embryo reveal the
differentiation of the inner envelope (ie) and at least two types of cells (tI and tII). Type II cells
are probably differentiating neuroblasts and concentrate in the interior of the embryo. In b, the
outer envelope (oe) seems to fuse with the yolk (yk). Pycnotic nuclei (py) are also visible. c
Transversal section of the embryo, showing the syncytial aspect of the inner envelope and the
localization of type-I (tI) and type-II (tII) cells. d-i Virtual sections of the same egg in ventral
view, showing the outer envelope (oe), the inner envelope (ie), cell types I and II (tI and tII),
and the onset of the neural mass formation. j Parasagittal sections of the embryo reveal the
differentiation of the neural mass primordium (nmp) with an acellular central region, called
neuropile (np). Notice the neuroblast nuclei stained in green on Masson trichrome. Scale bars
20 µm.
Figure 6. Stage 5 of S. mansoni embryonic development. a Bright field micrograph of a
whole egg obtained from the host, stained with basic fuchsine. The embryo occupies almost
the entire egg. Some yolk is located at the poles. Notice a more stained round mass in the
mid-region of the embryo. It is the neural mass primordium (nmp). b, c Bright field
138
Artigo 2
Jurberg et al. – Development, Genes and Evolution
micrographs of eggs in the intestine of the host. b Giemsa-staining. c PASH-staining. d-i
Confocal laser scanning microscope images of the same whole-mounted egg stained with
hydrochloric carmine. This egg was obtained from in vitro cultivation. b Parasagittal section
of the embryo shows the neural mass primordium (nmp) and its acellular neuropile (np), the
inner envelope (ie) and the onset of epidermis (epi) formation, by the fusion of some
peripheral cells. Type-I cells (tI) are spread mainly at the poles of the embryo. They will give
rise to the miracidial glands and to the germ cells. c Transversal section of the embryo,
detaching the neural mass primordium (nmp), its neuropile (np), and the syncytial epidermis
primordium (epi). The neuropile (np) has a slight staining in red on PASH sections. d-i
Virtual sections of the same egg in ventral view, showing the inner envelope (ie), the
epidermis (epi) primordium, yolk (yk), type-I cells (tI)), the neural mass primordium (nmp),
and its acellular neuropile (np). Scale bars 20 µm.
Figure 7. Stage 6 of S. mansoni embryonic development. a-c Bright field micrographs of eggs
in the intestine of the host. a, b PASH- staining. c Masson trichrome-staining. d-i Confocal
laser scanning microscope images of the same whole-mounted egg isolated from the host
stained with hydrochloric carmine. . a, c Parasagittal sections of the embryo reveal the
differentiation of miracidial glands and of the terebratorium (t). a Just above the neural mass
primordium (nmp) two laterally located type-I cells start to produce PAS-positive cytoplasmic
granules and will give rise to the lateral glands (lg). More anteriorly, other three type-I cells
also produce PAS-positive granules and will fuse to form the apical gland (ag). The inner
envelope (ie) is also positive to the PAS reaction. b Transversal section of three different
eggs. Notice the positive PAS-staining only in some type-I-like cells. c The epidermis (epi) is
almost fully formed, but no underlying musculature and cilia were revealed by the Masson
trichrome-staining (compare to Figs. 8b, g). d-i Virtual sections of the same egg in ventral
view, showing the inner envelope (ie), the epidermis (epi) primordium, yolk (yk), the
139
Artigo 2
Jurberg et al. – Development, Genes and Evolution
terebratorium (t), the formation of the two lateral glands (lg) and the three apical gland (ag)
nuclei, the neural mass primordium (nmp) and its acellular neuropile (np), and some germinal
cells (gc). Scale bars 20 µm.
Figure 8. Stages 7 and 8 of S. mansoni embryonic development. a-d, f, g Bright field
micrographs of eggs in the intestine of the host. a, c, d, f PASH- staining. b, g Masson
trichrome-staining. e Bright field micrographs of whole eggs obtained from the host, stained
with basic fuchsine. h-n Confocal laser scanning microscope images of the same wholemounted egg isolated from the host, stained with hydrochloric carmine. a, b, c Stage 7. a, b
Parasagittal sections of the embryos showing that the embryonic development is almost
complete. Notice the morphology of neuronal nuclei. They are bigger than in stage 8 and
present a lighter staining pattern. In a, the apical gland (ag) is completely fused and the lateral
glands (lg) are also formed. The basement membrane (bm) is distinguishable on PAS-stained
sections. In b, the epidermis (epi) is fully formed, presenting cilia (c). Masson trichromestaining reveals its underlying musculature (mu). The apical gland (ag) presents a granular
pattern of staining when compared with the lateral glands (lg). c Detail of the neural mass
primordium (nmp) from Fig. 8a. d Detail of the mature neural mass (nm) from Fig. 8f.
Compare c and d to notice the nuclear condensation of neuronal nuclei and the increase of
neuropile (np) size. The mature neural mass has smaller neuronal nuclei, with a stronger
pattern of staining. d-n Stage 8, mature egg. e In whole-stained mature egg, the neural mass
(nm), the terebratorium (t), and some germinal cells (gc) are visible under BM. f, g
Parasagittal sections of the mature larvae. In f, the PAS-positive gland contents seem to be
secreted to the interior of the egg in the murine host. In g, compare the staining pattern
between the apical gland (ag) and the lateral gland (lg) on the Masson trichrome sections.
Neuronal nuclei seem to be tightly compacted and darker than in stage 7 (compare to Fig. 8b).
h-n Virtual sections of the same egg in ventral view, showing the mature miracidium ready to
140
Artigo 2
Jurberg et al. – Development, Genes and Evolution
hatch. It is possible to distinguish the epidermal plates and their cilia (c), the inner envelope
(ie), a space between this envelope and the fully formed epidermis (epi), called Lehman
lacuna (l), the terebratorium (t), the pair of lateral glands (lg), the apical gland (ag), the
mature neural mass (nm) and its acellular neuropile (np), and the germinal cells (gc). Scale
bars 20 µm.
Figure 9. The oogram technique by brightfield and confocal microscopies. a-c Bright field
micrographs of compressed fragments of S. mansoni-infected mouse intestines (oogram
technique). a Classical oogram. Three mature eggs are shown. b, c Compressed intestinal
fragments stained with hydrochloric carmine under BM. It is difficult to identify the stages of
maturation in each egg. d, e, f Confocal laser scanning microscope images of carmine-stained
fragments of compressed intestines. d Two mature eggs (stage 8) shown in a sagittal section
and a third egg in an oblique view (nm, neural mass; np, neuropile; lg, lateral glands; gc,
germinal cells). e Stage 2 egg, with the developing embryo (em). The stereoblastula and the
yolk are visible. f Stage 3 egg, with an elongate embryo (em) and some yolk (yk). Scale bars
100 µm.
Figure 10. Comparison between the staging systems of S. mansoni egg maturation. a-e Bright
field micrographs of whole, unstained eggs isolated from the murine host, in accordance to
the Vogel and Prata’s staging system. a Stage I. b Stage II. See Fig. 4f to an egg in early stage
II. c Stage III. d Stage IV. e Stage V (mature egg). Notice the increase in embryo size in
relation to egg size itself. Scale bar 20 µm. More details in the text. f Schematic drawings of
the major events of egg embryogenesis in ventral view. Anterior is at the top and posterior at
the bottom. The number at the bottom left of each drawing indicates the embryonic stage
regarding the morphological events, as defined in the text. Tissues are shaded in different
colors as shown at the bottom right of the panel. Dotted lines indicate cell fusion. Cilia were
141
Artigo 2
Jurberg et al. – Development, Genes and Evolution
not represented. They arise in late stage 7. Drawings are not in scale. For more informations
on the morphological events during embryogenesis, see the text. The zygotic stage (also stage
0) occurs inside the female worm, from the formation of the eggshell in the ootype. Stage 1
corresponds to Vogel and Prata’s stage I. Stage 2 to Vogel and Prata’s stage II, and Stages 3
and 4 to Vogel and Prata’s stage III. Stages 5, 6, and 7 occur during Vogel and Prata’s stage
IV. Finally, the mature embryo in stage 8 corresponds to Vogel and Prata’s stage V.
Figure 11. Patterns of PAS-positive reaction during S. mansoni egg embryogenesis. a-c Light
microscope micrographs of eggs in the intestine of the host, stained by the PAS-AB method. a
Eggs in stage 1 show positive reaction only in the yolk. No positive reaction stains the embryo
(em) itself. b During the stage 4, a light positive reaction stains the inner envelope (ie). The
embryonic primordium (em) remains negative to the PAS reaction. c Mature eggs (stage 8)
are completely positive to the PAS reaction, except by the neural mass (nm) and the basement
membrane (bm), that are slightly stained. It is possible to distinguish the neuronal nuclei and
the neuropile (np) due to this negative staining.
142
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Table 1. Experimental design
Stagesa
Source
total
I
II
III
IV
V
isolated
30
30
30
30
30
150
cultivated
30
30
30
30
30
150
total
60
60
60
60
60
300
a
according to Vogel and Prata’s staging system
Table 2. Estimated mean areas (µm2) during S. mansoni egg growth in mice (isolated) and
under in vitro conditions (cultivated).
Source
Stagesa
Isolated SD
Cultivated SD
P value
I
3812.74 243.66
3492.87 450.73
0.325
II
3974.96 406.26
3442.46 394.08
0.005b
III
4280.97 464.45
5422.56 560.71
0.0001b
IV
5003.54 870.83
5948.06 428.83
0.0001b
V
6832.23 576.61
6730.61 510.27
0.999
a
according to Vogel and Prata’s staging system
b
statistical significance (P < 0.05)
143
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 1
144
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 2
145
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 3
146
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 4
147
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 5
148
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 6
149
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 7
150
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 8
151
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 9
152
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 10
153
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Figure 11
154
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Electronic Supplementary Material 1
155
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Electronic Supplementary Material 2
156
Artigo 2
Jurberg et al. – Development, Genes and Evolution
Electronic Supplementary Material 3
157
Considerações Finais
Dissertação de Mestrado
V- Considerações Finais
158
Considerações Finais
Dissertação de Mestrado
V – Considerações Finais
V. 1 – Discussão
Os últimos avanços na biologia dos esquistossomos foram principalmente
impulsionados pelos recentes adventos técnicos em Biologia Molecular e Bioquímica
(proteômica), o que gerou uma enorme quantidade de dados (como em VerjovskiAlmeida et al. 2003, 2004, 2007; Cass et al. 2007). Usando técnicas tradicionais
(p.ex. histologia e cultura de vermes) e microscopia óptica avançada (CLSM), essa
dissertação buscou responder uma das lacunas da biologia dos esquistossomos,
isto é, como acontece o desenvolvimento embrionário dos ovos de S. mansoni.
De fato, a biologia dos ovos vem sendo considerada apenas marginalmente,
como destacado na Fundamentação Teórica. Em geral, os ovos são tratados como
uma
entidade
invariável
durante
o
tempo
(desenvolvimento
embrionário).
Provavelmente, tal prática é resultante da ampla presença de ovos maduros após
procedimentos de isolamento a partir de intestinos e fígados de animais infectados
(Dresden e Payne 1981) ou da dificuldade em separar grandes quantidades de ovos
em estádios distintos de amadurecimento. No entanto, em estudos moleculares,
essa generalização pode gerar resultados equivocados sobre a expressão de algum
gene ou a presença de alguma proteína, por exemplo. Nesse caso, portanto, é
necessário um esforço maior e mais refinado na obtenção e separação dos ovos, ou
ainda, o emprego de kits de extração e técnicas de ampliação de material mais
sensível e eficaz para a avaliação dos mecanismos moleculares durante a
embriogênese
dos
ovos
de
esquistossomos.
É
possível,
ainda,
que
o
desenvolvimento embrionário dos ovos tenha sido superficialmente considerado até
o momento por causa de limitações técnicas impostas pela casca do ovo, ou mesmo
pela
grande
presença
de
células
vitelínicas
nos
estádios
iniciais
do
desenvolvimento.
Como resultado direto do esforço para descrever o desenvolvimento
embrionário de S. mansoni, dois artigos foram elaborados e estão incluídos nos
resultados dessa dissertação (Jurberg et al. 2008a; Jurberg et al. em preparação).
Um terceiro artigo, sobre a localização de antígenos do ovo durante o seu
desenvolvimento embrionário, está em preparação. Como consequência indireta
desse trabalho (para a obtenção de miracídios), um simples aparelho de eclosão foi
manufaturado e patenteado (2007). A sua avaliação experimental como método
diagnóstico para a esquistossomose originou um artigo (Jurberg et al. 2008b).
Outro método diagnóstico também foi desenvolvido. Por ser baseado em um
princípio diferente, ele também é capaz de diagnosticar outras helmintíases além da
159
Considerações Finais
Dissertação de Mestrado
esquistossomose. Sua patente está ainda pendente. Por essa razão, a avaliação
experimental desse outro método ainda não foi publicada. Recentemente, ambos os
métodos foram também avaliados em campo. A publicação desse inquérito aguarda
o término da análise das amostras e a redação do(s) manuscrito(s).
V.1.1 – Sistemas de classificação
Tradicionalmente, os ovos de esquistossomos são classificados a partir da
relação de tamanhos entre o embrião e o ovo propriamente dito (Vogel 1942; Prata
1957). Embora útil, esse sistema de estagiamento não considera a complexidade
dos eventos morfogenéticos que ocorrem durante o amadurecimento dos ovos.
Assim, conforme descrito no segundo artigo científico dessa dissertação, critérios
morfológicos de fácil reconhecimento em cortes histológicos e em ovos inteiros
analisados sob microscopia confocal foram definidos e identificados. A partir desses
critérios,
foi
então
desenvolvimento
proposto
embrionário
um
dos
novo
ovos
sistema
de
de
classificação
esquistossomos.
Esse
para
o
sistema,
entretanto, não é de todo original, tendo sido adaptado a partir de um sistema de
estagiamento inicialmente introduzido para platielmintos de vida-livre (Hartenstein
e
Ehlers
2000;
Younossi-Hartenstein
et
al.
2000;
Younossi-Hartenstein
e
Hartenstein 2000a, b, 2001; Ramachandra et al. 2002; Morris et al. 2004; Cardona
et al. 2005, 2006). A similaridade temporal em que eventos morfológicos homólogos
ocorrem entre os táxons de platielmintos possibilita que eles sejam comparados
filogeneticamente (ver adiante).
Todavia, os critérios morfológicos utilizados como referência não são
identificáveis em ovos vivos (como em cultura ou no caso da técnica do oograma),
ou em ovos inteiros sob microscopia de campo claro convencional. Por essa razão,
correlacionamos o sistema de estadiamento proposto com a classificação de Vogel
(1942) e de Prata (1957), conforme também exposto no segundo artigo (Jurberg et
al. em preparação). Nesse mesmo artigo, apresentamos uma adaptação do protocolo
de visualização de ovos inteiros individuais em CLSM (Jurberg et al. 2008a) para a
análise de ovos inteiros em fragmentos de intestino comprimidos, como na técnica
do oograma de Pellegrino e Faria (1965). Por exemplo, em situações de avaliações
quimioterapêuticas in vivo, a utilização em conjunto de ambas as técnicas pode
possibilitar a rápida inferência de alterações nas frequências de cada estádio de
amadurecimento (via técnica clássica de oograma) e da visualização de alterações
morfológicas nos embriões (via técnica do oograma para microscopia confocal), caso
elas de fato ocorram. Nesse caso, esse novo método necessita ser ainda melhor
avaliado. É importante ressaltar ainda que para a visualização adequada dos ovos,
160
Considerações Finais
Dissertação de Mestrado
as amostras de intestino devem ser fortemente achatadas ao serem fixadas, antes
de serem coradas. Por sua vez, em ovos individualizados, a remoção da casca (malsucedida até o momento) pode facilitar o acesso ao embrião, tornando possível a
construção de mapas de linhagem celular, imunomarcações em embriões inteiros e
análises ultra-estruturais do embrião propriamente dito, por exemplo.
Como apresentado no segundo artigo, o sistema de estadiamento proposto e
a classificação introduzida por Vogel (1942) e por Prata (1957) são, de fato,
complementares. Elas devem ser utilizadas de acordo com a conveniência e o
objetivo de cada investigação. No entanto, em alguns casos (p.ex. ver Freitas et al.
2007), é importante considerar os eventos morfológicos da embriogênese do ovo,
mesmo quando em uma primeira etapa do experimento, somente o sistema de Vogel
(1942) e de Prata (1957) possa ser empregado. Por exemplo, o estádio IV de Vogel e
Prata
pode
ser
subdividido
em
três
momentos
morfológicos
distintos
(cronologicamente: formação da epiderme; diferenciação do terebratório e das
glândulas miracidianas, e; o condensamento nuclear da massa nervosa), segundo a
nossa classificação. Assim, por revelar a complexidade morfológica durante o
amadurecimento dos ovos, é possível que o sistema de estadiamento apresentado
aqui possa contribuir para uma melhor compreensão da biologia dos ovos. Em
especial, ele pode ser empregado na busca por alterações fenotípicas e na
imunolocalização (em criosecções) de antígenos do ovo durante o desenvolvimento.
V.1.2 – Desenvolvimento embrionário in vivo e in vitro
Diversos protocolos de cultura de vermes adultos e ovos estão disponíveis na
literatura (p.ex., ver Michaels e Prata 1968; Lewis 2001; Kusel et al. 2006; Freitas et
al. 2007). Esses protocolos são empregados nas mais variadas investigações, desde
a
preparação
de
SEA
e
produção
de
anticorpos
monoclonais,
avaliações
quimioterapêuticas e em ensaios bioquímicos e moleculares, como por exemplo,
transfecção e inibição da expressão gênica por técnicas de RNA de interferência.
Alguns estudos avaliaram a oviposição e/ou o amadurecimento dos ovos em
diferentes condições de cultura (p.ex. Michaels e Prata 1968; Schiller et al. 1975;
Newport e Weller 1982a, b; Barth et al. 1996; El-Ridi et al. 1997). No entanto, pela
primeira vez, detalhes dos eventos morfológicos durante a embriogênese foram
revelados em ovos cultivados in vitro. Além disso, o desenvolvimento embrionário
desses ovos foi comparado com o desenvolvimento de ovos isolados a partir do
hospedeiro murino.
A dificuldade de acompanhamento dos eventos morfológicos em ovos vivos
fez necessária a utilização dos dois sistemas de estagiamento, reforçando a
161
Considerações Finais
Dissertação de Mestrado
complementaridade entre ambas as classificações. Em um primeiro momento, ovos
isolados e ovipostos em cultura foram classificados de acordo com o sistema de
Vogel (1942) e de Prata (1957) para a mensuração de seus eixos (maior
comprimento e largura) e subsequente cálculo de suas áreas. A área média de cada
estádio foi utilizada como parâmetro para comparação de crescimento, a partir de
modelagem estatística de variância por ANOVA two-way e teste Post Hoc de Tukey,
em ambiente R. Em um segundo momento, os ovos isolados e cultivados em cada
estádio do desenvolvimento foram fixados e corados para análise ao microscópio
confocal
(segundo
o
novo
sistema
de
classificação
do
desenvolvimento).
Aparentemente, a morfologia dos ovos foi bastante similar, comparando os estádios
correspondentes entre si. A avaliação conjunta desses resultados sugere que o
amadurecimento (acompanhado pelo crescimento em tamanho) dos ovos in vivo e in
vitro ocorreu a taxas desiguais, pois os padrões de desenvolvimento atingiram o
mesmo ponto: os ovos maduros em ambas as condições não exibiram diferenças
significativas entre as médias de suas áreas, os embriões maduros apresentaram as
mesmas características ao microscópio confocal e os ovos, quando colocados em
água, eclodiram e liberaram miracídios capazes de infectarem B. glabrata, com
eliminação de cercárias.
Segundo Michaels e Prata (1968), uma importante diferença morfológica nos
ovos cultivados é a ausência de sinais de morte quando comparados com ovos
obtidos a partir do hospedeiro. Recentemente, Sarvel e colaboradores (2006)
utilizaram a sonda fluorescente Hoechst 33258 para marcação dos núcleos de
células danificadas, assim diferenciando ovos mortos de ovos viáveis. Esse método,
no entanto, não foi aplicado com sucesso em conjunção com a coloração por
carmim clorídrico, mesmo alterando a ordem das etapas de coloração (dados não
mostrados). A utilização de outros corantes fluorescentes em conjunção com essa
sonda para viabilidade dos ovos precisa ainda ser avaliada. Para contornar essa
limitação, uma grande quantidade de ovos foi analisada, além dos ovos com sinais
evidentes de morte não terem sido avaliados. Assim, a cultura de ovos sob as
condições empregadas pode ser valiosa para estudos morfológicos da embriogênese,
como a determinação de mapas de destino. Todavia, em estudos moleculares e
bioquímicos, cuidados especiais devem ser considerados na interpretação dos
dados, como destacado por Gobert e colaboradores (2007) para esquistossômulos.
162
Considerações Finais
Dissertação de Mestrado
V.1.3 – Desenvolvimento embrionário e filogenia
“A evolução da forma ocorre por meio de alterações no desenvolvimento
embrionário” sintetizou Carrol (2006). Como visto na fundamentação teórica dessa
dissertação, as relações filogenéticas dos diversos táxons de platielmintos têm
certas incompatibilidades, com a persistência de alguns grupos parafiléticos. Uma
suposta
relação
filogenética
entre
os
diferentes
táxons
de
platielmintos,
considerando os vermes Acoela e Nemertodermatida como grupo externo aos
Platyhelminthes stricto sensu, foi sumariada na Fig. 1.14. No grupo parafilético
basal “Archoophora” são reunidos, por conveniência, aqueles que possuem ovos
endolécitos, ricos em vitelo. Anteriormente incluídos entre os platielmintos
arcoóforos, os Acoela apresentam um padrão único de desenvolvimento com
clivagem espiral em dueto, pouco parecido com outros espiralianos (p.ex. policlados)
(Henry et al. 2000). Nenhuma informação foi encontrada sobre a embriogênese dos
Nemertodermatida. É possível que ambos os grupos possuam características
embrionárias consideradas basais entre os platielmintos verdadeiros.
Por sua vez, o grupo dos platielmintos verdadeiros pode ser subdividido em
dois grandes ramos. Em um deles, representado pelos Catenulida, não foram
encontradas informações sobre a sua embriogênese. Contudo, sabe-se que eles se
reproduzem assexuadamente por fissão transversal, formando cadeias de zoóides
(Hyman 1951; ver também Egger et al. 2007). Já o táxon monofilético
Rhabditophora reúne os Macrostomorpha e os Trepaxonemata. Dentro dos
Macrostomorpha, encontram-se os Haplopharyngida e Macrostomida; porém, não
foram
encontradas
informações
sobre
o
desenvolvimento
embrionário
dos
Haplopharyngida. Os macrostomídeos apresentam uma modificação do padrão de
clivagem observado nos vermes acoelos, i.e., ao invés de duetos de células, são
formados quartetos. Neles, os micrômeros não são tão menores do que os
macrômeros. A estereoblástula resultante é cercada por uma camada vitelínica
externa transitória (membrana externa, do inglês hull membrane), a partir da
diferenciação de grandes células vegetais periféricas (Seilern-Aspang 1957; Tyler
1981;
Morris
et
al.
2004).
A
gastrulação
nesse
grupo
também
difere
significantemente do modo espiraliano típico, que é preservado em outros
arcoóforos. Como a formação do manto vitelínico externo, a gastrulação se
assemelha aos estádios iniciais do desenvolvimento de neoóforos (Bresslau 1904;
Hartenstein e Ehlers 2000; Morris et al. 2004). Assim, após a formação do manto
vitelínico, as células no interior do embrião estabelecem um primórdio digestório
rico em vitelo, formado por células grandes localizadas mais centralmente, e um
primórdio somático, que consiste de células menores localizadas anteriormente.
163
Considerações Finais
Dissertação de Mestrado
Gradualmente, essas células expandem-se posteriormente para formar massas
celulares mesenquimais achatadas, em cada lado do primórdio intestinal. Somente
durante os estádios tardios da embriogênese, bem após o início da diferenciação
celular, que o primórdio somático expande dorsalmente e ventralmente para
encerrar o primórdio intestinal (Morris et al. 2004).
Os Trepaxonemata ramificam-se ainda em duas linhagens, os Polycladida
basais e os Neoophora. Uma diferença é marcante no modo de formação da parede
corporal entre macrostomídeos e policlados (e outros espiralianos): nos policlados,
as células da membrana externa (do inglês, hull cells) não estão presentes. O
primórdio definitivo da epiderme é formado por micrômeros animais em um estádio
inicial durante a gastrulação, que por movimentos epibólicos alongam-se sobre as
grandes células ricas em vitelo no pólo vegetal (Surface 1907; Boyer et al. 1996,
1998; Younossi-Hartenstein e Hartenstein 2000b; Morris et al. 2004).
Os platielmintos neoóforos são agrupados juntos por possuírem ovos
ectolécitos, com células acessórias individualizadas (células vitelínicas), e se
ramificam
também
“Lecithoepitheliata”,
em
e
duas
outra
linhagens:
monofilética,
uma
chamada
parafilética,
chamada
Eulecithophora.
Os
“Lecithoepitheliata” reúnem cerca de 30 espécies, por dividirem uma condição
intermediária entre ovos endolécitos e ectolécitos (Brusca e Brusca 2003). Poucas
informações sobre a embriogênese desse grupo estão disponíveis. Por epibolia, um
quarteto de micrômeros alonga-se sobre os macrômeros, formando uma membrana
externa transitória (hull membrane) que circunda parte do vitelo em uma cavidade
corporal embrionária primária. Outros micrômeros reconstituem o ectoderma
embrionário propriamente dito, definindo a superfície ventral do embrião. Esse
ectoderma se expande gradualmente, envolvendo todo o embrião e o vitelo
posicionado logo abaixo da membrana externa (Reisinger et al. apud Hartenstein e
Ehlers 2000).
Os eulecitoforados agrupam os clados Prolecithophora, Rhabdocoela e
“Seriata”.
Não
foram
encontradas
informações
sobre
a
embriogênese
dos
prolecitóforos. O grupo parafilético “Seriata” possui uma grande capacidade
regenerativa, utilizada como estratégia de reprodução assexuada. Ele reúne os
Proseriata, os Bothrioplanida e os Tricladida. Dentre os “Seriata”, os tricladidos têm
recebido especial atenção. Eles compartilham diversas características com outros
neoóforos, mas são únicos em alguns aspectos. Os embriões não apresentam o
padrão regular de clivagem em espiral e formam uma massa irregular de
blastômeros praticamente iguais, que fica localizada no centro do vitelo. No
primórdio embrionário, os órgãos se diferenciam sem a ocorrência de gastrulação e
164
Considerações Finais
Dissertação de Mestrado
a formação evidente de camadas germinativas. Os blastômeros são altamente
móveis e deslocam-se ao redor do vitelo (fenômeno conhecido por “anarquia dos
blastômeros”). A faringe embrionária diferencia-se bombeando vitelo para o
embrião, dando origem à cavidade digestória. Durante esse processo, o primórdio
embrionário é deslocado para a periferia do ovo. Por essa razão, uma delgada
camada celular (banda germinativa) ao redor da cavidade digestória é formada. Ao
contrário da organogênese de outros platielmintos, a dispersão do primórdio
embrionário em estádios iniciais do desenvolvimento causa a formação irregular de
camadas de células. Os diversos tipos de precursores ficam misturados e somente
consolidam os primórdios de órgãos e dão forma ao embrião relativamente tarde
durante o desenvolvimento.
Os
rabdocelos
(“Dalyellioida”,
representam
Endoaxonemata,
seis
sub-clados,
alguns
Kalyptorhynchia,
parafiléticos
“Typhloplanoida”,
Temnocephalida e Revertospermata). A espécie tifloplanóide Mesostoma lingua, por
exemplo, parece também não seguir o padrão típico de clivagem em espiral, mas
investigações adicionais são ainda necessárias (Hartenstein e Ehlers 2000). Nessa
espécie, a membrana externa transitória (hull membrane) é formada exclusivamente
por células vitelínicas, ao invés de blastômeros. Desde o início, a membrana externa
circunda o vitelo inteiramente, de modo que a formação de uma faringe embrionária
não
é
necessária.
Não
parece
ocorrer
gastrulação
(considerando
como
o
estabelecimento de camadas germinativas antes do aparecimento dos primórdios de
órgãos). Os órgãos surgem a partir de agrupamentos homogêneos maciços de
células mesenquimais.
Investigações sobre genes homólogos desse grupo, que
sabidamente são responsáveis pela especificação das camadas germinativas em
outros animais, ainda precisam ser realizadas (para mais detalhes, ver Hartenstein
e Ehlers 2000).
Entre os Revertospermata estão reunidos os Fecampiida e os Mediofusata.
Os Mediofusata abrangem as famílias Urastomidae, Genostomatidae e o grupo
parasita Neodermata, que inclui as tradicionais classes Trematoda, Cestoda e
Monogenea. Dentro dos trematódeos, como visto na Fundamentação Teórica,
encontra-se a espécie estudada nessa dissertação. Nossos resultados sugerem que
o desenvolvimento do ovo de S. mansoni ocorre, aparentemente, de modo similar ao
padrão rabdocelo descrito na espécie M. lingua, no qual a gastrulação parece não
ocorrer (ver Hartenstein e Ehlers 2000). Grupamentos de células mesenquimais
também parecem originar os primórdios de órgãos. Entretanto, ao contrário dos
rabdocelos, o embrião de esquistossomo não forma faringe e intestino durante o seu
desenvolvimento no ovo. Provavelmente, a ausência dessas estruturas está
165
Considerações Finais
Dissertação de Mestrado
associada com hábito parasita. Esses órgãos somente surgem durante a
transformação
miracídio-esporocisto-cercária
no
interior
do
hospedeiro
intermediário (Pan 1996).
Outro evento similar entre esquistossomos e rabdocelos é a formação dos
envoltórios embrionários, que podem ser derivados da membrana externa (huell
membrane) dos turbelários. Por exemplo, no Mesostoma, essa membrana transitória
surge a partir de células vitelínicas que circundam o embrião ventralmente e
desaparecem progressivamente em torno do estádio 6 (Hartenstein e Ehlers 2000).
Contudo,
como
esquistossomos
em
têm
outros
dois
platielmintos
envoltórios,
parasitas
que
podem
(p.ex.
ser
uma
cestódeos),
os
adaptação
ao
parasitismo. Tais envoltórios protegem o embrião em desenvolvimento e o miracídio
completamente
formado,
atuam
como
compartimentos
de
produção
e
armazenamento de nutrientes, secretam materiais imunogênicos que podem atuar
na expulsão dos ovos para o lúmen intestinal e propiciam espaço para os
movimentos miracidianos antes da eclosão (Neill et al. 1988; Swiderski 1994;
Ashton et al. 2001; ver também Conn e Swiderski 2008). No S. mansoni, ambos os
envoltórios são celulares em origem, sincicial em natureza e circundam o embrião
(Swiderski 1994). Todavia, o envoltório externo tem origem mista (a partir de
macrômeros e células vitelínicas) e desaparece gradualmente tal qual a membrana
externa (huell membrane), enquanto o envoltório interno origina-se a partir de
mesômeros e persiste até a eclosão do ovo (Swiderski 1994).
Como exposto por Hartenstein e Ehlers (2000) para a espécie M. lingua,
investigações adicionais sobre os destinos celulares durante o desenvolvimento
(mapa de destino) e a presença de genes homólogos e suas localizações nos tecidos
do embrião em desenvolvimento precisam ser realizados para esclarecer alguns dos
eventos morfológicos observados nesse trabalho e acrescentar novas informações à
filogenia dos platielmintos em geral e à biologia dos ovos de esquistossomo. Se, de
fato, “a evolução da forma ocorre por meio de alterações no desenvolvimento
embrionário” (Carrol 2006), resta determinar quais alterações no desenvolvimento
embrionário dos platielmintos de vida-livre deu origem ao hábito parasita e definiu
a evolução dos esquistossomos.
V.1.4 – Desenvolvimento embrionário e granulomatogênese
Por si só, os ovos de S. mansoni têm destacada importância na infecção
esquistossomótica. Aqueles que não conseguem atingir o lúmen intestinal podem
causar
reações
inflamatórias
focais
(granulomas),
que
comprometem
o
funcionamento regular de diversos órgãos, em especial, o fígado. Em casos mais
166
Considerações Finais
Dissertação de Mestrado
graves, a infecção pode evoluir até o óbito. Como mencionado na Fundamentação
Teórica, entretanto, a formação de granulomas não ocorre ao redor de ovos
imaturos isolados (Prata 1957), mas é estreitamente dependente de ovos maduros
viáveis (Sorour 1929; Espin 1941).
Ao contrário do que era tradicionalmente considerado (Asahi et al. 1999;
Stadecker et al. 2001), os antígenos secretados pelos ovos maduros totalizam 188
proteínas (Cass et al. 2007). Utilizando soro de coelho previamente imunizado
contra as proteínas totais secretadas pelo ovo (ESP), Ashton e colaboradores (2001)
relataram que essas proteínas encontravam-se presentes predominantemente no
envoltório interno do ovo maduro (envoltório de von Lichtenberg); em ovos maduros,
tal estrutura possui retículo endoplasmático rugoso desenvolvido e grandes
agregados de material granular (Ashton et al. 2001). Com isso, eles sugeriram que
esse envoltório seria a fonte principal de secreções do ovo. Anticorpos monoclonais
anti-LacdiNAc (GalNAcβ1-4GlcNAc) e anti-IPSE/alfa-1 também localizaram seus
respectivos epítopos nessa mesma região (van Remoortere et al. 2000; van den Berg
et al. 2004; Schramm et al. 2006). Mais tarde, van de Vijver e colaboradores (2006)
atribuíram atividade granulomatogênica às glicoproteínas com unidades terminais
LacNAc (Galβ1-4GlcNAc, como na asialofetuina) ou LacdiNAc (GalNAcβ1-4GlcNAc).
Convencionalmente, as glicoproteínas podem ser demonstradas por técnicas
de coloração seletivas. Glicoconjugados neutros são revelados pela reação do ácido
periódico de Schiff (PAS), enquanto a diferenciação entre glicoconjugados ácidos
sulfatados e carboxilados pode ser realizada por modificações do método do azul de
Alciano (AB), apenas variando o pH das soluções (Kierman 1990). A utilização
dessas técnicas possibilitou avaliar a presença e localização de glicoproteínas
durante a embriogênese dos ovos. No entanto, ensaios histoquímicos com lectinas e
imuno-histoquímicos com anticorpos monoclonais contra os recentes descobertos
antígenos secretados do ovo (Cass et al. 2007) necessitam ainda serem realizados
para avaliar especificamente suas respectivas produções, localizações e dispersões
para o ambiente periovular durante a embriogênese dos ovos (localizoma).
Nossos resultados apontaram que a diferenciação do envoltório interno do
ovo, durante os estádios 3 e 4, é acompanhada por um aumento gradual de
positividade à reação ao PAS. O mesmo é observado em secções coradas pelas
técnicas de PAS-AB. Todavia, a produção de glicoconjugados neutros não é
exclusiva desse envoltório. No estádio 6, as células precursoras das glândulas
miracidianas passam a apresentar grânulos citoplasmáticos fortemente positivos ao
PAS. Mais tarde, com o embrião maduro, os conteúdos glandulares parecem ser
secretados para o interior dos ovos. Em secções coradas ao PAS-AB, as
167
Considerações Finais
Dissertação de Mestrado
glicoproteínas neutras ocupavam praticamente a totalidade dos embriões em
estádios mais tardios. Glicoconjugados ácidos não foram detectados pela coloração
ao AB durante toda a embriogênese. É possível que o material glandular também
contribua para a formação de granulomas. Nesse caso, o conteúdo glandular
liberado para o interior do ovo maduro (estádio 8) pode difundir através dos
envoltórios do ovo e alcançar o meio circundante. Nesse cenário, além do envoltório
interno produzir componentes imunogênicos, ele poderia atuar também como uma
barreira de liberação lenta dos antígenos para o ambiente periovular, como
postulado anteriormente por Ashton e colaboradores (2001). A diferenciação tardia
das glândulas miracidianas também suporta esse cenário. No entanto, o papel das
glândulas miracidianas na granulomatogênese ainda precisa ser melhor avaliado. O
ensaio de Ashton e colaboradores (2001) com imunomarcação anti-ESP em
microscopia de fluorescência convencional não deixa claro se outras estruturas do
ovo maduro estavam positivas.
Utilizando o mesmo modelo animal empregado nesse trabalho (camundongos
Swiss Webster), Romanha (2007) demonstrou que a oviposição tem início aos 30
dias após a infecção (p.i.) (ver também Brener 1956; Lenzi JA 1998; Lenzi et al.
2008a). Como inferido nessa dissertação, os ovos são liberados na vasculatura do
hospedeiro ainda sem terem sofrido qualquer clivagem. Nesse ambiente, os ovos
causam
uma
resposta
celular
inicial
(RI,
reação
inicial),
que
persiste
preponderantemente no fígado pelos próximos cinco a sete dias de infecção (35-37
dias p.i.) (Romanha 2007). O mecanismo de sensibilização do hospedeiro para essa
reação ainda é desconhecido. Todavia, a RI parece estar relacionada com o
amadurecimento dos ovos, que também tem aproximadamente a mesma duração
(Prata 1957; Pellegrino et al. 1962; Michaels e Prata 1968; Romanha 2007). Em
seguida, com os ovos maduros, a RI é substituída pelo estádio exsudativo (E), ainda
pré-granulomatoso. O estádio granulomatoso tem início a partir do 38° dia de
infecção, quando os granulomas hepáticos podem apresentar-se no estádio
exsudativo-produtivo (EP) inicial, com a presença de células fibroblastóides
dispersas (ver também Lenzi JA 1998; Lenzi et al. 1998; Romanha 2007). Um pouco
mais tarde, com 45 dias p.i., os granulomas mais velhos estão no estádio EP
maduro, com a definição de três zonas (central, paracentral e periférica) bem
delimitadas. Até esse momento, 15 dias se passaram desde a chegada dos primeiros
ovos ao fígado. Granulomas em outros estádios mais recentes de desenvolvimento
podem ser encontrados, devido à liberação contínua de ovos pelas fêmeas adultas.
Em seguida, os granulomas mais velhos evoluem para o estádio produtivo (P),
exibindo arranjo concêntrico compacto das fibras colagênicas na zona paracentral.
168
Considerações Finais
Dissertação de Mestrado
No hospedeiro, os ovos permanecem viáveis por cerca de 18-28 dias a partir da sua
oviposição (Prata 1957; Lenzi JA 1998). Com a morte do miracídio no interior do
ovo, o estímulo antigênico é interrompido, dando início a processos involutivos
(Lenzi et al. 1998; Lenzi et al. 2006; Romanha 2007).
O papel do amadurecimento dos ovos na formação dos granulomas parece
estar bem definido. Todavia, como mencionado anteriormente, a participação das
glândulas miracidianas ainda precisa ser melhor avaliada. De fato, os mecanismos
de interação ovo-granuloma ainda precisam ser melhor compreendidos através da
realização de novos estudos histoquímicos e imuno-histoquímicos. Para isso, é
preciso determinar o momento preciso e a localização para cada uma das 188
proteínas secretadas pelo ovo, bem como a sua difusão ao redor dos ovos e a
resposta
imunológica,
que
é
gerada
em
diferentes
linhagens
organismos
hospedeiros. No momento, uma meta-análise da literatura disponível revela que
apenas
pouquíssimos
antígenos
do
ovo
foram
localizados
por
anticorpos
monoclonais, em trabalhos que investigaram apenas ovos maduros (Jurberg et al.
em preparação). Estudos por microscopia eletrônica de transmissão podem ainda
revelar detalhes adicionais sobre a organogênese do miracídio e essa relação.
Todavia, a casca do ovo como barreira à impregnação de resinas é uma limitação
que precisa ser superada.
169
Considerações Finais
Dissertação de Mestrado
V. 2 – Conclusões e Perspectivas
1. O desenvolvimento embrionário dos ovos de esquistossomosos é mais complexo
do que considerado previamente por outros autores. Essa dissertação descreveu,
pela primeira vez, a sequência de eventos morfológicos até a completa formação do
miracídio.
2. As fêmeas de esquistossomosos possuem modo de desenvolvimento neoóforo,
com a participação de um órgão especializado (glândulas vitelínicas) na produção de
células vitelínicas. Essas células circundam o zigoto como uma camada celular
separada. Na literatura, o número de células vitelínicas no ovo recém-formado não é
preciso. Nossos resultados preliminares apontam para cerca de 40-45 células
vitelínicas por ovo.
3. Uma extensa análise de um amplo número de ovos tornou possível a construção
de uma sequência plausível dos eventos da embriogênese de S. mansoni;
4. O tratamento com hidróxido de potássio para a remoção da autofluorescência da
casca
mostrou
resultados
insatisfatórios
para
o
estudo
morfológico
do
desenvolvimento embrionário de S. mansoni e E. paraensei por CLSM. No entanto, a
microscopia confocal em conjução com a técnica do carmim clorídrico possibilitou a
visualização tridimensional em grandes detalhes da anatomia interna dos ovos
durante o seu desenvolvimento;
5. A partir de critérios morfológicos, o desenvolvimento dos ovos pode ser dividido
em dez estádios. De fato, os dois primeiros estádios são pré-embrionários e ocorrem
no interior da fêmea, enquanto os outros oito estádios ocorrem no hospedeiro (ou
em cultura). Resumidamente, o estádio pré-zigótico refere-se à liberação do oócito
maduro pelo ovário da fêmea; o estádio zigótico (também estádio 0) compreende a
fecundação a até a primeira clivagem. Os estádios subsequentes acontecem no
exterior. No estádio 1, ocorrem as clivagens iniciais. O estádio 2 refere-se às
clivagens tardias, com a formação de uma estereoblástula. No estádio 3, há o
alongamento e a diversificação do primórdio embrionário. No estádio 4, ocorre a
diferenciação de alguns primórdios (p.ex. massa nervosa). O estádio 5 é
caracterizado pelo início da formação de órgãos e tecidos (p.ex. epiderme). No
estádio 6, as glândulas miracidianas começam se diferenciar. No estádio 7, ocorre o
condensamento nuclear dos neurônios da massa nervosa e a diferenciação do
170
Considerações Finais
Dissertação de Mestrado
terebratório. O estádio 8 refere-se à larva completamente formada, logo antes de
eclodir;
6. A dificuldade de visualização desses critérios morfológicos em ovos inteiros nãocorados tornou necessária a correlação dos eventos observados com o sistema de
Vogel (1942) e de Prata (1957) (em algarismos romanos). Tais autores não
classificaram o desenvolvimento no interior das fêmeas, que dividimos em dois
momentos: antes da fecundação (estádio pré-zigótico) e formação do zigoto até a
primeira divisão celular (estádio zigótico ou estádio 0). As clivagens iniciais
correspondem ao primero estádio de ambos os sistemas de classificação (o embrião
é muito pequeno para ser visível sob microscopia de campo claro). O mesmo é
verdadeiro para o estádio subsequente. No nosso estádio 2, as clivagens tardias dão
origem a uma estereoblástula, que se posiciona no centro do ovo, como no estádio II
de Vogel e de Prata. O estádio III de Vogel e de Prata (embrião ocupa dois terços do
comprimento do ovo) pode ser dividido em dois momentos: nosso estádio 3 refere-se
ao início da citodiferenciação, enquanto o nosso estádio 4 refere-se ao surgimento
dos primeiros primórdios de órgãos. O estádio IV de Vogel e de Prata (aumento do
embrião, que ocupa quase todo interior do ovo) compreende os principais estádios
da organogênese: o nosso estádio 5 refere-se ao início da formação da epiderme; no
estádio 6 ocorre a diferenciação do terebratório e das glândulas miracidianas, e; no
estádio 7, a massa nervosa sofre condensamento nuclear. O último estádio para
ambos os sistemas de estadiamento (estádio V de Vogel e de Prata e estádio 8)
refere-se ao mirácidio completamente formado, antes de eclodir. Ambos os sistemas
de estadiamento são, portanto, complementares. Sempre que pertinente, eles
podem ser utizados em conjunto, a depender da conveniência e objetivos do estudo;
7.
Apesar
dos
esforços
empregados
durante
a
realização
desse
trabalho
(tratamentos químicos, físicos e enzimáticos), a casca do ovo permanece como uma
limitação técnica à impregnação por resinas, à realização de imunomarcações e a
uma melhor visualização do embrião em preparados inteiros. Novas tentativas para
a sua remoção devem ser realizadas;
8. As técnicas de visualização de ovos inteiros (em ovos isolados e no oograma)
apresentadas nessa dissertação parecem promissoras na busca de alterações
fenotípicas durante a embriogênese em avaliações in situ e in vitro de drogas
esquistossomicidas, bem como em estudos moleculares pela técnica de RNA de
interferência. É possível que a remoção da casca melhore a visualização do embrião,
171
Considerações Finais
Dissertação de Mestrado
o que provavelmente facilitaria a construção de mapas de destino celular e outros
estudos;
9. A comparação estatística da área média dos ovos durante seu desenvolvimento in
vitro e in vivo indica que a idade dos ovos e o ambiente no qual eles se desenvolvem
interagem para determinar seus tamanhos durante o amadurecimento. As
diferenças significativas observadas na área média estimada para essas duas
condições sugerem que o amadurecimento dos ovos ocorre a taxas desiguais, já que
a morfologia entre os estádios correspondentes pareceu similar. Ovos mantidos em
cultura (RPMI-1640) atigiram a maturidade e liberaram larvas viáveis, que
infectaram caramujos B. glabrata;
10. Quando comparado com os ovos no hospedeiro, a ausência de sinais de morte
(recente)
em
ovos
mantidos
em
cultura
dificulta
a
precisa
avaliação
do
desenvolvimento embrionário nessas condições. O emprego da sonda fluorescente
Hoechst 33258 para diferenciar ovos mortos não foi satisfatório quando em
conjunto com a técnica do carmim clorídrico;
11. A fusão celular é um evento-chave durante a embriogênese dos ovos de S.
mansoni. Eventos de fusão celular ocorrem na formação dos envoltórios da casca,
na diferenciação da epiderme e da glândula apical. O(s) mecanismo(s) de fusão, no
entanto, permane(m) desconhecido(s) para S. mansoni;
12. Sinais de apoptose (núcleo picnótico) foram identificados durante a clivagem
tardia, o estádio de blástula e a organogênese inicial. Estudos adicionais devem ser
realizados para avaliar seu papel na homeostasia tecidual durante a formação e
rearranjo de tecidos;
13. Tradicionalmente, a formação de granulomas está associada à presença de ovos
maduros viáveis. Os ovos liberam para o meio circundante glicoproteínas
imunogênicas ao hospedeiro. Previamente, tais proteínas foram localizadas no
envoltório interno do ovo (envoltório de von Lichtenberg). Nossos resultados
apontaram para uma marcada mudança no perfil de reação ao PAS (que evidencia
glicoproteínas neutras) durante o desenvolvimento dos ovos. A partir do estádio 4,
o envoltório interno em diferenciação passou a apresentar gradual reação positiva
ao PAS. Isso corrobora a literatura disponível, que atribuí a essa estrutura um
172
Considerações Finais
Dissertação de Mestrado
importante papel na produção e liberação de antígenos do ovo para o meio
periovular.
14. Em seguida, a diferenciação das glândulas miracidianas (a partir do estádio 6)
também
foi
acompanhada
por
uma
grande
produção
citoplasmática
de
glicoproteínas neutras grânulares (positivas à reação de PAS). Em ovos maduros,
tais conteúdos glandulares foram secretados para o interior do ovo. É possível,
portanto, que o material glandular também contribua para a formação de
granulomas. Como proposto anteriormente, além de seu papel na produção
antigênica, o envoltório interno pode também atuar com uma barreira de lenta e
gradual
liberação
antigênica.
Nesse
caso,
a
diferenciação
das
glândulas
miracidianas reforçaria o cenário de granulomatogênese apenas ao redor de ovos
maduros, visto que a produção de glicoproteínas somente tem início tardiamente
durante o desenvolvimento. Os ovos maduros apresentaram-se fortemente positivos
à reação de PAS. Estudos imunoistoquímicos e histoquímicos (lectinas) devem ser
realizados
para
avaliar
o
papel
da
diferenciação
glandular
durante
a
granulomatogênese;
15. Filogeneticamente, o desenvolvimento dos ovos de S. mansoni apresentou-se
bem similar ao padrão rabdocelo. Isso reforça a posição filogenética atual desses
dois grupos. Por sua vez, as diferenças morfológicas observadas na embriogênese de
S. mansoni podem estar associadas à aquisição do hábito de vida parasitário;
16. Os miracídios de S. mansoni parecem possuir uma “variação” das células
totipotentes (neoblastos) de outros platielmintos (p.ex. planárias). Essas células
(células germinativas) darão origem aos esporocistos durante a infecção do
hospedeiro invertebrado. As células germinativas apresentam características
histológicas e ultraestruturais de células imaturas (blastômeros) e são de difícil
identificação durante os estádios iniciais da embriogênese (por se assemelharem
aos blastômeros). É possível, portanto, que as células germinativas sejam células
embrionárias que não sofreram diferenciação durante o desenvolvimento, mantendo
suas características totipotentes. No entanto, o papel das células germinativas na
regeneração de partes do miracídio é desconhecido;
17. O postulado de que a sequência temporal em que eventos morfogenéticos
homólogos ocorrem e a estrutura espacial em que eles se desdobram é
173
Considerações Finais
Dissertação de Mestrado
suficientemente similar entre alguns táxons de platielmintos mostrou-se válida
também para S. mansoni, mas com algumas adaptações;
18. O sistema de estadiamento introduzido por Hartenstein e Ehlers (2000) revelouse de grande valor para detalhar e classificar o desenvolvimento da embriogênese do
ovo de esquistossomos. Entretanto, investigações ultraestruturais necessitam ainda
serem realizadas;
19. Acreditamos que o sistema de estagiamento descrito nessa dissertação
contribuirá significativamente para uma melhor compreensão da biologia dos ovos
de esquistossomos, especialmente na determinação (por imuno-histoquímica)
espaço-temporal da produção e liberação de antígenos do ovo;
20.
Estudos
adicionais
com
imunomarcadores
(de
preferência,
anticorpos
monoclonais) são necessários para uma completa discriminação e definição da
morfogênese de cada órgão da larva (miracídio).
174
Referências bibliográficas
Dissertação de Mestrado
VI- Referências Bibliográficas
175
Referências bibliográficas
Dissertação de Mestrado
VI- Referências Bibliográficas
Abath
FG,
Morais
CN,
Montenegro
CE,
Wynn
TA,
Montenegro
SM.
Immunopathogenic mechanisms in schistosomiasis: what can be learnt from
human studies? Trends Parasitol. 2006 Feb;22(2):85-91.
Abbas AK, Lichtman AH. Imunologia Celular e Molecular. Rio de Janeiro: Elsevier;
2005.
Abouel-Nour MF, Lotfy M, Attallah AM, Doughty BL. Schistosoma mansoni major
egg antigen Smp40: molecular modeling and potential immunoreactivity for
anti-pathology
vaccine
development.
Mem
Inst
Oswaldo
Cruz.
2006
Jun;101(4):365-72.
Adams DO. The biology of the granuloma. In: Ioachim HL, editor. Pathology of
Granuloma. New York: Press; 1983. p. 115-39.
Agatsuma T. Origin and evolution of Schistosoma japonicum. Parasitol Int. 2003
Dec;52(4):335-40.
Alger HM, Williams DL. The disulfide redox system of Schistosoma mansoni and the
importance of a multifunctional enzyme, thioredoxin glutathione reductase.
Mol Biochem Parasitol. 2002 Apr 30;121(1):129-39.
Andrade ZA. Schistosomiasis in Brazil after one century of research. Rev Soc Bras
Med Trop. 2002 Sep-Oct;35(5):509-13.
Asahi H, Hernandez HJ, Stadecker MJ. A novel 62-kilodalton egg antigen from
Schistosoma mansoni induces a potent CD4(+) T helper cell response in the
C57BL/6 mouse. Infect Immun. 1999 Apr;67(4):1729-35.
Asahi H, Osman A, Cook RM, LoVerde PT, Stadecker MJ. Schistosoma mansoni
phosphoenolpyruvate carboxykinase, a novel egg antigen: immunological
properties of the recombinant protein and identification of a T-cell epitope.
Infect Immun. 2000 Jun;68(6):3385-93.
Asahi H, Stadecker MJ. Analysis of egg antigens inducing hepatic lesions in
schistosome infection. Parasitol Int. 2003 Dec;52(4):361-7.
Ashton PD, Harrop R, Shah B, Wilson RA. The schistosome egg: development and
secretions. Parasitology. 2001 Mar;122(Pt 3):329-38.
Ax P. Multicellular animals. A new approach to the phylogenetic order in nature.
Berlin: Springer-Verlag; 1996.
Ax P. The phylogenetic system. The systematization of organisms on the basis of
their phylogenies. Chichester, N.Y., Brisbane, Toronto, Singapore: J.Wiley &
Sons; 1987.
176
Referências bibliográficas
Dissertação de Mestrado
Baguñà J, Martinez P, Paps J, Riutort M. Back in time: a new systematic proposal
for the Bilateria. Philos Trans R Soc Lond B Biol Sci. 2008 Jan 11.
Baguñà J, Riutort M. Molecular phylogeny of the Platyhelminthes. Can J Zool.
2004a;82(2): 168–193.
Baguñà J, Riutort M. The dawn of bilaterian animals: the case of acoelomorph
flatworms. Bioessays. 2004b Oct;26(10):1046-57.
Barth LR, Fernandes AP, Rodrigues V. Oviposition by Schistosoma mansoni during
in vitro cultivation. Rev Inst Med Trop Sao Paulo. 1996 Nov-Dec;38(6):423-6.
Basch PF. Schistosomes: Development, reproduction, and host relations. New York:
Oxford University Press; 1991.
Basch PF. Why do schistosomes have separate sexes? Parasitol Today. 1990
May;6(5):160-3.
Bennett JL, Gianutsos G. Disulfiram--a compound that selectively induces
abnormal egg production and lowers norepinephrine levels in Schistosoma
mansoni. Biochem Pharmacol. 1978 Mar 1;27(5):817-20.
Berridge MJ, Irvine RF. Inositol phosphates and cell signalling. Nature. 1989 Sep
21;341(6239):197-205.
Bilharz T. A study on human helminthography. Derived from information by letter
from Dr. Bilharz in Cairo, along with remarks by Prof. Th. V. Siebold in
Breslau. Z Wiss Zool. 1853a;4:53-71.
Bilharz T. Distomum haematobium and its relation to certain pathological chages of
the human urinary organs. Wich Med Wochenschr. 1856;6:49-52, 65-8.
Bilharz T. Further observations concerning Distomum haematobium in the portal
vein of man and its relationship to certain pathological formations. With brief
notes by Prof. Th. V. Siebold on 29 March 1852. Z Wiss Zool. 1853b;4:72-6.
Bloch EH. In vivo microscopy of schistosomiasis. II. Migration of Schistosoma
mansoni in the lungs, liver, and intestine. Am J Trop Med Hyg. 1980
Jan;29(1):62-70.
Boros DL. T helper cell populations, cytokine dynamics, and pathology of the
schistosome egg granuloma. Microbes Infect. 1999 Jun;1(7):511-6.
Boyer BC, Henry JJ, Martindale MQ. The cell lineage of a polyclad turbellarian
embryo reveals close similarity to coelomate spiralians. Dev Biol. 1998 Dec
1;204(1):111-23.
Boyer BC, Henry JQ, Martindale MQ. Dual origins of mesoderm in a basal spiralian:
cell lineage analyses in the polyclad turbellarian Hoploplana inquilina. Dev Biol.
1996 Nov 1;179(2):329-38.
177
Referências bibliográficas
Dissertação de Mestrado
Brant SV, Loker ES. Can specialized pathogens colonize distantly related hosts?
Schistosome evolution as a case study. PLoS Pathog. 2005 Nov;1(3):167-9.
Braun E. Beiträge zur mikroskopischen Anatomie und Fortpflanzungsbiologie von
Gyrodactylus wageneri V. Nordman 1832. Z Parasitenkd. 1966;28:142–174.
Brener Z. Observações sobre a infecção do camundongo pelo Schistosoma mansoni.
Rev Bras Malariol Doencas Trop. 1956 Oct;8(4):565-75.
Bresslau E. Beitraege zur Entwicklungsgeschichte der Turbellarien. I. Die
Entwicklung der Rhabdocoelen und Alloiocoelen. Z Wiss Zool. 1904;76:213332.
Brooks DR, Bandoni SM, Macdonald CA, O’Grady RT. Aspects of the phylogeny of
the Trematoda Rudolphi, 1808 (Platyhelminthes: Cercomeria). Can J Zool.
1989a;67:2609-24.
Brooks DR, McLennan DA. Parascript: Parasites and the Language of Evolution.
Washington, DC: Smithsonian Institute University Press; 1993.
Brooks DR. Phylogenetics and the future of helminth systematics. J Parasitol. 1985
Dec;71(6):719-27.
Brooks DR. The phylogeny of the Cercomeria (Platyhelminthes: Rhabdocoela) and
general evolutionary principles. J Parasitol. 1989b Aug;75(4):606-16.
Brusca RC, Brusca GJ. Invertebrates. 2ª ed. Sunderland (MA): Sinauer Associates.
2003.
Burton PM. Insights from diploblasts; the evolution of mesoderm and muscle. J Exp
Zoolog B Mol Dev Evol. 2008 Jan 15;310(1):5-14.
Cable J, Harris PD, Tinsley RC. Life history specializations of monogenean
flatworms: a review of experimental and microscopical studies. Microsc Res
Tech. 1998 Aug 1;42(3):186-99.
Cable J, Harris PD. Gyrodactylid developmental biology: historical review, current
status and future trends. Int J Parasitol. 2002 Mar;32(3):255-80.
Cable J, Tinsley RC, Harris PD. Survival, feeding and embryo development of
Gyrodactylus gasterostei (Monogenea: Gyrodactylidae). Parasitology. 2002
Jan;124(Pt 1):53-68.
Cai Y, Langley JG, Smith DI, Boros DL. A cloned major Schistosoma mansoni egg
antigen
with
homologies
to
small
heat
shock
proteins
elicits
Th1
responsiveness. Infect Immun. 1996 May;64(5):1750-5.
Caira JN, Jensen K. An investigation of the co-evolutionary relationships between
onchobothriid tapeworms and their elasmobranch hosts. Int J Parasitol. 2001
Jul;31(9):960-75.
178
Referências bibliográficas
Dissertação de Mestrado
Cancado JR, da Cunha AS, Carvalho DD, Carvalho DG, Cambraia JN. Evaluation of
the treatment of human Schistosoma mansoni infection by the quantitative
oogram technique. Bull World Health Organ. 1965;33(4):557-66.
Cardona A, Hartenstein V, Romero R. Early embryogenesis of planaria: a cryptic
larva feeding on maternal resources. Dev Genes Evol. 2006 Nov;216(11):66781.
Cardona A, Hartenstein V, Romero R. The embryonic development of the triclad
Schmidtea polychroa. Dev Genes Evol. 2005 Mar;215(3):109-31.
Carmichael AC. Phylogeny and historical biogeography of the Schistosomatidae
[tese]. East Lansing (Michigan): Michigan State University; 1984.
Carranza S, Baguna J, Riutort M. Are the Platyhelminthes a monophyletic primitive
group? An assessment using 18S rDNA sequences. Mol Biol Evol. 1997
May;14(5):485-97.
Carrol SB. Infinitas formas de grande beleza: como a evolução forjou a grande
quantidade de criaturas que habitam o nosso planeta. Rio de Janeiro: Jorge
Zahar; 2006.
Carvalho O dos S, Coelho PMZ, Lenzi HL. Schistosoma mansoni e Esquistossomose:
uma visão multidisciplinar. Rio de Janeiro: Fiocruz; no prelo 2008.
Cass CL, Johnson JR, Califf LL, Xu T, Hernandez HJ, Stadecker MJ, et al.
Proteomic analysis of Schistosoma mansoni egg secretions. Mol Biochem
Parasitol. 2007 Oct;155(2):84-93.
Cheever AW, Duvall RH, Hallack TA, Jr., Minker RG, Malley JD, Malley KG.
Variation of hepatic fibrosis and granuloma size among mouse strains infected
with Schistosoma mansoni. Am J Trop Med Hyg. 1987 Jul;37(1):85-97.
Cheever AW, Lenzi JA, Lenzi HL, Andrade ZA. Experimental models of Schistosoma
mansoni infection. Mem Inst Oswaldo Cruz. 2002 Oct;97(7):917-40.
Cheever AW, Macedonia JG, Mosimann JE, Cheever EA. Kinetics of egg production
and egg excretion by Schistosoma mansoni and S. japonicum in mice infected
with a single pair of worms. Am J Trop Med Hyg. 1994a Mar;50(3):281-95.
Cheever AW, Mosimann JE, Deb S, Cheever EA, Duvall RH. Natural history of
Schistosoma mansoni infection in mice: egg production, egg passage in the
feces, and contribution of host and parasite death to changes in worm
numbers. Am J Trop Med Hyg. 1994b Mar;50(3):269-80.
Chen Y, Boros DL. Identification of the immunodominant T cell epitope of p38, a
major
egg
antigen,
and
characterization
of
the
epitope-specific
Th
responsiveness during murine schistosomiasis mansoni. J Immunol. 1998 Jun
1;160(11):5420-7.
179
Referências bibliográficas
Dissertação de Mestrado
Cheruku SR, Xu Z, Dutia R, Lobel P, Storch J. Mechanism of cholesterol transfer
from the Niemann-Pick type C2 protein to model membranes supports a role in
lysosomal cholesterol transport. J Biol Chem. 2006 Oct 20;281(42):31594-604.
Cobbold TS. On some new forms of entozoan. Trans Linn Soc Lond. 1859;22:363-6.
Coelho PMZ, Andrade ZA, Borges C, Ribeiro F, Barbosa L. Evolução do Schistosoma
mansoni no Hospedeiro Intermediário. In: Carvalho O dos S, Coelho PMZ, Lenzi
HL,
editores.
Schistosoma
mansoni
e
Esquistossomose:
uma
visão
multidisciplinar. Rio de Janeiro: Fiocruz; no prelo 2008.
Colhoun LM, Fairweather I, Brennan GP. Observations on the mechanism of
eggshell formation in the liver fluke, Fasciola hepatica. Parasitology. 1998
Jun;116 ( Pt 6):555-67.
Combes C. The schistosome scandal. Acta Oecologica. 1991;12:165-73.
Conn DB, Swiderski Z. A standardised terminology of the embryonic envoltórios and
associated developmental stages of tapeworms (Platyhelminthes: Cestoda).
Folia Parasitol (Praha). 2008;55:42-52.
Creighton TE. Encyclopedia of Molecular Biology. Vol. 1-4. New York: John Wiley &
Sons. 1999.
Cribb TH, Bray RA, Littlewood DTJ, Pichelin SP, Herniou EA. The Digenea. In:
Littlewood DTJ, Bray RA, editores. Interrelationships of the Platyhelminthes.
London: Taylor and Francis; 2001. p. 168-85.
Cummings RD, Nyame AK. Schistosome glysoconjugates. Biochim Biophys Acta.
1999 Oct 8;1455(2-3):363-74.
Cunha AS, Pellegrino J, Oliveira CA, Alvarenga RJ. Observations on the oogram in
guinea pigs and rabbits experimentally infected with Schistosoma mansoni. Rev
Inst Med Trop Sao Paulo. 1962 Jul-Aug;4:242-8.
Darwin C. On the Origin of Species by Means of Natural Selection, or the
Preservation of Favoured Races in the Struggle for Life. 1 ed. London: John
Murray; 1859.
Darwin C. The descent of man and selection in relation to sex. 1 ed. London: John
Murray; 1871.
Davis GM. Evolution of prosobranch snails transmitting Asian Schistosoma;
coevolution with Schistosoma: a review. Prog Clin Parasitol. 1993;3:145-204.
Davis GM. Snail hosts of Asian Schistosoma infecting man: origin and coevolution.
Malacol Rev Suppl 1980;2:195 –238.
Day TA, Maule AG. Parasitic peptides! The structure and function of neuropeptides
in parasitic worms. Peptides. 1999;20(8):999-1019.
180
Referências bibliográficas
Dissertação de Mestrado
De Bont J, Vercruysse J. The epidemiology and control of cattle schistosomiasis.
Parasitol Today. 1997 Jul;13(7):255-62.
Despres L, Maurice S. The evolution of dimorphism and separate sexes in
schistosomes. Proc R Soc Lond B Biol Sci. 1995;262:175–180.
DiSilvestro RL. Out on a limb. BioScience. 1997;47:729-31.
Doenhoff MJ, Stanley RG, Pryce D, Curtis RC, Parry H, Griffiths K, et al.
Identification of a fibrinolytic enzyme in Schistosoma mansoni eggs and
modulated
blood
fibrinogen
metabolism
in
S.
mansoni-infected
mice.
Parasitology. 2003 Mar;126(Pt 3):231-4.
Donnelly FA, Appleton CC, Schutte CH. The influence of salinity on the ova and
miracidia of three species of Schistosoma. Int J Parasitol. 1984 Apr;14(2):11320.
Dresden MH, Payne DC. A sieving method for the collection of schistosome eggs
from mouse intestines. J Parasitol. 1981 Jun;67(3):450-2.
Dunne DW, Jones FM, Doenhoff MJ. The purification, characterization, serological
activity and hepatotoxic properties of two cationic glycoproteins (alpha 1 and
omega 1) from Schistosoma mansoni eggs. Parasitology. 1991 Oct;103 Pt 2:22536.
Ebersberger I, Knobloch J, Kunz W. Cracks in the shell--zooming in on eggshell
formation in the human parasite Schistosoma mansoni. Dev Genes Evol. 2005
May;215(5):261-7.
Egger B, Gschwentner R, Rieger R. Free-living flatworms under the knife: past and
present. Dev Genes Evol. 2007 Feb;217(2):89-104.
Egger B, Ishida S. Chromosome fission or duplication in Macrostomum lignano
(Macrostomorpha, Plathelminthes) – remarks on chromosome numbers in
“archoophoran turbellarians”. J Zool Syst Evol Res. 2005; 43:127–132.
Ehlers U. Comments on a phylogenetic system of the Plathelminthes. Hydrobiologia.
1986;132:1–12.
Ehlers U. Das phylogenetische System der Plathelminthes. Stuttgart: Fischer; 1985.
Ehlers U. Phylogenetisches System der Plathelminthes. Verh Naturwissenschaft
Vereins (Hamburg). 1984;27:291–294.
Ehlers
U.
The
basic
organization
of
the
Plathelminthes.
Hydrobiologia.
1995;305:21–26.
El-Dabaa E, Mei H, El-Sayed A, Karim AM, Eldesoky HM, Fahim FA, et al. Cloning
and
characterization
of
Schistosoma
mansoni
fructose-1,6-bisphosphate
aldolase isoenzyme. J Parasitol. 1998 Oct;84(5):954-60.
181
Referências bibliográficas
Dissertação de Mestrado
El-Ridi R, Ozaki T, Inaba T, Ito M, Kamiya H. Schistosoma mansoni oviposition in
vitro reflects worm fecundity in vivo: individual-, parasite age- and hostdependent variations. Int J Parasitol. 1997 Apr;27(4):381-7.
Erasmus DA. A comparative study of the reproductive system of mature, immature
and
"unisexual"
female
Schistosoma
mansoni.
Parasitology.
1973
Oct;67(2):165-83.
Erasmus DA. The adult schistosome: structure and reproductive biology. In:
Rollinson D, Simpson AJG, editores. The biology od schistosomes: from genes
to latrines. London, New York: Academic Press; 1987. p. 51-82.
Espin J. La sustancia metaplasmática en los nódulos producidos por Schistosoma
mansoni. Rev Pol Caracas. 1941;10:73-90.
Fanning MM, Peters PA, Davis RS, Kazura JW, Mahmoud AA. Immunopathology of
murine infection with Schistosoma mansoni: relationship of genetic background
to hepatosplenic disease and modulation. J Infect Dis. 1981 Aug;144(2):14853.
Faust EC, Jones CA, Hoffman WA. Estudios sobre la esquistosomiasis mansoni em
Puerto Rico. III. Estudio biológico. 2. La etapa mamífera del ciclo vital. PR J
Publ Health Trop Med. 1934;10:197-254.
File S. Interaction of schistosome eggs with vascular endothelium. J Parasitol. 1995
Apr;81(2):234-8.
Finnerty JR, Pang K, Burton P, Paulson D, Martindale MQ. Origins of bilateral
symmetry: Hox and dpp expression in a sea anemone. Science. 2004 May
28;304(5675):1335-7.
Fitzpatrick JM, Hirai Y, Hirai H, Hoffmann KF. Schistosome egg production is
dependent upon the activities of two developmentally regulated tyrosinases.
FASEB J. 2007 Mar;21(3):823-35.
Fitzsimmons CM, Schramm G, Jones FM, Chalmers IW, Hoffmann KF, Grevelding
CG, et al. Molecular characterization of omega-1: a hepatotoxic ribonuclease
from Schistosoma mansoni eggs. Mol Biochem Parasitol. 2005 Nov;144(1):1237.
Freitas TC, Jung E, Pearce EJ. TGF-beta signaling controls embryo development in
the parasitic flatworm Schistosoma mansoni. PLoS Pathog. 2007 Apr;3(4):e52.
Fujino T, Nakano T, Washioka H, Tonosaki A, Ichikawa H, Fried B. Comparative
ultrastructure of eggs in Echinostoma paraensei, E. caproni, and E. trivolvis
(Trematoda: Echinostomatidae). Parasitol Res. 2000 May;86(5):427-30.
George PM, Taylor HW, Rollinson T. Cholesterol levels in Christchurch blood
donors. N Z Med J. 1987 Nov 11;100(835):694.
182
Referências bibliográficas
Dissertação de Mestrado
Gilbert SF. Developmental Biology. 7ª ed. Sunderland: Sinauer Associates. 2003.
Girges K. Schistosomiasis (Bilharziasis). London: John Bale, Sons & Danielson.
1934.
Giribet G. Current advances in the phylogenetic reconstruction of metazoan
evolution. A new paradigm for the Cambrian explosion? Mol Phylogenet Evol.
2002 Sep;24(3):345-57.
Gobert GN, Chai M, McManus DP. Biology of the schistosome lung-stage
schistosomulum. Parasitology. 2007 Apr;134(Pt 4):453-60.
Grossman AI, Short RB, Cain GD. Karyotype evolution and sex chromosome
differentiation in Schistosomes (Trematoda, Schistosomatidae). Chromosoma.
1981;84(3):413-30.
Halanych KM, Bacheller JD, Aguinaldo AM, Liva SM, Hillis DM, Lake JA. Evidence
from 18S ribosomal DNA that the lophophorates are protostome animals.
Science. 1995 Mar 17;267(5204):1641-3.
Halton DW. Nutritional adaptations to parasitism within the platyhelminthes. Int J
Parasitol. 1997 Jun;27(6):693-704.
Harris PD. Ecological and genetic evidence for clonal reproduction in Gyrodactylus
gasterostei Glaser, 1974. Int J Parasitol. 1998 Oct;28(10):1595-607.
Harris
PD.
Interactions
between
reproduction
and
population
biology
in
gyrodactylid monogeneans – a review. Bull Fr Peche Piscic. 1993; 328:47-65.
Harris PD. Observations on the development of the male reproductive system in
Gyrodactylus
gasterostei
Gläser
(1974)
(Monogenea,
Gyrodactylidae).
Parasitology. 1985;91:519-29.
Hartenstein V, Ehlers U. The embryonic development of the rhabdocoel flatworm
Mesostoma lingua (Abildgaard, 1789). Dev Genes Evol. 2000 Sep;210(8-9):399415.
Hartenstein V, Jones M. The embryonic development of the bodywall and nervous
system of the cestode flatworm Hymenolepis diminuta. Cell Tissue Res. 2003
Mar;311(3):427-35.
Haszprunar G. The Mollusca: coelomate turbellarians or mesenchymate annelids?
In: Taylor J, editor. Origin and evolutionary radiations of the Mollusca. Oxford:
Oxford University Press; 1996. p. 1-28.
Henkle KJ, Davern KM, Wright MD, Ramos AJ, Mitchell GF. Comparison of the
cloned genes of the 26- and 28-kilodalton glutathione S-transferases of
Schistosoma japonicum and Schistosoma mansoni. Mol Biochem Parasitol. 1990
Apr;40(1):23-34.
183
Referências bibliográficas
Dissertação de Mestrado
Henry JQ, Martindale MQ, Boyer BC. Axial specification in a basal member of the
spiralian clade: Lineage relationships of the first four cells to the larval body
plan in the polyclad turbellarian Hoploplana inquilina. Biol Bull. 1995;189:1945.
Henry JQ, Martindale MQ, Boyer BC. The unique developmental program of the
acoel flatworm, Neochildia fusca. Dev Biol. 2000 Apr 15;220(2):285-95.
Hernandez HJ, Edson CM, Harn DA, Ianelli CJ, Stadecker MJ. Schistosoma
mansoni: genetic restriction and cytokine profile of the CD4 + T helper cell
response to dominant epitope peptide of major egg antigen Sm-p40. Exp
Parasitol. 1998 Sep;90(1):122-30.
Hernandez HJ, Stadecker MJ. Elucidation and role of critical residues of
immunodominant peptide associated with T cell-mediated parasitic disease. J
Immunol. 1999 Oct 1;163(7):3877-82.
Hernandez HJ, Trzyna WC, Cordingley JS, Brodeur PH, Stadecker MJ. Differential
antigen recognition by T cell populations from strains of mice developing polar
forms of granulomatous inflammation in response to eggs of Schistosoma
mansoni. Eur J Immunol. 1997a Mar;27(3):666-70.
Hernandez HJ, Wang Y, Tzellas N, Stadecker MJ. Expression of class II, but not
class I, major histocompatibility complex molecules is required for granuloma
formation in infection with Schistosoma mansoni. Eur J Immunol. 1997b
May;27(5):1170-6.
Hirai H, Taguchi T, Saitoh Y, Kawanaka M, Sugiyama H, Habe S, et al.
Chromosomal differentiation of the Schistosoma japonicum complex. Int J
Parasitol. 2000 Apr 10;30(4):441-52.
Horstmann HJ. Oxygen consumption and glycogen content of the ova of Fasciola
hepatica during the development of the miracidia. Z Parasitenkd. 1962;21:43745.
Horwitz J. Alpha-crystallin can function as a molecular chaperone. Proc Natl Acad
Sci U S A. 1992 Nov 1;89(21):10449-53.
Huxley TH. Evidence as to Man's Place in Nature. New York: D. Appleton; 1863.
Hyman LH. The invertebrates: Platyhelminthes and Rhynchocoela - The acoelomate
Bilateria. 1 ed. New York, Toronto, London: McGraw-Hill; 1951.
Idris N, Fried B. Development, hatching, and infectivity of Echinostoma caproni
(Trematoda) eggs, and histologic and histochemical observations on the
miracidia. Parasitol Res. 1996;82(2):136-42.
Infante-Duarte C, Kamradt T. Th1/Th2 balance in infection. Springer Semin
Immunopathol. 1999;21(3):317-38.
184
Referências bibliográficas
Dissertação de Mestrado
Johnson KS, Wells K, Bock JV, Nene V, Taylor DW, Cordingley JS. The 86kilodalton antigen from Schistosoma mansoni is a heat-shock protein
homologous to yeast HSP-90. Mol Biochem Parasitol. 1989 Aug;36(1):19-28.
Jondelius U, Ruiz-Trillo I, Baguna J, Riutort M. The Nemertodermatida are basal
bilaterians and not members of the Platyhelminthes. Zool Scr. 2002;31(2):20115.
Jurberg AD, Pascarelli BM, Pelajo-Machado M, Maldonado A, Jr., Mota EM, Lenzi
HL. Trematode embryology: a new method for whole-egg analysis by confocal
microscopy. Dev Genes Evol. 2008a May;218(5):267-71.
Jurberg AD, Oliveira AA, Lenzi HL, Coelho PM. A new miracidia hatching device for
diagnosing schistosomiasis. Mem Inst Oswaldo Cruz. 2008b Feb;103(1):112-4.
Kato K. On the development of some Japanese polyclads. Jap J Zool. 1940;8:53773.
Katz N. The discovery of Schistosomiasis mansoni in Brazil. Acta Trop. no prelo
2008. doi:10.1016/j.actatropica.2008.05.002
Khalil LF. Family Schistosomatidae Stiles & Hassall, 1898. In: Gibson DI, Jones A,
Bray RA, editores. Keys to the Trematoda. Wallingford: CABI Publishing; 2002.
p. 419-32.
Khayath N, Mithieux G, Zitoun C, Coustau C, Vicogne J, Tielens AG, et al.
Glyceroneogenesis: an unexpected metabolic pathway for glutamine in
Schistosoma mansoni sporocysts. Mol Biochem Parasitol. 2006 Jun;147(2):14553.
Khoo KH, Chatterjee D, Caulfield JP, Morris HR, Dell A. Structural mapping of the
glycans from the egg glycoproteins of Schistosoma mansoni and Schistosoma
japonicum: identification of novel core structures and terminal sequences.
Glycobiology. 1997 Jul;7(5):663-77.
Kierman JA. Histological and histochemical methods – Theory and practice. 2 ed.
Frankfurt: Pergamon Press; 1990.
Ko DC, Binkley J, Sidow A, Scott MP. The integrity of a cholesterol-binding pocket
in Niemann-Pick C2 protein is necessary to control lysosome cholesterol levels.
Proc Natl Acad Sci U S A. 2003 Mar 4;100(5):2518-25.
Koster B, Dargatz H, Schroder J, Hirzmann J, Haarmann C, Symmons P, et al.
Identification and localisation of the products of a putative eggshell precursor
gene in the vitellarium of Schistosoma mansoni. Mol Biochem Parasitol. 1988
Nov;31(2):183-98.
185
Referências bibliográficas
Dissertação de Mestrado
Kruger FJ, Hamilton-Attwell VL, Joubert PH, Visser PS. The tegument of
Schistosoma hippopotami from Hippopotamus amphibius in the Kruger
National Park. Onderstepoort J Vet Res. 1988 Sep;55(3):153-5.
Kuntz AN, Davioud-Charvet E, Sayed AA, Califf LL, Dessolin J, Arner ES, et al.
Thioredoxin glutathione reductase from Schistosoma mansoni: an essential
parasite enzyme and a key drug target. PLoS Med. 2007 Jun;4(6):e206.
Kusel JR, Oliveira FA, Todd M, Ronketti F, Lima SF, Mattos AC, et al. The effects of
drugs, ions, and poly-l-lysine on the excretory system of Schistosoma mansoni.
Mem Inst Oswaldo Cruz. 2006 Sep;101 Suppl 1:293-8.
Kusel JR. Studies on the structure and hatching of the eggs of Schistosoma
mansoni. Parasitology. 1970 Feb;60(1):79-88.
Kwatia MA, Botkin DJ, Williams DL. Molecular and enzymatic characterization of
Schistosoma mansoni thioredoxin peroxidase. J Parasitol. 2000 Oct;86(5):90815.
La Rue GR. The classification of digenetic trematoda: a review and a new system.
Exp Parasitol. 1957 May;6(3):306-49.
Lang A. Die Polycladen des Golfes von Neapel. Fauna Flora Golf Neapel 1884;11:1688.
Lejoly-Boisseau H, Appriou M, Seigneur M, Pruvost A, Tribouley-Duret J, Tribouley
J. Schistosoma mansoni: in vitro adhesion of parasite eggs to the vascular
endothelium. Subsequent inhibition by a monoclonal antibody directed to a
carbohydrate epitope. Exp Parasitol. 1999 Jan;91(1):20-9.
Lenzi HL, Jurberg AD, Coelho PMZ, Lenzi JA. Migração e Desenvolvimento do
Schistosoma mansoni no Hospedeiro Definitivo. In: Carvalho O dos S, Coelho
PMZ, Lenzi HL, editores. Schistosoma mansoni e Esquistossomose: uma visão
multidisciplinar. Rio de Janeiro: Fiocruz; no prelo 2008a.
Lenzi HL, Romanha W de S, Pelajo-Machado M, Mota EM, Lenzi JA. Patologia
Experimental com Enfoque no Granuloma Esquistossomótico. In: Carvalho O
dos
S,
Coelho
PMZ,
Lenzi
HL,
editores.
Schistosoma
mansoni
e
Esquistossomose: uma visão multidisciplinar. Rio de Janeiro: Fiocruz; no prelo
2008b.
Lenzi HL, Kimmel E, Schechtman H, Pelajo-Machado M, Romanha WS, Pacheco RG,
et
al.
Histoarchitecture
of
schistosomal
granuloma
development
and
involution: morphogenetic and biomechanical approaches. Mem Inst Oswaldo
Cruz. 1998;93 Suppl 1:141-51.
186
Referências bibliográficas
Dissertação de Mestrado
Lenzi HL, Lenzi JA, Kerr IB, Antunes SL, Mota EM, Oliveira DN. Extracellular
matrix in parasitic and infectious diseases. Mem Inst Oswaldo Cruz. 1991;86
Suppl 3:77-90.
Lenzi HL, Lenzi JA, Sobral AC. Eosinophils favor the passage of eggs to the
intestinal lumen in schistosomiasis. Braz J Med Biol Res. 1987;20(3-4):433-5.
Lenzi HL, Romanha W de S, Santos RM, Rosas A, Mota EM, Manso PP, et al. Four
whole-istic aspects of schistosome granuloma biology: fractal arrangement,
internal regulation, autopoietic component and closure. Mem Inst Oswaldo
Cruz. 2006 Sep;101 Suppl 1:219-31.
Lenzi HL, Romanha W de S. Schistosomal granuloma is like a small multicellular
organism that operates as a complex system. In: Mondaini R, editor.
Proceedings of the Second brazilian Symposium on Mathematical and
Computational Biology; Rio de Janeiro. 2003. p. 257-82.
Lenzi JA. Estudo do modelo Calomys callosus Rengger, 1830 (Rodentia: Cricetidae)
na
infecção
poe
Schistosoma
mansoni
Sambon,
1970:
Parâmetros
parasitológicos e histopatológicos [tese]. Salvador: Universidade Federal da
Bahia; 1998.
Lewis F. Schistosomiasis. Curr Protoc Immunol. 2001 May;Chapter 19:Unit 19 1.
Littlewood DTJ, Rohde K, Bray RA, Herniou EA 1999b. Phylogeny of the
Platyhelminthes and the evolution of parasitism. Biol J Linn Soc Lond.
1999b;68:257–287.
Littlewood DTJ, Rohde K, Clough KA. The interrelationships of all major groups of
platyhelminthes: phylogenetic evidence fkom morphology and molecules. Biol J
Linn Soc Lond. 1999a;66: 75-114.
Lockyer AE, Olson PD, Littlewood DTJ. Utility of complete large and small subunit
rRNA genes in resolving the phylogeny of the Neodermata (Platyhelminthes):
implications and a review of the cercomer theory. Biol. J. Linn. Soc.
2003a;78:155–171.
Lockyer AE, Olson PD, Ostergaard P, Rollinson D, Johnston DA, Attwood SW, et al.
The phylogeny of the Schistosomatidae based on three genes with emphasis on
the interrelationships of Schistosoma Weinland, 1858. Parasitology. 2003b
Mar;126(Pt 3):203-24.
Loeffler DA, Lundy SK, Singh KP, Gerard HC, Hudson AP, Boros DL. Soluble egg
antigens from Schistosoma mansoni induce angiogenesis-related processes by
up-regulating vascular endothelial growth factor in human endothelial cells. J
Infect Dis. 2002 Jun 1;185(11):1650-6.
187
Referências bibliográficas
Dissertação de Mestrado
Loker ES, Brant SV. Diversification, dioecy and dimorphism in schistosomes.
Trends Parasitol. 2006 Nov;22(11):521-8.
Loverde PT, Chen L. Schistosome female reproductive development. Parasitol Today.
1991 Nov;7(11):303-8.
Mair GR, Niciu MJ, Stewart MT, Brennan G, Omar H, Halton DW, et al. A
functionally atypical amidating enzyme from the human parasite Schistosoma
mansoni. FASEB J. 2004 Jan;18(1):114-21.
Manson P. Report of a case of bilharzia from the West Indies. Br Med J.
1902;2:1894-5.
Martindale MQ. The evolution of metazoan axial properties. Nat Rev Genet. 2005
Dec;6(12):917-27.
Maturana HR, Varela FJ. De máquinas y serres vivos. 2 ed. Santiago do Chile:
Editorial Universitária; 1994.
Matus DQ, Pang K, Marlow H, Dunn CW, Thomsen GH, Martindale MQ. Molecular
evidence for deep evolutionary roots of bilaterality in animal development. Proc
Natl Acad Sci U S A. 2006 Jul 25;103(30):11195-200.
McKerrow JH, Salter J. Invasion of skin Schistosoma cercariae. Trends Parasitol.
2002 May;18(5):193-5.
Michaels RM, Prata A. Evolution and characteristics of Schistosoma mansoni eggs
laid in vitro. J Parasitol. 1968 Oct;54(5):921-30.
Moczon T, Swiderski Z, Huggel H. Schistosoma mansoni: the chemical nature of the
secretions produced by the Mehlis' gland and ootype as revealed by
cytochemical studies. Int J Parasitol. 1992 Feb;22(1):65-73.
Moore DV, Sandground JH. The relative egg producing capacity of Schistosoma
mansoni and Schistosoma japonicum. Am J Trop Med Hyg. 1956 Sep;5(5):83140.
Morand S, Muller-Graf CD. Muscles or testes? Comparative evidence for sexual
competition among dioecious blood parasites (Schistosomatidae) of vertebrates.
Parasitology. 2000 Jan;120 ( Pt 1):45-56.
Morgan JA, Dejong RJ, Adeoye GO, Ansa ED, Barbosa CS, Bremond P, et al. Origin
and diversification of the human parasite Schistosoma mansoni. Mol Ecol. 2005
Oct;14(12):3889-902.
Morgan JA, DeJong RJ, Kazibwe F, Mkoji GM, Loker ES. A newly-identified lineage
of Schistosoma. Int J Parasitol. 2003 Aug;33(9):977-85.
Morris J, Nallur R, Ladurner P, Egger B, Rieger R, Hartenstein V. The embryonic
development of the flatworm Macrostomum sp. Dev Genes Evol. 2004
May;214(5):220-39.
188
Referências bibliográficas
Dissertação de Mestrado
Moser D, Doumbo O, Klinkert MQ. The humoral response to heat shock protein 70
in human and murine Schistosomiasis mansoni. Parasite Immunol. 1990
Jul;12(4):341-52.
Neill PJ, Smith JH, Doughty BL, Kemp M. The ultrastructure of the Schistosoma
mansoni egg. Am J Trop Med Hyg. 1988 Jul;39(1):52-65.
Nene V, Dunne DW, Johnson KS, Taylor DW, Cordingley JS. Sequence and
expression of a major egg antigen from Schistosoma mansoni. Homologies to
heat shock proteins and alpha-crystallins. Mol Biochem Parasitol. 1986
Nov;21(2):179-88.
Newport GR, Weller TH. Deposition and maturation of eggs of Schistosoma mansoni
in vitro: importance of fatty acids in serum-free media. Am J Trop Med Hyg.
1982a Mar;31(2):349-57.
Newport GR, Weller TH. Miracidia infective for snails derived from eggs laid by adult
Schistosoma mansoni in vitro. Parasitology. 1982b Jun;84(Pt 3):481-90.
Ngaiza JR, Doenhoff MJ. Blood platelets and schistosome egg excretion. Proc Soc
Exp Biol Med. 1990 Jan;193(1):73-9.
Nielsen C. Animal Evolution: Interrelationships of the Living Phyla. Oxford: Oxford
University Press; 1995.
Norén M, Jondelius U. Phylogeny of the Prolecithophora (Platyhelminthes) inferred
from 18S rDNA sequences. Cladistics. 1999(15):103-12.
Noren
M,
Jondelius
U.
The
phylogenetic
position
of
the
Prolecithophora
(Rhabditophora, 'Platyhelminthes'). Zool Scr. 2002;31:403-14.
Novo Aurélio Século XXI - o dicionário da língua portuguesa. 3 ed. São Paulo: Nova
Fronteira; 1999. pp. 2128.
Novo Michaelis - dicionário ilustrado: inglês-português. 2 ed. São Paulo:
Melhoramentos; 1958. pp. 1123.
Novo Michaelis - dicionário ilustrado: português-inglês. São Paulo: Melhoramentos;
1961. pp. 1320.
Olds GR, Dasarathy S. Schistosomiasis. In: Gillespie S, Pearson RD, editores.
Principles and Practice of Clinical Parasitology Chichester: John Wiley & Sons;
2001. p. 369-405.
Olson PD, Cribb TH, Tkach VV, Bray RA, Littlewood DT. Phylogeny and
classification of the Digenea (Platyhelminthes: Trematoda). Int J Parasitol.
2003 Jul;33(7):733-55.
Orido Y. Fertilization and oogenesis of the lung fluke, Paragonimus ohirai
(Trematoda:Troglotrematidae). Int J Parasitol. 1988 Nov;18(7):973-80.
189
Referências bibliográficas
Dissertação de Mestrado
Ottolina C. El miracidio del Schistosoma mansoni: anatomía, citología, fisiología.
Rev Sanid Asist Soc. 1957 Jan-Aug;22(1-4):1-412.
Pan SC. Schistosoma mansoni: the ultrastructure of larval morphogenesis in
Biomphalaria glabrata and of associated host-parasite interactions. Jpn J Med
Sci Biol. 1996 Aug;49(4):129-49.
Pan SC. The fine structure of the miracidium of Schistosoma mansoni. J Invertebr
Pathol. 1980 Nov;36(3):307-72.
Pasquinelli AE, McCoy A, Jimenez E, Salo E, Ruvkun G, Martindale MQ, et al.
Expression of the 22 nucleotide let-7 heterochronic RNA throughout the
Metazoa: a role in life history evolution? Evol Dev. 2003 Jul-Aug;5(4):372-8.
Pearce EJ, Caspar P, Grzych JM, Lewis FA, Sher A. Downregulation of Th1 cytokine
production accompanies induction of Th2 responses by a parasitic helminth,
Schistosoma mansoni. J Exp Med. 1991 Jan 1;173(1):159-66.
Pearson JC. On the position of the digenean family Heronimidae: an inquiry into a
cladistic classification of the Digenea. Syst Parasitol. 1992;21:81-166.
Pellegrino J, Coelho PM. Schistosoma mansoni: wandering capacity of a worm
couple. J Parasitol. 1978 Feb;64(1):181-2.
Pellegrino J, Faria J. The Oogram Method for the Screening of Drugs in
Schistosomiasis Mansoni. Am J Trop Med Hyg. 1965 May;14:363-9.
Pellegrino J, Oliveira CA, Faria J, Cunha AS. New approach to the screening of
drugs in experimental schistosomiasis mansoni in mice. Am J Trop Med Hyg.
1962 Mar;11:201-15.
Philippe H, Brinkmann H, Martinez P, Riutort M, Baguna J. Acoel flatworms are not
platyhelminthes: evidence from phylogenomics. PLoS ONE. 2007;2(1):e717.
Pirajá da Silva MA. Contribuição para o estudo da Schistosomíase na Bahia. Bras
Med. 1908a Aug, Dec;XXII(29, 45 e 46):1-25.
Pirajá da Silva MA. Contribution to the study of Schistosomiasis in Bahia, Brazil. J
Trop Med Hyg. 1909;12:159-64.
Pirajá da Silva MA. La Schistosomose a Bahia. Arch Parasitol. 1908b;tome 13:281300.
Platt TR, Blair D, Purdie J, Melville L. Griphobilharzia amoena n. gen., n. sp.
(Digenea: Schistosomatidae), a parasite of the freshwater crocodile Crocodylus
johnstoni (Reptilia: Crocodylia) from Australia, with the erection of a new
subfamily, Griphobilharziinae. J Parasitol. 1991;77: 65–68.
Platt TR, Brooks DR. Evolution of the schistosomes (Digenea: Schistosomatoidea):
the origin of dioecy and colonization of the venous system. J Parasitol. 1997
Dec;83(6):1035-44.
190
Referências bibliográficas
Dissertação de Mestrado
Prata A. Biópsia retal na esquistossomose mansoni - bases e aplicações no
diagnóstico e tratamento [tese]. Rio de Janeiro: Ministério da Saúde; 1957.
Raikova OI, Reuter M, Kotikova EA, Gustafsson MKS. A commissural brain! The
pattern of 5-HT immunoreactivity in Acoela (Plathelminthes). Zoomorphology.
1998;118:69–77.
Ramachandra NB, Gates RD, Ladurner P, Jacobs DK, Hartenstein V. Embryonic
development
in
the
primitive
bilaterian
Neochildia
fusca:
normal
morphogenesis and isolation of POU genes Brn-1 and Brn-3. Dev Genes Evol.
2002 Mar;212(2):55-69.
Read AF, Nee S. Male schistosomes: more than just muscle? Parasitol Today. 1990
Sep;6(9):297; author reply.
Read CP, Douglas LT, Simmons JE, Jr. Urea and osmotic properties of tapeworms
from elasmobranchs. Exp Parasitol. 1959 Feb;8(1):58-75.
Reisinger E, Cichocki I, Erlach R, Szyskowitz. Ontogenetische Studien an
Turbellarien:
ein
Beitrag
zur
Evolution
der
Dotterverarbeitung
im
ektolezithalen Ei. I Z Zool Syst Evol Forsch. 1974a;12:161–195.
Reisinger E, Cichocki I, Erlach R, Szyskowitz. Ontogenetische Studien an
Turbellarien:
ein
Beitrag
zur
Evolution
der
Dotterverarbeitung
im
ektolezithalen Ei. I Z Zool Syst Evol Forsch. 1974b;12: 241–278.
Reuter M, Raikova OI, Gustafsson MK. An endocrine brain? The pattern of FMRFamide immunoreactivity in Acoela (Plathyelminthes). Tissue Cell. 1998
Feb;30(1):57-63.
Reuter M, Raikova OI, Jondelius U, Gustafsson MKS, Maule AG, Halton DW.
Organisation of the nervous system in the Acoela: an immunocytochemical
study. Tissue Cell. 2001 Apr;33(2):119-28.
Rey L. Parasitologia: parasitos e doenças parasitárias do homem nas Américas e na
África. 3 ed. Rio de Janeiro: Guanabara Koogan; 2001.
Rieger RM, Ladurner P. Searching for the stem species of the Bilateria. Belg J Zool.
2001;131 Suppl 1: 27-34.
Rohde K, Georgi M. Structure and development of Austramphilina elongata
Johnston, 1931 (Cestodaria: Amphilinidae). Int J Parasit. 1983;13:273–287.
Rohde K. Phylogeny of Platyhelminthes, with special reference to parasitic groups.
Int J Parasitol. 1990 Dec;20(8):979-1007.
Rohde K. The Aspidogastrea: an archaic group of Platyhelminthes. In: Littlewood
DTJ, Bray RA, editores. Interrelationships of the Platyhelminthes. London:
Taylor and Francis; 2001. p. 159-67.
191
Referências bibliográficas
Dissertação de Mestrado
Rollinson D, Southgate VR. The genus Schistosoma: a taxonomic appraisal. In:
Rollinson D, Simpson AJG, editores. The biology of schistosomes from genes to
latrines. London: Academic Press; 1987. p. 1 –49.
Romanha W de S. Granuloma esquistossomótico como um sistema adaptativo
complexo.
Aplicação
propriedades
da
geométricas
dimensão
[tese].
fractal
Rio
de
na
caracterização
Janeiro:
Instituto
de
suas
Oswaldo
Cruz/Fiocruz; 2007.
Roux W. The problems, methods and scope of developmental mechanics. Biological
lectures of Marine Biology Laboratory, Woods Hole. Boston: Ginn; 1984. p.
149-90.
Rudel D, Sommer RJ. The evolution of developmental mechanisms. Dev Biol. 2003
Dec 1;264(1):15-37.
Ruiz-Trillo I, Paps J, Loukota M, Ribera C, Jondelius U, Baguna J, et al. A
phylogenetic analysis of myosin heavy chain type II sequences corroborates
that Acoela and Nemertodermatida are basal bilaterians. Proc Natl Acad Sci U
S A. 2002 Aug 20;99(17):11246-51.
Ruiz-Trillo I, Riutort M, Fourcade HM, Baguna J, Boore JL. Mitochondrial genome
data support the basal position of Acoelomorpha and the polyphyly of the
Platyhelminthes. Mol Phylogenet Evol. 2004 Nov;33(2):321-32.
Ruiz-Trillo I, Riutort M, Littlewood DT, Herniou EA, Baguna J. Acoel flatworms:
earliest extant bilaterian Metazoans, not members of Platyhelminthes. Science.
1999 Mar 19;283(5409):1919-23.
Rumbley CA, Phillips SM. The schistosome granuloma: an immunoregulatory
organelle. Microbes Infect. 1999 Jun;1(7):499-504.
Rybicka K. Embryogenesis in cestodes. Adv Parasitol. 1966;4:107-86.
Sambon LW. New or little known African Entozoa. J Trop Med Hyg. 1907a;10:117.
Sambon LW. Remarks on Schistosoma mansoni. J Trop Med Hyg. 1907b;10:303-4.
Sanchez
Alvarado
A.
The
freshwater
planarian
Schmidtea
mediterranea:
embryogenesis, stem cells and regeneration. Curr Opin Genet Dev. 2003
Aug;13(4):438-44.
Sarvel AK, Kusel JR, Araujo N, Coelho P, Katz N. Comparison between
morphological and staining characteristics of live and dead eggs of Schistosoma
mansoni. Mem Inst Oswaldo Cruz. 2006 Sep;101 Suppl 1:289-92.
Sayed AA, Simeonov A, Thomas CJ, Inglese J, Austin CP, Williams DL.
Identification
of
oxadiazoles
as
new
drug
schistosomiasis. Nat Med. 2008 Apr;14(4):407-12.
192
leads
for
the
control
of
Referências bibliográficas
Dissertação de Mestrado
Schiller EL, Bueding E, Turner VM, Fisher J. Aerobic and anaerobic carbohydrate
metabolism and egg production of Schistosoma mansoni in vitro. J Parasitol.
1975 Jun;61(3):385-89.
Schmidt GD, Roberts LS. Foundations of Parasitology. 6 ed. Boston: McGraw-Hill;
2000.
Schmidt J. Glycan vesicle formation in vitellocytes and hatching vacuoles in eggs of
Echinostoma caproni and Fasciola hepatica (Digenea). Tissue Cell. 1998
Aug;30(4):416-26.
Schramm G, Falcone FH, Gronow A, Haisch K, Mamat U, Doenhoff MJ, et al.
Molecular
characterization
of
an
interleukin-4-inducing
factor
from
Schistosoma mansoni eggs. J Biol Chem. 2003 May 16;278(20):18384-92.
Schramm G, Gronow A, Knobloch J, Wippersteg V, Grevelding CG, Galle J, et al.
IPSE/alpha-1: a major immunogenic component secreted from Schistosoma
mansoni eggs. Mol Biochem Parasitol. 2006 May;147(1):9-19.
Seilern-Aspang F. Die Entwicklung von Macrostomum appendiculatum (Fabricius).
Zool Jahrb Anat. 1957;76:311–330.
Sempere LF, Martinez P, Cole C, Baguna J, Peterson KJ. Phylogenetic distribution
of microRNAs supports the basal position of acoel flatworms and the polyphyly
of Platyhelminthes. Evol Dev. 2007 Sep-Oct;9(5):409-15.
Shaffer HB, Meylan P, McKnight ML. Tests of turtle phylogeny: molecular,
morphological, and paleontological approaches. Syst Biol. 1997 Jun;46(2):23568.
Short RB. Presidential address: Sex and the single schistosome. J Parasitol. 1983
Feb;69(1):3-22.
Simeonov A, Jadhav A, Sayed AA, Wang Y, Nelson ME, Thomas CJ, et al.
Quantitative High-Throughput Screen Identifies Inhibitors of the Schistosoma
mansoni Redox Cascade. PLoS Negl Trop Dis. 2008;2(1):e127.
Smith III JPS, Tyler S, Rieger RM. Is the Turbellaria polyphyletic? Hydrobiologia.
1986;132:71-78
Smyth JD, Clegg JA. Egg-shell formation in trematodes and cestodes. Exp Parasitol.
1959 Jun;8(3):286-323.
Smyth JD, Halton DW. The Physiology of trematodes. Cambridge, London, New
York: Cambridge Uni Press; 1983.
Snyder SD, Loker ES. Evolutionary relationships among the Schistosomatidae
(Platyhelminthes:Digenea) and an Asian origin for Schistosoma. J Parasitol.
2000 Apr;86(2):283-8.
193
Referências bibliográficas
Dissertação de Mestrado
Snyder SD. Phylogeny and paraphyly among tetrapod blood flukes (Digenea:
Schistosomatidae and Spirorchiidae). Int J Parasitol. 2004 Nov;34(12):1385-92.
Sorour F. Contribution a l'etude des tumeurs irritatives bénignes et malignes
produites par les Bilharzies. Ann Parasit. 1929;7:39-45.
Spence IM, Silk MH. Ultrastructural studies of the blood fluke--Schistosoma
mansoni. V. The female reproductive system--a preliminary report. S Afr J Med
Sci. 1971 Oct;36(3):41-50.
Sprong H, Suchanek M, van Dijk SM, van Remoortere A, Klumperman J, Avram D,
et al. Aberrant receptor-mediated endocytosis of Schistosoma mansoni
glycoproteins on host lipoproteins. PLoS Med. 2006 Aug;3(8):e253.
Stadecker MJ, Hernandez HJ, Asahi H. The identification and characterization of
new immunogenic egg components: implications for evaluation and control of
the immunopathogenic T cell response in schistosomiasis. Mem Inst Oswaldo
Cruz. 2001;96 Suppl:29-33.
Stadecker MJ, Hernandez HJ. The immune response and immunopathology in
infection with Schistosoma mansoni: a key role of major egg antigen Sm-p40.
Parasite Immunol. 1998 May;20(5):217-21.
Stadecker MJ. The development of granulomas in schistosomiasis: genetic
backgrounds, regulatory pathways, and specific egg antigen responses that
influence the magnitude of disease. Microbes Infect. 1999a Jun;1(7):505-10.
Stadecker MJ. The regulatory role of the antigen-presenting cell in the development
of hepatic immunopathology during infection with Schistosoma mansoni.
Pathobiology. 1999b;67(5-6):269-72.
Stanley RG, Ngaiza JR, Wambayi E, Lewis J, Doenhoff MJ. Platelets as an innate
defence mechanism against Schistosoma mansoni infections in mice. Parasite
Immunol. 2003 Oct;25(10):467-73.
Stavitsky AB. Regulation of granulomatous inflammation in experimental models of
schistosomiasis. Infect Immun. 2004 Jan;72(1):1-12.
Surface FM. The early development of a polyclad, Planocera inquilina. Proc Acad Nat
Sci Phila. 1907;59:514-59.
Swiderski Z. Electron microscopy and histochemistry of oncospheral hook
formation by the cestode Catenotaenia pusilla. Int J Parasitol. 1973
Jan;3(1):27-33.
Swiderski Z. Embryonic development of Schistosoma mansoni [resumo]. S Afr J Sci.
1984;80:434.
Swiderski Z. Origin, differentiation and ultracture of egg envoltórios surrounding
the miracidia of Schistosoma mansoni. Acta Parasitol. 1994;39(2):64-72.
194
Referências bibliográficas
Dissertação de Mestrado
Telford MJ, Lockyer AE, Cartwright-Finch C, Littlewood DT. Combined large and
small subunit ribosomal RNA phylogenies support a basal position of the
acoelomorph flatworms. Proc Biol Sci. 2003 May 22;270(1519):1077-83.
Telford MJ, Wise MJ, Gowri-Shankar V. Consideration of RNA secondary structure
significantly improves likelihood-based estimates of phylogeny: examples from
the bilateria. Mol Biol Evol. 2005 Apr;22(4):1129-36.
Threadgold LT. Fasciola hepatica: stereological analysis of vitelline cell development.
Exp Parasitol. 1982 Dec;54(3):352-65.
Tielens AG, Horemans AM, Dunnewijk R, van der Meer P, van den Bergh SG. The
facultative anaerobic energy metabolism of Schistosoma mansoni sporocysts.
Mol Biochem Parasitol. 1992 Nov;56(1):49-57.
Tielens AG, van den Heuvel JM, van Eden W. Schistosoma mansoni: an HSP60
homologue is constitutively expressed in cercariae, adults, and sporocysts. Exp
Parasitol. 1993 Dec;77(4):495-7.
Tielens AG, van der Meer P, van den Heuvel JM, van den Bergh SG. The enigmatic
presence of all gluconeogenic enzymes in Schistosoma mansoni adults.
Parasitology. 1991 Apr;102 Pt 2:267-76.
Trottein F, Kieny MP, Verwaerde C, Torpier G, Pierce RJ, Balloul JM, et al.
Molecular cloning and tissue distribution of a 26-kilodalton Schistosoma
mansoni glutathione S-transferase. Mol Biochem Parasitol. 1990 Jun;41(1):3544.
Tyler S, Schilling S, Hooge M, Bush LF. Turbellarian taxonomic database. Versão
1.5 [base de dados na internet]. Orono: The University of Maine. [atualizada em
2007
Nov
28].
[acesso
em
2008
Fev
25].
Disponível
em:
http://turbellaria.umaine.edu
Tyler S, Tyler MS. Origin of the epidermis in parasitic platyhelminths. Int J
Parasitol. 1997 Jun;27(6):715-38.
Tyler S. Development of cilia in embryos of the turbellarian Macrostomum.
Hydrobiologia. 1981;84:231–239.
Ubelaker JE. Structure and ultrastructure of the larvae and metacestodes of
Hymenolepis diminuta.
In:
Arai
HP,
editor.
Biology
of
the
tapeworm
Hymenolepis diminuta. New York: Academic Press; 1980. p. 59-156.
Valadares TE, Coelho PM, Pellegrino J, Sampaio IB. Schistosoma mansoni: aspects
of the oviposition of the LE' strain in mice infected with a couple of worms. Rev
Inst Med Trop Sao Paulo. 1981 Jan-Feb;23(1):6-11.
Valentine JW. Cleavage patterns and the topology of the metazoan tree of life. Proc
Natl Acad Sci U S A. 1997 Jul 22;94(15):8001-5.
195
Referências bibliográficas
Dissertação de Mestrado
van de Vijver KK, Deelder AM, Jacobs W, Van Marck EA, Hokke CH. LacdiNAc- and
LacNAc-containing glycans induce granulomas in an in vivo model for
schistosome egg-induced hepatic granuloma formation. Glycobiology. 2006
Mar;16(3):237-43.
van den Berg TK, Honing H, Franke N, van Remoortere A, Schiphorst WE, Liu FT, et
al. LacdiNAc-glycans constitute a parasite pattern for galectin-3-mediated
immune recognition. J Immunol. 2004 Aug 1;173(3):1902-7.
van den Biggelaar JA, Dictus WJ, van Loon AE. Cleavage patterns, cell-lineages and
cell specification are clues to phyletic lineages in Spiralia. Semin Cell Dev Biol.
1997 Aug;8(4):367-78.
van Liempt E, van Vliet SJ, Engering A, Garcia Vallejo JJ, Bank CM, SanchezHernandez M, et al. Schistosoma mansoni soluble egg antigens are internalized
by human dendritic cells through multiple C-type lectins and suppress TLRinduced dendritic cell activation. Mol Immunol. 2007 Apr;44(10):2605-15.
van Remoortere A, Hokke CH, van Dam GJ, van Die I, Deelder AM, van den Eijnden
DH. Various stages of Schistosoma express Lewis(x), LacdiNAc, GalNAcbeta1-4
(Fucalpha1-3)GlcNAc
carbohydrate
and
epitopes:
GalNAcbeta1-4(Fucalpha1-2Fucalpha1-3)GlcNAc
detection
with
monoclonal
antibodies
that
are
characterized by enzymatically synthesized neoglycoproteins. Glycobiology.
2000 Jun;10(6):601-9.
Vanier MT, Millat G. Structure and function of the NPC2 protein. Biochim Biophys
Acta. 2004 Oct 11;1685(1-3):14-21.
Verjovski-Almeida S, DeMarco R, Martins EA, Guimaraes PE, Ojopi EP, Paquola AC,
et al. Transcriptome analysis of the acoelomate human parasite Schistosoma
mansoni. Nat Genet. 2003 Oct;35(2):148-57.
Verjovski-Almeida S, Leite LC, Dias-Neto E, Menck CF, Wilson RA. Schistosome
transcriptome: insights and perspectives for functional genomics. Trends
Parasitol. 2004 Jul;20(7):304-8.
Verjovski-Almeida S, Venancio TM, Oliveira KC, Almeida GT, DeMarco R. Use of a
44k oligoarray to explore the transcriptome of Schistosoma mansoni adult
worms. Exp Parasitol. 2007 Nov;117(3):236-45.
Vermeire JJ, Yoshino TP. Antioxidant gene expression and function in in vitrodeveloping Schistosoma mansoni mother sporocysts: possible role in selfprotection. Parasitology. 2007 Sep;134(Pt 10):1369-78.
Vogel H. Über Entwicklung, Lebensdauer und Tod der Eier vom Bilharzia japonica
im Wirtsgewebe. Dtsch Tropenmed Ztsch. 1942;46:57-91.
196
Referências bibliográficas
Dissertação de Mestrado
von Graff LV. Monographie der Turbellarien. I. Rhabdocoela. Leipzig: Verlag W.
Engelmann; 1882.
Wallberg A, Curini-Galletti M, Ahmadzadeh A, Jondelius U. Dismissal of
Acoelomorpha: Acoela and Nemertodermatida are separate early bilaterian
clades. Zool Scr. 2007;36:509–23.
Warren KS. History of schistosomiasis. In: Warren KS, editor. Schistosomiasis The
evolution of a medical literature. Cambridge: MIT Press; 1973.
Webster BL, Southgate VR, Littlewood DT. A revision of the interrelationships of
Schistosoma including the recently described Schistosoma guineensis. Int J
Parasitol. 2006 Jul;36(8):947-55.
Webster BL, Southgate VR, Tchuem Tchuente LA. Isoenzyme analysis of
Schistosoma haematobium, S. intercalatum and their hybrids and occurrences
of natural hybridization in Cameroon. J Helminthol. 2003 Sep;77(3):269-74.
Weinstock JV, Elliott D, Metwali A, Blum A, Li J, Qadir K, et al. Immunoregulation
within the granulomas of murine schistosomiasis mansoni. Microbes Infect.
1999 Jun;1(7):491-8.
Wells KE, Cordingley JS. Schistosoma mansoni: eggshell formation is regulated by
pH and calcium. Exp Parasitol. 1991 Oct;73(3):295-310.
Wilkinson L. A J E Terzi and L W Sambon: early Italian influences on Patrick
Manson's "Tropical medicine", entomology, and the art of entomological
illustration in London. Med Hist. 2002 Oct;46(4):569-79.
Williams DL, Asahi H, Botkin DJ, Stadecker MJ. Schistosome infection stimulates
host CD4(+) T helper cell and B-cell responses against a novel egg antigen,
thioredoxin peroxidase. Infect Immun. 2001 Feb;69(2):1134-41.
Willmer P. Invertebrate relationships. Patterns in animal evolution. Cambridge:
Cambridge University Press; 1990.
Wilson EB. The cell lineage of Nereis. J Morphol. 1892;6:361-480.
Wilson MS, Mentink-Kane MM, Pesce JT, Ramalingam TR, Thompson R, Wynn TA.
Immunopathology
of
schistosomiasis.
Immunol
Cell
Biol.
2007
Feb-
Mar;85(2):148-54.
Wynn TA, Thompson RW, Cheever AW, Mentink-Kane MM. Immunopathogenesis of
schistosomiasis. Immunol Rev. 2004 Oct;201:156-67.
Wynn TA. Immune deviation as a strategy for schistosomiasis vaccines designed to
prevent infection and egg-induced immunopathology. Microbes Infect. 1999
Jun;1(7):525-34.
Xu YZ, Dresden MH. Leucine aminopeptidase and hatching of Schistosoma mansoni
eggs. J Parasitol. 1986 Aug;72(4):507-11.
197
Referências bibliográficas
Dissertação de Mestrado
Xylander WER. Ultrastructural results concerning the position of Gyrocotyle within
the parasitic Platyhelminthes. Verh Dtsch Zool Ges (München). 1986;79:193–
201.
Xylander WER. Ultrastructure of the lycophora larva of Gyrocotyle urna (Cestoda,
Gyrocotylidea).
I.
Epidermis,
neodermis,
and
body
musculature.
Zoomorphology. 1987;106:352–360.
Yang MY, Dong HF, Jiang MS. Ultrastructural observation of spermatozoa and
fertilization in Schistosoma japonicum. Acta Trop. 2003 Jan;85(1):63-70.
Younossi-Hartenstein A, Ehlers U, Hartenstein V. Embryonic development of the
nervous system of the rhabdocoel flatworm Mesostoma lingua (Abilgaard,
1789). J Comp Neurol. 2000 Jan 24;416(4):461-74.
Younossi-Hartenstein A, Hartenstein V. Comparative approach to developmental
analysis: the case of the dalyellid flatworm, Gieysztoria superba. Int J Dev Biol.
2000a Aug;44(5):499-506.
Younossi-Hartenstein A, Hartenstein V. The embryonic development of the polyclad
flatworm Imogine mcgrathi. Dev Genes Evol. 2000b Sep;210(8-9):383-98.
Younossi-Hartenstein A, Hartenstein V. The embryonic development of the
temnocephalid flatworms Craspedella pedum and Diceratocephala boschmai.
Cell Tissue Res. 2001 May;304(2):295-310.
Zamparo D, Brooks DR, Hoberg EP, McLennan DA. Phylogenetic analysis of the
Rhabdocoela (Platyhelminthes) with emphasis on the Neodermata and
relatives. Zool Scr. 2001;30:59-77.
198
Dissertação de Mestrado
Retirado de http://www.phdcomics.com/
199
Livros Grátis
( http://www.livrosgratis.com.br )
Milhares de Livros para Download:
Baixar livros de Administração
Baixar livros de Agronomia
Baixar livros de Arquitetura
Baixar livros de Artes
Baixar livros de Astronomia
Baixar livros de Biologia Geral
Baixar livros de Ciência da Computação
Baixar livros de Ciência da Informação
Baixar livros de Ciência Política
Baixar livros de Ciências da Saúde
Baixar livros de Comunicação
Baixar livros do Conselho Nacional de Educação - CNE
Baixar livros de Defesa civil
Baixar livros de Direito
Baixar livros de Direitos humanos
Baixar livros de Economia
Baixar livros de Economia Doméstica
Baixar livros de Educação
Baixar livros de Educação - Trânsito
Baixar livros de Educação Física
Baixar livros de Engenharia Aeroespacial
Baixar livros de Farmácia
Baixar livros de Filosofia
Baixar livros de Física
Baixar livros de Geociências
Baixar livros de Geografia
Baixar livros de História
Baixar livros de Línguas
Baixar livros de Literatura
Baixar livros de Literatura de Cordel
Baixar livros de Literatura Infantil
Baixar livros de Matemática
Baixar livros de Medicina
Baixar livros de Medicina Veterinária
Baixar livros de Meio Ambiente
Baixar livros de Meteorologia
Baixar Monografias e TCC
Baixar livros Multidisciplinar
Baixar livros de Música
Baixar livros de Psicologia
Baixar livros de Química
Baixar livros de Saúde Coletiva
Baixar livros de Serviço Social
Baixar livros de Sociologia
Baixar livros de Teologia
Baixar livros de Trabalho
Baixar livros de Turismo