Reações em meio ácido
Sumário e objetivo da aula (2 aulas)
1. O que ocorre com um lignocelulósico exposto ao meio ácido?
- Quais grupos funcionais podem reagir?
2. Reações dos polissacarídeos
- ligação glicosídica
- grupos pendentes na hemicelulose
- cinética de hidrólise
- fatores que influenciam na reação
- reações de desidratação
3. Reações da lignina
- desidratação e/ou quebra da ligação éter no carbono alfa
- reações de condensação
4. Metodologia analítica baseada em reações em meio ácido
- determinação de composnentes
- acidólise analítica
- tioacidólise
1. O que ocorre com um lignocelulósico exposto ao meio ácido?
Quais grupos funcionais podem reagir?
OH ou éter ligado ao
carbono alfa é muito
importante
Na lignina há uma
maior diversidade de
grupos funcionais,
mas o ponto de
partida será sempre
os grupos oxigenados
Relembre!!
O que ocorre com uma molécula que contém oxigênio exposta ao meio ácido?
Exemplo simples
- H+
+ H+
Qual a situação se houver outros
substituintes diferentes do hidrogênio?
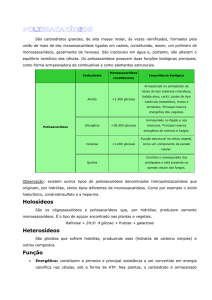
2. Reações dos polissacarídeos
Fato: o tratamento de um material lignocelulósico com solução
aquosa ácida, em condições relativamente brandas (veremos os
efeitos das condições mais à frente), gera um resíduo insolúvel
escuro e uma solução levemente amarelada
Resíduo insolúvel >> majoritariamente derivado da lignina
Solução >> majoritariamente açúcares monoméricos e
oligossacarídeos, dependendo da condição de reação
Modelo: Como é possível explicar o fenômeno observado?
2. Reações dos polissacarídeos
- olhando para a ligação glicosídica
HO
HOH C
2
OH
HO
CH OH
2
OH
O
O
HO
OH
HO
O
HO
CH OH
2
O
+
OH2
H+
HO
CH OH
2
HO
H2O
HO
HO
HOH C
2
OH
HO
O
H
+O
OH
HO
CH OH
2
HO
HOH C
2
OH
+
+
O
OH
HO
O
O
HO
HO
- H+
Próton liberado >> catálise ácida
HO
OH
HO
CH OH
2
O
OH
A reação seria via íon carbônio ou por substituição direta?
Estabilização do íon carbônio intermediário devido à presença
do oxigênio vizinho ao C1
OH
HO
RO
CH OH
2
O
H+
OR
HO
OH
HO
CH OH
2
H
OR
+
O
- ROH
OH
RO
OH
HO
HO
CH OH
2
O+
HO
+
CH OH
2
O
Note que a ruptura gerando um carbocátion no C4 não
permitiria a estabilização
As velocidades relativas de hidrólise de dissacarídeos e a
esterioquímica envolvida também justificam a formação do
carbocátion
Use um kit para construção de modelos de moléculas e monte uma
estrutura de celobiose. Considere a clivagem da ligação éter com a
consequente formação do carbônio.
- Qual é a alteração estereoquímica importante observada? Com
base nesse estudo, tente justificar porque um dímero de beta-Dmanose hidrolisa 3 vezes mais rápido que um dímero de beta-Dglicose.
Pense: os açúcares têm todos os carbonos sp3. Um íon carbônio tem
os elétrons distribuídos em um orbital híbrido sp2 com o orbital p
vazio. Isso deve justificar as alterações estereoquímicas observadas?
-D-glicose
OH do C-2 em posição equatorial
-D-manose
OH do C-2 em posição axial
OH do C-2 em posição equatorial
Demonstrações de formação do íon Carbônio durante a
hidrólise de polissacarídeos
Fato
Modelo
Cinética da hidrólise de polissacarídeos
(mais uma evidência para a formação do carbocátion)
A hidrólise de oligossacarídeos ou
polissacarídeos solúveis no meio reacional
seguem uma cinética de primeira ordem
Polissacarídeo (C/Co)
100
0
0
100
Tempo de reação
A hidrólise de polissacarídeos
insolúveis também segue um
modelo de primeira ordem.
5
Ln C/Co
É comum haver mais de uma fase
de reação > A etapa limitante
pode ser a acessibilidade do ácido e
da água às ligações glicosídicas
0
0
100
Tempo de reação
A velocidade de reação é uma a
duas ordens de magnitude menor
Desaparecimento de um composto glicosídico em função do tempo de reação
em meio ácido.
A hidrólise segue uma cinética de primeira ordem. Ou seja, a velocidade da
reação só depende da concentração do próprio polissacarídeo:
dC/dt = kC,
onde: C = concentração do polissacarídeo que ainda não reagiu
k = constante de velocidade
Integrando a equação obtem-se:
Ln C = - k1t + C,
para essa equação, no tempo t= 0, a concentração apresenta seu valor inicial
Co, de modo que C = Ln Co. Portanto: Ln C = - k1t + Ln Co, ou:
Ln C/Co = -k1t
Pode-se determinar a constante de velocidade graficando-se Ln C/Co vesus t
conforme figura anterior.
A constante de velocidade depende da temperatura e da energia de ativação da
reação segundo a equação de Arrhenius.
Outras variáveis que afetem a acessibilidade dos reagentes ao substrato e sejam
condições limitantes para que a reação ocorra, também afetam a velocidade de
reação.
- A cinética de hidrólise de polissacarídeos insolúveis também
segue um modelo de primeira ordem. No entanto, mais de uma fase
de reação (mais de uma velocidade de reação) pode ser distinguida
de acordo com a dificuldade de acessibilidade do ácido às ligações
glicosídicas.
Pense:
- É mais difícil hidrolisar em ácido diluído: xilana, celulose amorfa
ou celulose cristalina.
- O que hidrolisaria mais rápido em ácido diluído: celulose amorfa
ou carboxi-metil celulose
Busque ao menos um trabalho na literatura corrente que mostre
como diversos fatores relativos ao polissacarídeo ou ao meio
reacional afetam a velocidade de hidrólise.
Fontes de busca: ISI, ou Bioresource Technology; Holzfoschung;
Biotechnology for Biofuels; Journal of Wood Chemistry and
Technology; Wood Science and Technology; Cellulose Chemistry
and Technology
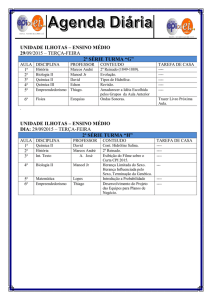
Tipos de hidrólise ácida segundo a fase dos reagentes
Fase da
amostra
dissolvido
Fase do
ácido
líquido
sólido
dissolvido
líquido
sólido
Tipo
Exemplo
Homogêneo sacarose/ác. diluído
celulose/ác. concentrado
Heterogêneo celulose/ác. diluído
Heterogêneo sacarose/resina de troca
iônica
Fatores importantes no meio de hidrólise
- Tipo do ácido (orgânico ou inorgânico; forte ou fraco).
- Concentração do ácido (afeta a acessibilidade à matriz
lignocelulósica; reações laterais indesejáveis).
- Temperatura de reação (afeta a velocidade da reação; reações
laterais indesejáveis).
- Pressão (afeta a acessibilidade à matriz lignocelulósica em
reações em duas fases).
Pense: Qual o produto da hidrólise ácida de:
celobiose; celotriose; oligômero com 10
anidroglicoses; oligômero com 100 anidroglicoses.
Verifique a estequeometria dessas reações.
Qual a conclusão factível a partir do balanço de
massas desse estudo?
Hidrólise das hemiceluloses
Hidrólise da ligação glicosídica
> similar ao já estudado de forma genérica
> Também se aplica às ligações glicosídicas das ramificações,
O que há de diferente em
termos de funções
químicas??
Éster de grupos acetila e
ácidos hidróxi-cinâmicos
no caso de hemicelulose de
gramíneas
hidrólise ácida de ésteres
hidrólise ácida dos ésteres
- Ácido acético liberado pode ser o precursor nos
processos de autohidrólise.
- Ambos são inibidores em processos fermentativos
Principais monosacararídeos derivados da hidrólise de hemiceluloses
Monosacararídeo derivados da hidrólise da celulose >> glicose
Reações secundárias em meio ácido
Envolvem a clivagem da ligação glicosídica (abaixo) ou a
desidratação
Reações secundárias em meio ácido > Desidratação
HO
OH
HO
CH OH
2
OH
O
+ H+
- 3 H2O
HOH2C
O
Em condições otimizadas para máxima
hidrólise e mínima decomposição, as
reações de desidratação ocorrem em
pequena extensão.
No entanto, a formação destes
compostos pode ser problemática para a
indústria de alimentos e de conversão
biológica
CHO
A desidratação depende de variáveis de processo,
principalmente concentração de ácido e temperatura
de reação.
Pense num mecanismo que explique a formação de furfural e
hidroxi-metil furfural a partir da desidratação de xilose e glicose,
respectivamente
HO
OH
HO
CH OH
2
OH
O
+ H+
- 3 H2O
HOH2C
O
CHO
Algumas reações de desidratação podem levar a formação de
compostos aromáticos, mesmo partindo de polissacarídeos.
Os polissacarídeos podem sofrer oxidação em meio ácido, quando
as reações de hidrólise são realizadas em meio oxigenado.
3. Reações da lignina em meio ácido
Formação de um íon carbônio por eliminação de um álcool (no caso de éteres na posição
C-alfa, ou água (no caso de uma função hidroxila no C-alfa
H
HC OR´
+
HC OR´
H+
trata-se de um carbônio
atipicamente estável,
pois está conjugado
com um anel aromático
OCH3
OCH3
OR
OR
- R´OH
HC d
d+
+
d+
OCH3
OR
d+
HC +
HC
OCH3
OR
+
Sítios deficientes em elétrons após eliminação de R´OH em meio ácido
OCH3
OR
Revise: ressonância em anéis aromáticos
Pense: como a deslocalização de elétrons pode estabilizar
o íon carbônio formado?
Quais reações poderiam ocorrer após a formação do íon
carbônio?
Quais seriam os nucleófilos disponíveis numa reação entre
lignina e ácido sulfúrico diluído?
Reações da lignina em meio ácido aquoso
Predomina a
condensação
O resultado é o
acúmulo de um
material insolúvel
em ácido
enriquecido em
ligações C-C que
são estáveis no
meio reacional
ácido
ilustração genérica
Possibilidades de condensação
Beta-1, com
eliminação da
cadeia lateral com
função aldeído
Beta-6, com
eliminação de
próton
Exemplo de solubilização de polissacarídeos em meio ácido (condições que afetam a reação)
Relação sólido: líquido 1:10
Máx. de monossacarídeos esperados em solução:
Xilose = 26 g/L
Glicose = 42 g/L
HOAc = 4,5 g/L
Glicose (g/L)
Glicose (g/L)
2% Acid
Glicose (g/L)
Xilose (g/L)
Xilose (g/L)
Xilose (g/L)
Máx. esperados: Xilose = 26 g/L
2% Acid
2% Acid
4% Acid
▲ 6% Acid
4% Acid
▲ 6% Acid
4% Acid
▲ 6% Acid
Glicose = 42 g/L
Furfural (g/L)
Furfural (g/L)
4% Acid
▲ 6% Acid
2% Acid
4% Acid
▲ 6% Acid
Desidratação
de pentoses
Furfural (g/L)
Acetic acid (g/L)
Acetic acid (g/L)
Acetic acid (g/L)
Máx. esperado: HOAc=4,5 g/L
2% Acid
2% Acid
4% Acid
▲ 6% Acid