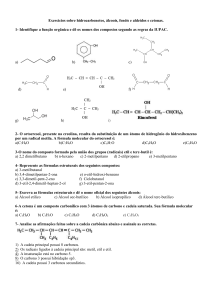
Capítulo 9
ESTUDO DOS ÁLCOOIS
Obtenção
1) Hidrólise básica de haletos de alquila
Nesse processo, as reações podem ocorrer por um mecanismo
E1 ou por um mecanismo SN1 ou SN2
Ex:
R
R
Br + HOH
OH + HBr
-
OH
Alceno
- Exemplo de mecanismo SN1:
A obtenção de álcoois por este processo ocorre quando o
carbono ligado ao halogênio for terciário.
C
C
C
C
Cl
solvente
polar
C
C
C
C
Cl
+
Na
C
+
OH
C
C
OH
C
2 metil propanol 2
Terc butanol
Álcool T-butílico
232
-
+
C
C
C
C
+
Cl
-
- Exemplo de reação SN2:
- Ocorre quando o carbono ligado ao halogênio for primário.
HO
+
C
Br
HO
C
C
C
C
C
C
C
+
K Br
butanol 1
álcool butílico
- Exemplo de reação E1
- Ocorre quando o carbono ligado ao halogênio está envolvido
por radicais volumosos.
C
C
C
C
C
C
Cl
C
C
C
S.P.
C
C
C
C
C
C
C
C
C
C
+ Cl
C
C
H
C
C
C + OH
C
C
C
C
H2O
+
C
C
C
C
C
C
C
C
2) Hidrólise Ácida de alcenos
Essa reação ocorre em presença de ácido sulfúrico que se
dissocia segundo a equação:
H2SO4
+
H + HSO4
233
O H+ faz um ataque eletrófilo à molécula do alceno
R
C
H
CH2
+
H
R
C
H
CH3
OH2
R
C
H
CH3 + OH2
R
C
CH3 HSO4
H
OH
R
C
CH3 + H2SO4
H
3) Reação de Aminas Primárias com ácido nitroso
+
HNO2
O
H + NO2
N
O
+
H
O
N
OH
+
H
O
N
OH2
NO
H2O
O
+
-
N + O
N
O
O
N
O
N
O
N
O (N2O3)
R
N
H2
N
O
O
R
NH2 + N
O
R
B
R
N
H
R
+
N
N
B
OH
R
N
N
OH2 + N2
+
B
234
+
OH2
+
R
R
+
N
OH
H
-
N + H2O
N
OH
R
+
N
N + H2O
EXERCÍCIOS
1) Explique como podemos obter butanol 2 através da hidrólise ácida de
um alceno e através da reação de uma amina primária com ácido
nitroso.
a)
C
C
C
CH2
+
H
+
+
C
C
C
H
CH3
OH2
+
C
C
C
H
CH3 + OH2
C
C
C
C
H
CH3
-
HSO4
C
C
CH3 + H2SO4
OH
b)
+
HNO2
-
H + NO2
+
NO
O
N
-
+
O +H
O
+
N
OH + H
O
N
OH2
H2O
O
+
-
N + O
N
O
O
N
O
N
O (N2O3)
O
+
C
C
C
N +N
H2
O
N
C
C
C
O
C
C
C
C
C
N
C
H
N
N
H2
N
O
B
OH
235
+
C
C
C
N
C
H
N
OH
C
C
C
N
N
OH2
C
OH2
+
C
C
C
N
N
+
H2O
C
C
C
+
C
C
C
+
N
N + OH2
C
C
OH2 + N2
C
+
C
C
C
OH2 + OH2
C
C
C
C
C + H3O
OH
4) Redução de aldeídos e cetonas
Os aldeídos e cetonas em presença de hidreto de lítio e
alumínio ou hidretos de metais alcalinos em meio não aquoso, dão
origem a álcoois primários ou secundários.
-
+
Na H
HCl
Na + H
H + Cl
-
O
O
R
-
C
+ H
OH
+
R
CH2 + H
R
CH2
H
-
O
R
C
R1
236
-
O+ H
R
C
H
OH
+
R1 + H
R
C
H
R1
EXERCÍCIOS
1) Identifique os álcoois formados na redução do 2-metil pentanal e da
etil propil cetona.
C
C
C
C
C
C
C
O
C
C
C
OH
C
CH2
-
C
-
H+ H
C
C
C
O
+
C
CH2 + H
2 metil pentanol 1
Hexanona 3
-
O
C
C
C
O
C
-
C
C+ H
C
C
C
C
+
C
C+H
OH
C
C
C
C
C
C
hexanol 3
5) Redução de Ácidos e Ésteres
A redução de ácidos e de ésteres leva a formação de aldeídos.
Se houver hidreto em excesso, haverá formação dos álcoois
correspondentes.
O
O
R
C
+ H
-
R
O
C
OH
OH
R
C
+ OH
H
H
-
O
O
R
-
C
+ H
O
R1
R
C
H
O
O
R1
R
C
+ R1
O
H
237
- Identifique os álcoois formados na redução do ácido acético e
do acetato de etila.
a)
-
O
O
C
-
C
+ H
C
O
C
OH
OH
C
-
C
+ HO
H
H
O
C
+ H-
C
C
O- + H+
C
H2
H
H2C
C
H2
OH
(Etanol)
b)
O
O
C
-
C
+ H
O
C
C
H2
C
O
R
C
H
C
+
+
H
C
C
O
C
C
+
R
C
+C
C
-
O
H
C
H2
(Etanol)
OH
O
O
R
O
+
H
R
CH2
+
H
R
C
H2
OH
H
6) Aldeídos e Cetonas com RMgX
Reagem a temperatura ambiente, em meio aquoso com
compostos de Grignard/H2O formando álcoois secundários ou terciários.
I)
O
R
C
+ R
H
238
O
MgCl
C
H + H OH
MgCl
R
R
II)
OMgCl
O
R
C
+ R
MgCl
R
R1
C
R1 + H OH
R
I)
OH
R
C
H + Mg(OH) Cl
R
II)
OH
R
C
R1 + Mg(OH) Cl
R
OBSERVAÇÃO: Grupos volumosos ligados ao carbono de carbonila
dificultam a reação.
C
Quando esses grupos são terc-butil, isopentil (C
C
C
C)
ocorrem reações paralelas. As reações com formação de álcool só
ocorrem se o grupo R do composto de Grignard for pequeno (metil ou
etil).
T bu
R = metil
C
O+R
MgCl
não se
forma álcool!
há reação se:
ou
R = etil
T bu
239
Exemplos:
C
C
C
C
H
C
C
O + MgCl
C
H
C
OMgCl + R
Ipr
Isopropil
R
Ipr
C
C
RH +
C
C
C
C
C
OH + MgOHCl
HOH
C
Ipr
OMgCl
Ipr
Enol
O enol formado sofre um fenômeno de “Tautomeria” formando
cetona correspondente.
C
C
O
H
C
C
C
2,4 dimetil
penteno 2; ol 3
C
taut.
C
C
C
O
H
C
C
C
C
C
2,4 dimetil
pentanona 3
7) Reação de compostos de Grignard/H2O com
Epóxidos (óxido de etileno)
R + H2C
MgI
240
CH2
O
H2C
R
CH2 + H OH
OMgI
H2C
R
CH2 + MgOHI
OH
8) Hidrólise de Ésteres (ácida e básica)
Nesse processo obtêm-se álcoois e sais orgânicos (básica) ou
álcoois e ácidos orgânicos.
-
O
O
R
C
+ OH
O
R
R1
O
C
OH
O
R1
O
R
R
C
+ OR
OH
O
C
+ OR
R
C
O H
+ HO
R
O Na
hidrólise ácida
OH
O
R
C
+H
O
R
R1
C
OH
O
R1
R
C
+ H2O
O
R1
OH2
B
OH
R
OH
C
OR1
R
C
OH
O
+
O R
R
C
+
HO
R
OH
OH
OBS: A hidrólise básica é utilizada industrialmente para obter
glicerina (propanotriol) e sabões, através de reações com óleos vegetais:
O
O
R
H2C
O
C
R
H2C
O
C
OH
O
O
R
HC
O
C
R
+
3 OH
HC
O
C
OH
O
O
R
H2C
O
C
R
H2C
O
C
OH
241
O
O
3R
C
CH2
+ O
H2C
CH
OH
HC
O
OH + 3R
C
-
OH
O
H2C
CH2
+
O Na
OH
sabão
glicerina
PROPRIEDADES QUÍMICAS
1) Oxidação com mistura sulfocrômica
Os álcoois quando oxidados dão origem rapidamente aos
ácidos orgânicos, formando intermediariamente aldeídos.
A oxidação pode parar no aldeído se este tiver ponto de
ebulição baixo, pois neste caso é facilmente separado por destilação.
O
H2
C
R
+
OH + H
H2
C
R
OH2 + O
Cr
OH
OH
O
H2
C
H2O + R
O
Cr
OH
OH
H
R
O
C
O
H
Cr
O
OH
O
242
OH
OH
B
+ OH2
H
+ H2CrO3
H3O
O
C
C
H
OH
H2O
R
R
R
C
H
OH2
R
C
H
OH + H
R
C
H
OH2
OH
R
O
C
OH2 + O
O
OH
Cr
OH
R
O
C
OH
+
O
Cr
H
OH
OH
H2O
O
R
C
+ H2CrO3
OH
EXERCÍCIOS
1) Qual seria o mecanismo da oxidação de um álcool se utilizássemos
KMnO4/H2SO4?
O
R
+
C
O +H
R
C
O+O
H2
Mn
H
O
C
O
-
R
O
O
H
R
O
O
Mn
H
Mn
O
-
O
O
-
O
R
C
+ HMnO3
H
O
OH2
O
O
R
C
+ OH2
R
H
C
OH2
R
C
H
OH
R
OH
OH
B
OH2 + O
H
Mn
O
R
H
O
C
OH + H
-
R
C
H
OH2
H
OH
O
C
O
O
Mn
O
O
OH2
H3O
O
R
C
+ HMnO3
OH
243
2) Reações de álcoois com Brometos de Acila
Esta reação ocorre à temperatura ambiente porque a diferença
de eletronegatividade entre o bromo e o carbono é suficiente para
permitir que o oxigênio do álcool faça um ataque nucleófilo ao carbono
da carbonila. Forma-se HBr e o éster correspondente.
R
O
O
O
O +
H
C
R1
+
R
O
H
C
Br
R1
R
C
O
H
R1
-
Br
Br
O
R1
C
O
R (éster)
+
HBr
3) Reações de álcoois com Amideto (R
OH/Na NH2 )
Nessas reações, pode ocorrer a formação de uma amina ou de
um alcóxido de Na.
a)
Na NH2
-
H2N + C
Na + NH2
OH
R
C
NH2 + NaOH
R
b)
-
H2N + H
NH3 + R
C
O Na
O
C
R
b) Predomina quando o álcool for 3o
a) Predomina quando o álcool for 1o
244
4) Esterificação (R OH / R C OOH)
A formação de ésteres é catalisada por ácidos inorgânicos
(H2SO4) Existem dois mecanismos que tentam explicar a formação dos
ésteres.
a) Cisão Alquil oxigênio
Admite-se esse mecanismo quando o álcool for terciário, isto é,
quando houver a possibilidade de formação de um cátion carbono
terciário.
R
+
C
OH + H
R
C
OH2
O
H2O + R
C
O
O
+
R1
C
+C
R
R1
C
H3O + R1
OH
O
H
C
C
R
O
C
R
H2O
b) Cisão Acil oxigênio
Esse mecanismo é admitido quando o álcool é primário. Nestas
condições ocorre uma interação entre o H+ e a molécula do ácido
orgânico.
OH
O
R
C
+H
R
+
C
OH
OH + HO
R
R
OH
C
+
OH
OH
B
-
R
OH
R
OH
C
OH2
H2O + R
C
O
O
R
R
+
OH
R
O
C
+ H2O
O
R
R
C
O
R
245
OBS: Nessas reações forma-se água e o éster correspondente.
Ambos são líquidos imiscíveis. Numa preparação de laboratório, podem
ser separados com o auxílio de um funil de bromo.
5) Reação de álcool com Anidridos dissolvidos em
Piridina
Esta é uma reação de “solvólise”: É a reação na qual o solvente
participa.
O
O
R
C
R
+ N
C
O
R
N
O
C
O
R
O
C
R
C
O
O
R
C
O
O
H
+ O
N
R1
R
+
C
O
H
N
R1
O
O
O
C
R
R
C
OH
6) Reação de Álcoois com Cetenas
O
R1
C
C
O +
H
O
R
R1
C
C
O
R1
HO
C
C
R
O
H
B
O
R1
246
C
H2
C
O
R
R
7) Reações de Álcoois com Metais Alcalinos
Nestas reações ocorre desprendimento de hidrogênio e
formação de sais, genericamente chamados de alcóxidos.
R
OH + Na
R
-
O Na + 1/2 H2
Ex:
H3C
C
H2
OH + Na
H3C
C
H2
O Na + 1/2 H2
etóxido de sódio
H3C
OH + Na
H3C
O Na + 1/2 H2
metóxido de sódio
8) R OH / Na /R1 X (síntese de Willianson)
Este é o principal método para preparação de éteres, tanto em
laboratório, quanto na indústria.
Além do éter, forma-se também um sal de sódio. O rendimento
deste processo é maior que 95%, pois o sal formado é insolúvel no éter.
R
OH + Na
R
O +C
R
-
+
O Na + 1/2 H2
Cl
R
O
C
+
R1 + Na Cl
-
éter
R1
EXERCÍCIO
Utilizando a síntese de Willianson, explique por equações, como pode ser
preparado o éter etil benzílico.
C
C
O
C
Ph
247
C
C
OH + Na
C
C
O Na + 1/2 H2
Ph
C
C
O +C
Cl
C
C
O
C
Ph + Na Cl
éter etil benzílico
9) Reação com CS2
Nestas reações formam-se compostos chamados chantatos.
Realizando-se as mesmas em meio básico, formam-se os chantatos de
sódio.
S
R
S
O +C
H
R
O
H
C
S
R
R
O
H
S
S
OH
+
H
O
R
S
C
R
C
S
R
O
2Na+ OH-
O
H
S
S Na
C
R
O
+ 2H2O
+
S Na
10) Reações com Isocianatos
Na reação com os álcoois formam-se produtos chamados
carbamatos.
O
R
O +O
H
C
N
R1
R1
N
C
O
H
O
R1
N
B
248
O
C
R1
O
H
R
R
N
C
O
R
O
C
C
N
H
C
O
C
C
C
N - Etil, Propil Carbamato
11) Reação de Álcoois com nitrilas em meio ácido
Nesses casos formam-se compostos chamados de imidoÉteres.
R
C
N
+
R
C
H
Cl
R
C
NH
+
Cl
NH
Cl
R
C
NH + O
H
R1
R
Cl
C
NH
O
H
R1
R
C
NH
O
R1
Cl
12) Reações de álcoois com cetonas ou aldeídos/H +
Dependendo da proporção dos reagentes, pode-se obter
produtos chamados de semi acetais ou acetais.
R1
R1
+
R
O +C
O
R
R2
H
O
C
H
R2
H
O
R1
R
O
C
H
R2
R1
OH
-H
R
O
C
OH + H
(semi acetal)
R2
249
R1
R
O
R1
C
OH2
H2O + R
O
C
R2
R2
R1
R1
+
R
O
C+ O
H
R
R
O
C
R2
O
H
-H
R
R2
R1
R
O
C
O
acetal
R
R2
13) Reação com fosgênio (cloreto de carbonila)
Formam-se carbonatos orgânicos.
Cl
R
Cl
O +C
H
O
R
Cl
O
C
H
Cl
Cl
R
Cl
O
-HCl
R
O
C
Cl
O + C
O
H
R
O
R
O
C
H
OR
O
O
O
-HCl
R
O
C
O
R
OBSERVAÇÃO:
Os álcoois em meio ácido reagem com compostos aromáticos,
sob aquecimento.
R
OH + H
R
OH2
R + H2O
R
R+
250
+ HCl