Funções da Química
Inorgânica I
Introdução às funções e Ácidos.
Química
1ª Série
Profº Edilzo Filho
Natal, Setembro de 2015.
Introdução às funções inorgânicas
Funções Orgânicas versus Funções Inorgânicas.
Eletrólitos:
Substâncias que, pela adição de um solvente ou
por aquecimento, se tornam condutoras de
eletricidade.
Solução eletrolítica:
Solução aquosa que conduz eletricidade por
apresentar íons livres, mas ela sempre será
eletricamente neutra.
Fonte: http://www.ebah.com.br/content/ABAAAgPuMAL/relatorio-i-analitica-i# ( Acesso em 09/09/2015).
Dissociação
Separação de íons já existentes na estrutura.
Ocorre quando um solvente dissolve uma
substância iônica, causando a separação dos seus
íons que ficam livres na solução.
𝑁𝑎𝐶𝑙(𝑠)
𝑀𝑔𝐵𝑟2(𝑠)
𝐴𝑙𝐶𝑙3(𝑠)
𝐻2 𝑂
𝐻2 𝑂
𝐻2 𝑂
𝑁𝑎+ (𝑎𝑞) + 𝐶𝑙 − (𝑎𝑞)
𝑀𝑔2+ (𝑎𝑞) + 2𝐵𝑟 − (𝑎𝑞)
𝐴𝑙 3+ (𝑎𝑞) + 3𝐶𝑙 − (𝑎𝑞)
Fonte: Ricardo Feltre, 2004. p. 188.
Ionização
Produção de
covalentes.
íons
𝐻𝐶𝑙
𝐻2 𝑆𝑂4
𝐻𝑆𝑂4
−
𝐻2 𝑂
𝐻2 𝑂
𝐻2 𝑆𝑂4
𝐻2 𝑂
quebra
de
ligações
𝐻3 𝑂+ (𝑎𝑞) + 𝐶𝑙 − (𝑎𝑞)
𝐻3 𝑂+ (𝑎𝑞) + 𝐻𝑆𝑂4 − (𝑎𝑞) 1ª 𝑒𝑡𝑎𝑝𝑎
𝐻2 𝑂
(𝑎𝑞)
pela
𝐻3 𝑂+ (𝑎𝑞) + 𝑆𝑂4 2− (𝑎𝑞) 2ª 𝑒𝑡𝑎𝑝𝑎
2𝐻3
𝑂+
(𝑎𝑞)
+ 𝑆𝑂4
2−
(𝑎𝑞) (Etapa Global)
Grau de Ionização (α)
É a relação entre o número de moléculas ionizadas
e o número total de moléculas dissolvidas.
𝑛º 𝑑𝑒 𝑚𝑜𝑙é𝑐𝑢𝑙𝑎𝑠 𝑖𝑜𝑛𝑖𝑧𝑎𝑑𝑎𝑠
𝛼=
𝑛º 𝑑𝑒 𝑚𝑜𝑙é𝑐𝑢𝑙𝑎𝑠 𝑑𝑖𝑠𝑠𝑜𝑙𝑣𝑖𝑑𝑎𝑠
Exemplo: Calcule o α do HCl que apresenta 100
moléculas dissolvidas e 92 ionizadas.
92
𝛼=
= 0,92 = 92%
100
Grau de Ionização (α)
O grau de ionização varia de 0 e 1 (ou 0% e 100%).
Com isso, temos:
Classificação
Grau de ionização
em % (α%)
Exemplos
Forte
α% > 50%
HCl (α% = 92%)
Moderado ou Médio
5% ≤ α% ≤ 50%
HF (α% = 8%)
Fraco
α% < 5%
H2CO3 (α% = 0,18%)
IMPORTANTE!!!
Na dissociação iônica, a
água separa os íons já
existentes
no
retículo
cristalino.
Na ionização, a água
atua como reagente - fator
determinante
para
a
Fonte: http://dicasdeciencias.com/2015/03/21/aulada-celula-para-os-orgaos/ ( Acesso em 09/09/2015).
formação de íons.
Resumindo...
Exercício de Fixação
1) Qual a diferença entre dissociação e ionização? Dê
um exemplo de cada processo.
2) Equacione as dissociações iônicas de:
a) KBr
b) Al2O3
3) Toda substância iônica, quando adicionada à água,
sofre dissociação iônica? Justifique.
4) Toda substância molecular que seja solúvel em
água pode ser considerada um bom eletrólito?
Justifique.
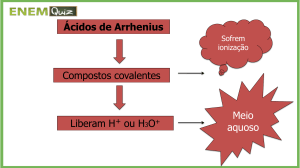
Ácidos de Arrhenius
São compostos que sofrem ionização em solução
aquosa, produzindo um único tipo de cátion, o íon
hidrônio (H3O+).
𝐻3 𝑃𝑂4
𝐻2 𝑃𝑂4
𝐻𝑃𝑂4
−
𝐻3 𝑂+ (𝑎𝑞) + 𝐻2 𝑃𝑂4 − (𝑎𝑞) 1ª 𝑒𝑡𝑎𝑝𝑎
𝐻2 𝑂
(𝑎𝑞)
2−
𝐻3 𝑃𝑂4
𝐻2 𝑂
(𝑎𝑞)
𝐻2 𝑂
𝐻3 𝑂+ (𝑎𝑞) + 𝐻𝑃𝑂4 2− (𝑎𝑞) 2ª 𝑒𝑡𝑎𝑝𝑎
𝐻2 𝑂
𝐻3 𝑂+ (𝑎𝑞) + 𝑃𝑂4 3− (𝑎𝑞) 3ª 𝑒𝑡𝑎𝑝𝑎
3𝐻3 𝑂+ (𝑎𝑞) + 𝑃𝑂4 3− (𝑎𝑞) 𝐸𝑡𝑎𝑝𝑎 𝐺𝑙𝑜𝑏𝑎𝑙
Classificação dos Ácidos
Quanto à presença de oxigênio:
Hidrácidos:
• São ácidos que não apresentam oxigênio na sua
estrutura.
• Exemplos: HCl, H2S, HCN, HBr, ...
Oxiácidos:
• São ácidos que apresentam oxigênio na sua
estrutura.
• Exemplos: H2SO4, HNO3, H3PO4, ...
Classificação dos Ácidos
Quanto ao número de elementos químicos:
Binários:
• Aqueles que têm dois elementos em sua
composição (hidrácidos).
Ternários:
• Aqueles que têm três elementos em sua
composição.
Quaternários:
• Aqueles que têm quatro elementos em sua
composição.
Nomenclatura dos Ácidos
Hidrácidos:
Ácido +
nome do elemento
+ ÍDRICO
HF – Ácido fluorÍDRICO (fluoreto de hidrogênio)
HI – Ácido iodÍDRICO (iodeto de hidrogênio)
HCl – Ácido clorÍDRICO (cloreto de hidrogênio)
H2S – Ácido sulfurÍDRICO (sulfeto de hidrogênio)
HCN – Ácido cianÍDRICO (cianeto de hidrogênio)
Nomenclatura dos Ácidos
Oxiácidos:
IMPORTANTE!!!
Verificar o NOx do elemento central.
Ácido + Nome do ânion* + ICO (NOx ≥ 5) ou OSO (NOx < 5)
OBSERVAÇÃO:
Se NOx = +7 colocar o prefixo per no ânion.
Se o NOx = +1 colocar o prefixo hipo no ânion.
* Verificar a tabela com o nome dos ânions nos slides seguintes.
Nomenclatura dos Ácidos
Oxiácidos:
HClO4 – Ácido perclórICO
HClO3 – Ácido clórICO
HClO2 – Ácido clorOSO
HClO – Ácido hipoclorOSO
H2SO4 – Ácido sulfúrICO
H2SO3 – Ácido sulfurOSO
HNO3 – Ácido nítrICO
HNO2 – Ácido nitrOSO
As famílias 3A (13) 3
4A (14) só apresentam um
Oxiácido,
portanto
a
terminação será –ICO (NOx
máximo da família):
H3BO3 – Ácido bórICO
H2CO3 – Ácido carbônICO
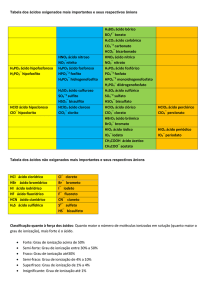
Tabela de ânions
Fonte: Usberco e Salvador, 5ª ed. p. 161.
Força dos ácidos
Hidrácidos:
Fortes: HCl, HBr, HI
Moderado: HF
Fraco: todos os demais (H2S, HCN, ...).
Oxiácidos:
X = nº de O – nº de H
X ≥ 2 – Forte
X = 1 – Moderado
X = 0 – Fraco
Força dos ácidos
Oxiácidos:
HClO4 – Ácido forte (X = 3)
HNO2 – Ácido moderado (X = 1)
H2SO4 – Ácido forte (X = 2)
H3BO3 – Ácido fraco (X = 0)
OBSERVAÇÃO!!!
O ácido carbônico é considerado fraco devido a
sua instabilidade.
𝐻2 𝐶𝑂3 ⇌ 𝐶𝑂2(𝑔) ↑ +𝐻2 𝑂(𝑙)
Exercício de Fixação
1) Escreva a equação química de ionização completa
dos seguintes ácidos:
a) HBr
b) H2S
2) Corrija, justificando o erro da frase a seguir: “De
acordo com Arrhenius, ácidos são substâncias que se
dissociam ionicamente na água, liberando como
cátion exclusivo o íon H+”.
3) Dê nome aos ácidos HNO2, HClO3, H2SO3 e
H3PO4.
Propriedades dos Ácidos
Reação com metais;
Reação com carbonatos e bicarbonatos;
Ação sobre indicadores (pH);
Fonte: Usberco e Salvador, 5ª ed. p. 146.
Fonte: Usberco e Salvador, 5ª ed. p. 149.
Referências Bibliográficas
FONSECA, Martha Reis Marques da. Química: meio
ambiente, cidadania, tecnologia. 1. ed. V. 1.. São Paulo:
FTD, 2010.
MORTIMER, Eduardo Fleury. Andrea Horta Machado.
Química, 1. São Paulo: Scipione, 2010.
SANTORO, Antonio C. Baroni. Luiz E. G. Dias. Química. Ético
Sistema de Ensino.
Ser Protagonista: Química. Revisão do Ensino Médio,
Volume Único. São Paulo: Editora SM, 2014.
USBERCO & SALVADOR. Química. 5. ed. vol. único. São
Paulo: Saraiva.