Gabaritos
Professores:
Alinne Borges
Tiago Albuquerque
Sandro Sobreira
Josiane
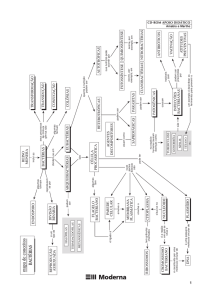
Momento
Sheldon
Pesquise
Exercícios
Reação química
Transformações
físicas e químicas
Vídeos
Leis de Lavoisier
e Proust
Transformações físicas
Transformações físicas
Não altera a natureza da matéria, isto é, a sua
composição.
•Fragmentação
•Mudança de estado físico
H2O(l) → H2O(g)
Exemplos: dissolução do açúcar em água,
obtenção do carvão em pó por trituração,
congelamento da água, transformação de
barra de cobre em fios e etc.
Início
Transformação química
Início
Transformações
químicas
Ocorre a formação de novas substâncias
com propriedades diferentes.
REAGENTES → PRODUTOS
Indícios de uma reação química
*clique para visualizar
Transformação química
Início
MUDANÇA DE ODOR
LIBERAÇÃO DE GÁS
FORMAÇÃO DE UM SÓLIDO
MUDANÇA DE COR
Representação de uma reação química
EM
EQUAÇÃO
2 H2(g) + O2(g) → 2 H2O(g)
REAGENTES
(SÃO CONSUMIDOS)
PRODUTO
(SÃO PRODUZIDOS)
Os reagentes gás hidrogênio e gás oxigênio
reagem para formar o produto água no
estado gasoso.
(s) sólido
(l) líquido
(g) gasoso
(aq) aquoso
(↑) liberação de gás
(↓)formação de precipitado (subst. Insolúvel
(∆) Aquecimento
EM
PALAVRAS
ALGUNS TIPOS DE REAÇÕES
*clique para visualizar
Início
Representação de uma reação química
TIPOS DE REAÇÕES
Início
FOTÓLISE
Decomposição sob ação da LUZ
2 H2O2(aq)
λ
luz
2 H2O(l) + O2(g)
SÍNTESE
Reações nas quais dois ou
mais substâncias reagente
originam uma única
substância como produto
PIRÓLISE
C(s) + O2(g)
Decomposição sob ação do CALOR
CO2(g)
DECOMPOSIÇÃO
Reações nas quais uma
única substância reagente
origina como produtos duas
ou mais substâncias
CATÁLISE
Reação que ocorre na presença de um CATALISADOR
CaCO3(aq)
Δ
calor
CaO(s) + CO2(g)
ELETRÓLISE
Decomposição provocada por uma
CORRENTE ELÉTRICA
Exercícios
Início
Questão 1
Classifique as transformações em físicas ou
químicas:
(a)
(b)
(c)
(d)
(e)
(f)
(g)
(h)
(i)
Secagem da roupa no varal
Queima de um palito de fósforo
Enferrujamento de um prego
Sublimação da naftalina
Fabricação de fios de cobre a partir de uma
barra de cobre
Respiração dos seres vivos
Quebra de uma jarra de vidro
Queima da gasolina
Produção do álcool a partir da cana de açúcar
Exercícios
Questão 2
Início
Elementos químicos
Início
Elemento
químico
Conjunto de átomos que
possuem características
químicas iguais e que tomam
parte da constituição das
substâncias.
Elementos químicos
Reação de combustão
Combustão do etanol ou álcool comum:
Nesta reação química, uma molécula de
etanol (C2H5OH) reage com três moléculas de
gás oxigênio do ar atmosférico (O2),
produzindo duas moléculas de gás carbônico
(CO2) e três moléculas de água, conforme a
equação:
C2H 5OH(l) + 3 O2(g) 2 CO2(g) + 3 H2O(l) + calor
(Exotérmica)
Início
Substâncias químicas
Início
SIMPLES
Átomos de apenas
1 elemento
químico
H2
O2
O3
N2
S8
SUBSTÂNCIA
PURA
COMPOSTA
Átomos de 2 ou
mais elementos
químicos
H2O
CO2
NH3
C 2 H6O
H3PO4
Substâncias químicas
Início
Subst. Pura simples
Molécula: H2
2u
Subst. Pura simples
Molécula: O2
32 u
Subst. Pura composta
Molécula: NH3
17 u
Subst. Pura composta
Molécula: CH4
16 u
HIDROGÊNIO (H)
1u
ENXOFRE (S)
32 u
OXIGÊNIO (O)
16 u
NITROGÊNIO (N)
14 u
CLORO (Cl)
35,5 u
CARBONO (C)
12 u
Substâncias químicas
Início
Subst. Pura simples
Molécula: O3
48 u
Subst. Pura simples
Molécula: Cl2
71 u
Subst. Pura simples
Molécula: N2
28 u
Subst. Pura simples
Molécula: S8
256 u
HIDROGÊNIO (H)
1u
ENXOFRE (S)
32 u
OXIGÊNIO (O)
16 u
NITROGÊNIO (N)
14 u
CLORO (Cl)
35,5 u
CARBONO (C)
12 u
Substâncias químicas
Início
Subst. Pura composta
Molécula: H2O
18 u
Subst. Pura composta
Molécula: CO2
44 u
Subst. Pura composta
Molécula: C2H6O
46 u
Subst. Pura composta
Molécula: CS2
76 u
HIDROGÊNIO (H)
1u
ENXOFRE (S)
32 u
OXIGÊNIO (O)
16 u
NITROGÊNIO (N)
14 u
CLORO (Cl)
35,5 u
CARBONO (C)
12 u
Lei de Lavoisier
Início
Lei de Lavoisier
Lei da conservação da
massa
Quando uma reação química é realizada num
recipiente fechado, a massa dos produtos é sempre
igual à massa dos reagentes.
Mg(s) + 2 HCl(aq) → MgCl2(aq) + H2(g)↑
REAGENTES
24 g + 2 . 36 =
PRODUTOS
94 g + 2 g
Lei de Proust
Início
Lei de Proust
Lei das proporções constantes
A proporção em massa das substâncias que reagem e que são produzidas numa reação
é fixa, constante e invariável.
+
2x
2x
+
2x
Exercícios
Início
Questão 3
A decomposição da água oxigenada está
representada na seguinte equação
química:
2 H2O2(aq) → 2 H2O(l) + O2(g)
Ao realizarmos dois experimentos anotouse os dados conforme a tabela a seguir:
→
Calcule o valor de x, y e z e complete a
tabela.
Momento Sheldon Cooper
Início
Pesquise
Pesquise
•
http://portaldoprofessor.mec.gov.br/
storage/recursos/17328/Web/labvirt
q/simulacoes/tempUpLoad/sim_qui_
aconstrucao.htm
•
http://webeduc.mec.gov.br/port
aldoprofessor/quimica/cd2/cont
eudo/recursos/12_animacao/De
ntroDaLei/DentroDaLei/executav
el/DentroDasLeis.html
Início
Professores
Prof(a). Alinne Borges
Prof. Sandro Sobreira
Início
Prof. Tiago Quick
Prof(a). Josiane