PREPARAR OS TESTES
QUÍMICA 11
QUÍMICA E INDÚSTRIA: EQUILÍBRIOS E DESEQUILÍBRIOS
Leia o texto seguinte.
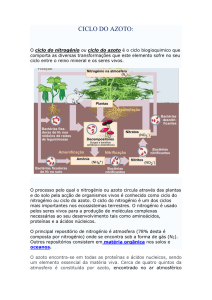
a) Justifique os seguintes procedimentos: adição de NaHO (aq) e ligeiro aquecimento.
b) Identifique o composto obtido no teste C e a cor do gel.
©
1.
TTESTE
ESTE D
DEE A
AVALIAÇÃO
VALIAÇÃO 5
AL EDITORES
TTESTE
ESTE DE
DE AVALIAÇÃO
AVALIAÇÃO 5
Alimentar a população mundial em crescimento rápido
requer que os agricultores tenham melhores colheitas.
Todos os anos adicionam centenas de milhões de toneladas de fertilizantes químicos ao solo a fim de aumentar
a qualidade das colheitas e produção. Para além do dióxido de carbono e da água, as plantas precisam essencialmente de seis elementos, um dos quais é o azoto.
O azoto pode ser fornecido às plantas através de fertilizantes azotados que contêm sais de nitrato e de amónio.
A principal matéria-prima dos fertilizantes azotados é o
amoníaco, que é obtido industrialmente.
2.
Na indústria química, o cumprimento das regras de segurança é fundamental
para a protecção das pessoas e do meio ambiente.
2.1.
Na produção industrial do amoníaco, essas regras devem ser seguidas escrupulosamente. Das afirmações seguintes, selecione as verdadeiras e corrija as
falsas.
(A) O amoníaco libertado para a atmosfera não altera a sua composição.
(B) O derramamento de amoníaco na pele provoca efeitos nocivos, independentemente da quantidade derramada.
(C) A presença de amoníaco na atmosfera provoca um aumento da concentração de material particulado e de dióxido de azoto.
(D) O tipo de lesão provocada pelo contacto com o amoníaco depende do
seu estado físico.
2.2.
Enumere alterações que podem ocorrer devido à utilização em excesso de
fertilizantes azotados, a nível ambiental.
2.3.
N a i n d ú s t r i a d e p r o d u ç ã o d e c o m p o s t o s a z o t a d o s , u m d o s c u i d a d os q ue s e
tem é evitar fugas de amoníaco e a utilização de máscaras pelos operadores
q u e e s t ã o m a i s e m c o n t a c t o c o m e l e . J u s t i f i q u e a n e c e s s i d a d e d e u t i l i z aç ã o
de máscaras pelos operadores da indústria do amoníaco comparativamente
com as pessoas que utilizam produtos de limpeza com amoníaco.
3.
A decomposição de KC’O3 só ocorre com o aquecimento permanente do
composto.
2 KC’O3 (s) — 2 KC’ (s) + 3 O2 (g)
3.1.
Classifique a reação em termos energéticos.
3.2.
Indique se a variação de entalpia da reação é superior ou inferior a zero.
3.3.
Selecione a afirmação correta, r elat ivamen te às ligações e stabe lecid as en t re
os corpúsculos dos reagentes e dos produtos de reação.
(A) Os reagentes precisam de menos energia para a rutura de ligações do que
a libertada pela formação de ligações dos produtos.
(B) A energia dos produtos é inferior à energia dos reagentes.
(C) A quantidade de energia libertada na formação dos produtos é superior à
energia absorvida pela rutura de ligação dos reagentes.
(D) As ligações que ocorrem nos reagentes são mais fortes do que a dos produtos.
Adaptado de: Raymond Chang, Química, McGraw-Hill
1.2.
1.3.
Através de um texto, evidencie a importância do amoníaco e a sua produção,
abordando:
• A diversidade da utilização do amoníaco.
• O modo de produção industrial do amoníaco, representando a reação utilizada e enumerando as condições mais favoráveis à sua produção.
• Obtenção das matérias-primas utilizadas na produção de amoníaco.
Com o objetivo de produzir 68,0 g de amoníaco, segundo o processo iniciado
no princípio do século XX, colocaram-se num reator 56,0 dm3 de ar, medidos
nas condições PTN, com 80,0% (V/V) de azoto e 24,0 g de H2. Contudo, só foi
possível sintetizar 50,0 g de NH3.
a) Identifique o reagente limitante.
b) Calcule o rendimento da reação.
Para identificar a presença de amoníaco em fertilizantes químicos, pode-se
utilizar o seguinte esquema.
Solução aquosa
aquosa de
de fertilizante
fertilizante
Solução
Adição de NaHO (aq)
Teste A
Teste B
Teste C
Aproximação
de papel vermelho
de tornesol
Adição de
solução de sulfato
de cobre
Aproximação
de uma vareta
de HC’
O papel fica azul
Formação de um gel
Fumo branco
258
258
© AREAL EDITORES
1.1.
PREPARAR OS TESTES
259
259